Т-клетки с трансдуцированным в них антигеном, применяемые в качестве системы доставки антигенов
Иллюстрации
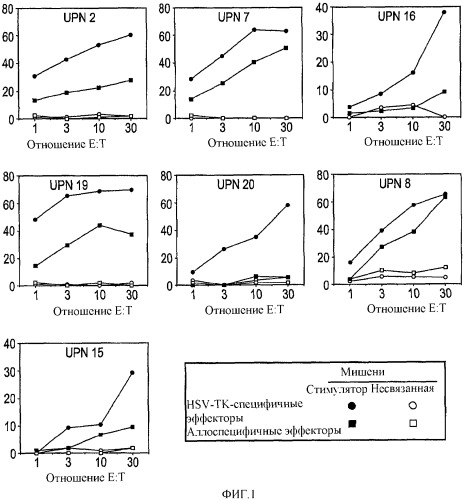
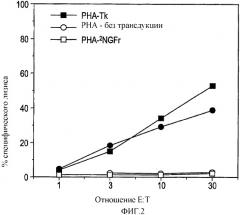
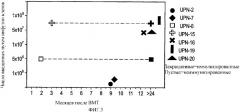
Показать всеГруппа изобретений относится к системе доставки для антигена в виде Т-клетки, содержащую, по меньшей мере, один антиген, способную загружать данным антигеном антигенпрезентирующие клетки. Предложено применение Т-клетки, содержащей по меньшей мере один антиген, в приготовлении лекарственного средства для доставки антигена в лимфатический узел. Предложено применение антигена, ассоциированного с Т-клеткой, содержащей по меньшей мере один другой антиген, способный вызывать иммунный ответ, в приготовлении лекарственного средства для мониторинга иммунного ответа против по меньшей мере одного другого антигена. Предложено применение Т-клетки, содержащей по меньшей мере один антиген, для приготовления лекарственного средства для загрузки антигенпрезентирующих клеток (АРС) антигеном. Предложен способ получения Т-клетки для применения по любому предшествующему пункту, включающий выделение Т-клетки, активацию Т-клетки, культивирование Т-клетки и введение антигена в Т-клетку, где Т-клетка трансдуцирована антигеном. 4 н. и 20 з.п. ф-лы, 1 табл., 7 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к системе доставки для антигена в виде Т-клетки, применению такой Т-клетки для мониторинга иммунного ответа и к способу получения данной Т-клетки.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Перенос генов в человеческие клетки исследуется в плане лечения разнообразных генетических и приобретенных человеческих заболеваний. Генетические заболевания, развивающиеся вследствие дефекта единичного гена, были первыми предложены в качестве первичных целей генной терапии. Однако большинство испытаний по генной терапии человека, одобренных к настоящему времени, относятся к лечению приобретенных заболеваний, таких как злокачественные опухоли и СПИД. Один из подходов к генной терапии опухолей основывается на стимуляции иммунной системы хозяина против опухолевых антигенов путем вакцинации пациента генетически модифицированными опухолевыми клетками, в которых трансген (цитокин, алло-HLA и т.д.) направлен на повышение их иммуногенности. Альтернативный подход основан на адаптивном переносе полученных ex vivo опухолеспецифических рецепторов. Вводимые путем инфузии эффекторы обычно представляют собой аутологичные или совместимые по HLA лимфоциты, пролиферация которых была стимулирована in vitro специфичными, а также неспецифическими стимулами. Амплификация эффекторной функции введенных путем инфузии клеток достигалась путем их трансдукции кодирующих цитокины генов.
В EP 0904786 описан способ опухолевой вакцинации путем, по меньшей мере, двух последовательных введений композиций, состоящих по существу из аутологичных или родственных по HLA клеток, которые способны представлять антиген в пациенте, причем данные клетки представляют собой опухолевые клетки, трансдуцированные чужеродным геном, или антигенпрезентирующие клетки, трансдуцированные опухолевым антигеном или чужеродным антигеном.
В WO 97/19169 описана противоопухолевая вакцина, содержащая опухолевые клетки, по меньшей мере, часть которых содержит, по меньшей мере, один гаплотип MHC-I пациента на клеточной поверхности и которые загружены антигеном.
Таким образом, предшествующий уровень техники использует подход применения опухолевых клеток в качестве системы доставки антигена, или антигенпрезентирующей клетки, которая считается представляющей антиген непосредственно Т-клетке.
Однако понятно, что имеет место постоянная потребность в предоставлении вакцин и подходов к вакцинации. Настоящее изобретение относится к такому подходу.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к подвергнутым манипуляции Т-клеткам, которые при введении пациенту способны приводить в контакт с профессиональными антигенпрезентирующими клетками (APC) антигены, такие как опухолевые, бактериальные или вирусные антигены. Более конкретно, изобретение относится к трансдуцированной Т-клетке, содержащей экзогенный (или чужеродный) ген, кодирующий антиген, для стимуляции ответа против данного антигена, и Т-клетке, нагруженной антигенным полипептидом для стимуляции ответа. Т-клетка также может включать в себя другой антиген, такой как HSV-Tk, который может использоваться для мониторинга эффективности вакцинации. Данные Т-клетки удобно получают in vitro, и затем их вводят инъекцией или иным способом in vivo, так что они несут продукты трансгена к профессиональным антигенпрезентирующим клеткам, таким образом стимулируя иммунный ответ против продуктов трансгена. Изобретение также относится к методологии, в соответствии с которой можно проводить мониторинг иммунологического статуса пациента. Настоящее изобретение, кроме того, относится к способу культивирования Т-клеток.
Таким образом, авторы изобретения в настоящее время обнаружили, что Т-клетки, содержащие антиген, действуют, доставляя антиген к антигенпрезентирующим клеткам (APC), так что APC впоследствии представляют антиген с формированием иммунного ответа. Поэтому настоящее изобретение характеризуется иной стратегией по сравнению с предшествующим уровнем техники.
ИЗЛОЖЕНИЕ ИЗОБРЕТЕНИЯ
Согласно одному из аспектов настоящего изобретения предоставляется система доставки, включающая в себя Т-клетку, содержащую, по меньшей мере, один антиген и способную доставлять антиген в лимфатический узел, или другую часть лимфатической системы.
Иными словами, настоящее изобретение относится к системе доставки, включающей в себя Т-клетку, содержащую, по меньшей мере, один антиген, способную нагружать антигенпрезентирующие клетки (APC) данным антигеном.
Антиген в основном чужероден в отношении Т-клетки. В определение «чужеродный» авторы изобретения включают антигены, которые в норме экзогенны относительно Т-клетки.
Антиген может вводиться в Т-клетку в качестве полинуклеотида, кодирующего антиген, т.е. Т-клетка может трансфицироваться или трандуцироваться данным полинуклеотидом или Т-клетка может быть нагружена антигеном в виде полипептида, который с тем же успехом может быть белком. Для простоты употребления, термины «полипептид» и «белок», в общем, используются в данном описании взаимозаменяемо. Таким образом, под Т-клеткой, содержащей антиген, авторы изобретения подразумевают, что антиген ассоциирован с Т-клеткой, так что Т-клетка способна доставлять антиген в лимфатический узел и/или APC.
Согласно другому аспекту настоящего изобретения предоставляется система доставки, включающая в себя Т-клетку, содержащую, по меньшей мере, один антиген, и способную доставлять антиген к APC для последующего представления на APC.
В одном из осуществлений чужеродный антиген представляет собой бактериальный или вирусный антиген. Предпочтительно, чужеродный антиген представляет собой опухолевый антиген.
Предпочтительно Т-клетка далее включает в себя, по меньшей мере, одну другую чужеродную полипептидную или полинуклеотидную последовательность.
В одном из осуществлений еще один чужеродный ген представляет собой маркер, т.е. маркерный ген или ген селекции.
Предпочтительно маркер представляет собой ген устойчивости бактерий, например ген устойчивости бактерий, который обеспечивает устойчивость к неомицину.
В другом осуществлении маркер представляет собой еще один антиген, предпочтительно HSV-Tk или CD20. Данные антигены особенно предпочтительны, поскольку они могут использоваться в так называемых суицидных системах.
В дальнейшем осуществлении система доставки, кроме того, включает в себя еще один антиген и маркерный ген.
Предпочтительно Т-клетка экспрессирует, по меньшей мере, один из следующих маркеров: HLA-I, HLA-II, CD80, CD86, CD27, CD40L, CD62L, CCR7, CD54 и CD25.
Таким образом, в другом аспекте настоящего изобретения предоставляется Т-клетка, которая экспрессирует, по меньшей мере, один из следующих маркеров: HLA-I, HLA-II, CD80, CD86, CD27, CD40L, CD62L, CCR7, CD54 и CD25.
По другому аспекту настоящего изобретения предоставляется применение Т-клетки, содержащей, по меньшей мере, два антигена, способных вызывать иммунный ответ, в котором ответ против одного из антигенов используется для мониторинга иммунного ответа против другого антигена.
По другому аспекту настоящего изобретения предоставляется способ мониторинга иммунного ответа против Т-клетки, содержащей первый антиген, способный вызывать иммунный ответ, причем способ охватывает введение в Т-клетку второго антигена.
По другому аспекту настоящего изобретения предоставляется способ загрузки APC in vivo, охватывающий воздействие на APC Т-клетки, содержащей антиген.
Еще по одному аспекту настоящего изобретения предоставляется способ получения Т-клетки для применения по заявленному способу, охватывающий:
выделение Т-клетки;
активацию Т-клетки;
культивирование Т-клетки;
введение в данную Т-клетку антигена.
Предпочтительно Т-клетка подлежит трансдукции или трансфекции полинуклеотидной последовательностью, кодирующей антиген.
Предпочтительно Т-клетка активируется фитогемагглютинином, гранулами, покрытыми моноклональным антителом против CD3 или моноклональным антителом против CD3/CD28.
Предпочтительно Т-клетка культивируется в присутствии факторов роста, таких как hu-r-IL-2.
Предпочтительно Т-клетка культивируется в культуральной среде, которая содержит 5% аутологичной сыворотки.
Предпочтительно Т-клетка культивируется в количестве 1×106 клеток/мл.
По дальнейшему аспекту настоящего изобретения предоставляется Т-клетка, которую можно получить способом по настоящему изобретению и которую можно использовать в качестве системы доставки по настоящему изобретению.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Различные предпочтительные характеристики и осуществления настоящего изобретения теперь будут описаны посредством неограничивающих примеров.
Хотя, в общем, указанные здесь способы хорошо известны в данной области, может быть сделана конкретная ссылка на Sambrook et al., Molecular Cloning, A Laboratory Manual (1989) и Ausubel et al., Short Protocols in Molecular Biology (1999) 4th Ed, John Wiley & Sons, Inc (а также на полную версию Current Protocols in Molecular Biology).
В общем плане настоящее изобретение относится к Т-лимфоцитам (Т-клеткам), подвергаемым манипуляциям in vitro, которые при инъекции in vivo способны приводить антигены (например, опухолевые, бактериальные или вирусные антигены) в контакт с профессиональными антигенпрезентирующими клетками. Однако настоящее изобретение также относится к манипуляциям Т-клетками in vivo. Более конкретно, изобретение относится к: а) трансдуцированным/трансфицированным in vitro Т-лимфоцитам, содержащим экзогенные гены, кодирующие опухолевый антиген, для стимуляции иммунного ответа против опухоли; и b) Т-лимфоцитам, нагруженным in vitro пептидами, кодирующими эпитопы опухолевых антигенов. Т-клетки могут также содержать сильный антиген, например HSV-Tk, для мониторинга эффективности вакцинации.
Имелись сообщения о том, что Т-клетки являются подходящими мишенями для переноса генов, например, посредством ретровирусных векторов. В частности, описано применение Т-клеток, экспрессирующих опухолевые антигены, для противоопухолевой вакцинации. Однако также сообщалось, например в EP 0905786, о том, что некий эффект имеет место посредством Т-клеток, действующих в качестве антигенпрезентирующих клеток (APC). В отличие от данной точки зрения, авторами изобретения в настоящее время показано, что Т-клетки действуют путем воздействия на APC трансгена, который затем представляется APC. Иными словами, Т-клетки воздействуют на APC трансгенным продуктом для процессинга и представления антигена. В термин «воздействие» авторы изобретения включают приведение трансгена в контакт с APC, так что происходит связывание и/или захват трансгенного продукта. APC интернализует антиген и процессирует его для представления.
В термин «процессинг антигена» авторы изобретения включают деградацию антигена с образованием более коротких пептидных последовательностей и ассоциацию пептида с молекулами МНС. Два различных класса молекул МНС, МНС класса I и МНС класса II, регулируют представление антигенов CD8+ или CD4+ клеткам соответственно. Представление антигена, строго говоря, представляет собой активацию T-клеток через Т-клеточные рецепторы, которые специфично распознают антигенный пептид в ассоциации с молекулами MHC класса I или класса II на поверхности APC; однако B-клетки также способны распознавать и связывать некоторые антигены.
Авторами изобретения также обнаружено, что настоящая система предоставляет эффективный способ доставки антигена в лимфатическую систему и, особенно, в лимфатические узлы. T-клетки могут вводиться местно, но авторы изобретения также полагают, что T-клетки способны эффективно мигрировать в лимфатические узлы, даже если их вводят в удаленном участке. Лимфатические узлы функционируют как иммунный фильтр для жидкости организма, известной как лимфа. Лимфатические узлы расположены по всему организму. При том, что они состоят по большей части из В-клеток, дендритных клеток и макрофагов, узлы дренируют жидкость из большей части тканей человека. Антигены фильтруются из лимфы в лимфатическом узле до возвращения лимфы в циркуляцию. Сходным образом в селезенке макрофаги и дендритные клетки, которые захватывают антигены, представляют данные чужеродные вещества T- и B-клетки, инициирующие впоследствии иммунный ответ.
Изобретение далее относится к клеточно-зависимой системе доставки антигена. В данной системе антиген, или полинуклеотид, кодирующий антиген, вводят в одну или несколько клеток ex vivo и затем вводят пациенту.
T-клетки по настоящему изобретению могут вводиться отдельно, но в общем их вводят в виде фармацевтической композиции.
APC и иммунный ответ
Как указывалось выше, настоящее изобретение относится к доставке антигена антигенпрезентирующей клетке (APC). APC включают в себя макрофаги, дендритные клетки, В-клетки и любые другие клеточные типы, экспрессирующие молекулу MHC.
Макрофаги и клетки-фагоциты моноцитарного ростка постоянно находятся в тканях и особо хорошо приспособлены для эффективного представления антигена. Они в основном экспрессируют молекулы MHC класса II и со своими фагоцитарными характеристиками исключительно эффективны в плане поглощения макромолекулярного материала или материала в виде частиц, его расщепления, его процессинга в интенсивной лизосомальной системе с образованием формы антигенных пептидов и экспрессии пептидов на поверхности клетки для распознавания T-лимфоцитами.
Дендритные клетки, названные так из-за своего разветвленного строения, обнаруженные во многих органах по всему организму, имеют костномозговое происхождение и обычно экспрессируют большие количества антигена MHC класса II. Дендритные клетки активно двигаются и могут рециркулировать между кровяным руслом и тканями. Дендритные клетки являются антигенпрезентирующими клетками с уникальной способностью индуцировать первичные иммунные реакции, обеспечивая таким образом формирование иммунологической памяти. Дендритные клетки в незрелом состоянии имеют высокую фагоцитарную способность. После захвата антигена незрелые дендритные клетки мигрируют в лимфатические узлы, где после созревания активируют циркулирующие антигенспецифические лимфоциты. Таким образом, они тоже считаются важными APC. Клетки Лангерганса являются примером дендритных клеток, которые локализованы в коже.
B-лимфоциты, хотя и не активные в плане фагоцитоза, являются позитивными по классу II и обладают антигенспецифическими рецепторами клеточной поверхности, иммуноглобулинами или молекулами антител. Вследствие своего потенциала к связыванию антигена с высоким сродством, B-клетки наделены уникальной способностью концентрировать на своей поверхности малые количества антигена, эндоцитировать его, процессировать его и представлять его в виде антигенного пептида в ассоциации с антигеном MHC на своей поверхности. За счет этого B-клетки становятся исключительно эффективными APC.
Таким образом, иммунный ответ на чужеродный антиген требует присутствия антигенпрезентирующей клетки (APC) (обычно макрофага или дендритной клетки) в комбинации с B-клеткой или Т-клеткой. Когда APC представляет антиген на своей клеточной поверхности B-клетке, В-клетка получает сигнал к пролиферации и продукции антител, которые специфично связывают тот самый антиген. Если антитело связывается с антигенами на бактериях или паразитах, оно действует как сигнал для полиморфно-ядерных лейкоцитов или макрофагов к их поглощению (фагоцитозу) и уничтожению. Другой важной функцией антител является инициация «разрушающего каскада комплемента». При связывании антител с клетками или бактериями белки сыворотки, называемые комплементом, связываются с иммобилизованными антителами и разрушают бактерии путем образования в них отверстий. Антитела также могут служить сигналом для клеток-естественных киллеров и макрофагов к уничтожению клеток, инфицированных вирусами или бактериями.
Если APC представляет антиген Т-клеткам, T-клетки становятся активированными. Активированные T-клетки пролиферируют и становятся секреторными в случае CD4+ T-клеток, или, если они являются CD8+ T-клетками, они становятся активированными в плане уничтожения клеток-мишеней, которые специфично экспрессируют антиген, представленный APC. Продукция антител и активность CD8+ киллерных T-клеток преимущественно регулируется субпопуляцией CD4+ хелперных Т-клеток. CD4+ T-клетки обеспечивают данные клетки факторами роста или сигналами, которые дают им сигнал к пролиферации и более эффективному функционированию.
Т-клетки
T-клетки или Т-лимфоциты обычно подразделяют на две основных субпопуляции, которые являются функционально и фенотипически (что можно идентифицировать) различными. Субпопуляция T-хелперов, также называемых CD4+ T-клетками, является подходящим координатором иммунной регуляции. Основной функцией Т-хелперной клетки является усиление или потенцирование иммунных реакций путем секреции специализированных факторов, которые активируют другие лейкоциты для борьбы с инфекцией.
Другой важный тип T-клетки называется Т-киллерной субпопуляцией или CD8+ Т-клеткой. Данные клетки имеют значение при непосредственном уничтожении некоторых опухолевых клеток, инфицированных вирусом клеток и иногда паразитов. Они часто зависят от вторичных лимфоидных органов (лимфатических узлов и селезенки), как от участков, где происходит активация, но также их находят в других тканях организма, более очевидно, в печени, легких, крови и кишечном и репродуктивном трактах.
При использовании Т-клеток в способах ex vivo по изобретению, данные T-клетки обычно представляют собой Т-лимфоциты, выделенные из крови пациента или донора. T-клетки получают любым подходящим способом (например, описанным в US-A-4663058) и могут быть обогащены и/или очищены стандартными способами, включая опосредованное антителами разделение. Т-клетки могут использоваться в комбинации с другими иммунными клетками, полученными из того же или другого субъекта. Альтернативно в качестве источника Т-клеток и других клеточных типов может использоваться цельная кровь или обогащенная лейкоцитами кровь или очищенные лейкоциты. Особенно предпочтительно применение хелперных T-клеток (CD4+). Альтернативно могут использоваться другие Т-клетки, такие как CD8+ клетки. Также может быть удобным применять клеточные линии, такие как Т-клеточные гибридомы, незрелые Т-клетки периферического или тимусного происхождения и NK-T-клетки. В предпочтительном осуществлении Т-клетки, используемые по настоящему изобретению, представляют собой Т-клетки, которые могут переносить антигенспецифичную супрессию на другие T-клетки.
Введение полипептидов и последовательностей нуклеиновой кислоты в Т-клетки
Антигенные полипептидные вещества могут вводиться в Т-клетки в виде полипептидов как таковых или путем введения конструкций нуклеиновой кислоты/вирусных векторов, кодирующих полипептид, в клетки в условиях, которые обеспечивают экспрессию полипептида в Т-клетке.
Предпочтительно полинуклеотид для применения по изобретению в векторе функционально связан с последовательностью контроля, которая способна обеспечивать экспрессию кодирующей последовательности клеткой хозяина, то есть вектор является экспрессирующим вектором. Термин «функционально связанный» означает, что описанные компоненты находятся во взаимоотношениях, позволяющих им функционировать в присущей им манере. Регуляторная последовательность, «функционально связанная» с кодирующей последовательностью, лигирована таким путем, что экспрессия кодирующей последовательности достигается в условиях, совместимых с такими контрольными последовательностями.
Контрольные последовательности могут модифицироваться, например, путем добавления дальнейших элементов регуляции транскрипции, чтобы уровень транскрипции, направляемой последовательностями контроля, лучше реагировал на модуляторы транскрипции.
Векторы по изобретению могут вводиться в Т-клетки путем трансформации или трансфекции, как описано ниже для обеспечения экспрессии антигена.
Настоящее изобретение также относится к Т-клеткам, в которые введены, то есть загружены антигены, например, в виде полипептидов.
Для простоты ссылки антигенные полипептиды и кодирующие их полинуклеотиды будут указываться как «антиген».
Подходящие неограничивающие способы введения обоих генов и полипептидов в Т-клетки обсуждаются ниже.
Любой подходящий способ трансформации Т-клетки может использоваться. Неограничивающими примерами доступных в настоящее время механизмов доставки являются электропорация, трансформация с применением фосфата кальция и бомбардировка частицами. Однако перенос конструкции может проводиться любым из указанных способов, которые физически или химически повышают проницаемость клеточной мембраны. Подходящие способы описаны более подробно ниже.
1. Электропорация
В некоторых предпочтительных осуществлениях настоящего изобретения антиген вводят в клетки путем электропорации. В электропорации задействуется воздействие на суспензию клеток и ДНК высоковольтного электрического разряда.
Считается, что условия электропорации могут оптимизироваться для Т-клеток. Можно, в частности, оптимизировать такие параметры, как вольтаж, емкость, время и композиция среды для электропорации. Выполнение других рутинных настроек известно специалистам в данной области.
2. Бомбардировка частицами
В одном из способов переноса голой ДНК-конструкции в клетки участвует бомбардировка частицами. Данный способ зависит от способности ускорять покрытые ДНК микроснаряды до высоких скоростей, что позволяет им пронизывать клеточные мембраны и проникать в клетки без их уничтожения. Используемые микроснаряды состоят из биологически инертных веществ, таких как вольфрамовые, платиновые и золотые гранулы.
Считается, что в некоторых случаях для доставки ДНК в клетку-реципиент нет необходимости в осаждении ДНК на металлических частицах с использованием бомбардировки частиц. Считается, что частицы могут содержать ДНК, а не быть покрытыми ДНК. Следовательно, предполагается, что покрытые ДНК частицы могут повышать уровень доставки ДНК посредством бомбардировки частицами, но само по себе это не обязательно.
Разработаны некоторые устройства для ускорения малых частиц. Одно из таких устройств основывается на разряде высокого напряжения, генерирующем электрический ток, который, в свою очередь, обеспечивает движущую силу. Другой способ задействует применение системы доставки Biolistic Particle Delivery System, которая может использоваться для пролета частиц, покрытых ДНК, через экран, такой как экран из нержавеющей стали или материала Nytex, на поверхность фильтра, покрытую клетками из суспензии. Данный экран диспергирует частицы так, что они не доставляются в клетки-реципиенты в виде больших агрегатов. Полагают, что встраивание экрана между устройством бомбардировки и бомбардируемыми клетками снижает размер бомбардируемых агрегатов и может вносить вклад в более высокую частоту трансформации за счет снижения повреждения, наносимого клеткам-реципиентам снарядами, которые слишком велики.
Для бомбардировки клетки в суспензии предпочтительно концентрируют на фильтрах или, альтернативно, на твердой культуральной среде. Клетки, подлежащие бомбардировке, располагают на подходящем расстоянии ниже планшета, останавливающего макроскопические снаряды. Если это требуется, один или несколько экранов также помещают между устройством ускорения и бомбардируемыми клетками.
Считается, что может возникнуть намерение настроить различные параметры бомбардировки в мелкомасштабных исследованиях с целью полной оптимизации условий. В частности, может возникнуть намерение настроить физические параметры, такие как расстояние пропуска, расстояние полета, расстояние до ткани и давление гелия. Также можно оптимизировать факторы снижения травмы путем модификации условий, которые влияют на физиологическое состояние клеток реципиента и которые поэтому могут влиять на эффективность трансформации и интеграции. Например, осмотическое состояние, гидратация ткани и стадия субкультивирования или клеточный цикл Т-клетки-реципиента могут доводиться до оптимальной трансформации. Выполнение других рутинных настроек известно специалистам в данной области.
3. Трансформация вирусами
a. Аденовирусная инфекция
В одном из способов доставки конструкций нуклеиновой кислоты используется аденовирусный экспрессирующий вектор. Хотя аденовирусные векторы, как известно, обладают низкой способностью к интеграции в геномную ДНК, данная характеристика уравновешивается высокой эффективностью переноса генов, предоставляемой данными векторами. «Аденовирусный экспрессирующий вектор», как подразумевается, включает в себя те конструкции, содержащие последовательности аденовируса, которых достаточно для (a) поддержки упаковки конструкции и (b) конечной экспрессии конструкции, которая была клонирована.
Вектор включает в себя генноинженерную форму аденовируса. Знание генной организации аденовируса, вируса с линейной, двухцепочечной ДНК размером 36 т.п.н., позволяет осуществлять замену больших фрагментов аденовирусной ДНК чужеродными последовательностями размером до 7 т.п.н. В отличие от ретровируса, аденовирусная инфекция клетки хозяина не приводит к хромосомной интеграции, поскольку аденовирусная ДНК может реплицироваться по типу эписомы без потенциальной генотоксичности. Также аденовирусы структурно стабильны, и после интенсивной амплификации не отмечали никаких перестановок в геноме.
Аденовирус особенно подходит для применения в качестве вектора переноса генов из-за его генома средних размеров, простоты манипуляций с ним, высокого титра, широкого интервала клеток-мишеней и высокой инфекционности. Оба конца вирусного генома содержат инвертированные повторы (ITR) длиной 100-200 пар оснований, где находятся цис-элементы, необходимые для репликации и упаковки вирусной ДНК. Ранние (E) и поздние (L) области генома содержат различные транскрипционные единицы, которые подразделены по началу репликации вирусной ДНК. Область E1 (E1A и E1B) кодирует белки, ответственные за регуляцию транскрипции вирусного генома и небольшого количества клеточных генов. Экспрессия области E2 (E2A и E2B) приводит к синтезу белков для репликации вирусной ДНК. Данные белки вовлечены в репликацию ДНК, экспрессию поздних генов и запирание клетки хозяина. Продукты поздних генов, включающие большинство белков вирусного капсида, экспрессируются только после значительного процессинга единичного первичного транскрипта, выходящего с главного позднего промотора (MLP). MLP (расположенный на 16,8 m.u.) является особенно эффективным во время поздней фазы инфекции, и все мРНК, выходящие с данного промотора, обладают 5'-концевой тройственной лидерной (TPL) последовательностью, которая обеспечивает этим мРНК предпочтение для трансляции.
В настоящей системе рекомбинантный аденовирус получают путем гомологичной рекомбинации между вектором-челноком и провирусным вектором. Вследствие возможной рекомбинации между двумя провирусными векторами в данном процессе может генерироваться аденовирус дикого типа. Поэтому критичным является выделение единственного клона вируса из индивидуальной бляшки и оценка структуры его генома.
Получение и размножение настоящих аденовирусных векторов, которые характеризуются дефицитом репликации, зависит от уникальной вспомогательной клеточной линии, обозначенной 293, которая трансформирована из клеток эмбриональной почки человека введением ДНК-фрагментов Ad5, и полученная линия конститутивно экспрессирует белки E1. Поскольку область E3 из генома аденовируса несущественна, настоящие аденовирусные векторы, функционирующие с помощью клеток 293, несут чужеродную ДНК в E1, в D3 или в обеих областях. В природе аденовирус может упаковывать примерно 105% генома дикого типа, обеспечивая возможность добавления примерно 2 дополнительных т.п.н. ДНК. В комбинации примерно с 5,5 т.п.н. ДНК, которой замещены E1- и E3-области, максимальная емкость настоящих аденовирусных векторов составляет до 7,5 т.п.н., или примерно 15% от общей длины вектора. Более 80% аденовирусного генома остается в виде каркаса вектора.
Вспомогательные клеточные линии могут происходить от человеческих клеток, таких как клетки эмбриональной почки человека, мышечные клетки, кроветворные клетки или другие человеческие эмбриональные мезенхимальные или эпителиальные клетки. Альтернативно вспомогательные клетки могут происходить от клеток других видов млекопитающих, которые переносят аденовирус человека. Такие клетки включают в себя, например, клетки Vero, или другие эмбриональные мезенхимальные или эпителиальные клетки обезьян. Как указывалось выше, предпочтительной вспомогательной клеточной линией является 293.
Кроме того требования, что аденовирусный вектор должен быть дефективным по репликации, или, по меньшей мере, дефективным при определенных условиях, природа аденовирусного вектора не считается значимой для успешного воплощения изобретения. Аденовирус может относиться к любому из 42 различных известных серотипов из подгрупп A-F. Аденовирус типа 5 подгруппы C является предпочтительным исходным материалом для получения дефективного по репликации при определенных условиях аденовирусного вектора для применения по настоящему изобретению. Такое условие связано с тем, что аденовирус типа 5 является человеческим аденовирусом, о котором накоплено большое количество биохимической и генетической информации, и он исторически использовался в большинстве конструкций, использующих аденовирус в качестве вектора.
Как утверждалось выше, типичный вектор по настоящему изобретению дефективен по репликации и не содержит области аденовируса E1. Таким образом, наиболее удобным является введение трансформирующей конструкции в положении, из которого удалены кодирующие E1 последовательности. Однако положение вставки конструкции в аденовирусные последовательности не являются критичными в контексте изобретения. Полинуклеотид, кодирующий интересующий ген, может также встраиваться в место удаленной области E3 в векторах замещения E3 или в область E4, где вспомогательная клеточная линия или вспомогательный вирус компенсируют дефект E4.
Рост и манипуляции с аденовирусом известны специалистам в данной области, и данный вирус характеризуется большим разнообразием хозяев in vitro и in vivo. Данная группа вирусов может быть получена с высоким титром, например 109-1011 бляшкообразующих единиц на мл, и они высокоинфекционны. Жизненный цикл аденовируса не требует интеграции в геном клетки хозяина. Чужеродные гены, доставляемые аденовирусными векторами, являются эписомными и поэтому характеризуются низкой генотоксичностью в отношении клеток хозяина. Не сообщалось о побочных эффектах в исследованиях по вакцинации аденовирусами дикого типа, что демонстрирует их безопасность и терапевтический потенциал также в качестве векторов для переноса генов in vivo.
b. Инфекция AAV
Адено-ассоциированный вирус (AAV) является привлекательной векторной системой для применения по настоящему изобретению, поскольку он характеризуется высокой частотой интеграции, и он может инфицировать неделящиеся клетки, что, таким образом, делает его удобным для доставки генов в клетки млекопитающих в культуре ткани. AAV характеризуется широким интервалом инфекционности. Подробности, касающиеся получения и применения rAAV-векторов, описаны в патенте США № 5139941 и в патенте США № 4797368, каждый из которых включен сюда в качестве ссылки.
Рекомбинантные AAV-векторы также успешно используют для трансдукции in vivo и in vitro маркерных генов и генов, вовлеченных в заболевания человека. Недавно AAV-вектор был одобрен для испытаний фазы I на людях для лечения кистозного фиброза.
AAV представляет собой зависимый парвовирус, который требует совместной инфекции другим вирусом (аденовирусом или представителем семейства герпесвирусов) для прохождения продуктивной инфекции культивируемых клеток. В отсутствие совместной инфекции вспомогательным вирусом геном AAV дикого типа интегрируется посредством его концов в человеческую хромосому 19, где он остается в латентном состоянии как провирус. Однако rAAV не ограничен в плане интеграции хромосомой 19, если также не экспрессируется белок AAV Rep. Когда клетка, несущая провирус AAV, подвергается суперинфекции вспомогательным вирусом, геном AAV «спасается» из хромосомы или из рекомбинантной плазмиды, и устанавливается нормальная продуктивная инфекция.
Обычно рекомбинантный вирус AAV (rAAV) получают путем совместной трансфекции плазмидой, содержащей интересующий ген, фланкированный двумя терминальными повторами AAV, и экспрессирующей плазмидой, содержащей кодирующие последовательности AAV дикого типа без терминальных повторов, например pIM45. Клетки также инфицировали или трансфицировали аденовирусом или плазмидами, несущими аденовирусные гены, требуемые для вспомогательной функции для AAV. Запасы вируса rAAV, полученные таким способом, контаминируют аденовирусом, которые должны быть физически отделены от частиц rAAV (например, центрифугированием в градиенте плотности хлорида цезия). Альтернативно могут использоваться аденовирусные векторы, содержащие кодирующие области AAV, или клеточные линии, содержащие кодирующие области AAV и некоторые или все аденовирусные гены. Также могут использоваться клеточные линии, несущие ДНК rAAV в качестве интегрированного провируса.
c. Ретровирусная инфекция
В одном из предпочтительных способов по настоящему изобретению применяются ретровирусы. Ретровирусный вектор по настоящему изобретению может происходить или быть получаемым из любого подходящего ретровируса. Идентифицировано большое количество различных ретровирусов. Примеры включают в себя: вирус лейкоза мыши (MLV), вирус иммунодефицита человека (ВИЧ), вирус иммунодефицита обезьян, вирус Т-клеточного лейкоза человека (HTLV), вирус инфекционной анемии лошади (EIAV), вирус опухоли молочной железы мыши (MMTV), вирус саркомы Рауса (RSV), вирус саркомы Фуджинами (FuSV), вирус мышиного лейкоза Молони (Mo-MLV), вирус мышиной остеосаркомы FBR (FBR MSV), вирус мышиной саркомы Молони (Mo-MSV), вирус мышиного лейкоза Абельсона (A-MLV), вирус птичьего миелоцитоматоза 29 (MC29) и вирус птичьего эритробластоза (AEV). Подробный список ретровирусов может быть найден в Coffin et al., 1997, "retroviruses", Cold Spring Harbour Laboratory Press Eds: JM Coffin, SM Hughes, HE Varmus p. 758-763.
Подробности структуры генома некоторых ретровирусов могут быть найдены в данной области. Для примера, подробности по ВИЧ и Mo-MLV могут быть найдены в NCBI Genbank (инвентарные номера геномов № AF033819 и AF033811 соответственно).
Ретровирусы в общих чертах могут быть разделены на две категории: а именно «простые» и «комплексные». Ретровирусы могут далее подразделяться на семь групп. Пять из этих групп представляют собой ретровирусы с онкогенным потенциалом. Оставшиеся две группы представляют собой лентивирусы и спумавирусы. Обзор данных ретровирусов представлен в Coffin et al., 1997 (ibid).
Группа лентивирусов может даже далее подразделяться на вирусы «приматов» и «организмов, не относящихся к приматам». Примеры лентивирусов приматов включают в себя вирус иммунодефицита человека (ВИЧ), агент, вызывающий синдром приобретенного иммунодефицита человека (СПИД), и вирус иммунодефицита обезьян (SIV). Группа лентивирусов организмов, не относящихся к приматам, включает в себя прототип «медленный вирус» visna/maedi (VMV), а также родственный ему вирус артрита-энцефалита козы (CAEV), вирус инфекционной анемии лошади (EIAV) и описанные позднее вирус иммунодефицита кошек (FIV) и вирус иммунодефицита крупного рогатого скота (BIV).
Различие между семейством лентивирусов и другими типами ретровирусов состоит в том, что лентивирусы обладают способностью инфицировать делящиеся и неделящиеся клетки. Другие лентивирусы, такие как MLV, наоборот, не способны инфицировать неделящиеся клетки, такие как те, что составляют ткань мышцы, головного мозга, легкого и печени.
Каждый ретровирусный геном содержит гены, называемые gag, pol и env, которые кодируют белки вириона и ферменты. В провир