Электропряденые аморфные фармацевтические композиции
Иллюстрации
Показать всеНастоящее изобретение относится к медицине, конкретно к применению электропрядения, т.е. процесса изготовления полимерных нановолокон из раствора или расплава под действием электрических сил, для изготовления стабильных твердых дисперсий аморфных лекарственных средств в полимерных нановолокнах. Твердые дисперсии аморфных лекарственных средств являются стабильными, и для них можно использовать более высомолекулярные полимеры для облегчения процесса растворения лекарственных средств. 8 н. и 40 з.п. ф-лы, 4 ил., 5 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к стабилизации твердых дисперсий аморфных лекарственных средств в полимерных нановолокнах, способу их изготовления и фармацевтическим композициям, содержащим указанные нановолокна.
Уровень техники
С появлением комбинаторной химии и скрининга высокой пропускной способности большая часть возможных лекарственных средств, отобранных для дальнейшей разработки, оказалась в высокой степени гидрофобной, с низкой или ничтожно малой растворимостью в воде. С целью улучшения перорального всасывания указанных плохо растворимых в воде лекарственных средств в фармацевтической промышленности производятся обширные исследования в области изготовления лекарственных препаратов с использованием нескольких стратегий, таких как образование солей, комплексообразование, уменьшение размеров частиц, пролекарства, мицеллизация и твердые дисперсии.
Несмотря на то что твердые дисперсии известны последние четыре десятилетия, к данной технологии, как представляется, вновь возникает интерес, как описано у Serajudin et al., Journal of Pharmaceutical Sciences, 1999, 88(10), 1058, и у Habib et al., Pharmaceutical Solid Dispersion Technology (Technomic, Lancaster, PA, 2001). Твердые дисперсии можно определить как дисперсию одного или нескольких активных ингредиентов в инертном носителе или матриксе в твердом состоянии, изготовленную способом плавления, способом растворителя и способом плавления-растворителя. Твердые дисперсии классифицируют на шесть главных категорий: (1) простые эвтектические смеси, (2) твердые растворы, (3) стекловидные растворы суспензий, (4) осаждение лекарственного средства в аморфной форме в кристаллическом носителе, (5) осаждение лекарственного средства в аморфной форме в аморфном носителе и (6) любая комбинация указанных групп.
В настоящее время используются два способа формирования твердых дисперсий - способы плавления и растворителя. В способе плавления лекарственное средство и носитель расплавляют либо выше температуры плавления (размягчения) компонента с более высокой температурой плавления (размягчения), либо, в некоторых случаях, выше температуры плавления компонента с более низкой температурой плавления, при условии, что другой, не расплавленный, компонент хорошо растворяется в первом. Сплавленную смесь быстро гасят и распыляют для получения свободно текущих порошков для наполнения ими капсул или для таблетирования. Способ плавления требует, чтобы как лекарственное средство, так и наполнитель были термостабильными при температуре обработки.
В способе растворителя лекарственное средство и носитель растворяют в одном или нескольких смешивающихся органических растворителях с образованием раствора. Удаление органического растворителя (растворителей) осуществляют любым из следующих способов или комбинированными способами, такими как выпаривание растворителя, осаждение нерастворителем, лиофильная сушка, распылительная сушка и распылительное замораживание. Среди нескольких недостатков способа растворителя есть следующие: использование больших объемов органических растворителей, наличие остаточных органических растворителей в полученной композиции, сбор, возвращение на повторную переработку и/или удаление органических растворителей.
Твердые дисперсии лекарственных средств с плохой растворимостью, изготовленные как способом плавления, так и способом растворителя, обычно обладают более высокими скоростями растворения по сравнению с тем же лекарственным средством в кристаллической форме. Однако скорость растворения лекарственного средства может снижаться растворением носителя, обычно высокомолекулярного полимера. Таким образом, твердые дисперсии обычно изготавливают из полимеров с низкой или средней молекулярной массой.
Из уровня техники известен патент WO 01/127365 А1, 2001.04.19 (наиболее близкий аналог), описывающий продукт, включающий, по крайней мере, электропряденое волокно из гомогенизированной смеси, содержащей, по крайней мере, один гидрофильный полимер, по крайней мере, один гидрофобный полимер, также продукт дополнительно содержит усиливающую терапевтическое действие добавку, выбранную из антибиотика, бактерицида, фунгицида и т.п.
Все еще существует потребность в разработке процесса, посредством которого можно получать твердые дисперсии лекарственных средств, имеющих аморфное строение, которые остаются стабильными и для которых можно использовать более высокомолекулярные полимеры для облегчения процесса растворения указанных лекарственных средств.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
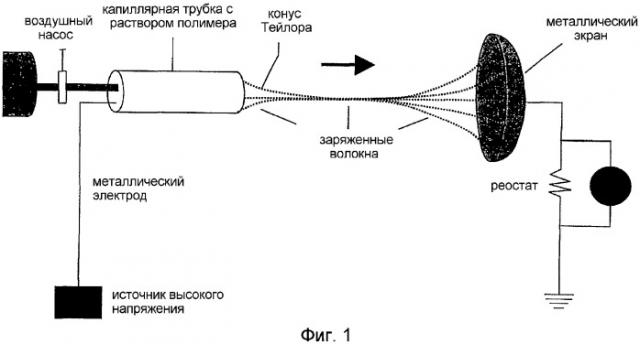
Фигура 1 демонстрирует схему электропрядения вязких композиций лекарственное средство/полимер как в растворе, так и в расплаве для получения нановолокон.
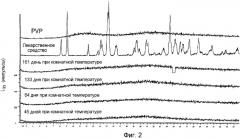
Фигура 2 показывает рентгеновскую порошковую дифрактограмму РСА порошков электропряденых волокон из гемигидрата 6-ацетил-3,4-дигидро-2,2-диметил-транс(+)-4-(4-фторбензоиламин)-2Н-бензо[b]пиран-3-ола во время хранения в течение периода времени до 161 дня при 25°С. Сравнение с РСА порошков кристаллического соединения, также показанное на фигуре, подтверждает аморфную природу электропряденого волокна.
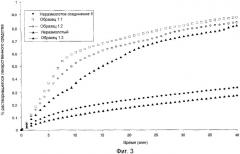
Фигура 3 демонстрирует улучшенные in vitro профили растворения электропряденых аморфных волокон из гемигидрата 6-ацетил-3,4-дигидро-2,2-диметил-транс(+)-4-(4-фторбензоиламин)-2Н-бензо[b]пиран-3-ола по сравнению с кристаллическими.
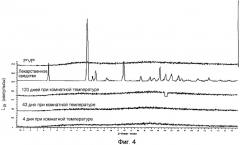
Фигура 4 показывает РСА порошков электропряденых волокон из 3-гидрокси-2-фенил-N-[1-фенилпропил]-4-хинолинкарбоксамида (Talnetant) во время хранения в течение периода времени до 120 дней при 25°С, комнатной температуре. Для сравнения в фигуру включена РСА порошков кристаллического лекарственного средства и поливинилпирролидона (PVP). Рентгеновские дифрактограммы показывают расплывчатость (эффект гало), без каких бы то ни было резких пиков, что подтверждает аморфную природу электропряденого образца.
Подробное описание изобретения
Настоящее изобретение относится к открытию того факта, что технологию электропрядения, т.е. процесса изготовления полимерных нановолокон как из раствора, так и из расплава под действием электрических сил, можно использовать для изготовления стабильных твердых дисперсий аморфной формы лекарственного средства в полимерных нановолокнах.
Аморфные твердые вещества представляют собой неупорядоченные материалы, которые не имеют протяженного порядка, как у кристаллических материалов. Аморфные материалы демонстрируют как композиционную, так и структурную неупорядоченность. Существует четкое различие между композиционной и структурной неупорядоченностью. При композиционной неупорядоченности атомы располагаются упорядоченными множествами, как в кристаллических материалах. Расстояние между атомами является одинаковым, лишь только атомы разных типов располагаются случайным образом. При структурной неупорядоченности все расстояния между связями имеют случайную длину и случайные углы. Следовательно, не существует протяженной упорядоченности, и, следовательно, не существует определенных четких рентгеновских дифрактограмм. Аморфное твердое вещество представляет собой стекло, в котором атомы и молекулы существуют в виде полностью неоднородного массива. Аморфные твердые вещества не имеют граней и не могут быть идентифицированы как габитусы или полиморфы. Поскольку свойства аморфных твердых веществ не зависят от направления, указанные твердые вещества называются изотропными. Аморфные твердые вещества отличаются уникальной температурой стеклования, т.е. температурой, при которой происходит переход от состояния стекла до состояния каучука.
Вследствие отсутствия протяженной упорядоченности аморфные материалы находятся в неустойчивом (возбужденное состояние) равновесии, что приводит как к физической, так и химической нестабильности. Физическая нестабильность проявляется в более высокой растворимости в воде по сравнению с кристаллическим лекарственным средством. Более высокая растворимость аморфного лекарственного средства приводит к более высокой скорости растворения и к более хорошей биодоступности при пероральном введении.
Фармацевтическая промышленность использует аморфное состояние плохо растворимого в воде лекарственного средства для повышения его растворимости в воде и улучшения его биодоступности при пероральном введении. Однако, как было сказано выше, аморфное состояние обладает нежелательной физической и химической нестабильностью. Это можно преодолеть смешиванием аморфного лекарственного средства с подходящими полимерами, чтобы стабилизировать аморфное состояние для достижения желательного срока хранения лекарственного средства. Сообщалось [Zografi et al., Pharm. Res. 1999, 16, 1722-1728], что комбинация полимер-лекарственное средство должна иметь некоторое специфическое взаимодействие для стабилизации аморфного лекарственного средства.
Электропряденые волокна по настоящему изобретению, как ожидается, будут иметь диаметры в диапазоне нанометров и, следовательно, обеспечивать очень большую площадь поверхности. Указанная чрезвычайно большая площадь поверхности может резко повысить скорость растворения высокомолекулярного полимерного носителя, а также присутствующего в нем лекарственного средства.
Подходящую лекарственную форму, такую как пероральная или парентеральная лекарственная форма, включая формы для внутрилегочного введения, можно изготовить при тщательном рассмотрении полимерных носителей, с точки зрения их физико-химических свойств, а также их регуляторного статуса. Другие фармацевтически приемлемые наполнители могут быть включены для улучшения стабилизации или деагломерации наночастиц аморфного лекарственного средства. Фармацевтические наполнители могут также иметь другие свойства, такие как свойство повышать всасывание.
Электропряденые фармацевтические лекарственные формы можно изготавливать таким образом, чтобы обеспечивать любое количество профилей скорости растворения, таких как быстрое растворение, немедленное или отсроченное растворение или модифицированный профиль растворения, такой как замедленное и/или импульсное высвобождение.
Маскировка вкуса активного агента также может достигаться использованием полимеров, имеющих функциональные группы, способные обеспечивать специфические взаимодействия с лекарственной частью. Электропряденые лекарственные формы могут быть представлены в обычных форматах лекарственных форм, таких как прессованные таблетки, капсулы, пастилки или пленки. Указанные обычные лекарственные формы могут представлять собой системы с немедленным, отсроченным и модифицированным высвобождением, которые могут быть изготовлены путем должного подбора полимерного носителя для комбинации с активным агентом/лекарственным средством, с использованием технологий, хорошо известных специалистам.
Один вариант осуществления настоящего изобретения заключается в изготовлении частиц лекарственного средства в аморфной форме, гомогенно внедренных в полимерные нановолокна, таким образом, чтобы лекарственное средство было легко биодоступным, независимо от пути введения.
Другой вариант осуществления настоящего изобретения заключается в изготовлении наночастиц лекарственного средства, имеющих аморфную морфологию, которые гомогенно внедрены в полимерные нановолокна.
Исходное соединение, используемое по настоящему изобретению, может находиться, с морфологической точки зрения, как в кристаллическом, так и в аморфном состоянии. Как можно видеть из настоящего документа, настоящее изобретение относится к новому носителю, который обеспечивает средство, позволяющее кристаллическую форму лекарственного средства стабилизировать в его аморфной форме или использовать аморфную форму лекарственного средства и сохранить ее морфологию в контролируемой окружающей среде, т.е. в спряденных волокнах. Его можно использовать, как упомянуто, в качестве средства увеличения площади поверхности (размеры наночастиц и т.п.) и для улучшения его скорости растворения.
Электропрядение, обычно называемое электростатическим вытягиванием нити, представляет собой процесс изготовления волокон, диаметры которых находятся в пределах 100 нм. Данный процесс состоит из приложения высокого напряжения к полимерному раствору или расплаву для получения полимерной струи. По мере прохождения струи по воздуху она удлиняется под действием отталкивающей электростатической силы с образованием нановолокон. Данный процесс описан в литературе с 1930 г. Ряд полимеров как натурального, так и синтетического происхождения, имеющих оптимальные характеристики, подвергали процессу электропрядения в соответствующих условиях для получения нановолокон (см. Reneker et al., Nanotechnology, 1996, 7, 216). Были предложены различные варианты применения указанных электропряденых волокон, такие как воздушные фильтры, молекулярные композиты, сосудистые трансплантаты и перевязочный материал.
Патент США №4 043 331 предназначен для применения их в качестве перевязочного материала, в то время как патент США №4 044 404 и патент США №4 878 908 относятся к созданию совместимой с кровью выстилки для протезирующего устройства. Все описанные в них не растворимые в воде полимеры не являются фармацевтически приемлемыми для применения по настоящему изобретению, однако описанные водорастворимые полимеры, как представляется, являются фармацевтически приемлемыми. Ни один из препаратов в данных патентах не описывает рабочего примера электропряденого волокна с активным агентом. Патенты заявляют применение ферментов, лекарственных средств и/или активированного угля на поверхности нановолокон, изготовленных иммобилизацией активных частей таким образом, что они могут действовать на участке применения и «не распространяются по организму».
ЕР 542514, US 5 311 884 и US 5 522 879 имеют отношение к применению пряденых волокон в пьезоэлектрическом биомедицинском устройстве. Пьезоэлектрические свойства имеются у фторированных полимеров, таких как полимеры, полученные из сополимера винилиденфторида и тетрафторэтилена, которые не считаются фармацевтически приемлемыми полимерами для применения по настоящему изобретению.
В патенте США №5 024 671 используются электропряденые пористые волокна в качестве материала для сосудистых трансплантатов, который наполнен лекарственным средством с целью достижения прямой доставки лекарственного средства к участку шва. Пористый материал трансплантата импрегнирован (но не прядением электростатическим способом) лекарственным средством, а биоразлагаемый полимер добавлен для модулирования высвобождения лекарственного средства. Сосудистые трансплантаты также изготавливают из полимеров, которые не являются фармацевтически приемлемыми, таких как политетрафторэтилен или его смеси.
Патент США №5 376 116, патент США №5 575 818, патент США №5 632 772, патент США №5 639 278 и патент США №5 724 004 описывают ту или иную форму протезирующего устройства, имеющего покрытие или выстилку из электропряденого не являющегося фармацевтически приемлемым полимера. Электропряденый внешний слой впоследствии обрабатывается лекарственным средством, таким как средство, описанное в патенте '116 (для протеза молочной железы). Другие патенты описывают ту же технологию и полимеры, но применяют их по-другому, например для внутрипросветных протезов или внутрисосудистых стентов.
Таким образом, настоящее изобретение впервые производит электропряденую композицию фармацевтически приемлемого полимера, в которой один или несколько фармацевтически приемлемых активных агентов или лекарственных средств стабилизированы в своей аморфной форме. Однородный характер данного процесса обеспечивает такое количество волокон, которое позволяет диспергировать среди них наночастицы лекарственных средств. Размер частиц и качество дисперсии обеспечивают большую площадь поверхности лекарственного средства. Одно применение увеличенной площади поверхности лекарственного средства заключается в улучшенной биодоступности в случае плохой растворимости лекарственного средства в воде. Другие применения будут состоять в уменьшении взаимодействий частиц лекарственного средства между собой или с ферментами.
Еще одно применение настоящего изобретения заключается в том, что оно позволяет отсрочить высвобождение лекарственных средств в желудочно-кишечном тракте посредством использования рН-чувствительных полимеров, таких как полимеры группы Eudragit от компании Rohm, в частности полимера Eudragit L100-55.
Настоящее изобретение, таким образом, относится к применению в любой форме электропряденой комбинации «лекарственное средство/полимер», в которой лекарственное средство стабилизировано в аморфной форме; а также в которой полученная комбинация «лекарственное средство/полимер» обеспечивает улучшенную биодоступность плохо растворяющегося в воде лекарственного средства или позволяет модифицировать профиль всасывания лекарственного средства (лекарственных средств). Модификация скорости высвобождения активного соединения после инкорпорирования в полимерные волокна может заключаться в повышении или понижении скорости. Полученная биодоступность активного агента также может быть повышена или понижена по сравнению с лекарственной формой с немедленным высвобождением.
Хотя данный процесс можно использовать для инкорпорации фармацевтически приемлемого лекарственного средства для местной доставки, предпочтительным путем введения, по всей видимости, будет пероральный, внутривенный, внутримышечный или путем ингаляции.
Фармацевтически приемлемый агент, активный агент или лекарственное средство, определенные в настоящем документе, соответствуют руководству Guide to Good Manufacturing Practice Совета Европы: т.е. представляют собой любое вещество или смесь веществ, которое предназначено для использовании в изготовлении лекарственного (медицинского) продукта, и которое, когда его используют для производства лекарственного средства, становится активным ингредиентом лекарственного продукта. Указанные вещества предназначены для предоставления фармакологической активности или другого прямого эффекта для диагностики, лечения, смягчения, обработки или профилактики заболевания или для влияния на структуру или функцию организма. Предпочтительно данное применение осуществляется для млекопитающего, более предпочтительно для человека. Фармакологическая активность может быть профилактической или использоваться для лечения болезненного состояния. Фармацевтические композиции, описанные в настоящем документе, могут, необязательно, содержать один или несколько распределенных в них фармацевтически приемлемых активных агентов или ингредиентов.
В настоящем документе термины «агент», «активный агент», «лекарственная часть» или «лекарственное средство» используются взаимозаменяемым образом.
Растворимость в воде активного агента определяется Фармакопеей Соединенных Штатов. Таким образом, активные агенты, которые отвечают критериям высокорастворимых, свободно растворимых, растворимых и умеренно растворимых, как определено в указанном источнике, входят в объем настоящего изобретения. Полагают, что электропряденая полимерная композиция обеспечивает наибольшие преимущества тем лекарственным средствам, которые являются нерастворимыми или умеренно растворимыми. Однако, поскольку электропряденая полимерная композиция формирует или стабилизирует аморфную форму лекарственного средства, растворимость лекарственного средства может не иметь такого большого значения, как если бы оно было в кристаллическом состоянии.
Волокна по настоящему изобретению будут содержать высокомолекулярные полимерные носители. Указанные полимеры, благодаря своей большой молекулярной массе, образуют вязкие растворы, которые могут образовывать нановолокна, когда их подвергают действию электростатического потенциала. Нановолокна, спряденные электростатическим способом, могут иметь очень маленький диаметр. Диаметр может составлять вплоть до 0,1 нанометра, более типично менее 1 микрона. Это обеспечивает высокое значение соотношения площади поверхности и массы. Волокно может иметь любую длину, и оно может включать частицы, которые отличаются от более традиционной спряденной цилиндрической формы, например представлять собой каплю или иметь плоскую форму.
Подходящие полимерные носители могут быть предпочтительно выбраны из известных фармацевтических наполнителей. Физико-химические характеристики указанных полимеров диктуют дизайн лекарственной формы, как, например, лекарственная форма с быстрым растворением, немедленным высвобождением, отсроченным высвобождением, модифицированным высвобождением, таким как замедленное высвобождение, или импульсным высвобождением и т.п.
Скорость доставки активного агента можно контролировать путем выбора полимера, используемого в волокнах, концентрации полимера, используемого в волокне, диаметра полимерного волокна и/или количества активного агента, помещаемого в волокно.
Подходящие лекарственные вещества можно выбрать из множества известных классов лекарственных средств, включая, например, анальгетики, противовоспалительные агенты, противоглистные агенты, антиаритмики, антибиотики (включая пенициллины), антикоагулянты, антидепрессанты, противодиабетические агенты, противоэпилептические или противосудорожные агенты (также называемые нейропротекторами), антигистаминные агенты, антигипертензивные агенты, антимускариновые агенты, антимикобактериальные агенты, антинеопластические агенты, иммунодепрессанты, антитироидные агенты, противовирусные агенты, анксиолитические седативные агенты (гипнотики и нейролептики), вяжущие средства, бета-адреноблокаторы, продукты и заместители крови, сердечные инотропные агенты, кортикостероиды, подавляющие кашель агенты (отхаркивающие и муколитики), диагностические агенты, диуретики, дофаминергические агенты (антипаркинсонические агенты), гемостатики, иммунологические агенты, агенты, регулирующие липидный обмен, мышечные релаксанты, антагонисты рецепторов NK3, парасимпатомиметики, паратироидный кальцитонин и бифосфонаты, простагландины, радиофармацевтики, половые гормоны (включая стероиды), антиаллергические агенты, стимуляторы и агенты, снижающие аппетит, симпатомиметики, тироидные агенты, ингибиторы PDE IV, вазодилятаторы и ксантины.
Предпочтительные лекарственные вещества включают вещества, предназначенные для перорального введения и внутривенного введения. Описание указанных классов лекарственных средств и перечень видов в пределах каждого класса можно найти, например, в Martindale, The Extra Pharmacopoeia, двадцать девятое издание, The Pharmaceutical Press, Лондон, 1989 г., описание которого целиком включено в настоящий документ посредством ссылки. Лекарственные вещества являются коммерчески доступными и/или могут быть изготовлены с помощью технологий, известных специалистам и описанных в технике.
Как было отмечено, электропряденая композиция может быть способна маскировать вкус многих горьких или имеющих неприятный вкус лекарственных средств, независимо от их растворимости. Подходящие активные ингредиенты для инкорпорирования в волокна по настоящему изобретению включают многие горькие или имеющие неприятный вкус лекарственные средства, включая, без ограничений, антагонист гистаминовых рецепторов Н2, такие как циметидин, ранитидин, фамотидин, низатидин, этинидин, люпитидин, нифенидин, ниперотидин, роксатидин, сульфотидин, туватидин и залтидин; антибиотики, такие как пенициллин, ампициллин, амоксициллин и эритромицин; ацетаминофен; аспирин; кофеин, декстрометорфан, дифенгидрамин, бромфенирамин, хлорфенирамин, теофиллин, спиронолактон, НПВП, такие как ибупрофен, кетопрофен, напросин и набуметон; ингибиторы 5НТ4, такие как гранисетрон или ондасетрон; ингибиторы обратного захвата серотонина, такие как пароксетин, флуоксетин и сертралин; витамины, такие как аскорбиновая кислота, витамин А и витамин D; пищевые минералы и добавки, такие как карбонат кальция, лактат кальция и т.п., или их комбинации.
Можно также удобно комбинировать указанные выше активные агенты, в частности противовоспалительные агенты, с другими активными терапевтическими агентами, такими как различные стероиды, противоотечные агенты, антигистаминные агенты и т.п., насколько это может быть подходящим в электропряденом волокне или в полученной лекарственной форме.
Предпочтительно активными агентами являются полугидрат 6-ацетил-3,4-дигидро-2,2-диметил-транс(+)-4-(4-фторбензоиламин)-2Н-бензо[b]пиран-3-ола, 3-гидрокси-2-фенил-N-[1-фенилпропил]-4-хинолинкарбоксамид (Talnetant), розиглитазон, карведилол, гидрохлортиазид, эпросартан, индометацин, нифедипин, напроксен, ASA и кетопрофен, или агенты, описанные в разделе "Примеры", ниже в настоящем документе.
Относительное количество материала, образующего волокна (главным образом, полимерного носителя), и активного агента, который может присутствовать в полученном волокне, может варьировать. В одном варианте осуществления настоящего изобретения активный агент включает приблизительно от 1 до 50 мас.% волокна, когда оно получено электростатическим прядением, предпочтительно от 35 до 45 мас.%.
Волокна ДНК также использовали для формирования волокон электростатическим прядением, Fang et al., J. Macromol. Sci.-Phys., B36(2), 169-173 (1997). Инкорпорирование фармацевтически приемлемого активного агента, такого как биологический агент, вакцина или пептид, в ДНК, РНК или их производные, если только они аморфны и представляют собой электропряденое волокно, также входит в объем настоящего изобретения.
При изготовлении нановолокон используются характеристики волокнообразования полимера. Следовательно, молекулярная масса полимера является одним из отдельных наиболее важных параметров для выбора полимера.
Другим важным критерием для выбора полимера является смешиваемость полимера и лекарственного средства. Теоретически возможно удостовериться в смешиваемости путем сравнения параметров растворимости лекарственного средства и полимера, как описано Hancock et al., в International Journal of Pharmaceutics, 1997, 148, 1.
Другим важным критерием для выбора полимера является его способность стабилизировать аморфное лекарственное средство. В Journal of Pharmaceutical Sciences, 1997, 86, 1, было сообщение Hancock et al. о том, что стабильные композиции «лекарственное средство/полимер» должны иметь температуру стеклования (Tg) выше температуры хранения. Если Tg комбинации «лекарственное средство/полимер» ниже температуры хранения, лекарственное средство будет существовать в каучукообразном состоянии и впоследствии будет склонно к молекулярной мобильности и кристаллизации. Примером является полимер полиэтиленоксид, который представляет собой полукристаллический/кристаллический полимер. Было показано, что по крайне мере некоторые кристаллические лекарственные средства, спряденные в подобном полимере, имеющие исходно аморфную морфологию, со временем будут выкристаллизовываться.
Показательные примеры аморфных полимеров для использования в настоящем изобретении включают, без ограничения, поливиниловый спирт, поливинилацетат, поливинилпирролидон, гиалуроновую кислоту, альгинаты, каррагинан, производные целлюлозы, такие как натрий-карбоксиметилцеллюлоза, метилцеллюлоза, этилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, фталат гидроксипропилметилцеллюлозы, ацетофталат целлюлозы, некристаллическая целлюлоза, крахмал и его производные, такие как гидроксиэтилкрахмал, гликолят натрий-крахмала, хитозан и его производные, альбумин, желатин, коллаген, полиакрилаты и сополимеры метакриловой кислоты и их производные, такие как члены семейства полимеров Eudragit от компании Rohm Pharma, полиальфагидроксикислоты и их сополимеры, такие как полиальфааминокислоты и их сополимеры, сложные полиортоэфиры, полифосфазины, полиэтилоксазолины, полифосфоэфиры и их комбинации.
Полимеры поли-ε-капролактон, поли(лактид-гликолид), полиангидриды, полиэтиленоксид являются кристаллическими или полукристаллическими полимерами.
Большинство указанных фармацевтически приемлемых полимеров подробно описаны в Handbook of Pharmaceutical Excipients, опубликованном совместно американской фармацевтической ассоциацией и фармацевтическим обществом Британии.
Предпочтительно полимерные носители разделяют на две категории - водорастворимые полимеры, пригодные для немедленного высвобождения активных агентов, и не растворимые в воде полимеры, пригодные для контролируемого высвобождения активных агентов. Установлено, что для настоящего изобретения могут быть полезны комбинации обоих носителей. Установлено также, что растворимость нескольких полиакрилатов является рН-зависимой, и они могут подпадать под обе категории.
Водорастворимые полимеры включают, без ограничения, поливиниловый спирт, поливинилпирролидон, гиалуроновую кислоту, альгинаты, каррагинан, производные целлюлозы, такие как натрий-карбоксиметилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, фталат гидроксипропилметилцеллюлозы, ацетофталат целлюлозы, крахмал и его производные, такие как гидроксиэтилкрахмал, гликолят натрий-крахмала, декстрин, хитозан и его производные, альбумин, зеин, желатин и коллаген.
Подходящим водорастворимым полимером для использования в настоящем изобретении является поливинилпирролидон или поливинилпирролидон и его сополимер с поливинилацетатом.
Не растворимые в воде полимеры включают, без ограничения, поливинилацетат, метилцеллюлозу, этилцеллюлозу, некристаллическую целлюлозу, полиакрилаты и его производные, такие как члены семейства полимеров Eudragit от компании Rohm Pharma (Германия), полиальфагидроксикислоты и их сополимеры, такие как полиальфааминокислоты и их сополимеры, сложные полиортоэфиры, полифосфазины и полифосфоэфиры.
Акриловые полимеры семейства Eudragit хорошо известны специалистам и включают ряд различных полимеров: Eudragit L100-55 (Eudragit L30D, высушенный способом распылительной сушки), L30D, L100, S100, 4135F, E100, EPO (порошкообразная форма Е100), RL30D, RLPO, RL100, RS30D, RSPO, RS100, NE30D и NE40D.
Указанные фармацевтически приемлемые полимеры и их производные являются коммерчески доступными и/или могут быть изготовлены с помощью технологий, известных специалистам. Под производными подразумеваются полимеры варьирующейся молекулярной массы, полимеры с модификацией функциональных групп, или сополимеры данных агентов, или их смеси.
Кроме того, можно использовать в комбинации два или более полимеров для формирования волокон, как указано в настоящем документе. Данная комбинация может улучшать образование волокон или достигать желаемого профиля высвобождения лекарственного средства. Одна подходящая комбинация полимеров включает полиэтиленоксид и поликапролактон.
Предпочтительно выбираемым полимером является аморфный полимер, как, например, но без ограничения указанными: поливиниловый спирт, поливинилацетат, поливинилпирролидон, гиалуроновая кислота, альгинаты, каррагинан, производные целлюлозы, такие как натрий-карбоксиметилцеллюлоза, метилцеллюлоза, этилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, фталат гидроксипропилметилцеллюлозы, ацетофталат целлюлозы, некристаллическая целлюлоза, крахмал и его производные, такие как гидроксиэтилкрахмал, гликолят натрий-крахмала, хитозан и его производные, альбумин, желатин, коллаген, полиакрилаты и их производные, такие как члены семейства полимеров Eudragit от компании Rohm Pharma, такие как Eudragit L100-55, полиальфагидроксикислоты, полиальфааминокислоты и их сополимеры, сложные полиортоэфиры, полифосфазины и полифосфоэфиры. Предпочтительными полимерами являются такие полимеры, которые имеют функциональные группы, способные промотировать специфическое взаимодействие с активным агентом, для помощи в стабилизации аморфной формы агента. Подходящими полимерами являются PVP и PVP с сополимерами или группа полимеров Eudragit, как описано в настоящем документе.
Выбор полимеров для использования вместе с активными агентами может обеспечить удобные функции маскировки вкуса активных агентов. Например, использование ионогенного полимера противоположного заряда, такого как катионогенный полимер, связанный в комплекс с анионогенным активным агентом, или анионогенный полимер, связанный в комплекс с катионогенным активным агентом, может дать нужный результат. Добавление второго агента, маскирующего вкус, такого как подходящий циклодекстрин или его производные, также можно использовать в настоящем изобретении.
Полимерную композицию можно подвергать электропрядению из раствора или в чистом виде (в виде расплава). Выбор растворителя предпочтительно основан на растворимости активного агента. Вода является самым лучшим растворителем для водорастворимого активного агента и полимера. Альтернативно, можно использовать воду и смешивающийся с водой органический растворитель. Однако в случае, когда лекарственное средство не растворимо в воде или умеренно растворимо, для изготовления гомогенного раствора лекарственного средства с полимером необходимо использовать органический растворитель.
Установлено, что указанные полимерные композиции, которые подвергают прядению в чистом виде, могут также содержать дополнительные агенты, такие как пластификаторы и антиоксиданты. Пластификаторы применяются для вспомогательных целей при расплавлении композиции. Примерами пластификаторов, которые могут использоваться в покрытиях по настоящему изобретению, являются триэтилцитрат, триацетин, трибутилцитрат, ацетилтриэтилцитрат, ацетилтрибутилцитрат, дибутилфталат, дибутилсебакат, винилпирролидон и пропиленгликоль.
Предпочтительно выбираемым растворителем является разрешенный GRASS органический растворитель, хотя растворитель необязательно может быть «фармацевтически приемлемым», поскольку, если их остаточные количества оказываются ниже предела обнаружения или предела, установленного для потребления человеком, то их можно использовать.
Подходящие растворители для использования в настоящем изобретении включают, но без ограничения указанными, уксусную кислоту, ацетон, ацетонитрил, метанол, этанол, пропанол, этилацетат, пропилацетат, бутилацетат, бутанол, N,N-диметилацетамид, N,N-диметилформамид, 1-метил-2-пирролидон, диметилсульфоксид, диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, пентан, гексан, 2-метоксиэтанол, формамид, муравьиную кислоту, гексан, гептан, этиленгликоль, диоксан, 2-этоксиэтанол, трифторуксусную кислоту, метилизопропилкетон, метилэтилкетон, диметоксипропан, метиленхлорид и т.п. или их смеси.
Предпочтительным растворителем является этанол, ацетон, н-винилпирролидон, дихлорметан, ацетонитрил, тетрагидрофуран или смеси данных растворителей.
Соотношение растворителя и полимерной композиции удобно определять, руководствуясь желаемой вязкостью получающегося препарата.
Для электропрядения фармацевтической полимерной композиции ключевыми параметрами являются вязкость, поверхностное натяжение и удельная электропроводность системы растворитель/полимерная композиция.
Под термином «наночастицы лекарственного средства» в настоящем документе подразумевается, что в пределах нанодиапазона находятся размеры частиц активного агента, находящегося внутри электропряденого волокна, в противоположность имеющим размеры, находящиеся в пределах нанодиапазона, самим полученным волокнам.
Полимерные носители могут действовать также как модификаторы поверхности для наночастиц лекарственного средства. Таким образом, добавить к раствору, предназначенному для электропрядения, можно также второй олигомерный модификатор поверхности. Все данные модификаторы поверхности могут физически адсорбироваться на поверхности наночастиц лекарственного средства, предохраняя их, таким образом, от агломерации.
Характерные примеры указанных вторых олигомерных модификаторов поверхности или наполнителей включают, без ограничения ими, Pluronics® (блоксоп