Топический состав, содержащий наночастицы спиронолактона
Иллюстрации
Показать всеИзобретение касается топического состава со спиронолактоновыми наночастицами, содержащего наночастицы среднего диаметра, измеренного способом фотонной корреляционной спектроскопии, в пределах примерно от 300 нм до примерно 900 нм, а также дисперсию твердых кристаллов полярных липидов в полярной жидкости, и дополнительно содержащего стабилизатор. Наночастицы включены в кристаллическую структуру, образованную твердыми кристаллами полярных липидов, при этом указанные липиды обращены своей гидрофильной стороной наружу, а гидрофобной стороной внутрь по направлению к наночастицам спиронолактона. Также заявляется способ получения состава, сама система кристаллической решетки твердых кристаллов полярных липидов с включенными в нее наночастицами спиронолактона и применение наносуспензии упомянутой структуры для полчения медикамента, предназначенного для лечения состояния, поддающегося лечению антиандрогенами. Использование заявленных системы, состава и способа его получения позволяет достичь высокой стабильности состава и повысить биодоступность спиронолактона. 4 н. и 13 з.п. ф-лы, 13 табл., 11 ил.
Реферат
Настоящее изобретение относится к применению спиронолактона в форме наночастиц для местного лечения состояния, возникающего в результате реакции на антиандрогены. Такие состояния включают акне, гирсутизм, андрогенное облысение или розовые угри.
Спиронолактон известен в качестве ингибитора альдостерона и применяется как калийсберегающий диуретик. Он поступает в продажу, в частности, под наименованием альдактон и может использоваться, например, для лечения застойной сердечной недостаточности. Спиронолактон обладает чрезвычайно низкой растворимостью в воде, а именно: 2,8 мг/100 мл. Такая низкая растворимость может отрицательно влиять на абсорбцию лекарственной субстанции живым организмом, что приводит к плохой биологической усвояемости. Поэтому для достижения желаемого уровня в крови требуются увеличенные дозы лекарственной субстанции. Низкая растворимость спиронолактона также ограничивает возможности приготовления составов лекарственной субстанции.
В других вариантах фармацевтического применения антиандрогенные свойства спиронолактона используют для лечения различных кожных нарушений, в частности, акне, гирсутизма, андрогенного облысения и розовых угрей. Местное введение для лечения этих нарушений является предпочтительным способом, поскольку позволяет в большой степени снизить системные побочные эффекты. Однако и в этом случае плохая растворимость препарата ограничивает разработку эффективных и эстетически приемлемых составов для местного нанесения.
После перорального приема абсорбция препаратов из кишечника зависит главным образом от их растворимости в интестинальных жидкостях и их кишечной проницаемости. Плохо растворимые препараты обычно имеют низкие скорости растворения и создают лишь небольшой градиент концентрации в слизистой оболочке кишечника, что может приводить к низкой и ненадежной абсорбции. Лекарственные субстанции, которые имеют низкую растворимость, страдают недостатками и при других способах введения, например, при топическом.
Значительные усилия направлены на получение лекарственных субстанций в форме микрочастиц и наночастиц. Однако получение таких мелких частиц является нетривиальной задачей и может создать дополнительные трудности как в отношении технических аспектов процесса, так и в получении удовлетворительного продукта. Так, например, могут возникнуть трудности получения частиц со стабильным и узким диапазоном размеров, особенно при производстве в промышленных масштабах. Кроме того, при этом необходимо получать устойчивые продукты, например, наносуспензии, однако, микрочастицы и наночастицы имеют тенденцию к образованию агрегатов и флокуляции, что оказывает отрицательное влияние на устойчивость продукта. Для получения микрочастиц и наночастиц исследовали ряд различных подходов.
Патент США 5,091,188 описывает способ получения растворов для инъекции водорастворимых препаратов, который включает уменьшение размеров кристаллической лекарственной субстанции в пределах от 50 нм до 10 мкм с помощью обработки ультразвуком или других способов, вызывающих интенсивный сдвиг, в присутствии фосфолипида или другого пленкообразующего амфипатического липида, при этом указанный липид покрывает микрокристаллы препарата.
Патент США 5,145,684 описывает частицы кристаллической лекарственной субстанции, содержащей поверхностный модификатор, не имеющий поперечных связей и адсорбированный на поверхности, при этом эффективный средний размер частицы составляет менее примерно 400 нм. Указано, что эти частицы получают помолом в присутствии мелющей среды, например, в шаровой мельнице, фрикционной мельнице, вибрационной мельнице или мельнице с наполнителем.
Международная патентная заявка WO 96/14830 (патент США №5,858,410) описывает состав для доставки лекарственного средства, который содержит частицы чистого активного соединения, нерастворимого или слабо растворимого в воде. При этом средний диаметр частиц составляет от 10 нм до 1000 нм, а доля частиц, превышающих 5 мкм, в общей среде составляет менее 0,1%. Описаны также способы получения частиц с применением или предпочтительно - без применения поверхностно-активного агента посредством кавитации (например, с применением поршневого гомогенизатора) или сдвигающих и ударных сил (т.е. принцип реактивной струи).
Таким образом, существует потребность в топическом составе, содержащем наночастицы спиронолактона, который устранил бы указанные трудности с получением лекарственных препаратов для местного введения.
Заявители показали, что для местного применения спиронолактон в форме наночастиц можно успешно вводить в основу для крема, состоящую из кристаллической решетки моноглицеридов в воде.
Таким образом, первой задачей настоящего изобретения является топический состав спиронолактона, содержащий наночастицы со средним диаметром, измеренным способом фотонной корреляционной спектроскопии, в пределах примерно от 300 нм до примерно 900 нм, предпочтительно - от 400 нм до 600 нм, введенные в систему кристаллической решетки, которая содержит дисперсию твердых кристаллов полярных липидов, при этом указанные липиды обращены своей гидрофильной стороной наружу, а гидрофобной стороной - внутрь по направлению к наночастицам спиронолактона.
Состав пригоден для нанесения на кожу при лечении дерматологических состояний, которые, как известно, поддаются лечению антиандрогенами, в частности, акне, гирсутизма, андрогенного облысения и розовых угрей. Основы для крема, состоящие из кристаллической решетки моноглицеридов, описаны в патентных заявках WO 87/02582, WO 82/03173 и W093/20812. Примеры таких кристаллических решеток моноглицеридов известны как Crystalip™.
Липиды могут иметь температуру кристаллизации от 20°С до 100°С. Предпочтительными липидными кристаллами являются β-кристаллы из моноглицерида жирной кислоты, имеющей длину цепи 12-18 атомов углерода, или простых моноглицериновых эфиров, имеющих эфирные цепи соответствующей длины, или сложных эфиров жирных кислот аскорбиновой кислоты с длиной цепи жирной кислоты 12-18 атомов углерода или из их смесей. Жирные кислоты и простые эфиры могут быть насыщенными или ненасыщенными, предпочтительно - насыщенными.
При этом жирные кислоты могут включать лауриновую кислоту (С12), миристиновую кислоту (С14), пальмитиновую кислоту (С16) или стеариновую кислоту (C18), однако, кислоты C13, C15 или C17 также могут быть использованы.
Предпочтительными моноглицеридами могут быть 1- или 2-моноглицерид, предпочтительно 1-монолаурин, 1-мономиристин, 1-монопальмитин и 1-моностеарин или смесь из двух или нескольких из них, в частности, смесь 1-монолаурина и 1-мономиристина. Примерами ненасыщенных моноглицеридов являются монопальмитолеин, моноолеин, монолинолеин и монолиниоленин.
Состав состоит главным образом из дисперсии вышеуказанных липидных кристаллов в воде или другой полярной жидкости или их смесях, способствующих образованию кристаллов. Примеры полярных жидкостей, пригодных для использования в соответствии с изобретением, являются вода, глицерин, пропиленгликоль и этиленгликоль или их смеси, однако, другие пригодные полярные жидкости также могут быть использованы.
Спиролактон является защищенным в решетке вплоть до времени применения, когда его наносят на кожу, при этом спиролактон вступает в контакт с поверхностью кожи вследствие размягчения или расплавления кристаллической структуры оболочки.
В общем случае можно было ожидать заметного увеличения размера частиц после введения очень мелких твердых частиц в матрицу, которая содержит гидрофильные, а также липофильные структуры. Как ни странно, этого не происходило, и в течение семимесячного периода заметного роста кристалла спиронолактона не наблюдали. Кроме того, крем с мембранной моделью имел более высокую скорость протекания, чем крем, содержащий спиронолактон, в форме, отличной от наночастиц.
Фармацевтам хорошо известно, что размер частиц можно измерить различными способами, которые могут служить причиной различия описываемых размеров частиц. Такие способы включают фотонную корреляционную спектроскопию (PCS) и лазерную дифракцию. Кроме того, размер частиц может быть выражен как средний размер частиц (например, средний количественный, средний весовой или средний объемный размер частиц). В данном описании, если не указано иного, в качестве размера частиц представляется средний объемный размер частиц. Так, например, D50 500 нм указывает, что 50% объема частиц имеют диаметр менее 500 нм. Альтернативно можно указать, что частицы, имеющие диаметр менее 500 нм, занимают 50% от суммарного объема, занимаемого общим количеством частиц.
Если размер частиц спиронолактона согласно настоящему изобретению измерять с помощью лазерной дифракции, то D50 лежит в пределах 350-750 нм, а D99 - в пределах 500-900 нм.
Наносуспензии и наночастицы, содержащие спиролактон согласно настоящему изобретению, предпочтительно включают стабилизатор для предотвращения агрегации наночастиц. Такие стабилизаторы, хорошо известные специалистам, более подробно описаны далее.
В данном описании наночастицы, содержащие спиронолактон, и наносуспензии, содержащие спиронолактон согласно настоящему изобретению, называются спиронолактоновыми наночастицами. Следует понимать, что этот термин включает также наночастицы и наносуспензии, содержащие спиронолактон совместно со стабилизатором.
Спиронолактоновые наночастицы согласно настоящему изобретению можно получить любым способом, известным для получения наночастиц, в частности, способом гомогенизации при высоком давлении.
Спиронолактоновые наночастицы можно получить с помощью кавитации грубой дисперсии спиронолактона. Наночастицы предпочтительно получают с помощью поршневого гомогенизатора высокого давления. Наночастицы могут быть связаны со стабилизатором. Такие стабилизаторы, хорошо известные специалистам, более подробно описаны далее.
Для получения наночастиц предпочтительно использовать исходный спиронолактоновый материал в форме крупных частиц, которые предпочтительно имеют размер менее примерно 100 мкм. В случае необходимости размер частиц спиронолактона можно уменьшить до этого уровня обычными средствами, в частности, помолом. Крупные частицы спиронолактона предпочтительно диспергируют в жидкой среде, содержащей растворитель, в котором лекарственная субстанция практически не растворяется. В случае спиронолактона жидкая среда предпочтительно содержит водный растворитель и наиболее предпочтительно состоит главным образом из воды. Концентрация спиронолактона в указанной дисперсии крупных частиц может быть в пределах от 0,1 до 50%. Затем грубую дисперсию можно использовать для получения наночастиц любым известным способом.
Предпочтительным способом является гомогенизация при высоком давлении, когда размер частиц уменьшают главным образом с помощью кавитации. Наиболее предпочтительно этого достигают, используя поршневой гомогенизатор высокого давления. В этом способе дисперсию крупных частиц пропускают при высокой скорости потока через зазор шириной около 25 мкм. Статическое давление, оказываемое на жидкость, падает ниже внутреннего давления пара жидкости. Поэтому жидкость закипает, образуя пузырьки газа в зоне зазора. Однако после выхода жидкости из зазора нормальное давление восстанавливается, и пузырьки газа разрушаются. Возникающие при этом мощные силы взрыва, направленного внутрь, достигают достаточной величины, чтобы разрушить крупные частицы лекарственной субстанции, и приводят к образованию наночастиц.
Гомогенизацию при высоком давлении можно производить при давлении в пределах от 100 до 3000 бар, предпочтительно - от 1000 до 2000 бар (от 107 до 3×108 Па, предпочтительно - от 108 до 2×108 Па) и при температуре в пределах от 0 до 50°С, предпочтительно - от 10 до 20°С, например, около 15°С. Гомогенизацию можно производить циклически до получения желаемого размера частиц или непрерывно в течение 2-30 часов, предпочтительно в течение 2-10 часов.
Наносуспензии спиронолактона согласно настоящему изобретению предпочтительно содержат стабилизатор для предотвращения агрегации наночастиц. Указанный стабилизатор можно вводить на любой удобной стадии процесса получения наносуспензии. Так, например, поверхностно-активный агент можно добавлять к исходной грубой дисперсии перед образованием наночастиц или после уменьшения размера частиц, например, с помощью гомогенизации при высоком давлении. В альтернативном варианте реализации стабилизатор можно частично добавлять до и после уменьшения размера частиц. Предпочтительно вводить стабилизатор в грубую дисперсию. Концентрация стабилизатора в грубой дисперсии или нанодисперсии может составлять от 0 до 10%.
Стабилизаторы, которые могут быть использованы для получения наносуспензии согласно настоящему изобретению, можно выбирать из группы, включающей обычные стабилизаторы, а также соединения, описанные как поверхностно-активные вещества и поверхностные модификаторы. Примеры стабилизаторов, пригодных для использования, включают сложные полиоксиэтиленсорбитановые эфиры жирных кислот, например, твин- и спан-эмульгаторы, полиоксиэтиленстеараты, сложные полиоксиэтиленалкильные эфиры, полиэтиленгликоли, блочные полимеры и блочные сополимеры, в частности, полоксамеры, например, Lutrol F68, и полоксамины, лецитины различного происхождения (например, яичный лецитин и соевый лецитин), химически модифицированные лецитины (например, гидратированный лецитин), а также фосфолипиды и и сфинголипиды, стерины (например, производные холестерина, а также стигмастерин), сложные и простые эфиры сахаров или сахарных спиртов с жирными кислотами или жирные спирты (например, моностеарат сахарозы), этоксилированные моно- и диглицериды, этоксилированные липиды и липоиды, дицетилфосфат, фосфатидилглицерин, холат натрия, гликохолат натрия, таурохолат натрия, цитрат натрия, простые и сложные эфиры целлюлозы (например, метилцеллюлоза, оксиэтилцеллюлоза, оксипропилцеллюлоза, натрийкарбоксиметилцеллюлоза), поливиниловые производные, в частности, поливиниловый спирт, поливинлпирролидон, поливинилацетат, альгинаты, полиакрилаты (например, карбополь), ксантаны, пектины, желатин, казеин, гуммиарабик, холестерин, трагакант, стеариновую кислоту, стеарат кальция, глицерилмоностеарат, диоктилсульфосукцинат натрия (докузат натрия), лаурилсульфат натрия, додецилсульфат натрия, бензалкониум хлорид, сложный алкил-арильный полиэфир сульфонат, полиэтиленгликоли, коллоидный диоксид кремния, алюмомагниевый силикат и фосфаты.
Предпочтительным стабилизатором является докузат натрия, который поставляется на рынок в форме 70% раствора в пропиленгликоле под маркой Octowet 70PG™ (диоктилсульфосукцинат натрия).
Из приведенного выше описания очевидно, что процесс проводят в жидкой среде и поэтому продукт спиронолактоновых наночастиц вначале получают в форме наносуспензии. Если требуется, жидкую среду можно удалить, например, способом лиофилизации или распылительной сушки, чтобы получить спиронолактоновые наночастицы в твердой форме. При этом, если при получении наносуспензии присутствует стабилизатор, то соответствующий высушенный продукт наночастиц будет содержать указанный стабилизатор.
После получения спиронолактоновых наночастиц состав согласно изобретению можно приготовить следующим образом. Полярный липид смешивают с водой и/или другой полярной жидкостью (в частности, с глицерином, этиленгликолем или пропиленгликолем), способной образовывать структуры с кристаллической решеткой из полярных липидов. Образующаяся смесь имеет концентрацию воды и/или полярной жидкости, соответственно, 50-95% по массе. Смесь нагревают до температуры, превышающей температуру фазового перехода липида. Температуру фазового перехода липида определяют как минимальную температуру, при которой частица липида, находящаяся в контакте с избыточным количеством воды или полярной жидкости, поглощает воду или полярную жидкость, соответственно, и превращается в цилиндрические или сферические кристаллические структуры, имеющие сильное двойное лучепреломление. Перемешивая, смесь выдерживают при температуре, превышающей температуру фазового перехода липида до полного завершения перехода. Затем смесь охлаждают при непрерывном перемешивании до температуры окружающей среды или желательной температуры, чтобы образовались твердые кристаллические решетки. В процессе этого охлаждения при температуре примерно от 30 до 35°С образуется характерная кристаллическая структура.
Спиронолактоновые наночастицы диспергируют в смеси полярного липида и воды или полярной жидкости до или во время перехода липида в кристаллические структуры. Чтобы обеспечить внедрение спиронолактоновых наночастиц в кристаллическую структуру, их следует добавлять до охлаждения смеси ниже 30-35°С.
Если спиронолактоновые наночастицы добавляют после охлаждения смеси ниже 30-35°С, то получается физическая смесь, однако, они не образуют части кристаллической структуры. Поэтому защита рекристаллизации и ее предотвращение, а также увеличение размера частиц активного компонента не приносит пользы спиронолактоновым наночастицам, поскольку кристаллические слои не образуются вокруг активных частиц.
Однако наносуспензии, применяемые согласно настоящему изобретению для получения топического состава, не выдерживают нагревания. При нагревании могут образовываться агломераты, и активный компонент при высоких температурах может переходить в раствор. Это может приводить к рекристаллизации в процессе охлаждения и вызывать существенное увеличение размера частиц.
Однако заявители определили состав, способ и температуру введения наносуспензии, чтобы обеспечить образование кристаллической структуры после добавления наносуспензии, сохраняя минимальное тепловое воздействие на наносуспензию.
Топические составы со спиронолактоновыми наночастицами согласно настоящему изобретению предпочтительно содержат активный препарат в форме наносуспензии, наиболее предпочтительно - в водном растворе. Фармацевтические составы согласно настоящему изобретению можно получить способами, хорошо известными специалистам.
Топические составы согласно настоящему изобретению можно приготовить в форме мази, крема, геля, жидкости, аэрозоля или мусса. Водные составы могут содержать непосредственно наносуспензию, неводные составы могут альтернативно содержать высушенные наночастицы.
Второй задачей настоящего изобретения является топический состав, содержащий спиронолактоновые наночастицы и предназначенный для местного лечения состояний, которые, как известно, поддаются лечению антиандрогенами, например, акне, андрогенное облысение, гирсутизм или розовые угри.
Третьей задачей изобретения является применение спиронолактоновых наносуспензий, содержащих наночастицы со средним диаметром, измеренным способом фотонной корреляционной спектроскопии, в пределах примерно от 300 нм до примерно 900 нм, предпочтительно - от 400 нм до 600 нм, для получения медикамента, предназначенного для лечения состояния, которое представляет собой реакцию на антиандрогены, в частности, акне, гирсутизм, андрогенное облысение или розовые угри. Медикамент можно адаптировать для местного нанесения. Наночастицы можно вводить в основу для крема, которая может состоять из кристаллической решетки моноглицеридов в воде или других полярных жидкостях.
Эта задача изобретения расширяется до способа лечения состояния, которое является реакцией на антиандрогены, при этом указанный способ включает введение состава, содержащего спиронолактоновые наночастицы, пациенту, нуждающемуся в таком лечении. Указанным состоянием может быть акне, гирсутизм, андрогенное облысение или розовые угри.
Четвертой задачей изобретения являются составы, содержащие систему кристаллической решетки твердых кристаллов полярных липидов, при этом указанные липиды обращены своей гидрофильной стороной наружу, а гидрофобной стороной - внутрь по направлению к внедренной субстанции, для применения с целью местного лечения акне. Система кристаллической решетки твердых кристаллов полярных липидов ранее описана в патентной заявке WO 87/02582 применительно к микрокапсулам.
Пятой задачей изобретения является способ получения топического состава спиронолактоновых наночастиц, содержащего наночастицы со средним диметром, измеренным способом фотонной корреляционной спектроскопии, в пределах примерно от 300 нм до примерно 900 нм, при этом указанный способ включает введение наносуспензии спиронолактона в водную дисперсию твердых кристаллов полярных липидов, и указанные липиды обращены своей гидрофильной стороной наружу, а гидрофобной стороной - внутрь по направлению к наночастицам спиронолактона.
Наносуспензию можно вводить после охлаждения смеси до 60°С-35°С, более предпочтительно - до 55°С-45°С, возможно - до 50°С, прежде чем смесь достигнет точки кристаллизации. Температура наносуспензии при введении предпочтительно равна комнатной температуре, т.е. 20-25°С.
Предпочтительные характеристики второй и последующих задач изобретения являются такими же, как и для первой задачи с соответствующими изменениями.
Ниже приведено более подробное описание изобретения со ссылками на неограничительные примеры реализации и прилагаемые фигуры.
Фигура 1 - изображение под микроскопом спиронолактоновых наночастиц согласно настоящему изобретению непосредственно после их получения. Расстояние между соседними делениями шкалы соответствует 0,01 мм.
Фигура 2 - изображение под микроскопом спиронолактоновых наночастиц согласно настоящему изобретению после их хранения в течение 7 месяцев при комнатной температуре. Расстояние между соседними делениями шкалы соответствует 0,01 мм.
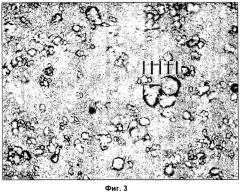
Фигура 3 - изображение под микроскопом серийно выпускаемого спиронолактона в форме, отличной от наночастиц. Расстояние между соседними делениями шкалы соответствует 0,01 мм.
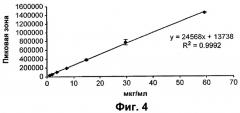
Фигура 4 - типичная калибровочная кривая спиронолактоновых стандартов 0,93-59,2 мкг/мл.
Фигура 5 - график среднего потока спиронолактона из наносуспензии (2% по массе) и водного крема (2% по массе) (n=4, среднее значение +/-стандартная ошибка)
y=35,552x-20,258r2=0,991 Спиронолактоновый водный крем 2%
y=42,097х-26,784r2=0,989 Спиронолактоновая наносуспензия 2%
Фигура 6 - средний диаметр зоны S. epidermidis спиронолактонового состава Crystalip™ по сравнению с 2% по массе спиронолактона в водном креме В.Р. (British Pharmacopeia - Британская Фармакопея) (среднее значение ± стандартное отклонение, n=5).
Фигура 7 - средний диаметр зоны Р.acnes спиронолактонового состава Crystalip™ по сравнению с 2% по массе спиронолактона в водном креме В.Р. (среднее значение ± стандартное отклонение, n=5).
Фигура 8 - распределение размера частиц спиронолактоновой наносуспензии после нагревания до 50°С или 70°С с последующим охлаждением по сравнению с наносуспензией, не подвергавшейся нагреванию .
Фигура 9 - распределение размера частиц спиронолактоновой наносуспензии через 24 часа после нагревания до 50°С или 70°С с последующим охлаждением по сравнению с наносуспензией, не подвергавшейся нагреванию .
Фигура 10 - вязкость смеси после введения состава OctowetTM при 50°С, 70°С и комнатной температуре.
Фигура 11 - зависимость вязкости смеси от ее состава.
ПРИМЕРЫ
Пример 1: Получение топического состава, содержащего спиронолактоновые наночастицы
Получение спиронолактоновых наночастиц
В таблице 1 показаны примеры составов спиронолактоновых наночастиц, предназначенных для введения в кристаллическую структуру согласно настоящему изобретению. Спиронолактоновые наночастицы можно получить следующим образом. Препарат водного раствора стабилизатора вливали в воду или буфер для инъекции при перемешивании магнитной мешалкой до получения прозрачного раствора. Получили суспензию путем увлажнения спиронолактона соответствующим количеством водного раствора поверхностно-активного вещества. Полученную суспензию диспергировали с помощью высокоэффективного диспергатора. Суспензии выдержали при перемешивании магнитной мешалкой, чтобы предотвратить пенообразование.
Полученные суспензии пропустили через поршневой гомогенизатор высокого давления, чтобы получить наносуспензию. Составы 1-7 получили, используя Avestin С5™, а составы 8 и 9 - используя Avestin C50™. При гомогенизации частицы препарата разрушились под действием кавитации и сил сдвига, и образовались микро- и наночастицы. Размеры частиц определили способом фотонной корреляционной спектроскопии (PCS) с помощью прибора Zetasizer 3000 HS™ (Malvern). D50 и D90 измерили способом лазерной дифракции с помощью прибора Coulter LS230.
| Таблица 1 | |||||||||
| Состав | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| Спиронолактон, % | 10 | 10 | 20 | 10 | 10 | 10 | 10 | 10 | 10 |
| Лаурилсульфат натрия, % | 1 | 0,1 | 0,4 | 0,1 | |||||
| Lutrol F68% | - | 1 | 1 | 0,4 | 0,1 | 0,4 | - | - | - |
| NaCl | - | - | - | - | - | 0,9 | - | - | - |
| Octowet 70 (докузат натрия),% | - | - | - | - | - | - | 0,5 (0,35) | 0,5 (0,35) | 0,5 (0,35) |
| Вода | до 100% | ||||||||
| Режимы процесса | |||||||||
| Давление (бары) | 1500 | 1500 | 1500 | 1500 | 1500 | 1500 | 1250 | 1500 | 1500 |
| Время(мин) | 90 | 180 | 180 | 180 | 180 | 300 | 300 | 1080 | |
| Объем образца (мл) | 40 | 40 | 40 | 40 | 40 | 40 | 40 | 100 | 500 |
| Результаты | |||||||||
| D50 (мкм) | 1,69 | 0,85 | 1,06 | 0,84 | 0,88 | 0,86 | 0,78 | 0,54 | 0,539 |
| D90 (мкм) | 4,39 | 1,83 | 2,49 | 1,92 | 1,82 | 1,5 | 1,8 | 0,68 | 0,772 |
| Средний диаметр PCS | - | 581 | 880 | 608 | 681 | 656 | 609 | 415 | 436 |
| PI | - | 0,7 | 0,2 | 0,15 | 0,03 | 0,1 | 0,2 | 0,05 | 0,1 |
| Получение состава Crystalip™ |
В таблице 2 представлены примеры препаратов, содержащих спиронолактоновые наночастицы, в форме топического крема, полученного из составов 7, 8 и 9, указанных в таблице 1. Топические наносуспензионные препараты получили следующим образом.
Нагрели воду до 70°С и добавили пропиленгликоль. Расплавили моноглицериды при 70°С и добавили расплавленные моноглицериды в водную фазу при перемешивании со скоростью 70 об/мин. Затем начали охлаждение смеси. Когда температура смеси достигла примерно 50°С, скорость перемешивания увеличили до 95 об/мин и добавили холодную наносуспензию. При 35°С, когда начала образовываться β-кристаллическая структура, скорость перемешивания уменьшили до 75 об/мин.
| Таблица 2 | ||||
| Состав | А | В | С | D |
| Спиронолактоновая наносуспензия (составы 7, 8 или 9 из таблицы 1) | 20 | 10 | 20 | 20 |
| Глицеринмонолаурат | 7 | 6 | 6 | 5 |
| Глицеринмономиристат | 21 | 18 | 18 | 15 |
| Пропиленгликоль | - | 10 | 10 | 20 |
| Вода | 52 | 56 | 46 | 40 |
Для определения оптимальных составов и способа получения топического состава, содержащего спиронолактоновые наночастицы в соответствии с настоящим изобретением, провели следующие эксперименты.
Выбор оптимального состава Crystalip™
Приготовили две партии состава Crystalip™, как указано в таблице 3.
| Таблица 3 | ||||
| Воспроизведение плацебо состава Crystalip™ | ||||
| Номер партии | Глицерин-монолаурат | Глицерин-мономиристат | Пропиленгликоль (PG) | Вода |
| 4011-001/01 | 7% | 21% | / | 72% |
| 4011-001/02 | 5% | 15% | 20% | 60% |
Для первой партии характерный экзотермический пик наблюдали при охлаждении. В конце этапа охлаждения крем был очень вязким, однако, не имел блеска, типичного для β-кристаллической структуры. При хранении этот блеск начинал появляться.
Для второй партии экзотермического пика не наблюдали, однако, материал отличался блеском. Вязкость, по-видимому, была более низкой, чем у первой партии.
Затем испытали состав с меньшим содержанием пропиленгликоля (PG) (таблица 4), поскольку имелись опасения возможного появления раздражения вследствие высоких концентраций PG. Пропиленгликоль целесообразно сохранить в составе, т.к. он может увеличивать антибактериальную эффективность основы и, следовательно, усиливать проникновение активных компонентов в кожу. Изготовили следующие партии материала:
| Таблица 4 | ||||
| Партии Crystalip™ | ||||
| Номер партии | Глицерин-монолаурат | Глицерин-мономиристат | Пропиленгликоль (PG) | Вода |
| 4011-001/03 | 5% | 15% | 10% | 70% |
| 4011-001/04 | 6% | 18% | 10% | 66% |
Для партии с 20% моноглицерида (MG) вязкость снизилась примерно при 40°С, и смесь снова стала жидкой сразу после того, как вязкость начала увеличиваться.
Поэтому содержание MG увеличили до 24%. Вязкость также снизилась примерно при 40°С, однако, она снова увеличилась при последующем охлаждении. Экзотермический пик наблюдали при 33°С, а готовый крем обладал блеском, что указывало на образование в конечном счете β-кристаллической структуры.
Испытания совместимости поверхностно-активного вещества и Crystalip™
Ранее установили, что Crystalip™ совместим с Myrj 59 и Span 20, которые являются неионными поверхностно-активными веществами. Однако для спиронолактоновой наносуспензии применяют Octowet 70PG, который представляет собой анионное поверхностно-активное вещество. Octowet 70PG известен так же как натрий диоктилсуьфосукцинат и представляет собой 70% раствор (70% DOSS) в воде и пропиленгликоле.
Для получения крема, содержащего 2% спиронолактона, необходимо ввести 20% спиронолактоновой наносуспензии, поскольку наносуспензия содержит 10% активного спиронолактона и 0,5% поверхностно-активного вещества. Поэтому при испытании совместимости состава Crystalip™ с раствором Octowet использовали 20% раствор Octowet и заменили часть водной фазы.
Испытали совместимость раствора Octowet 70 PG с выбранным составом Crystalip™ (10%PG + 24%MG). Изготовили три партии Crystalip™ (таблица 5), в которые добавили 20% раствора Octowet 70 PG при различных температурах: 70°С, 50°С и при комнатной температуре.
| Таблица 5 | ||||||
| Партии Crystalip™, содержащие раствор Octowet | ||||||
| Номер партии | Глицерин монолаурат | Глицерин мономиристат | Пропиленгликоль | Раствор Octowet(0.5%) | Вода | T°C* |
| 4011-001/05 | 6% | 18% | 10% | 20% | 46% | 70 |
| 4011-001/06 | 6% | 18% | 10% | 20% | 46% | 50 |
| 4011-001/07 | 6% | 18% | 10% | 20% | 46% | комн. темп. |
| *Т°С: температура добавления раствора поверхностно-активного вещества |
Все три партии образовывали экзотермический пик и обладали блеском. Партии номер 05 и 06 имели приемлемую вязкость, в то время как вязкость партии номер 07 после добавления раствора Octowet была недостаточной.
На основании вышеуказанного сделали заключение, что выбранный состав Crystalip™ совместим с 20% 0,5% раствора Octowet. Раствор Octowet лучше добавлять при температуре, превышающей точку кристаллизации, чем при комнатной температуре.
Добавление спиронолактоновой наносуспензии в Crystalip™
Наносуспензия содержала 10% спиронолактона и 0,5% Octowet 70PG.
Размер частиц свежей наносуспензии, определенный способом лазерной дифракции (COULTER), составлял:
D50=0,686
D90=1,033
D99=1,033
Размер частиц, определенный способом фотонной корреляционной спектроскопии (Zetasizer 3000HS): Z среднее = 476 нм.
Описанные выше испытания совместимости показали, что добавление материалов при комнатной температуре не является оптимальным вариантом. Поэтому оказалось необходимым исследовать нагревание наносуспензии. Измерили размер частиц до и после нагревания суспензии.
Провели следующий эксперимент.
Два образца наносуспензии нагрели до 50° и 70°С соответственно. Выдержали при указанной температуре в течение 10 минут, а затем образцы охладили до комнатной температуры. Размер частиц измерили способами фотонной корреляционной спектроскопии и лазерной дифракции в следующие моменты времени:
- после ультразвуковой обработки, перед нагреванием (базовый образец),
- после охлаждения (t0),
- через 24 часа (t24h).
Результаты, представленные в таблице 6 и 7, показаны также на фигурах 8 и 9.
| Таблица 6 | |||||
| Определение размера частиц способом лазерной дифракции (Coulter) | |||||
| Распределениеразмеров частиц | Образец | ||||
| Базовый | 50°С - t0 | 70°С - t0 | 50°С - t24h | 70°С - t24h | |
| D50 | 0,579 нм | 0,638 нм | 0,700 нм | 0,634 нм | 0,694 нм |
| D90 | 0,740 нм | 0,878 нм | 1,053 нм | 0,861 нм | 1,572 нм |
| Таблица 7 | |||||
| Определение размера частиц способом фотонной корреляционной спектроскопии (PCS) (Zetasizer 3000HS) | |||||
| Образец | Базовый | 50°С - t0 | 70°С - t0 | 50°С - t24h | 70°С - t24h |
| Размер частиц (нм) | 456,3 | 469,7 | 538,3 | Неопределен* | Не определен* |
| (*): измерение способом лазерной дифракции показало слишком большой размер, поэтому измерение способом PCS не проводили |
Результаты, полученные при нагревании наносуспензии, показывают резкое увеличение размера частиц при 70°С, в особенности после выдержки в течение последующих 24 часов. Это позволяет предположить, что препарат частично переходит в раствор, а затем рекристаллизуется. Размер частиц увеличивался также при 50°С, однако при этом, по-видимому, не происходило столь сильной рекристаллизации в течение последующих 24 часов.
На основании полученных результатов пришли к выводу, что весьма кратковременная выдержка при 50°С является допустимой. Поэтому окончательную партию решили изготовить следующим образом: приготовить Crystalip™ с уменьшенным содержанием водной фазы. Наносуспензию подвергнуть ультразвуковой обработке, но не нагревать. После достижения температуры Crystalip™ 50°C добавить холодную суспензию, что приведет к быстрому снижению температуры и минимизирует воздействие тепла на спиронолактоновую суспензию. Этому процессу не будет мешать также кристаллизация Crystalip™, которая происходит при более низких температурах.
Получили партию материала согласно вышеуказанной методике, при этом холодную наносуспензию добавили к Crystalip™ при 50°C (таблица 8).
| Таблица 8 | |||||
| Партия Crystalip™, содержащая спиронолактоновую наносуспензию | |||||
| Номер партии | Глицерин монолаурат | Глицерин мономиристат | Пропиленгликоль | Наносуспензия | Вода |
| 4011-001/08ас | 6% | 18% | 10% | 20% | 46% |
Данная партия была удачной. Окончательно полученный крем имел хорошую вязкость, блеск и однородный состав.
Измерение вязкости (см. табл.9).
| Таблица 9 | |
| Образец | Состав |
| Bioglan | 20%MG-20%PG |
| 4011-001/05рс | 24%MG-10%PG-20% раствора Octowet (добавили при 70°С) |
| 4011-001/Обрс | 24%MG-10%PG-20% раствора Octowet (добавили при 50°С) |
| 4011-001/07рс | 24%MG-10%PG-20% раствора Octowet (добавили при |
| Образец | Состав |
| комнатной температуре) | |
| 4011-001/08ас | 24%MG-10%PG-20% наносуспензии |
| 4011-001/13рс | 28%MG |
| 4011-001/17рс | 20%MG-20%PG |
Результаты измерения вязкости составов, представленные в приведенн