Иммунизация против chlamydia trachomatis
Иллюстрации
Показать всеИзобретение относится к лекарственным средствам для профилактики или лечения инфекций, вызванных Chlamydia trachomatis. Указанные лекарственные средства (варианты) состоят из иммуногенного белка или нуклеиновой кислоты, кодирующей соответствующий иммуногенный белок (соответствующие последовательности представлены в списке последовательностей). Лекарственные средства на основе иммуногенного белка или кодирующей его нуклеиновой кислоты используют в составе иммуногенной композиции для индукции гуморального иммунитета, которая применяется в качестве фармацевтического средства. Изобретение охватывает способ нейтрализации инфективности указанных бактерий у пациента, а также способ иммунизации пациента против инфекции, вызванной Chlamydia trachomatis, с использованием иммуногенных композиций. Использование идентифицированных по изобретению антигенов и иммуногенов обеспечивает получение более эффективных вакцинных и лечебно-диагностических препаратов. 6 н. и 1 з.п. ф-лы, 106 ил., 2 табл.
Реферат
Все цитируемые в данном описании документы включены в качестве ссылки в их полном виде.
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к области иммунизации против хламидиальной инфекции, в частности, против инфекции Chlamydia trachomatis.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Chlamydiae (хламидии) являются облигатными внутриклеточными паразитами эукариотических клеток, которые являются ответственными за эндемические, переносимые половым путем инфекции и различные другие патологические синдромы. Они занимают особое филогенетическое ответвление эубактерий, не имеющее близкого родства с какими-либо другими известными организмами, - они классифицируются в их собственном отряде (Chlamydiales), который содержит единственное семейство (Chlamydiaceae), которое, в свою очередь, содержит единственный род (Chlamydia, также называемый Chlamydophila). Особенной характеристикой хламидии является их уникальный жизненный цикл, в котором эта бактерия чередующимся образом меняется между двумя морфологически отличающимися формами: внеклеточной инфекционной формой (элементарными телами, ЕВ) и внутриклеточной неинфекционной формой (ретикулярными телами, RB). Этот жизненный цикл завершается реорганизацией RB в ЕВ, которые оставляют разрушенную клетку-хозяина готовыми инфицировать следующие клетки.
В настоящее время известны четыре хламидиальных вида: С. trachomatis, С. pneumoniae, С. pecorum и С. psittaci (например, ссылки 1, 2), и доступны геномные последовательности (ссылки 3-9).
Сероварианты (серовары) С. trachomatis человека делятся на два биоварианта (биовары). Серовары A-К индуцируют эпителиальные инфекции прежде всего в глазной ткани (А-С) или мочеполовых путях (D-K). Серовары L1, L2 и L3 являются агентами инвазивной венерической лимфогранулемы (LGV).
Хотя хламидиальная инфекция сама вызывает заболевание, считается, что у некоторых пациентов тяжесть симптомов обусловлена фактически отклоняющимся от нормы иммунным ответом. Невозможность освободиться от инфекции приводит к персистентной иммунной стимуляции и скорее не к помощи хозяину, а к хронической инфекции с тяжелыми последствиями, в том числе стерильности и слепоте (10). Кроме того, защита (иммунитет), сообщаемая природной хламидиальной инфекцией, обычно является неполной, временной и штамм-специфической.
Вследствие серьезного характера этого заболевания существует желание обеспечить подходящие вакцины. Они могут быть полезными (а) для иммунизации против хламидиальной инфекции или против индуцируемого хламидией заболевания (профилактической вакцинации) или (b) для ликвидации установленной хронической хламидиальной инфекции (терапевтической вакцинации). Однако, будучи внутриклеточным паразитом, эта бактерия может обычно избегать опосредованных антителами иммунных реакций.
Различные антигенные белки были описаны для С. trachomatis, и, в частности, клеточная поверхность была мишенью подробного исследования (например, 1, 11). Они включают, например, Рgр3 (12, 13, 14), МОМР (15), Нsp60 (GroEL) (16) и Hsp70 (DnaK-подобный) (17). Однако не все из них оказались эффективными вакцинами, так что целью данного изобретения является идентификация антигенов С. trachomatis, которые индуцируют иммунный ответ во время природной инфекции, для обеспечения антигенов и иммуногенов, пригодных для применения в разработке вакцин. Другой целью является идентификация антигенов, применимых для диагностики (например, иммунодиагностики) С. trachomatis.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Ссылка 18 описывает различные белки из С. pneumoniae, которые были эмпирически подтверждены как являющиеся иммунореактивными, иммунодоступными и/или присутствующими в элементарных телах. Эти свойства данных белков не были получаемыми из информации о геномной последовательности. Ссылка {18} описывает, что эти белки могут быть использованы в лечении или предупреждении инфекции, вызываемой бактериями Chlamydia, причем главным объектом является С. pneumoniae. Белки С. pneumoniae могут быть также использованы для лечения или предупреждения инфекции другими видами Chlamydia вследствие межвидовой перекрестной реактивности.
С. pneumoniae является близкородственной относительно С. trachomatis, как показано сравнениями полных геномов (3, 4, 5).
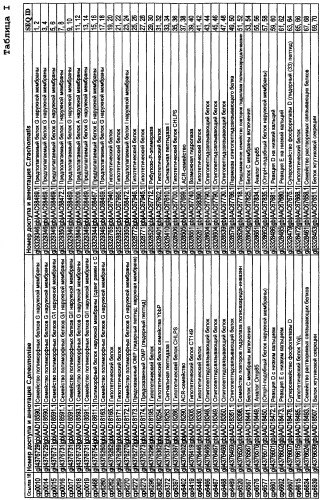
Данное изобретение относится к белкам С. trachomatis (SEQ ID NO:1-261 с нечетными номерами), которые соответствуют белкам С. pneumoniae, описанным в ссылке 18. Эти белки могут быть использованы в лечении или предупреждении инфекции, вызываемой бактериями Chlamydia, в частности С. trachomatis. Особенно предпочтительными белками являются белки, снабженные примечанием "гипотетический белок" (см. таблицу I в данном описании), или которые считали ранее белками, имеющими цитоплазматическую локализацию.
Белки С. trachomatis
Данное изобретение обеспечивает белки, содержащие одну или более аминокислотных последовательностей с нечетными номерами из SEQ ID NO:1-261.
Оно обеспечивает также белки, содержащие последовательности, которые имеют, по меньшей мере, х% идентичность с одной или более аминокислотными последовательностями с нечетными номерами из SEQ ID NO:1-261. В зависимости от конкретной последовательности х обозначает предпочтительно 50% или более (например, 60%, 70%, 80%, 90%, 95%, 99% или более). Эти белки включают мутанты и аллельные варианты. Обычно 50% или большая идентичность между двумя белками считается указанием на функциональную эквивалентность. Идентичность между белками предпочтительно определяют с использованием алгоритма поиска гомологии Смита-Уотермана, осуществляемого в программе MPSRCH (Oxford Molecular), с использованием поиска аффинных гэпов с параметрами штраф за открывание гэпа=12 и штраф за удлинение гэпа=1.
Данное изобретение обеспечивает, далее, белки, содержащие фрагменты аминокислотных последовательностей с нечетными номерами из SEQ ID NO:1-261. Эти фрагменты должны содержать, по меньшей мере, n последовательных аминокислот из этих последовательностей, и в зависимости от конкретной последовательности n равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 30, 40, 50, 75, 100, 150, 200 или более). Предпочтительно эти фрагменты содержат один или более эпитопов из этой последовательности. Другие предпочтительные фрагменты не содержат сигнального пептида.
Белки данного изобретения могут быть получены различными средствами, например химическим синтезом (по меньшей мере, частично), расщеплением более длинных полипептидов с использованием протеаз, трансляцией из РНК, очисткой из культуры клеток (например, рекомбинантной экспрессией или из культуры С. trachomatis) и т.д. Предпочтительным способом является гетерологичная экспрессия в Е. coli.
Белки данного изобретения могут принимать различные формы, например могут быть природными, слитыми, гликолизилированными, негликозилированными, липидированными и т.д.
Белки данного изобретения предпочтительно получают по существу в чистой форме (т.е. по существу не содержащей других белков С. trachomatis или клеточных белков хозяина).
Белки данного изобретения могут быть присоединены к твердому носителю. Они могут содержать детектируемую метку (например, радиоактивную или флуоресцентную метку или биотиновую метку).
Белки данного изобретения являются предпочтительно хламидиальными белками.
Нуклеиновые кислоты С. trachomatis
Данное изобретение обеспечивает нуклеиновые кислоты, содержащие одну или более нуклеотидных последовательностей с четными номерами из SEQ ID NO:2-262.
Настоящее изобретение также обеспечивает нуклеиновые кислоты, содержащие последовательности, которые имеют, по меньшей мере, х% идентичности с последовательностями с четными номерами SEQ ID NO:2-262. В зависимости от конкретной последовательности х обозначает предпочтительно 50% или более (например, 60%, 70%, 80%, 90%, 95%, 99% или более).
Кроме того, данное изобретение обеспечивает нуклеиновые кислоты, которые могут гибридизоваться с нуклеиновыми кислотами, содержащими нуклеотидные последовательности с четными номерами из SEQ ID NO:2-262. Реакции гибридизации могут выполняться в условиях различной "жесткости". Условия, которые увеличивают жесткость реакции гибридизации, широко известны и опубликованы в данной области. Примеры релевантных условий включают (в порядке увеличения жесткости): температуры инкубирования 25°С, 37°С, 50°С, 55°С и 68°С; концентрации буфера 10xSSC, 6xSSC, 1xSSC, 0,1xSSC и их эквиваленты с использованием других буферных систем; концентрации формамида 0%, 25%, 50% и 75%; периоды инкубации от 5 минут до 24 часов; 1, 2 или более стадий промывок; периоды инкубации промывок 1, 2 или 15 минут и промывные растворы 6xSSC, 1xSSC, 0,1xSSC или деионизованная вода. В некоторых вариантах выделенная нуклеиновая кислота данного изобретения селективно гибридизуется в условиях низкой жесткости; в других вариантах она селективно гибридизуется в условиях промежуточной жесткости; в других вариантах она селективно гибридизуется в условиях высокой жесткости. Примером набора условий гибридизации низкой жесткости является 50°С и 10xSSC. Примером условий гибридизации промежуточной жесткости является 55°С и 1xSSC. Примером условий гибридизации высокой жесткости является 68°С и 0,1 х SSC.
Обеспечены также нуклеиновые кислоты, содержащие фрагменты нуклеотидных последовательностей с четными номерами SEQ ID NO:2-262. Они должны содержать, по меньшей мере, n последовательных нуклеотидов из последовательностей С. trachomatis, и в зависимости от конкретной последовательности n равно 7 или более (например, 10, 12, 14, 15, 18, 20, 25, 30, 35, 40, 50, 75, 100, 200, 300 или более).
Согласно следующему аспекту данное изобретение обеспечивает нуклеиновую кислоту, кодирующую белки и фрагменты белков данного изобретения.
Данное изобретение обеспечивает нуклеиновую кислоту, содержащую последовательности, комплементарные последовательностям, описанным выше (например, для антисмысловых целей или целей зондирования).
Конечно, нуклеиновая кислота данного изобретения может быть получена многими путями, например химическим синтезом (по меньшей мере, частично), расщеплением более длинных полинуклеотидов с использованием рестрикционных ферментов (рестриктаз), из геномных библиотек или кДНК-библиотек, из самого организма и т.д.
Нуклеиновые кислоты данного изобретения могут принимать различные формы (например, быть одноцепочечными, двухцепочечными, линейными, кольцевыми, быть векторами, зондами и т.д.).
Нуклеиновые кислоты данного изобретения могут быть прикреплены к твердому носителю (например, к грануле, планшету, фильтру, пленке, предметному стеклу, смоле и т.д.). Нуклеиновые кислоты данного изобретения могут включать детектируемую метку (например, радиоактивную или флуоресцентную метку или биотиновую метку). Это особенно применимо, когда полинуклеотид должен быть использован в способах обнаружения нуклеиновых кислот, например, когда данная нуклеиновая кислота является праймером или зондом для использования в таких способах, как PCR, LCR, ТМА, NASBA, bDNA и т.д.
Нуклеиновые кислоты данного изобретения являются предпочтительно хламидиальными нуклеиновыми кислотами.
Термин "нуклеиновая кислота" включает ДНК, РНК, гибриды ДНК/РНК и аналоги ДНК или РНК, такие как аналоги, содержащие модифицированные скелеты молекул или основания, а также пептиднуклеиновые кислоты (ПНК) и т.д.
Нуклеиновые кислоты данного изобретения могут быть выделены и получены по существу в чистом виде, обычно не в виде интактной хромосомы. Обычно эти полинуклеотиды получают по существу не содержащими природно встречающихся последовательностей нуклеиновых кислот, являющихся обычно, по меньшей мере, на приблизительно 50% (по массе) чистыми, обычно, по меньшей мере, на приблизительно 90% чистыми.
Нуклеиновые кислоты могут быть использованы, например, для получения полипептидов; в качестве зондов для обнаружения нуклеиновой кислоты в биологических образцах; для генерирования дополнительных копий полинуклеотидов; для генерирования рибозимов или антисмысловых олигонуклеотидов и в качестве одноцепочечных ДНК-зондов или в качестве образующих тройную цепь олигонуклеотидов и т.д.
Данное изобретение обеспечивает векторы, содержащие нуклеотидные последовательности данного изобретения, (например, клонирующие векторы или экспрессирующие векторы) и трансформированные ими клетки-хозяева.
Композиции
Согласно следующему аспекту данное изобретение обеспечивает композиции, содержащие белок и/или нуклеиновую кислоту данного изобретения. Эти композиции предпочтительно являются иммуногенными композициями, такими как вакцины, и пригодны для целей иммунизации и вакцинации. Вакцины данного изобретения могут быть профилактическими или терапевтическими и будут обычно содержать антиген, который может индуцировать антитела, способные ингибировать (а) хламидиальную адгезию, (b) хламидиальное вхождение и/или (с) успешную репликацию в клетке-хозяине. Эти вакцины предпочтительно индуцируют любые клеточно-опосредованные Т-клеточные ответы, которые необходимы для клиренса хламидий из хозяина.
Данное изобретение обеспечивает также нуклеиновую кислоту или белок в соответствии с данным изобретением для применения в качестве медикаментов (например, в качестве вакцин).
Данное изобретение обеспечивает также применение нуклеиновой кислоты или белка в соответствии с данным изобретением в приготовлении лекарственного средства (например, вакцины или иммуногенной композиции) для лечения или предупреждения инфекции, обусловленной Chlamydia. Ею является обычно С. trachomatis, но вследствие межвидовой перекрестной реактивности она может быть также С. pneumoniae, С. pecorum или С. psitacci. Для профилактики это лекарственное средство предпочтительно индуцирует иммунный ответ, который является специфическим в отношении ЕВ-формы Chlamydia, для лечения это лекарственное средство предпочтительно индуцирует иммунный ответ, который является специфическим в отношении RB-формы Chlamydia.
Данное изобретение обеспечивает также применение нуклеиновой кислоты или белка в соответствии с данным изобретением в приготовлении лекарственного средства (например, вакцины или иммуногенной композиции) для нейтрализации элементарных тел Chlamydia trachomatis.
Данное изобретение обеспечивает также способ лечения (например, иммунизации) пациента (например, человека), предусматривающий введение пациенту терапевтически эффективного количества нуклеиновой кислоты или белка данного изобретения.
Данное изобретение обеспечивает способ индукции иммунного ответа у пациента, предусматривающий введение пациенту иммунологически эффективного количества нуклеиновой кислоты или белка данного изобретения. Иммунный ответ может включать индукцию антител у пациента и/или индукцию клеточного иммунного ответа (например, CTL-ответа). Этот иммунный ответ может быть специфическим в отношении белка ЕВ или RB или в отношении белка, который экспрессируется в цитоплазме хозяина. Антительный ответ предпочтительно является специфическим в отношении ЕВ, тогда как клеточный иммунный ответ является предпочтительно специфическим в отношении цитоплазматического белка или предпочтительно в отношении RB-белка.
Данное изобретение обеспечивает также способ индукции антител, которые узнают белок данного изобретения, предусматривающий стадию введения пациенту элементарного тела или ретикулярного тела Chlamydia. Эти антитела являются предпочтительно специфическими в отношении ЕВ.
Данное изобретение обеспечивает также способ нейтрализации инфективности С. trachomatis, предусматривающий стадию введения пациенту белка, нуклеиновой кислоты или антитела данного изобретения. Этот способ предпочтительно нейтрализует ЕВ-инфективность.
Данное изобретение обеспечивает также способ обнаружения ЕВ или RB Chlamydia в биологическом образце, предусматривающий стадию контактирования антитела данного изобретения с этим образцом. Этим образцом может быть проба крови, другая жидкость тела или образец ткани. Этот способ может быть использован для диагностики хламидиальной инфекции.
Иммуногенные композиции данного изобретения могут также включать один или более из следующих антигенов:
- белковый антиген из Helicobacter pylori, такой как VacA, CagA, NAP, HopX, HopY (например, WO 98/04702) и/или уреазу;
- белковый антиген из серогруппы В N. meningitidis, такой как в WO99/24578, WO99/36544, WO99/57280, WO00/22430, Tettelin et al. (2000) Science 287:1809-1815, Pizza et al. (2000) Science 287:1816-1820, и WO96/29412, причем предпочтительными являются белок '287' и его производные;
- препарат везикул наружной мембраны (OMV) из серогруппы В N. meningitidis, такой как описанный в WO01/52885; Bjune et al. (1991) Lancet 338(8775): 1093-1096; Fukasawa et al. (1999) Vaccine 17:2951-2958; Rosenqvist et al. (1998) Dev. Biol. Stand. 92:323-333 и т.д.;
- сахаридный антиген из серогруппы А, С, W135 и/или Y N. meningitidis, такой как олигосахарид, описанный в Costantino et al. (1992) Vaccine 10:691-698, и из серогруппы С (см. также Costantino et al. (1999) Vaccine 17:1251-1263);
- сахаридный антиген из Streptococcus pneumonias (например, Watson (2000) Pediatr Infect Dis J 19:331-332; Rubin (2000) Pediatr Clin North Am 47:269-285, v; Jedrzejas (2001) Microbiol Mol Biol Rev 65:187-207);
- антиген из вируса гепатита А, такой как инактивированный вирус (например. Bell (2000) Pediatr Infect Dis J 19:1187-1188; Iwarson (1995) APMIS 103:321-326);
- антиген из вируса гепатита В, такой как антигены поверхности и/или коры (например, Gerlich et al. (1990) Vaccine 8 Suppi: S63-68 & 79-80);
- антиген из вируса гепатита С (например, Hsu et al. (1999) Clin Liver Dis 3:901-915);
- антиген из Bordetella pertussis, такой как коклюшный голотоксин (РТ) и нитевидный гемагглютинин (FHA) из В. pertussis, необязательно также в комбинации с пертактином и/или агглютиногенами 2 и 3 (например, Gustafsson et al. (1996) N. Engl. J. Med. 334:349-355; Rappuoli et al. (1991) TIBTECH 9:232-238);
- дифтерийный антиген, такой как дифтерийный токсоид (например, часть 3 Vaccines (1988) eds. Plotkin & Mortimer. ISBN 0-7216-1946-0), например, мутант CRM197 (например, Del Guidice et al. (1998) Molecular Aspects of Medicine 19:1-70);
- столбнячный антиген, такой как столбнячный токсоид (например, часть 4 Plotkin & Mortimer);
- сахаридный антиген из Haemophilus influenzae В.;
- антиген из N. gonorrhoeae (например, WO99/24578, WO99/36544, WO99/57280);
- антиген из Chlamydia pneumoniae (например, PCT/IB01/01445; Kalman et al. (1999) Nature Genetics 21:385-389; Read et al. (2000) Nucleic Acids Res 28:1397-406; Shirai et al. (2000) J. Infect. Dis. 181 (Suppl 3):S524-S527; WO99/27105; WO00/27994; WO00/37494);
- антиген из Chlamydia trachomatis (например, WO99/28475);
- антиген из Porphyromonas gingivalis (например, Ross et al. (2001) Vaccine 19:4135-4142);
- антиген (антигены) полио (например, Sutter et al. (2000) Pediatr Clin North Am 47:287-308; Zimmerman & Spann (1999) Am Fam Physician 59:113-118, 125-126), такой как IPV или OPV;
- антиген (антигены) бешенства (например, Dreesen (1997) Vaccine 15 Suppl:S2-6), такой как лиофилизированный инактивированный вирус (например, MMWR Morb Mortal Wkly Rep 1998 Jan 16; 47(1):12, 19; RabAvert™);
- антигены кори, эпидемического паротита и/или краснухи (например, 9, 10 и 11 Plotkin & Mortimer);
- антиген (антигены) гриппа (например, часть 19 Plotkin & Mortimer), такие как поверхностные белки гемагглютинина и/или нейраминидазы;
- антиген из Moraxella catarrhalis (например, McMichael (2000) Vaccine 19 Suppl 1:S101-107);
--антиген из Staphylococcus aureus (например, Kuroda et al. 2001) Lancet 357(9264):1225-1240; см. также страницы 1218-1219);
- антиген из Streptococcus agalactiae (например, см. WO02/34771);
- антиген из Streptococcus pyogenes (например, см. WO02/34771).
Если включен сахаридный или углеводный антиген, он предпочтительно конъюгирован с белком-носителем для усиления иммуногенности (например, Ramsay et al. (2001) Lancet 357 (9251):195-196; Lindberg (1999) Vaccine 17 Suppi 2:328-36; Conjugate Vaccines (eds. Cruse et al.) ISBN 3805549326, в частности, vol. 10:48-114 и т.д.). Предпочтительными белками-носителями являются бактериальные токсины или токсоиды, такие как дифтерийный или столбнячный токсоиды. Особенно предпочтительным является дифтерийный токсоид CRM197. Другие подходящие белки-носители включают белок наружной мембраны N. meningitidis (например, ЕР-0372501), синтетические пептиды (например, ЕР-0378881), белки теплового шока (например, WO93/17712), коклюшные белки (например, WO98/58668, ЕР-0471177), белок D из H. influenzae (например, WO00/56360), токсин А или В из С. difficile (например, WO00/61761) и т.д. Может быть использована любая подходящая реакция конъюгации с любым подходящим линкером, если это необходимо.
Токсические белковые антигены могут быть детоксицированы, если необходимо, (например, детоксикацией коклюшного токсина химическими и/или генетическими средствами).
Если в композицию включен дифтерийный антиген, предпочтительно также включать столбнячный и коклюшный антигены. Подобным образом, если включен столбнячный антиген, предпочтительно также включать дифтерийный и коклюшный антигены. Подобным образом, если включен коклюшный антиген, предпочтительно также включать дифтерийный и столбнячный антигены.
Антигены предпочтительно адсорбированы на соли алюминия.
Антигены в этой композиции обычно присутствуют в концентрации, по меньшей мере, 1 мкг/мл каждый. Обычно концентрация любого конкретного антигена должна быть достаточной для индукции иммунного ответа на этот антиген.
Данное изобретение обеспечивает также композиции, содержащие два или более белков данного изобретения.
Способы
Данное изобретение обеспечивает способ получения белков данного изобретения, предусматривающий стадию культивирования клетки-хозяина данного изобретения в условиях, которые индуцируют экспрессию белка.
Данное изобретение обеспечивает способ получения белка или нуклеиновой кислоты данного изобретения, где этот белок или эту нуклеиновую кислоту синтезируют частично или полностью химическими средствами.
Данное изобретение обеспечивает способ обнаружения С. trachomatis в образцах, где этот образец контактирует с антителом, которое связывается с белком данного изобретения.
Далее следует краткое изложение стандартных способов и процедур, которые могут использоваться для осуществления данного изобретения (например, для применения описанных последовательностей для иммунизации). Это краткое изложение не является ограничением данного изобретения, но дает примеры, которые могут быть использованы, но не являются обязательными.
Общая часть
В практике данного изобретения будут использоваться, если нет других указаний, общепринятые способы молекулярной биологии, микробиологии, рекомбинантных ДНК и иммунологии, которые находятся в рамках компетенции в данной области. Такие способы полностью объясняются в литературе, например в Sambrook Molecular Cloning; A Laboratory Manual, Second Edition (1989) and Third Edition (2001); DNA Cloning, Volumes I and II (D.N. Glover ed. 1985); Oligonucleotide Synthesis (M.J. Gait ed, 1984); Nucleic Acid Hybridization (B.D. Hames & S.J. Higgins eds. 1984); Transcription and Translation (B.D. Hames & S.J. Higgins eds. 1984); Animal Cell Culture (R.I. Freshney ed. 1986); Immobilized Cells and Enzymes (IRL Press, 1986); В. Perbal, A Practical Guide to Molecular Cloning (1984); The Methods in Enzymology series (Academic Press, Inc.), especially volumes 154 & 155; Gene Transfer Vectors for Mammalian Cells (J.H. Miller and M.P. Calos eds. 1987, Cold Spring Harbor Laboratory); Mayer and Walker, eds. (1987), Immunochemical Methods in Cell and Molecular Biology (Academic Press, London); Scopes, (1987) Protein Purification: Principles and Practice, Second Edition (Springer-Verlag, N.Y.), and Handbook of Experimental Immunology, Volumes I-IV (D.M. Weir and С.С. Blackwell eds 1986).
В данном описании используются стандартные аббревиатуры для нуклеотидов и аминокислот.
Определения
Композиция, содержащая X, является "по существу свободной от" Y, когда, по меньшей мере, 85% по массе общего количества X+Y в этой композиции составляет X. Предпочтительно Х содержит, по меньшей мере, приблизительно 90% по массе общего количества X+Y в этой композиции, более предпочтительно, по меньшей мере, приблизительно 95% или даже 99% по массе.
Термин "содержащий" означает "включающий в себя", а также "состоящий", например, композиция, "содержащая" X, может состоять исключительно из Х или может включать что-нибудь дополнительно к X, например, X+Y.
Термин "гетерологичные" относится к двум биологическим компонентам, которые не обнаруживаются вместе в природе. Этими компонентами могут быть клетки-хозяева, гены или регуляторные районы, такие как промоторы. Хотя гетерологичные компоненты не обнаруживаются вместе в природе, они могут функционировать вместе, например, когда промотор, гетерологичный в отношении гена, функционально связан с этим геном. Другим примером является пример, когда хламидиальная последовательность является гетерологичной для мышиной клетки-хозяина. Другими примерами могли бы быть два эпитопа из одного и того же белка или различных белков, которые были собраны в единый белок в расположении, не обнаруживаемом в природе.
"Начало репликации" является полинуклеотидной последовательностью, которая инициирует и регулирует репликацию полинуклеотидов, таких как экспрессирующий вектор. Начало репликации ведет себя как автономная единица репликации полинуклеотида в клетке, способная реплицироваться под своим собственным контролем. Начало репликации может быть необходимым для вектора для его репликации в конкретной клетке-хозяине. С определенными началами репликации экспрессирующий вектор может репродуцироваться при высоком количестве копий в присутствии подходящих белков внутри клетки. Примерами начал репликации являются автономно реплицирующиеся последовательности, которые являются эффективными в дрожжах, и вирусный Т-антиген, эффективный в клетках COS-7.
"Мутантная последовательность" определяется как ДНК, РНК или аминокислотная последовательность, отличающаяся, но имеющая идентичность последовательности с нативной или описанной последовательностью. В зависимости от конкретной последовательности степень идентичности последовательности между нативной или описанной последовательностями и мутантной последовательностью составляет предпочтительно более чем 50% (например, 60%, 70%, 80%, 90%, 95%, 99% или более, при расчете с использованием алгоритма Смита-Уотермана, как описано выше). В данном контексте, "аллельный вариант" молекулы нуклеиновой кислоты, или района, для которого обеспечена последовательность нуклеиновой кислоты в данном описаниии, является молекулой нуклеиновой кислоты, или районом, которые встречаются по существу в том же самом локусе в геноме другого или второго изолята и которые, вследствие природной изменчивости, вызванной, например, мутацией или рекомбинацией, имеют сходную, но не идентичную последовательность нуклеиновой кислоты. Аллельный вариант кодирующего района обычно кодирует белок, имеющий сходную активность относительно активности белка, кодируемого геном, с которым его сравнивают. Аллельный вариант может также содержать изменение в 5'- или 3'-нетранслируемых районах этого гена, например в районах регуляторного контроля (например, см. патент США 5753235).
Системы экспрессии
Хламидиальные нуклеотидные последовательности могут экспрессироваться в ряде различных систем экспрессии, например в системах экспрессии, используемых клетками млекопитающих, бакуловирусами, растениями, бактериями и дрожжами.
i. Системы млекопитающих
Системы экспрессии млекопитающих известны в данной области. Промотор млекопитающих является любой последовательностью ДНК, способной связывать РНК-полимеразу млекопитающих и инициировать направленную к 3'-концу транскрипцию кодирующей последовательности (например, структурного гена) в мРНК. Промотор будет иметь район инициации транскрипции, который обычно расположен проксимально относительно 5'-конца кодирующей последовательности, и ТАТА-блок, обычно расположенный в 25-30 парах оснований (п.н.) "слева" от начала транскрипции. Считают, что ТАТА-блок управляет РНК-полимеразой II, заставляя ее начинать синтез РНК в правильном сайте. Промотор млекопитающих содержит также "левый" промоторный элемент, обычно расположенный в 100-200 п.н. слева от ТАТА-блока. "Левый" промоторный элемент определяет скорость, с которой инициируется транскрипция, и может действовать в любой ориентации (Sambrook et al. (1989) "Expression of Cloned Genes in Mammalian Cells", In Molecular Cloning: A Laboratory Manual, 2nd ed.).
Гены вирусов млекопитающих являются часто высокоэкспрессируемыми и имеют большой диапазон хозяев; таким образом, последовательности, кодирующие гены вирусов млекопитающих, обеспечивает особенно полезные промоторные последовательности. Примеры включают ранний промотор SV40, мышиный промотор LTR вируса опухоли молочной железы, главный поздний промотор аденовируса (Ad MLP) и промотор вируса простого герпеса. Кроме того, последовательности, произведенные не из вирусных генов, такие как мышиный ген металлотионеина, также обеспечивают полезные промоторные последовательности. Экспрессия может быть либо конститутивной, либо регулируемой (индуцибелной), зависящей от промотора, который может индуцироваться глюкокортикоидом в гормон-чувствительных клетках.
Присутствие энхансерного элемента (энхансера), в комбинации с описанными выше промоторными элементами, обычно будет увеличивать уровни экспрессии. Энхансером является регуляторная последовательность ДНК, которая может стимулировать транскрипцию до 1000-кратного уровня при связывании с гомологичными или гетерологичными промоторами, причем синтез начинается в нормальном стартовом сайте РНК. Энхансеры являются также активными, когда они помещены "слева" или "справа" от начала транскрипции, либо в нормальной, либо в реаранжированной ориентации, или на расстоянии более чем 1000 нуклеотидов от промотора (Maniatis et al. (1987) Science 236:1237; Alberts et al. (1989) Molecular Biology of the Cell, 2nd ed.). Энхансерные элементы, полученные из вирусов, могут быть особенно полезными, так как они обычно имеют более широкий спектр хозяев. Примеры включают энхансер раннего гена SV40 (Dijkema et al. (1985) EMBO J. 4:761) и энхансер/промоторы, полученные из длинного концевого повтора (LTR) вируса саркомы Рауса (Gorman et al. (1982) PNAS USA 79:6777) и из цитомегаловируса человека (Boshart et al. (1985) Cell 41:521). Дополнительно некоторые энхансеры являются регулируемыми и становятся активными только в присутствии индуктора, такого как гормон или ион металла (Sassone-Corsi and Borelli (1986) Trends Cenet. 2:215; Maniatis et al. (1987) Science 236:1237).
Молекула ДНК может экспрессироваться внутриклеточно в клетках млекопитающих. Промоторная последовательность может быть непосредственно связана с молекулой ДНК, и в этом случае первой аминокислотой на N-конце рекомбинантного белка всегда будет метионин, который кодируется стартовым кодоном ATG. Если желательно, N-конец может быть отщеплен от этого белка инкубацией in vitro с цианогенбромидом.
Альтернативно чужеродные белки могут также секретироваться из клетки в среду для выращивания посредством создания химерных молекул ДНК, которые кодируют слитый белок, включающий фрагмент лидерной последовательности, которая обеспечивает секрецию чужеродного белка в клетках млекопитающих. Предпочтительно имеются сайты процессинга, кодируемые между этим лидерным фрагментом и чужеродным геном, которые могут расщепляться in vivo или in vitro. Фрагмент лидерной последовательности обычно кодирует сигнальный пептид, состоящий из гидрофобных аминокислот, которые управляют секрецией этого белка из клетки. Аденовирусный, состоящий из трех частей лидер является примером лидерной последовательности, которая обеспечивает секрецию чужеродного белка в клетках млекопитающих.
Обычно последовательности терминации транскрипции и последовательности полиаденилирования, узнаваемые клетками млекопитающих, являются регуляторными районами, расположенными 3' (справа) от стоп-кодона трансляции, и, следовательно, вместе с промоторными элементами фланкируют кодирующую последовательность. 3'-конец зрелой мРНК образуется сайт-специфическим посттрансляционным расщеплением и полиаденилированием (Birnstiel et al. (1985) Cell 41:349; Proudfoot and Whitelaw (1988) "Termination and 3' end processing of eukaryotic RNA. In Transcription and splicing (ed. B.D. Hames and D.M. Glover); Proudfoot (1989) Trends Biochem. Sci. 14:105). Эти последовательности управляют транскрипцией мРНК, которая может транслироваться в полипептид, кодируемый ДНК. Примеры сигналов терминации транскрипции/полиаденилирования включают эти элементы, происходящие из SV40 (Sambrook et al. (1989) "Expression of cloned genes in cultured mammalian cells." In Molecular Cloning: A Laboratory Manual).
Обычно описанные выше компоненты, содержащие промотор, сигнал полиаденилирования и последовательность терминации транскрипции, помещают вместе в экспрессионные конструкции. Энхансеры, интроны с функциональными донорными и акцепторными сайтами сплайсинга и лидерные последовательности могут быть включены в экспрессионную конструкцию, если это желательно. Экспрессионные конструкции часто поддерживаются в репликоне, таком как внехромосомный элемент (например, плазмиды), способном к стабильному сохранению в хозяине, таком как клетки млекопитающих или бактерии. Системы репликонов млекопитающих включают системы, произведенные из вирусов животных, которые требуют для репликации транс-активирующих факторов. Например, плазмиды, содержащие системы репликации паповавирусов, таких как SV40 (Gluzman (1981) Cell 23:175) или полиомавирус, реплицируются до чрезвычайно высокого количества копий в присутствии подходящего вирусного Т-антигена. Дополнительные примеры репликонов млекопитающих включают репликоны, полученные из бычьего папилломавируса и вируса Эпштейна-Барра. Кроме того, этот репликон может иметь две системы репликации, что позволяет ему сохраняться, например, в клетках млекопитающих для экспрессии и в прокариотическом хозяине для клонирования и амплификации. Примеры таких челночных (млекопитающее-бактерии) векторов включают рМТ2 (Kaufman et al. (1989) Mol. Cell. Biol. 9:946) и pHEBO (Shimizu et al. (1986) Mol. Cell. Biol 6:1074).
Используемая процедура трансформации зависит от трансформируемого хозяина. Способы введения гетерологичных полинуклеотидов в клетки млекопитающих известны в данной области и включают опосредованную декстраном трансфекцию, осаждение фосфатом кальция, опосредованную полибреном трансфекцию, слияние протопластов, электропорацию, инкапсулирование полинуклеотида (полинуклеотидов) в липосомах, прямую микроинъекцию ДНК в ядра.
Клетки млекопитающих, доступные в качестве хозяев для экспрессии, известны в данной области и включают многие иммортализованные клеточные линии, доступные из Американской коллекции типовых культур (АТСС), в том числе, но не только, клетки яичника китайского хомячка (СНО), клетки HeLa, клетки почки детеныша хомячка (ВНК), клетки почки обезьяны (COS), клетки печеночно-клеточной карциномы человека (например, Нер G2) и ряд других клеточных линий.
ii. Системы бакуловируса
Полинуклеотиды, кодирующие белок, могут быть также введены в подходящий экспрессирующий вектор насекомых и функционально связаны с регуляторными элементами в этом векторе. Конструирование векторов использует способы, которые известны в данной области. Обычно компоненты этой экспрессионной системы включают вектор-переносчик, обычно бактериальную плазмиду, которая содержит как фрагмент генома бакуловируса, так и удобный сайт рестрикции для встраивания гетерологичного гена или генов, которые должны быть экспрессированы; бакуловирус дикого типа с последовательностью, гомологичной бакуловирус-специфическому фрагменту в векторе-переносчике (это делает возможным гомологичную рекомбинацию для встраивания гетерологичного гена в геном бакуловируса), и подходящие клетки-хозяева насекомых и среды для выращивания.
После встраивания ДНК-последовательности, кодирующей этот белок, в вектор-переносчик этот вектор и вирусный геном дикого типа трансфицируют в клетку-хозяина насекомого, где этому вектору и вирусному геному представляют возможность рекомбинироваться. Упакованный рекомбинантный вирус экспрессируется и рекомбинантные бляшки идентифицируют и очищают. Материалы и способы для систем экспрессии бакуловирус/клетка насекомого являются коммерчески доступными в форме набора из, inter alia, Invitrogen, San Diego CA (набор "MaxBac"). Эти способы обычно известны специалистам с квалификацией в данной области и полностью описаны в работе Summers and Smith, Texas Agricultural Experiment Station Bulletin No. 1555 (1987) (далее называемой "Summers and Smith").
Перед встраиванием ДНК-последовательности, кодирующей белок, в бакуловирусный геном вышеописанные компоненты, содержащие промотор, лидер (если желательно), представляющую интерес кодирующую последовательность и последовательность терминации транскрипции, обычно собирают в промежуточную перемещающую конструкцию (вектор-переносчик). Эта конструкция может содержать единственный ген и функционально связанные регуляторные элементы; множественные гены, каждый с его собственным набором функционально связанных регуляторных элементов, или множественные гены, регулируемые одним и тем же набором регуляторных элементов. Промежуточные, переносящие конструкции часто поддерживаются в репликоне, таком как внехромосомный элемент (например, плазмиды), способном стабильно сохраняться в хозяине, таком как бактерия. Репликон имеет систему репликации, что позволяет ему сохраняться в подходящем хозяине для клонирования и амплификации.
В настоящее время наиболее часто используемым вектором-переносчиком для введения чужеродных генов в AcNPV является рАс373. Были сконструированы также многочисленные другие векторы, известны