Использование медных катализаторов на металлических носителях для риформинга спиртов
Иллюстрации
Показать всеИзобретение относится к дегидрированию или риформингу спиртов, в частности к способу дегидрирования первичного спирта, такого как метанол или этанол, для получения водорода, в частности для использования в топливном элементе с целью получения электрической энергии. В способе дегидрирования используют медьсодержащий катализатор, включающий в себя металлический носитель, при этом такой катализатор обладает повышенной активностью в газофазном риформинге первичных спиртов, также являются более устойчивыми и особенно активными для термического разложения этанола на водород, метан, монооксид углерода и диоксид углерода при умеренной температуре. Для решения поставленной задачи способ включает приведение в контакт исходной сырьевой смеси газов, содержащей спирт, с катализатором риформинга, чтобы получить смесь продуктов риформинга, содержащую водород, причем катализатор риформинга содержит металлический губчатый носитель и покрытие на меди, по меньшей мере, частично покрывающее поверхность данного металлического губчатого носителя, где данный металлический губчатый носитель получают при помощи способа, включающего выщелачивание алюминия из сплава, содержащего алюминий и основной металл. 4 н. и 125 з.п. ф-лы, 12 табл., 2 ил.
Реферат
Область техники, к которой относится изобретение
Данное изобретение в целом относится к дегидрированию или риформингу спиртов. Более точно, данное изобретение относится к способу дегидрирования первичного спирта, такого как метанол или этанол, для получения водорода, в частности для использования в топливном элементе с целью получения электрической энергии. Способ дегидрирования использует медьсодержащий катализатор, включающий в себя металлический носитель.
Уровень техники
Хорошо известно, что контактирование первичных спиртов с подходящим катализатором при повышенных температурах (например, свыше 200оС) заставляет спирт разлагаться на газообразный водород и углеродсодержащие вещества. Этот процесс обычно известен как "спиртовой риформинг". Например, риформинг метанола ведет к образованию водорода и моноксида углерода, как проиллюстрировано следующим уравнением 1:
СН3ОН -> СО + 2Н2 (1)
Водород, полученный в процессе риформинга, может затем подаваться в топливный элемент для получения электрической энергии. Процесс риформинга является эндотермичным и требует эффективного переноса тепла к катализатору, особенно в применении к транспортным средствам (например, электрические автомобили), где необходима высокая пиковая мощность, особенно при запуске.
Риформинг метанола описан, например, Гюнтер(ом) (Gunter) с соавторами, J. Catal. 203, 133-49 (2001); Брином(Breen) с соавторами, J. Chem. Soc. Chem. Comm. 2247-48 (1999); European Chemical News, стр. 22, (May 11, 1998); и Джанг(ом)(Jiang) с соавторами, Appl., Cat., 97A, 145-58 (1993). Риформинг метанола и конкретное применение риформинга метанола в качестве источника водорода для топливных элементов описано Агрелл(ом) с соавторами, Catalysis-Specialist Periodical Reports, том 16, сс. 67-132 (J.J. Spivey, ed., Royal Society of Chemistry, Cambridge, UK, 2002).
Важно отметить, что моноксид углерода обычно является токсичным для электродов топливного элемента. Например, производительность топливного элемента и экономия энергии обычно уменьшаются, когда уровень содержания моноксида углерода превышает примерно 20 частей на миллион (по массе) в исходном водороде. См., Петерсон (Pettersson) с соавторами в Int'1 J. Hydrogen Energy, том 26, стр. 246 (2001). Поэтому желательно преобразовывать моноксид углерода в диоксид углерода с помощью реакции с водяным паром, как показано следующим уравнением 2:
CO + H2O -> CO2 + H2 (2)
Это превращение известно как реакция конверсии водяного пара и широко применяется на практике в промышленном масштабе. Описание катализаторов, процессов и применений реакции конверсии водяного пара, можно найти, например, в Catalyst Handbook, сс. 283-339 (2nd ed., M.V. Twigg ed., Manson Publishing, London, 1996).
В условиях, подобных описанным выше относительно метанола, при риформинге этанола сначала получают ацетальдегид, который затем может быть разложен (т.е. декарбонилирован) до моноксида углерода и метана, как показано следующим уравнением (3):
CH3CH2OH - CH3C(O)H + H2 ->CO + CH4 + H2 (3)
Как в случае риформинга метанола, риформинг этанола предпочтительно сочетать с реакцией конверсии водяного пара для превращения моноксида углерода в диоксид углерода и получения дополнительного водорода. Таким образом, реакция конверсии водяного пара в сочетании с риформингом этанола дает диоксид углерода, метан и водород, как показано следующим уравнением 4:
СО + СН4 + Н2 + Н2О -> СО2 + СН4 + 2Н2 (4)
Наиболее распространенные катализаторы для дегидрирования спирта и низкотемпературных реакций конверсии водяного пара содержат медь с оксидом цинка и иногда другие промоторы (ускорители катализа) на жаростойкой структуре-носителе, обычно оксида алюминия или оксида кремния. Катализаторы (типа) медь-оксид цинка, хотя и показывающие превосходную прочность для синтеза метанола, имеют не отвечающую требованиям прочность для риформинга метанола, что было сообщено и описано Ченгом (Cheng), Appl. Cat. A, 130, с. 13-30 (1995) и Амфлетом (Amphlett) с соавторами, Stud. Surf. Sci. Catal., 139, с. 205-12 (2001).
Большинство других катализаторов, которые, как сообщалось, являются активными для риформинга спирта, состояли из оксидов металлов, обычно содержащих каталитические металлы. Yee с соавторами, J. Catal., 186, 279-95 (1999) и Шенг(Sheng) с соавторами, J. Catal., 208, 393-403 (2002) описывают риформинг этанола (непосредственно) над СеО2 самим по себе или с добавленными родием, платиной или палладием. Однако эти статьи сообщают, что этанол может разложиться до ряда нежелательных побочных продуктов, таких как ацетон, кетен и бутен.
Известно, что медно-никелевые катализаторы имеют высокую активность для дегидрирования этанола. Например, медно-никелевые катализаторы, нанесенные на алюминий, являются активными для риформинга этанола. Риформинг этанола над медно-никелевыми катализаторами описан Мариньо (Marino) с соавторами в Stud. Surf. Sci. Catal. 130c., 2147-52 (2000) и Френи Freni с соавторами в React. Kinet. Catal. Lett. 71, 143-52 (2000). Хотя в ссылках описывают катализаторы как обеспечивающие хорошую селективность при декарбонилировании ацетальдегида, каждая из ссылок страдает от недостатков в виде неполной конверсии и минимальной активности конверсии водяного пара при температурах порядка 300°С. Кроме того, обычные катализаторы для риформинга этанола имеют тенденцию быстро выходить из строя из-за отложения углерода на поверхности, процесса известного как коксование. При температурах свыше 400°С коксование ускоряется из-за присутствия кислотных центров на поверхности катализатора, которые способствуют дегидрированию этанола до этилена, который затем полимеризуется. Проблема коксования, связанная с катализаторами для риформинга этанола, описана, например, Хага (Haga) с соавторами в Nippon Kagaku Kaishi, 33-6 (1997) и Френи (Freni) с соавторами в React. Kinet. Catal. Lett., 71, с. 143-52 (2000).
Таким образом, продолжает существовать необходимость в усовершенствованных катализаторах для дегидрирования спирта и процессах риформинга спиртов, возможных при умеренных температурах реакции и с достаточной конверсией.
Раскрытие изобретения
В числе несомненных целей настоящего изобретения таким образом имеются: разработка нового и усовершенствованного способа дегидрирования спиртов с образованием водорода, особенно такого способа, в котором используется катализатор, имеющий более высокую плотность, чем катализаторы для риформинга спирта в известном уровне техники; усовершенствованный способ, использующий катализатор для риформинга спирта, обеспечивающий лучшую теплопроводность для поддержания эндотермичной реакции; усовершенствованный способ, использующий катализатор без кислотных центров; усовершенствованный способ, использующий катализатор, имеющий высокую активность и повышенную прочность при конверсии ацетальдегида до метана и моноксида углерода при умеренной температуре; усовершенствованный способ, который дает смесь продуктов, содержащую водород, пригодный для использования в топливном элементе для получения электрической энергии; а также новый и практичный способ генерации энергии из этанола при температурах риформинга ниже примерно 400°С, который предусматривает упрощенную энергетическую систему, требующую менее дорогостоящих частей водородного топливного элемента, и обеспечивает улучшенную энергетическую эффективность.
Вкратце, следовательно, настоящее изобретение относится к способу риформинга спирта. Способ включает в себя приведение в контакт спирта с катализатором для риформинга, включающего в себя медь на поверхности металлической структуры-носителя. В предпочтительном варианте осуществления катализатор для риформинга включает в себя медь на поверхности металлического губчатого носителя, предпочтительно металлической губки, содержащей никель или металлической губки, содержащей никель и медь.
Кроме того, настоящее изобретение относится к способу риформинга этанола. Способ включает контактирование при температуре ниже примерно 400°С исходной сырьевой смеси газов, содержащей этанол, с катализатором для риформинга с получением смеси продуктов риформинга, содержащей водород. Катализатор для риформинга включает в себя медь на поверхности металлического носителя. В предпочтительном варианте осуществления способ включает в себя контактирование при температуре менее чем примерно 350°С исходной сырьевой смеси газов, содержащей этанол, с катализатором, содержащим медь на поверхности никелевого носителя.
Кроме того, настоящее изобретение относится к способу получения электрической энергии из топливного элемента. Способ включает контактирование исходной сырьевой смеси газов, содержащей этанол, с катализатором для дегидрирования в реакционной зоне дегидрирования с получением смеси продуктов, содержащей водород. Катализатор дегидрирования содержит медь на поверхности металлического носителя. Водород из смеси продуктов и кислород вводят в топливный элемент для получения электрической энергии и отходящего из топливного элемента потока газов, содержащего метан. Вытекающий из топливного элемента поток газов вводят в камеру сгорания и сжигают в присутствии кислорода. В дополнительном варианте осуществления настоящее изобретение относится к усовершенствованной методике нанесения медного покрытия с целью приготовления катализатора дегидрирования.
Другие цели и признаки настоящего изобретения будут отчасти очевидны, а отчасти указаны ниже.
Краткое описание чертежей
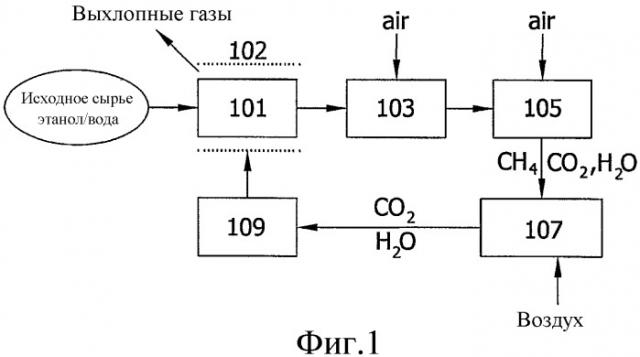
Фиг.1 представляет собой схематическое изображение энергетической системы в соответствии с вариантом осуществления настоящего изобретения, в котором смесь водородсодержащих продуктов, полученных при риформинге спирта, вводят в качестве источника топлива в водородный топливный элемент для генерации электрической энергии.
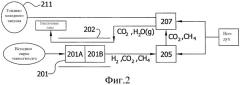
Фиг.2 представляет собой схематическое изображение энергетической системы в соответствии с другим вариантом осуществления настоящего изобретения, в котором смесь продуктов, содержащую водород, полученную при риформинге спирта, вводят в качестве источника топлива в водородный топливный элемент для генерации электрической энергии, и в котором отходящий из топливного элемента поток газов проходит к двигателю внутреннего сгорания, который также снабжен отдельным сырьевым источником спирта.
Описание предпочтительных вариантов осуществления
В соответствии с настоящим изобретением смеси меди с другими металлами, особенно смеси меди и никеля, используют в качестве катализаторов для дегидрирования спиртов (например, риформинга). Было обнаружено, что медьсодержащие катализаторы, содержащие металлический носитель, например катализатор, приготовленный осаждением меди на никелевый губчатый носитель, показывают повышенную активность в качестве катализаторов в газофазном риформинге первичных спиртов, таких как метанол и этанол. Катализаторы, используемые при осуществлении настоящего изобретения, являются более устойчивыми и особенно активными для термического разложения этанола на водород, метан, моноксид углерода и диоксид углерода при умеренной температуре. Получаемый водород можно использовать, например, для генерации энергии путем конверсии водорода в воду в топливном элементе и сгорания метана вместе с любым остаточным водородом в газовом потоке, выходящем из топливного элемента. Процесс сгорания может или приводить в движение генератор для получения дополнительной электрической энергии или использоваться в двигателе внутреннего сгорания для генерации механической энергии. Такая энергетическая система обеспечивает удобный способ получения энергии из этанола с теми дополнительными преимуществами, что сгорание используют с целью сведения к минимуму нежелательных выбросов, в то же время обеспечивая теплом слой катализатора. Более широко, смесь продуктов, полученная при риформинге первичных спиртов в соответствии с настоящим изобретением, может быть использована в качестве источника водорода и/или моноксида углерода в приложениях к химическому процессу (например, карбонилирование, гидрирование и гидроформилирование) и в приложениях к обработке материалов.
Кроме этого, описанный здесь катализатор для риформинга спирта может быть использован для получения смеси продуктов, содержащей водород и моноксид углерода, известной как синтез-газ, из спиртового исходного сырья.
А. Катализатор
В одном варианте осуществления изобретения катализатор дегидрирования или риформинга спирта включает в себя медьсодержащую активную фазу на поверхности металлического носителя, включающего в себя медь и/или один или более не являющихся медью металлов. Катализатор обычно включает в себя, по меньшей мере, примерно 10 мас.% меди, предпочтительно от примерно 10 мас.% до примерно 90 мас.% меди и более предпочтительно от примерно 20 мас.% до примерно 45 мас.% меди. Катализатор может содержать, по существу, гомогенную структуру, такую как губчатая медь, однофазный медьсодержащий сплав, или гетерогенную структуру, имеющую более чем одну дискретную фазу. Таким образом, медьсодержащая активная фаза может присутствовать на поверхности носителя в виде дискретной фазы, такой как медное покрытие или внешний слой; в виде поверхностного слоя или как часть гомогенной структуры катализатора. В случае медьсодержащей активной фазы, включающей в себя дискретную фазу на поверхности носителя, металлический носитель может быть полностью или частично покрыт медьсодержащей активной фазой. Например, в особенно предпочтительном варианте осуществления, который описан ниже, катализатор содержит медьсодержащую активную фазу на поверхности металлического губчатого носителя, включающего в себя никель. Такие катализаторы включают в себя от примерно 10 мас.% до примерно 80 мас.% меди и более предпочтительно от примерно 20 мас.% до примерно 45 мас.% меди. Остальной катализатор предпочтительно состоит из никеля и менее чем 10 мас.% алюминия или других металлов. Дополнительно, в предпочтительных вариантах осуществления, в которых металлический носитель содержит никель, важно отметить, что медь и никель смешиваются во всех соотношениях. Таким образом, катализаторы, включающие в себя медьсодержащую активную фазу на поверхности никелевого носителя, могут не обязательно иметь фазовую границу между медьсодержащей активной фазой и носителем.
Как обычно в катализе, активность катализатора дегидрирования улучшается с увеличением площади поверхности. Таким образом, обычно предпочтительно, чтобы свежеприготовленный катализатор имел площадь поверхности, по меньшей мере, примерно 10 м2/г, измеренную методом Брунауэра-Эмметта-Теллера (по БЭТ). Более предпочтительно, чтобы катализатор имел площадь поверхности по БЭТ от примерно 10 м2/г до примерно 100 м2/г, даже более предпочтительно, чтобы катализатор имел площадь поверхности по БЭТ от примерно 25 м2/г до примерно 100 м2/г и еще более предпочтительно, чтобы катализатор имел площадь поверхности по БЭТ от примерно 30 м2/г до примерно 80 м2/г. В определенном предпочтительном варианте осуществления риформинга этанола поверхность катализатора предпочтительно содержит такое количество атомов никеля, которое способствует декарбонилированию альдегидов, таких как ацетальдегид. Предпочтительно поверхность содержит от примерно 5 до примерно 100 мкмоль/г никеля, что измерено методом, описанным в "Surfaces of Raney® Catalysts" Шмидта в "Катализе органических реакций" (Catalysis of Organic Reactions), сс. 45-60 (M.G. Scaros и M.L. Prunier, eds., Dekker, New York, 1995). Более предпочтительно, концентрация поверхностного никеля составляет от примерно 10 мкмоль/г до примерно 80 мкмоль/г, наиболее предпочтительно от примерно 15 мкмоль/г до примерно 75 мкмоль/г.
1. Структура-носитель
Носитель катализатора дегидрирования спирта содержит металл. Подходящие носители могут включать в себя широкий набор структур и компоновок. Предпочтительно металлические носители содержат металл, имеющий больший предел прочности на разрыв и/или предел текучести, чем медь. Таким образом, в соответствии с предпочтительным вариантом осуществления носитель включает в себя иной чем медь металл. Иной чем медь металл может содержать единственный металл или разнородные металлы. В таком предпочтительном варианте осуществления, по меньшей мере, примерно 10 мас.% металла носителя составляет иной чем медь металл. В одном особенно предпочтительном варианте осуществления, по меньшей мере, примерно 50 мас.% (более предпочтительно, по меньшей мере, примерно 65 мас.%, по меньшей мере, примерно 80 мас.%, по меньшей мере, примерно 85 мас.% или даже, по меньшей мере, примерно 90 мас.%) металлического носителя составляет иной чем медь металл. В другом особенно предпочтительном варианте осуществления носитель содержит, по меньшей мере, примерно 10 мас.% иного чем медь металла и, по меньшей мере, примерно 50 мас.% (более предпочтительно от примерно 60% до примерно 80%) меди.
Металл или сплав, из которого изготовлен металлический носитель, предпочтительно имеет больший предел прочности на разрыв и/или предел текучести, чем медь сама по себе. Особенно предпочтительно для композиции иметь предел текучести, по меньшей мере, примерно 70 МПа, более предпочтительно, по меньшей мере, примерно 100 МПа, даже более предпочтительно, по меньшей мере, примерно 110 МПа.
Также особенно предпочтительно для композиции иметь предел прочности на разрыв, по меньшей мере, примерно 221 МПа, более предпочтительно примерно 275 МПа и даже более предпочтительно, по меньшей мере, примерно 300 МПа. Например, композиция, содержащая 90 мас.% меди и 10 мас.% никеля по имеющимся сообщениям, имеет предел текучести 110 МПа и предел прочности на разрыв 303 МПа; композиция, содержащая 70 мас.% меди по массе и 30 мас.% никеля по имеющимся сообщениям, имеет предел текучести 138 МПа и предел прочности на разрыв 372 МПа; и композиция, содержащая 70 мас.% меди и 30 мас.% цинка по имеющимся сообщениям, имеет предел текучести 124 МПа и предел прочности на разрыв 331 МПа. См. Krisher и Siebert, Perry's Chemical Engineers' Handbook, стр. 23-42 по 23-49 (6th ed., McGraw Hill, New York, NY 1934).
Предпочтительно иной чем медь металл металлического носителя выбирают из группы, состоящей из никеля, кобальта, цинка, серебра, палладия, золота, олова, железа и смесей из них. Более предпочтительно металлический носитель включает в себя никель. Никель обычно наиболее предпочтителен, потому что, например: (1) - никель, относительно недорогой по сравнению с другими подходящими металлами, такими как палладий, серебро и кобальт; (2) как было показано, комбинации никеля и меди способствуют декарбонилированию ацетальдегида до метана и моноксида углерода и (3) осаждение меди на никельсодержащий носитель обычно является менее сложным по сравнению с осаждением меди на носитель, содержащий достаточное количество других подходящих металлов. Например, медь может быть осаждена на никельсодержащий носитель с использованием простого процесса заместительного электрохимического осаждения. Однако имеются другие технологии (например, нанесение покрытия методом химического восстановления и металлоорганическое химическое осаждение из паровой фазы), которые могут быть использованы для осаждения меди на носители, включающие в себя другие подходящие металлы, иные чем медь.
Часто желательно осадить медь на поверхность металлического носителя, используя электрохимическое заместительное осаждение (описанное также в данной области техники как нанесение металлического покрытия погружением), что описано более детально ниже. В этом случае, когда металлический носитель предпочтительно содержит металл, потенциал восстановления которого до свободного металла меньше, чем восстановительный потенциал металлической меди, т.е. восстановительный потенциал металла меньше, чем примерно +343 мВ относительно НВЭ (нормального водородного электрода). Иными чем медь металлами с таким потенциалом (являются), например, никель, цинк, олово, железо и кобальт. Присутствие таких металлов вблизи поверхности носителя допускает простое осаждение металлической меди на поверхности носителя при контактировании поверхности с раствором соли меди (обычно соли Cu(II)). Более точно, в ходе заместительного электрохимического осаждения такой металл вблизи поверхности носителя имеет тенденцию к окислению (и переходу в раствор в качестве иона) при контактировании с раствором, содержащим ион меди. Если это происходит, то ионы меди в растворе вблизи поверхности носителя восстанавливаются до металлической меди, которая, в свою очередь, осаждается на поверхности носителя. Происходящая реакция, например, при контактировании носителя, включающего в себя никель, с раствором соли меди иллюстрируется в следующем уравнении 5:
Cu2+ + Ni° -> Cu° + Ni2+ (5)
Как предлагалось выше, в случае если катализатор готовят путем осаждения меди на поверхность носителя с использованием заместительного электрохимического осаждения, то особенно предпочтительно использовать никельсодержащий носитель, потому что никель имеет, по меньшей мере, четыре желательные характеристики: (1) его восстановительный потенциал до металла меньше, чем потенциал восстановления металлической меди, (2) относительная стабильность условий реакции дегидрирования спирта по данному изобретению, (3) большие механическая прочность и сопротивление истиранию, чем у меди, и (4) катализаторы никель/медь ускоряют декарбонилирование ацетальдегида до моноксида углерода и метана.
Когда металлический носитель включает в себя более одного металла, то предпочтительно, чтобы, по меньшей мере, примерно 80 мас.% (более предпочтительно, по меньшей мере, примерно 85 мас.% даже более предпочтительно, по меньшей мере, примерно 90 мас.% и еще даже более предпочтительно, по существу, все количество) металлов в носителе находились в виде сплава. В особенно предпочтительном варианте осуществления металлы образуют сплав замещения (также известный, как "монофазный сплав"), в котором сплав имеет единственную однородную фазу. Многофазные сплавы (т.е. сплавы, содержащие, по меньшей мере, 2 дискретные фазы) можно также использовать как носители. В вариантах осуществления, в которых медьсодержащую активную фазу осаждают на носитель, содержащий многофазный сплав, медь имеет тенденцию предпочтительно покрывать обогащенные медью участки поверхности многофазного носителя, чем относительно обедненные медью участки поверхности. Является ли сплав однофазным или многофазным будет зависеть от компонентов сплава и их концентраций. Обычно, например, металлические носители, состоящие, по существу, из никеля и меди, являются однофазными при любой концентрации никеля. Но, например, когда носитель состоит, по существу, из меди и цинка, имеется много (значений) концентраций цинка (обычно, концентрации более чем примерно 35 мас.%), которые приводят к тому, что сплав становится двухфазным.
Следует понимать, что носитель может также содержать атомы неметаллов (т.е. бора, углерода, кремния, азота, фосфора и т.д.) вдобавок к атомам металла. Сплав, содержащий такой неметалл, обычно описывается в данной области техники как "сплав внедрения". Носители, содержащие такой сплав, могут иметь различные преимущества, такие как повышенная механическая прочность. Однако, в типичном случае, катализаторы, включающие в себя сплав внедрения, содержат, по меньшей мере, примерно 70 мас.% металла.
В особенно предпочтительном варианте осуществления носитель является металлической губкой, содержащей медь и/или один или несколько перечисленных выше подходящих металлов, иных чем медь. Используемый здесь термин "металлическая губка" относится к пористой форме металла или металлического сплава с площадью поверхности по БЭТ, по меньшей мере, примерно 10 м2/г. Предпочтительные металлические губчатые носители имеют площадь поверхности по БЭТ, по меньшей мере, примерно 20 м2/г, более предпочтительно, по меньшей мере, примерно 35 м2/г, даже более предпочтительно, по меньшей мере, примерно 50 м2/г и еще более предпочтительно, по меньшей мере, примерно 70 м2/г. Было найдено в соответствии с настоящим изобретением, что медьсодержащая активная фаза на поверхности металлического губчатого носителя приводит к материалу, обладающему механической прочностью, большей площадью поверхности, высокой теплопроводностью и плотностью губчатого носителя в сочетании с желательной каталитической активностью меди.
Металлический губчатый носитель и получающийся катализатор могут быть в виде порошка или гранул. Кроме того, катализатор для дегидрирования спирта можно использовать в виде монолита, полученного внедрением катализатора изобретения на поверхность подходящего перфорированного субстрата (например, сотовой структуры). Обычно, катализатор в форме гранул и монолитов является предпочтительным для минимизации противодавления в риформинг-установке, как описано ниже. Кроме того, монолитные катализаторы могут быть более устойчивыми к механическому разрушению, вызванному вибрацией (например, в применении к автотранспортному средству) и/или химической коррозией в реакционной среде.
Важно отметить, что когда катализатор изобретения используется в виде гранулы или монолита, то предполагается, что только часть гранулы или монолита может включать в себя металлическую губку в качестве носителя медьсодержащей активной фазы. То есть, катализатор риформинга спирта может включать в себя непористый субстрат для обеспечения прочности и формы неподвижного слоя или монолитного катализатора, наряду с наличием одного или нескольких пористых участков (т.е. металлической губки) с площадью поверхности по БЭТ, по меньшей мере, примерно 10 м2/г в качестве носителя медьсодержащей активной фазы. Подходящие непористые материалы для использования в качестве неподвижного слоя или монолитных субстратов обычно могут включать в себя любой материал, который является термически и химически устойчивым в условиях нанесения покрытия и риформинга. Хотя можно использовать неметаллические субстраты, обычно более предпочтительны металлические субстраты, такие как нержавеющая сталь, медь, никель, кобальт, цинк, серебро, палладий, золото, олово, железо и их смеси.
Когда металлический губчатый носитель находится в виде порошка, то предпочтительный средний размер частицы металлической губки составляет, по меньшей мере, примерно 0,1 мкм, предпочтительно от примерно 0,5 до примерно 100 мкм, более предпочтительно от примерно 15 до примерно 100 мкм, еще более предпочтительно от примерно 15 до примерно 75 мкм и даже еще более предпочтительно от примерно 20 до примерно 65 мкм. Когда катализатор находится в виде гранулы или монолита, то размеры гранулы или монолитного субстрата, на которую внедряется катализатор настоящего изобретения, а также размер ячеистых отверстий в любом таком монолитном носителе, могут изменяться, как это необходимо в соответствии с конструкцией установки для риформинга, что понятно специалистам в этой области техники.
Металлические губчатые носители могут быть приготовлены путем технологий обычно известных специалистам в этой области техники. См., в основном Либер(Lieber) и Мориц(Morritz), Adv. Catal., 5, 417(1953) (основной обзор, посвященный губчатым металлам). См. также Hawley's Condensed Chemical Dictionary, 13th Ed., стр. 621 (Rev. by Richard J. Lewis, Sr., Van Nostrand Reinhold, New York, NY 1997) (описание способа приготовления железной губки).
Ссылки, описывающие приготовление никелевых губок, включают в себя, например, Augustine, Robert L., « Техника каталитического дегидрирования и применение в органическом синтезе» (Catalytic Hydrogenation Techniques and Applications in Organic Synthesis), приложение на стр. 147-49 (Marcel Dekker, Inc.,1965). См., также Hawley's Condensed Chemical Dictionary, 13th Ed., стр. 955 (Rev, by Richard J, Lewis, Sr., Van Nostrand Reinhold, New York, NY 1997) (описывающие обычно признанные способы изготовления губчатого никеля путем выщелачивания алюминия из сплава, содержащего 50 мас.% никеля и 50 мас.% алюминия с использованием 25 мас.% раствора каустической соды). В случае никелевых губок металлический носитель предпочтительно, по существу, не содержит неактивированных участков и промыт до состояния, когда он, по существу, не содержит оксидов алюминия. Непрореагировавший алюминий будет стремиться прореагировать с паром в условиях риформинга с образованием оксидов алюминия, которые могут препятствовать диффузии и обеспечивать кислотные центры для дегидратации этанола.
Ссылки, описывающие приготовление медноцинковых губок, включают в себя, например, Бриджуотер(а)(Bridgewater) с соавторами, Appl. Catal., 7, 369 (1983). Такие ссылки также включают в себя, например, М.С.Уэнрайт(а)(M.S. Wainwright), "Медь Ренея и медь-цинк Ренея" ("Raney Copper and Raney Copper-Zinc Catalysts", Chem. Ind. (Dekker), 68, 213-30 (1996).
Ссылки, описывающие приготовление никель-железных губок, включают в себя, например, Беккер(а)(Becker) и Шмидт(а)(Schmidt), "Никель-железные катализатор Ренея" ("Raney nickel-iron catalyst",Ger. Offen. DE 2713374 19780928 (1978).
Ссылки, описывающие приготовление никель-кобальтовых губок, включают в себя, например, Орчард(а) с соавторами, "Приготовление и свойства никель-кобальтовых катализаторов Ренея" ("Preparation and Properties of Raney Nickel-Cobalt Catalists") J. Catal., 84, 189-99 (1983).
В соответствии с одним предпочтительным вариантом осуществления носитель содержит никель-медную губку (т.е. никелевую губку с примесью меди или медную губку с примесью никеля), как описано в совместно уступленном (co-assigned) патенте США №6376708.
Ссылки, описывающие приготовление никель-медных губок, также включают в себя, например, Юнга(Young) с соавторами, J. Catal., 64, 116-23 (1980) и Уэнрайта (Wainwright) и Андерсона (Anderson), J. Catal., 64, 124-31 (1980).
Подходящие металлические губки включают материал, производимый фирмой W.R.Grace & Co, (Davison Division, Chattanooga, TN) под торговой маркой Реней(RANEY), а также материалы, обычно описываемые в этой области техники как "металлы Ренея", независимо от источника. Металлы Ренея могут быть получены, например, путем выщелачивания алюминия из сплава алюминия и основного металла (например, никеля, кобальта, меди) раствором каустической соды. Различные металлические губки производятся также в промышленном масштабе, например, фирмами Gorwara Chemical Industries (Udaipur, India); Activated Metals & Chemicals, Inc. (Sevierville, TN); Degussa-Huls Corp. (Ridgefield Park, NJ); Engelhard Corp. (Iselin, NJ) и Aldrich Chemical Co, (Milwaukee, WI).
В соответствии с другими предпочтительными вариантами осуществления носитель включает в себя никелевую губку. Примеры пригодных, производимых в промышленном масштабе никелевых губок, например, включают RANEY 2800 (характеризуемая производителем, как имеющая, по меньшей мере, 89 мас.% никеля; не более чем 9,5 мас.% алюминия; не более чем 0,8 мас.% железа; средний размер частицы в интервале 20-60 мкм; удельный вес приблизительно - 7 и объемная плотность 1,8-2,0 кг/л (15-17 фунтов/галлон), в расчете на массу суспензии катализатора в воде с 56 мас.% сухого остатка), Реней(RANEY) 4200 (характеризуемая производителем, как имеющая, по меньшей мере, 93 мас.% никеля; не более чем 6,5 мас.% алюминия; не более чем 0,8 мас.% железа; средний размер частиц в интервале 20-50 мкм; удельный вес приблизительно - 7 и объемная плотность 1,8-2,0 кг/л (15-17 фунтов/галлон), в расчете на массу суспензии катализатора в воде с 56 мас.% сухого остатка), Реней 4310 (характеризуемая производителем, как имеющая, по меньшей мере, 90 мас.% никеля; не более чем 8 мас.% алюминия; 0,5-2,5 мас.% молибдена; не более чем 0,8 мас.% железа; средний размер частиц в интервале 20-50 мкм; удельный вес приблизительно - 7 и объемная плотность 1,8-2,0 кг/л (15-17 фунтов/галлон), в расчете на массу суспензии катализатора в воде с 56 мас.% сухого остатка), Реней 3110 (характеризуемая производителем, как имеющая, по меньшей мере, 90 мас.% никеля; 0,5-1,5 мас.% молибдена; не более чем 8,0 мас.% алюминия; не более чем 0,8 мас.% железа; средний размер частиц в диапазоне 25-65 мкм; удельный вес приблизительно - 7 и объемная плотность 1,8-2,0 кг/л (15-17 фунтов/галлон), в расчете на массу суспензии катализатора в воде с 56 мас.% сухого остатка), Реней 3201 (характеризуемая производителем, как имеющая, по меньшей мере, 92 мас.% никеля; не более чем 6 мас.% алюминия; не более чем 0,8 мас.% железа; 0,5-1,5 мас.% молибдена; средний размер частиц в интервале 25-65 мкм; удельный вес приблизительно - 7 и объемная плотность 1,8-2,0 кг/л (15-17 фунтов/галлон), в расчете на массу суспензии катализатора в воде с 56 мас.% сухого остатка), Реней 3300 (характеризуемая Патентом США № 5922921, как имеющая, 90-99,1 мас.% никеля; не более чем 8,0 мас.% алюминия; не более чем 0,8 мас.% железа; 0,5-1,5 мас.% молибдена; средний размер частиц в диапазоне 25-65 мкм; удельная масса приблизительно - 7 и объемная плотность 1,8-2,0 кг/л (15-17 фунтов/галлон), в расчете на массу суспензии катализатора в воде с 56 мас.% сухого остатка), Реней 2724 (Cr-активированная), все продаваемые компанией W,R, Grace & Co; катализатор, описанный как "никель Ренея", продаваемый компанией Gorwara Chemical Industries; А-4000 и А-5000, продаваемые компанией Activated Metals & Chemicals Inc,; никель марки АВМС, продаваемый компанией Degussa-Huls Corp, и "никель Ренея", каталог № 22, 167-8, продаваемый компанией Aldrich Chemical Co.
Примеры субстратов в виде неподвижного слоя, включающих в себя металлический носитель, включают гранулы губчатого никеля, описанные в Европейском патенте № EP 0648534 Al и патенте США № 6284703, раскрытие которых включено в данное описание посредством этой ссылки. Гранулы никелевой губки, особенно для использования в качестве неподвижного слоя катализаторов, производятся в промышленном масштабе, например, компанией W.R. Grace & Co, (Chattanooga, TN) и Degussa-Huls Corp. (Ridgefield Park, NJ),
2. Осаждение активной фазы, содержащей медь
Медьсодержащая активная фаза может быть осаждена на поверхность металлического носителя с использованием различных способов, хорошо известных в области техники осаждения металла на металлические поверхности. Эти способы включают, например, жидкофазные способы, такие как электрохимическое заместительное осаждение, нанесение покрытия методом химического восстановления; методы осаждения из газовой фазы, такие как физическое осаждение и химическое осаждение. Пригодные способы осаждения меди на поверхности металлического носителя описаны в совместно уступленном патенте США № 6376708 и совместно уступленной одновременно находящейся на рассмотрении заявке на патент США с порядковым № 09/832541 и опубликованной под номером US-2002-0019564-A1. Полные тексты включены в настоящее описание посредством этой ссылки.
Важно отметить, что медь, по меньшей мере, частично смешивается с большинством представляющих интерес металлов носителя и полностью смешивается с никелем. Так, было найдено, что процесс осаждения меди дает в результате катализатор, имеющий медь или более конкретно медьсодержащую активную фазу, на поверхности подложки в виде части дискретной фазы, такой как наружный слой или покрытие, на поверхности носителя в виде части поверхностного слоя, или медь может мигрировать из поверхности носителя в объем носителя. Не вдаваясь в подробную теорию, полагают, что поверхность катализатора может перемещаться, спекаться или по-другому изменять структуру в условиях реакции осаждения и процессов риформинга спирта, что приводит к таким изменениям вида медьсодержащей активной фазы. Тем не менее было обнаружено, что процесс осаждения меди приводит к общему повышению содержания меди в катализаторе, причем осажденная медь преимущественно присутствует на или вблизи поверхности свежеприготовленного катализатора, который богаче медью, чем перед осаждением.
а. Электрохимическое заместительное осаждение меди
Упомянутая выше медь может быть осаждена на поверхность металлического носителя посредством электрохимического заместительного осаждения, в котором ионы меди в растворе соли меди при контакте с носителем восстанавливаются до металлической меди, в то время как иные чем медь металлы вблизи поверхности подложки окисляются. Медный металл (металл, содержащий медь), в свою очередь, образует покрытие на поверхности подложки, в то время как безмедные ионы переходят в раствор. Основное обсуждение, относящееся к электрохимическому заместительному осаждению, можно найти, например, в работе Крулика (Krulik) и Mandich «Металлические покрытия» ("Metallic Coatings (Survey)"), Kirk-Othmer Encyclopedia of Chemical Technology, 4th Ed., том 16, стр. 258-91 (J.I. Kroschwitz and M. Howe-Grant, eds., Wiley, New York, NY, 1995). Более детальное обсуждение электрохимического заместительного осаждения меди на металлический губчатый носитель можно найти в принадлежащему тому же заявителю патенте США № 6376708, который включен в настоящее описание посредством этой ссылки.
В ос