Способ получения 1,1,3-тригидроперфторпропиловых эфиров эпсилон-аминокапроновой кислоты
Иллюстрации
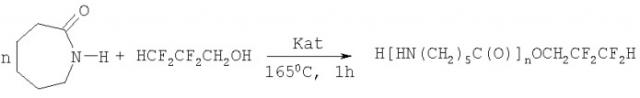
Показать всеИзобретение относится к химии органических соединений, а именно к способу получения 1,1,3-тригидроперфторпропиловых эфиров ε-аминокапроновой кислоты, которые могут быть использованы при введении в полимерные композиции и оказывать существенное влияние на улучшение физико-механических показателей получаемых материалов. Кроме того, в сочетании с фосфорорганическими компонентами они могут применяться для создания композиций с пониженной горючестью. Техническим результатом изобретения является упрощение процесса получения низкомолекулярных продуктов из ε-капролактама и ПФС1, а также получение эфиров ранее не описанных с числом мономерных звеньев, равных 1 и 2. Сущность состоит в способе получения 1,1,3-тригидроперфторпропиловых эфиров ε-аминокапроновой кислоты формулы HCF2CF2CH2O[C(O)(CH2)5NH]nH (n=1, 2), заключающемся во взаимодействии ε-капролактама и 1,1,3-тригидроперфторпропанола в присутствии катализатора, при этом в качестве катализатора используют диацетат-N-(1,3,2-диоксофосфоланил)-ε-капролактамат меди формулы
причем процесс проводят при мольном соотношении реагентов и катализатора, равном 1:(1-2):(0,05-0,1), при температуре 150-170°С в течение 0,5-1 ч с последующим разделением смеси этиловым спиртом. 1 табл.
Реферат
Изобретение относится к химии органических соединений, а именно к способу получения 1,1,3-тригидроперфторпропиловых эфиров ε-аминокапроновой кислоты, которые могут быть использованы при введении в полимерные композиции и оказывать существенное влияние на улучшение физико-механических показателей получаемых материалов. Кроме того, в сочетании с фосфорорганическими компонентами они могут применяться для создания композиций с пониженной горючестью.
Известны способы получения эфиров ε-аминокапроновой кислоты реакцией бутилового спирта и ε-капролактама в присутствии каталитических количеств цинковой пыли [Сторожакова Н.А., Ефанова Е.Ю., Рахимов А.И. Синтез бутилового эфира тримера ε-аминокапроновой кислоты и иминов на этой основе. // ЖОрХ. 2000. Т.36. Вып.12. С.1875-1876]. Смесь ε-капролактама и бутилового спирта в присутствии цинковой пыли (мольное соотношение 1:1:0,05) термостатируют при 250°С в течение 5 часов. Очистку н-бутилового эфира тримера ε-аминокапроновой кислоты проводят перекристаллизацией из уксусной кислоты. Степень превращения ε-капролактама 72%, выход олигомера в расчете на вступивший в реакцию ε-капролактам 80%. Т.пл. 185-188°С.
Недостатками этого способа являются большая продолжительность процесса, высокая температура. Данным способом получают продукт н-бутиловый эфир тримера ε-аминокапроновой кислоты, при этом низкомолекулярные продукты не были получены.
Известен способ получения н-бутилового эфира тримера ε-аминокапроновой кислоты бутанолизом ε-капролактама в присутствии оксида свинца [Хитрин С.В., Багаев С.И. Исследование взаимодействия ε-капролактама со спиртами // Известия ВУЗов. Серия Химия и химическая технология. 1997. Т.40. Вып.1. С.3-7]. Смесь ε-капролактама и бутилового спирта в присутствии оксида свинца (мольное соотношение 1:10:0,1) термостатируют при 240°С в течение 4 часов. Очистку проводят перекристаллизацией из метанола. Степень превращения ε-капролактама 18%. Максимальная конверсия ε-капролактама за 20 часов бутанолиза не превышает 44%. Т.пл. 182°С.
Недостатками этого способа в первую очередь являются большой избыток бутилового спирта, незначительная степень конверсии ε-капролактама при значительной продолжительности процесса и высокой температуре очень низкий выход н-бутилового эфира тримера ε-аминокапроновой кислоты.
Также известны способы получения эфиров ε-аминокапроновой кислоты реакцией 1,1,3-тригидроперфторпропилового спирта (ПФС1) и ε-капролактама в присутствии каталитических количеств N,N-диметилформамида (ДМФА) [Сторожакова Н.А., Ефанова Е.Ю., Рахимов А.И. Реакции полифторированных спиртов теломеров с ε-капролактамом. // ЖПХ. 2002. - Т.75. Вып.10. С.1749-1751]. Реакцию ε-капролактама с ПФС1 проводят при мольном соотношении ε-капролактам: ПФС1 как 1:1,2 в присутствии каталитических количеств (0,05 моля) ДМФА. Температура реакции 260°С, время реакции 5 часов. Очистку 1,1,3-тригидроперфторпропилового эфира тримера ε-аминокапроновой кислоты проводят перекристаллизацией из уксусной кислоты. Степень превращения ε-капролактама 64%, выход олигомера в расчете на вступивший в реакцию ε-капролактам 81%. Т.пл. 192°С.
Недостатками этого способа являются большая продолжительность процесса, высокая температура, небольшая степень превращения исходных реагентов, низкий выход тримера, загрязнение образующегося тримера продуктами побочной реакции дегидрофторирования, при этом опять же не были получены 1,1,3-тригидроперфторпропиловый эфир ε-аминокапроновой кислоты и 1,1,3-тригидроперфторпропиловый эфир димера ε-аминокапроновой кислоты.
Наиболее близким к предлагаемому изобретению по технической сущности и достигаемому результату является способ получения 1,1,3-тригидроперфторпропиловых эфиров ε-аминокапроновой кислоты реакцией ε-капролактама и ПФС1 (прототип) [Ефанова Е.Ю. Диссертация канд. хим. наук. Волгоград, 2002, 156 с. С.133, 139]. Процесс проводят ампульным методом при мольном соотношении ε-капролактам: ПФС1: ДДКМ как 1:1:0,05, температуре 260°С. Продолжительность реакции составляет 4 часа. Очистку полученного 1,1,3-тригидроперфторпропилового эфира тримера ε-аминокапроновой кислоты от продуктов разложения катализатора осуществляют перекристаллизацией из уксусной кислоты. Степень превращения 70%, выход олигомера в расчете на вступивший в реакцию ε-капролактам 50%. Т.пл. 178-187°С.
Недостатками этого способа являются жесткие условия - высокая температура и большая продолжительность процесса, а самым главным недостатком - невысокий выход 1,1,3-тригидроперфторпропилового эфира тримера ε-аминокапроновой кислоты; не были получены 1,1,3-тригидроперфторпропиловый эфир ε-аминокапроновой кислоты и 1,1,3-тригидроперфторпропиловый эфир димер ε-аминокапроновой кислоты.
Задача предлагаемого изобретения - разработка нового технологичного, более простого и экономичного способа получения 1,1,3-тригидроперфторпропиловых эфиров ε-аминокапроновой кислоты, которые представляют интерес в качестве матрицы для получения веществ с медико-биологической активностью [Сторожакова Н.А., Ефанова Е.Ю., Рахимов А.И. // ЖОрХ. 2000. - Т.36. Вып.12. С.1875-1876], а в случае введения атомов фтора в сложноэфирную группу, они могут также использоваться для получения материалов с пониженной горючестью, повышенной устойчивостью к действию агрессивных сред, органических растворителей и пониженным коэффициентом трения [Сторожакова Н.А. Модификация полифторированными спиртами-теломерами поли-ε-капроамида и его свойства. Автореф. канд. дис. Волгоград. 1998. - 16 с.].
Техническим результатом изобретения является упрощение процесса получения низкомолекулярных продуктов из ε-капролактама и ПФС1, а также получение эфиров, ранее не описанных, с числом мономерных звеньев, равных 1 и 2.
Технический результат достигается в способе получения 1,1,3-тригидроперфторпропиловых эфиров ε-аминокапроновой кислоты формулы HCF2CF2CH2О[C(О)(CH2)5NH]nH (n=1, 2), заключающийся во взаимодействии ε-капролактама и 1,1,3-тригидроперфторпропанола в присутствии катализатора, причем в качестве катализатора используют диацетат-N-(1,3,2-диоксофосфоланил)-ε-капролактамат меди формулы
при этом процесс проводят при мольном соотношении реагентов и катализатора, равном 1:(1-2):(0,05-0,1), при температуре 150-170°С в течение 0,5-1 ч с последующим разделением смеси этиловым спиртом.
Сущность предлагаемого метода состоит в том, что применяемый в качестве катализатора ДДФКМ обладает более высокой активностью, которая объясняется большей полярностью кислородсодержащего комплекса, образующегося с участием карбонильной группы лактама и кислорода пятичленного фосфоланового цикла. Использование ДДФКМ позволяет снизить температуру каталитической реакции с 260 до 150-170°С и селективно получать 1,1,3-тригидроперфторпропиловые эфиры ε-аминокапроновой кислоты с числом мономерных звеньев, равных 1 и 2.
Результаты кинетических исследований показали, что снижение температуры ниже 150°С ведет к увеличению продолжительности процесса олигомеризации, а увеличение температуры выше 170°С приводит к увеличению степени олигомеризации, что нецелесообразно.
Время протекания реакции оказывает влияние на продукт, в котором важно число мономерных звеньев; при увеличении времени олигомеризации выше 1 часа соответственно увеличивается молекулярная масса продукта, а уменьшение времени реакции меньше 0,5 часа сказывается на выходе продуктов.
Увеличение ε-капролактама в системе приводит также к увеличению степени олигомеризации, что влечет за собой образование более высокомолекулярных продуктов.
Снижение концентрации катализатора ниже 0,05 моль приводит к торможению реакции, т.е. идет процесс с очень незначительной скоростью, а увеличение катализатора свыше 0,1 моля приводит к незначительному увеличению выхода продуктов, что также нецелесообразно.
где n=1, 2
Технология способа состоит в следующем: реакцию проводят в ампулах при соотношении ε-капролактам: ПФС1: ДДФКМ как 1:(1-2):(0,05-0,1) мольных частей при температуре 150-170°С, продолжительность процесса 0,5-1 ч. Степень конверсии ε-капролактама составляет 61-94%. Выход мономера в смеси меняется от 81 до 51,2%, димера - от 19 до 48,8%. Степень конверсии определяли по не вступившему в реакцию ε-капролактаму и ПФС1, которые выделяли вакуум-перегонкой.
ДДФКМ получают следующим образом. К раствору 3,64 г (0,018 моль) 2-(2'-оксоазепанил)-1,3,2-диоксафосфолана, полученного по способу [Рахимов А.И., Е.А.Пугачева. Синтез и свойства фосфорсодержащих производных азепама // Advanced Science of Organic Chemistry: abstracts of International Symposium - Судак (Украина), 2006. - С.137], в 10 мл абсолютного хлороформа добавляют 1,64 г (0,009 моль) ацетата меди и перемешивают в течение 1 часа при 25°С. Реакционную смесь отфильтровывают. Растворитель упаривают. ДДФКМ экстрагируют водой из фильтрата. , ИК-спектр, ν см-1: 2927,7 (С-Н); 1707,6 (СО); 1624,5 (амид 1); 1335,1-1485,3 (δ СН2); 1197,7-1232,7 (C-N); 960,0-1120,1 (Р-О-С); 869,2 (О-Р-О); 748,8 (P-N). Структурная формула
Пример.
Синтез 1,1,3-тригидроперфторпропилового эфира аминокапроновой кислоты и 1,1,3-тригидроперфторпропилового эфира димера ε-аминокапроновой кислоты
В стеклянную ампулу объемом 8-10 см3 помещают 1,13 г (0,01 моль) ε-капролактама, 1,32 г (0,01 моль) ПФС1 и 0,0016 г (0,0005 моль) ДДФКМ. Ампулу запаивают и термостатируют при 170°С. Через 1 час ампулу извлекают из термостата и охлаждают при комнатной температуре. Реакционную смесь из ампулы переносят в химический стакан объемом 50 мл. К реакционной смеси прибавляют 10-15 мл хлороформа и тщательно перемешивают для отделения образовавшейся смеси продуктов от исходных веществ. Полученную смесь отфильтровывают, промывают последовательно 5 мл хлороформа и 10 мл диэтилового эфира, затем высушивают. Для разделения смеси используют этиловый спирт: мономер хорошо растворим в нем при температуре 20°С, димер хорошо растворим при температуре 70°С. Мономер выделяют переосаждением из спирта диэтиловым эфиром и производят очистку перекристаллизацией из воды. Очистку димера производят перекристаллизацией из спирта. Степень превращения ε-капролактама составляет 92%, выход мономера в смеси 56,8%, выход димера в смеси 43,2%.
Мономер представляет собой порошок светло-серого цвета. Т.пл. 126-129°С. ИК-спектр, ν, см-1: 1728 (νC=O), 1635 (амид I), 1537 (амид II). Вычислено, %: N 5,7; F 31. M 245. C9H15F4NO4. Найдено, %: N 6,1; F 30,8. M 252 (уксусная кислота).
Димер представляет собой порошок светло-серого цвета. Т.пл. 153-157°С. ИК-спектр, ν, см-1: 1724 (νC=O), 1636 (амид I), 1540 (амид II). Вычислено, %: N 7,82; F 21,2. M 358. С14Н26F4N2O3. Найдено, %: N 7,86; F 23. M 360 (уксусная кислота).
Для определения оптимальных условий реакции были проведены опыты с ПФС1, аналогичные примеру 1. Условия и результаты опытов приведены в таблице (пример 2-5).
| Определение оптимальных условий реакции получения 1,1,3-тригидроперфторпропиловых эфиров ε-аминокапроновой кислоты формулы HCF2CF2CH2О[C(O)(CH2)5NH]nH (n=1, 2) | ||||||||
| № п/п | Соотношение реагентов, моль | Время реакции, ч | Температура реакции, °С | Выход продукта в смеси, % | Степень конверсии, % | |||
| ε-Капролактам | ПФС1 | ДДФКМ | Мономер | Димер | ||||
| 1 | 2 | 1 | 4 | 5 | 6 | 7 | 8 | 9 |
| 1 | 1 | 1 | 0,05 | 1 | 170 | 56,8 | 43,2 | 92 |
| 2 | 1 | 1 | 0,05 | 1 | 150 | 65,2 | 34,8 | 74 |
| 3 | 1 | 1 | 0,05 | 0,5 | 170 | 71 | 29 | 83 |
| 4 | 1 | 1 | 0,1 | 1 | 170 | 51,2 | 48,8 | 94 |
| 5 | 1 | 2 | 0,05 | 1 | 170 | 81 | 19 | 61 |
Из таблицы видно, что при снижении температуры от 170 до 150°С снижается выход смеси продуктов (пример 2), что, очевидно, связано с высоким энергетическим барьером, а данная температура не позволяет его быстро преодолеть. Так же при увеличении ПФС1 в реакционной системе (пример 5) происходит уменьшение концентрации ε-капролактама в исходной смеси, что ведет к блокировке процесса олигомеризации, а начальная стадия образования мономера является и последней. Но это соотношение исходных реагентов выгодно тем, что позволяет селективно получать 1,1,3-тригидроперфторпропиловый эфир ε-аминокапроновой кислоты.
Таким образом, мы предлагаем способ получения 1,1,3-тригидроперфторпропиловых эфиров ε-аминокапроновой кислоты реакцией ПФС1 и ε-капролактама с использованием в качестве катализатора ДДФКМ при соотношении реагентов ε-капролактам:ПФС1:ДДФКМ, равном 1:(1-2):(0,05-0,1), при температуре реакции 150-170°С, где степень конверсии ε-капролактама составляет 61-94%.
Способ получения 1,1,3-тригидроперфторпропиловых эфиров ε-аминокапроновой кислоты формулы HCF2CF2CH2O[C(O)(CH2)5NH]nH (n=1, 2), заключающийся во взаимодействии ε-капролактама и 1,1,3-тригидроперфторпропанола в присутствии катализатора, отличающийся тем, что в качестве катализатора используют диацетат-N-(1,3,2-диоксофосфоланил)-ε-капролактамат меди формулы
причем процесс проводят при мольном соотношении реагентов и катализатора, равном 1:(1-2):(0,05-0,1), при температуре 150-170°С в течение 0,5-1 ч с последующим разделением смеси этиловым спиртом.