2-тиозамещенные производные имидазола и их применение в фармацевтике
Иллюстрации
Показать всеИзобретение относится к 2-тиозамещенному производному имидазола формулы I, где R1 представляет собой арил, который является замещенным атомом галогена или галоген-С1-С6-алкилом; R2 выбран из группы, включающей а) арил-С1-С4-алкил и b) C1-С6-алкил; R3 выбран из группы, включающей (a) NR4R10, (b) NR7COR10, (с) OR10, (d) NH2; R4 представляет собой H; R5 и R6, которые могут быть одинаковыми или различными, представляют собой H, галоген, ОН, С1-С6-алкокси, C1-С6-алкил или галоген-C1-С6-алкил; R7 представляет собой R4; R10 имеет одно из следующих значений: (а) А-В, (b)-(e), (f) C1-С6-алкил, который замещен 2 фенильными группами; А представляет собой линейный или разветвленный C1-С6-алкилен; В выбран из группы, включающей (а) H, (b)-(е), (f) OC1-С6-алкил, (g) ОН; Ну представляет собой 3-10-членный неароматический, моно-, би- или трициклический карбоцикл, который может быть или может не быть конденсирован с бензольным кольцом; Ar представляет собой 5- или 6-членный ароматический гетероцикл, который имеет 1 гетероатом, выбранный из группы, состоящей из О, S и N, и который может не быть конденсирован с бензольным кольцом; Het представляет собой 5- или 6-членный неароматический гетероцикл, который имеет 1 гетероатом, который представляет собой О, который может не быть конденсирован с бензольным кольцом; m равно 0, 1 или 2; или его оптические изомеры или физиологически приемлемые соли. Соединения формулы I применяют при получении фармацевтической композиции, обладающей ингибирующей активностью в отношении высвобождения цитокинов. Технический результат - 2-тиозамещенные производные имидазола, обладающие ингибирующим высвобождением цитокина действием. 3 н. и 10 з.п. ф-лы, 4 табл.
, , ,
Реферат
Настоящее изобретение относится к 2-тиозамещенным производным имидазола, обладающим иммуномодулирующим и ингибирующим высвобождение цитокина действием, к фармацевтическим композициям, включающим данные соединения и их применению в фармацевтике.
Фармакологически активные соединения имидазола с противовоспалительной активностью уже известны. Так, среди прочих, соединения, имеющие 4,5-ди(гетеро)арилимидазольные фрагменты, были исследованы более подробно и было описано их различное фармацевтическое действие. Также известны соединения, которые являются замещенными во 2-положении. В патенте США 4585771 описаны производные 4,5-дифенилимидазола, которые замещены во 2-положении пирролильным, индолильным, имидазолильным или тиазолильным радикалом и которые обладают противовоспалительной и противоаллергической активностью. В патентах США 4461770, 4528298 и 4584310 (ЕР 004648А) описаны производные 4-(5-арил)-5-(4-гетероарил)имидазола, которые замещены во 2-положении по тио-, сульфинильной или сульфонильной группе замещенным или незамещенным алифатическим углеводородом и которые, помимо прочего, обладают противовоспалительным действием. Соединения имидазола, обладающие иммуномодулирующим и ингибирующим высвобождение цитокина действием, описаны в WO 02/066458, WO 02/076951 и DE 10222103. Кроме того, в WO 96/03387, EP 005545 (US 4440776, 4355039, 4269847), EP 236628 (патент США 4686231), патенте Германии 3504678, патенте США 4190666, патенте США 4402960 и патенте США 4585771 описаны производные имидазола, обладающие противовоспалительным действием. В патентах ЕР 372445 (патент США 5318984; патент США 5166214) и патенте США 5364875 описаны соединения имидазола, обладающие антигиперхолестеринемической активностью.
Патент WO 00/17192 (патент Германии 19842833) относится к производным 4-гетероарил-5-фенилимидазола, которые замещены во 2-положении фенилалкилтио группой. Данные соединения действуют как противовоспалительные соединения и ингибиторы высвобождения цитокина. В WO 99/03837 и WO 93/14081 описаны 2-замещенные имидазолы, которые ингибируют синтез ряда воспалительных цитокинов. Соединения, описанные в WO 93/14081, имеют во 2-положении присоединенный через атом серы фосфорсодержащий заместитель или арильный, или гетероарильный заместитель. В WO 91/10662 и WO 91/13876 описаны производные имидазола, которые ингибируют трансферазу ацил-коэнзим А:холестерин О-ацил и связывание тромбоксана TxA2. В WO 95/00501 описаны производные имидазола, которые можно использовать в качестве ингибиторов циклооксигеназы.
В J.Med.Chem., 1996, 39, 3927-37, описаны соединения, обладающие 5-липоксигеназа- и циклооксгеназа-ингибирующим действием, 2-(4-метилсульфинилфенил)-4-(4-фторфенил-5-(пирид-4-ил)имидазол, также обладающий цитоксинингибирующим действием.
Кроме того, 2-тиозамещенные производные имидазола описаны в патенте Японии 01-040467, патенте России 1415725, Acta Chim., 1969, 61-77, J.Pract. Chem., 1972, 314, 785-792 и патенте Германии 10114775, Indian J.Chem., Sect.B, 1983, 22B(3), 268-269, Bioorganic & Medical Chem. Lett., Vol.5, No.2, 177-180, 1995, Phosphorus Sulfur 1988, 35(1-2), 83-88, Arch.Biochem.Biophys., Vol. 297, 258-164, 1992, J.Med.Chem. 1995, 38, 1067-1083, Helv.Chim.Acta 82, 1999, 290-296, Helv.Chim.Acta 81, 1998, 1585-1595.
Несмотря на то, что известны многочисленные соединения, все еще сохраняется необходимость в соединениях, обладающих противовоспалительным действием, которые ингибируют высвобождение цитокина.
Задачей настоящего изобретения является разработка таких соединений.
Неожиданно было установлено, что некоторые 2-замещенные производные имидазола обладают высокой иммуномодулирующей и/или ингибирующей высвобождение цитокина активностью.
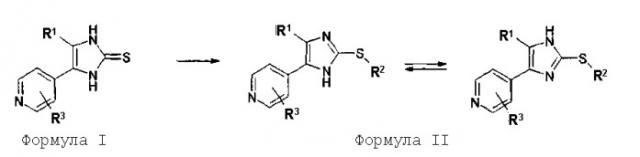
Соответственно, настоящее изобретение относится к 2-тиозамещенным производным имидазола формулы I
где
R1 представляет собой С1-С6-алкил, С3-С7-циклоалкил или арил, который является незамещенным или замещенным атомом галогена, С1-С6-алкилом или галоген-С1-С6-алкилом;
R2 выбран из группы, включающей
a) арил-С1-С4-алкил, где арильный радикал может иметь один, два или три заместителя, независимо друг от друга выбранных из группы, состоящей из С1-С6-алкила, С1-С6-алкокси, галогена, С1-С6-алкилсульфанила, С1-С6-алкилсульфинила, С1-С6-алкилсульфонила и гидроксила, и
b) С1-С6-алкил, который является незамещенным или замещенным CN или галогеном;
с)
d)
R3 выбран из группы, включающей
a) NR4R10;
b) NR7COR10;
c) NR7COOR10;
d) NR7CONR7R10;
e) NR7CONR7COR10;
f) OR10;
g) S(O)mR10;
h) галоген;
i) OH;
j) N3;
k) NH2;
l) SH;
где R3 не является ОН, галогеном, С1-С6-алкилтио или С1-С6-алкокси, если R2 представляет собой фенил-С1-С4-алкил, и фенильный радикал имеет С1-С6-алкилсульфанильный, С1-С6-алкилсульфинильный или С1-С6-алкилсульфонильный заместитель;
R4 представляет собой Н или физиологически отщепляемую группу,
R5 и R6, которые могут быть одинаковыми или различными, представляют собой Н, галоген, ОН, С1-С6-алкокси, С1-С6-алкил, галоген-С1-С6-алкил, С1-С6-алкилсульфанил, NH2, С1-С6-алкиламино или ди-С1-С6-алкиламино;
R7 представляет собой R4, С1-С6-алкил или бензил;
R10 имеет одно из следующих значений:
| a) | A-B |
| b) | |
| c) | |
| d) | |
| e) |
f) С1-С6-алкил, который замещен 2 или 3 фенильными группами;
g) трифторметил (в частности, если R3 представляет собой один из радикалов b)-f)).
А представляет собой линейный или разветвленный С1-С6-алкилен, С2-С6-алкенилен или С3-алкинилен;
В выбран из группы, включающей
| a) | Н |
| b) | |
| c) | |
| d) | |
| e) |
f) OC1-С6-алкил;
g) NR11R12;
h) OH;
i) галоген;
j) С1-С6-алкилсульфанил;
R11 и R12, которые могут быть одинаковыми или различными, представляют собой Н, С1-С6-алкил или фенил;
Hy представляет собой 3-10-членный неароматический, моно-, би- или трициклический карбоцикл, который может быть или может не быть конденсированным с бензольным кольцом;
Ar представляет собой 5- или 6-членный ароматический гетероцикл, который имеет 1, 2 или 3 гетероатома, независимо друг от друга выбранных из группы, состоящей из О, S и N, и который может быть или может не быть конденсирован с бензольным кольцом;
Het представляет собой 5- или 6-членный неароматический гетероцикл, который имеет 1, 2 или 3 гетероатома, независимо друг от друга выбранных из группы, состоящей из О, S и N, который может быть или может не быть конденсирован с бензольным кольцом, и который может быть или может не быть мостиковым бициклическим или трициклическим;
m равно 0,1 или 2;
n равно 1, 2, 3, 4 или 5
и их таутомерам, оптическим изомерам и физиологически приемлемым солям.
Если соединения согласно изобретению имеют центры асимметрии, в объем изобретения входят как рацематы, так и оптические изомеры (энантиомеры, диастереомеры). Для соединений согласно изобретению возможно существование следующего таутомерного равновесия:
Данное изобретение охватывает обе таутомерные формы.
Изобретение также охватывает физиологически приемлемые соли соединений формулы I. В настоящем случае они в частности представляют кислотно-аддитивные соли. Для получения кислотно-аддитивных солей используют неорганические кислоты, такие как хлористоводородная кислота, серная кислота или фосфорная кислота, или органические кислоты, такие как винная кислота, лимонная кислота, малеиновая кислота, фумаровая кислота, яблочная кислота, миндальная кислота, аскорбиновая кислота, глюконовая кислота и тому подобные.
Термин «алкил» (также в сочетании с другими группами, такими как фенилалкил, алкилсульфонил, алкокси и т.д.) охватывает линейные и разветвленные алкильные группы, имеющие от 1 до 6 или от 1 до 4 атомов углерода, такие как метил, этил, н- и изопропил, н-, изо- и трет-бутил, втор-бутил, н-пентил, изоамил, неопентил и н-гексил. Соответственно, это применяется к термину «С1-С6-алкилен».
Термин «карбоцикл» охватывает насыщенные или ненасыщенные неароматические моноциклические, бициклические и трициклические углеводороды. Углеводороды могут быть конденсированы с одним или двумя бензольными кольцами. Моноциклические углеводороды представляют собой С3-С6-циклоалкил, такие как циклопропил, циклопентил, циклогексил. Примерами би- и трициклических углеводородов и бензоконденсированных карбоциклов являются инданил, декалинил, тетралинил, флуоренил, дигидроантрацнил, дибензосуберенил, норборнил или адамантил. Примерами замещенных карбоциклов являются метилциклопропил или метилциклогексил. Предпочтение отдается незамещенным радикалам.
Термин «арил» охватывает ароматические кольцевые системы, такие как фенил или нафтил. Термин «галоген» означает атом фтора, хлора, брома или иода, в частности, атом фтора или атом хлора.
Термин «галоген-С1-С6-алкил» охватывает моно- и полигалогенированные линейные и разветвленные алкильные группы, имеющие от 1 до 6 и, в частности, от 1 до 4 атомов углерода. Предпочтительно присутствуют 1, 2, 3, 4 или 5 атомов галогена. Предпочтительными атомами галогена являются F и Cl. Примерами галоген-С1-С6-алкила являются -CH2Cl, -CH2CH2Cl, -CH2CCl3, -CF3, -CHF2, -CH2F, -CH2CF3 и CF2CF3. Предпочтительным является CF3.
Физиологически отщепляемая группа представляет собой группу, которая может отщепляться от остатка молекулы при физиологических условиях, ферментативно или химически. Примерами являются -COR14, -CO2R14, -CONH2, -CONHR14, -CHR16-OR14, -CHR16-O-COR14, -COC(R16)2-OH, -COR15, SO2R15 и -SO2R14, где R14 представляет собой С1-С6-алкил или CF3, R15 представляет собой фенил или толил (в частности п-толил), и R16 представляет собой Н или С1-С6-алкил.
Ароматический 5- или 6-членный гетероцикл в частности представляет собой незамещенный (R5, R6=H) или замещенный 2-пиридил, 3-пиридил, 4-пиридил, 2- или 3-тиенил, 2- или 3-фурил, тиазолил, имидазолил, оксазолил, изотиазолил, триазолил или пиримидил. Предпочтительными заместителями являются одна или две группы, независимо друг от друга выбранные из группы, включающей галоген, в частности Cl, и С1-С6-алкил. Заместитель(и) присоединены к атому углерода или атому азота ароматического радикала. Предпочтительными являются незамещенные радикалы. Примерами замещенных радикалов являются хлортиенил, в частности 5-хлорфур-2-ил, примерами конденсированных радикалов являются бензофуранил, бензотиазолил и бензотиофен.
Неароматический 5- или 6-членный гетероцикл может быть насыщенным или ненасыщенным. Предпочтительно это незамещенный или замещенный тетрагидрофуранил, тетрагидропиранил, пирролидинил, N-метилпирролидинил, N-этилпирролидинил, пиперазинил или морфолинил, где гетероцикл может быть присоединен через гетероатом азота или кольцевой атом углерода или может быть замещенным. Предпочтительными заместителями являются один или два радикала, независимо друг или друга выбранные из группы, включающей галоген, в частности Cl, и С1-С6-алкил. Предпочтение отдается незамещенным радикалам.
представляет собой замещенный или незамещенный циклопропил, циклобутил, циклогептил и, в частности, циклопентил и циклогексил. R5 и R6 предпочтительно, независимо друг от друга, представляют собой Н, галоген или С1-С6-алкил. Примерами замещенных циклоалкильных групп являются метилциклопропил или метилциклогексил. Предпочтение отдается незамещенным радикалам.
Фенил-С1-С4-алкил представляет собой, в частности, бензил, 1-фенилэтил или 2-фенилэтил.
R1 предпочтительно представляет собой фенильный радикал и, в частности, галоген-, CF3- или С1-С6-алкил-замещенный фенильный радикал, при этом особенно предпочтительным является фторзамещенный фенильный радикал. Заместитель предпочтительно находится в 3- и, в частности, в 4-положении. Примерами замещенных фенильных радикалов являются 4-фторфенил, 2,4-дифторфенил, 3-трифторметил, 3-толил или 3-хлорфенил.
R2 предпочтительно представляет собой бензильный, С3-С6-циклоалкильный, С4-С7-метилциклоалкильный или С1-С6-алкильный радикал, где фенильная группа в бензильном радикале может быть замещенной, как указано выше. Предпочтительными заместителями фенильной группы в бензильном радикале являются С1-С6-алкилсульфанил, С1-С6-алкилсульфинил и С1-С6-алкилсульфонил. Примерами R2 являются CH3, CH3CH2, (CH3)2CH, CH2CN, CH2CF3, CF3 и циклопропил.
R3 предпочтительно представляет собой радикал формулы
где R4, R5 и R6, а также А являются такими, как определено выше. R5 и R6 предпочтительно представляют собой Н, метил, метокси или хлор. Если фенильное кольцо в данной группе является замещенным, радикалы R5 и R6 предпочтительно расположены в 3- и/или 4-положении.
Кроме того, R3 предпочтительно представляет собой
а) NR4R10, где R10 представляет собой циклопропил, циклопропилметил, циклопентил, циклогексил или циклогептил;
b) NR4R10, где R10 представляет собой С1-С6-алкил, в частности, метил, этил или изопропил, или представляет собой 3,3-дифенилпропил или 1,3-дифенилпроп-2-ил;
с) NR4R10, где R10 представляет собой А-В, и В представляет собой ОН, С1-С6-алкокси, NR11R12 или фенил;
d) NR7COR10, где R10 представляет собой А-В, и В представляет собой фенил;
е) NR7COR10, где R10 представляет собой С1-С6-алкил.
А предпочтительно представляет собой С1-С6-алкилен и, в частности, этилиден.
Особенно предпочтительным вариантом осуществления являются соединения формулы I, в которой R1 представляет собой 4-фторфенил, R2 представляет собой С1-С6-алкил или бензил, где фенильная группа в бензильном радикале может быть замещенной, как указано выше; R3 представляет собой радикал формулы
где R4, R5 и R6, а также А являются такими, как определено выше, и m равно 0.
Следующим предпочтительным вариантом осуществления являются соединения формулы I, в которой R2 представляет собой С1-С6-алкил, в частности метил, и R1 представляет собой галогенфенил или галоген-С1-С6-алкилфенил, в частности, 4-фторфенил, 2,4-дифторфенил, 4-трифторметилфенил или 3-трифторметилфенил. Далее R3 предпочтительно представляет собой группы, определенные ниже:
а) галоген, в частности F или Cl;
b) OH или OC1-C6-алкил, в частности метокси и изопропокси,
с) фениламино;
d) фенил- или нафтил-C1-C6-амино, где фенильная группа может быть замещена 1 или 2 галогенами, в частности F или Cl, С1-С6-алкокси или С1-С6-алкилом. Аминогруппа дополнительно может быть замещена С1-С6-алкилом. Примерами таких радикалов являются бензиламино, 4-метоксибензиламино, 4-метилбензиламино, 4-хлорбензиламино, 3,4-дихлорбензиламино, 2-фенилэтиламино, 1-фенилэтиламино, 1-нафт-1-ил-амино, 1-нафт-2-иламино; 1-фенилпроп-3-иламино, 3-фенилпропиламино, -4-изобутилфенил)этиламино;
е)
,
где А представляет собой С1-С2-алкилен, R5 и R6 представляют собой Н, и
представляет собой тиенил, фурил, 2-, 3- или 4-пиридил, тиазолил, оксазолил, бензотиофенил или бензофуранил, где гетероциклические радикалы могут быть замещены галогеном, в частности F или Cl, или С1-С6-алкилом.
f)
,
где А, R5,R6 и
являются такими, как определено в пункте е).
g) NH-C1-C6-алкил, который замещен 2 или 3 фенильными группами, например, 3,3-дифенилпропиламино, 1,3-дифенилпроп-2-иламино;
h)
,
где А представляет собой С1-С2-алкилен, R5 и R6 представляют собой Н, и
представляет собой тетрагидрофуранил, тетрагидропиранил, пирролидин, N-метил или N-этилпирролидин;
i)
,
где R5,R6 и
являются такими, как определено в пункте h);
j) -NHCOOR10, где R10 представляет собой С3-С6-циклоалкил;
k) -NH-CO-NHR10, где R10 представляет собой С3-С6-циклоалкил;
l) NH-COR10, где R10 представляет собой С3-С6-циклоалкил-С1-С4-алкил, например, циклопентилметил, циклогексилметил;
m) NHCONHCOфенил;
n) -A-С3-С6-циклоалкил, где А представляет собой С1-С2-алкилен, например, циклопентилметиламино, циклогексилметиламино.
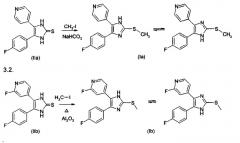
Соединения согласно изобретению могут быть получены соответствующим образом в соответствии со способами, описанными в данной области и указанными в начале данного описания, в частности, в WO 00/17192. Установлено, что особенно подходящим является способ получения в соответствии со следующим двухстадийным способом. На первой стадии сначала получают замещенный имидазол-2-тион формулы II. На второй стадии его подвергают взаимодействию таким образом, что получают 2-тиозамещенные производные имидазола формулы I с введением требуемого заместителя R2.
1) Получение имидазол-2-тиона
Имидазол-2-тионы, где R3=Н, галоген (Br, Cl, F), O-алкил или S-алкил, получают в соответствии со способами А или В. В качестве примера, способ А проиллюстрирован для соединений, в которых R1 представляет собой 4-фторфенил, и R3 представляет Н; способ В проиллюстрирован для соединений, в которых R1 представляет собой 4-фторфенил, и R3 представляет Cl, (25а), F (25b) или О-алкил (25с, 25d). Номера в скобках относятся к номерам примеров. 2-Тиозамещенные производные имидазола, где R3=NR4R10 получают не из соответствующих имидазол-2-тионов, где R3=NR4R10, а другим образом в соответствии со способом С. 2-Тиозамещенные производные имидазола, где R3=О-алкил или S-алкил, могут быть получены как в соответствии со способом С, так и в соответствии со способом В.
Способ А
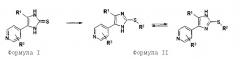
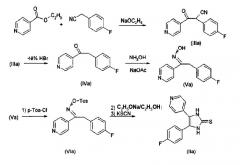
Синтез замещенных имидазол-2-тионов, где R3 представляет собой Н, проводят в соответствии с реакционным путем по схеме 1 с использованием изоникотината и 4-фторфениоацетонитрила в качестве исходных веществ.
Исходные вещества преобразуют в процессе реакции конденсации с помощью металлического натрия в спирте, например, этаноле, в 2-циано-2-(4-фторфенил)-1-(4-пиридил)этанон (IIIa). Цианогруппу затем удаляют гидролизом, например, с использованием бромистоводородной кислоты, и декарбоксилированием, получая 2-(4-фторфенил)-1-(4-пиридил)этанон (IVa). На следующей стадии IVa превращают обработкой смесью хлорида аммония/ацетата натрия в спиртовом растворителе, таком как метанол, в оксим (Va). Взаимодействием с п-толуолсульфонилхлоридом в пиридине последний преобразуют в тозилат (VIa). Из тозилата получают тионовое соединение (IIa) обработкой этоксидом натрия и взаимодействием образующегося промежуточного азирена с тиоцианатом калия.
Схема 1.
Синтез тионов согласно изобретению в соответствии со способом А
Способ В
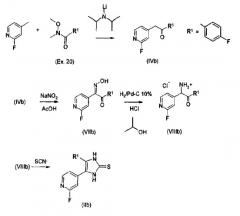
Получение соединений согласно изобретению, в которых пиридиновый радикал имеет галогеновый, О-алкильный или S-алкильный заместитель, проводят в соответствии со схемой 2 через соответствующие 2-галогенпиридилзамещенные имидазолтионы (способ В). Получение данных имидазолтионов проиллюстрировано с использованием в качестве примера 2-фторзамещенного пиридинового соединения (R3=2-F), где R1=п-фторфенил. Имидазолтионы, содержащие в положении 4 алкильный и циклоалкильный радикалы (R1 = С1-С4-алкил, С3-С7-циклоалкил), получают аналогичным образом, исходя из подходящим образом замещенных 2-фтор-γ-пиколин кетонов.
Схема 2.
γ-Пиколин (R3=Н) и галоген- (R3=F, Cl, Br, I), метокси- (R3=ОСН3) и метилтио- (24, R3=SCH3) замещенные γ-пиколины подвергают введению лития по γ-метильной группе в отсутствие влаги в растворителях, подходящих для этой цели, таких как углеводороды, простые эфиры и их смеси (например, гексан, тетрагидрофуран, этиленгликоль, диметиловый эфир) с использованием диизопропиламида лития (LDA), а затем конденсируют с подходящими производными карбоновых кислот (R1-COOR, R1-CONR2, R1-CN). Установлено, что в данном случае особенно подходящими являются амиды N,O-диметилгидроксиламина (R1-CONCH3(OCH3), 20). С использованием нитритов и оснований, например смеси амилнитрит/метоксид натрия, или с использованием нитрита щелочного металла и кислоты, образующиеся γ-пиколилкетоны (IVb) нитрозируют в γ-пиколильное положение. Установлено, что особенно удобным является взаимодействие γ-пиколилкетона, растворенного в ледяной уксусной кислоте, с водным раствором нитрита натрия. В процессе реакции нитрозокетоны полностью преобразуются в таутомерные оксимы кетонов (VIIb).
Оксимы кетонов восстанавливают в спиртовом растворе в присутствии водорода и минеральных кислот, например, HCl, с использованием палладия-на-угле, получая аммониевые соли аминокетонов (VIIIb) (23 b).
Альтернативно, другие оксимы кетонов могут быть восстановлены в спиртовом растворе в присутствии минеральных кислот, например, H2SO4, с использованием цинковой пыли, с получением соответствующих аммониевых кетонов (23f).
Данные аммониевые кетоны дают, после действия тиоцианатов щелочных металлов, например, тиоцианата калия, в сухом диметилформамиде (ДМФ) при кипении с обратным холодильником, имидазолтионы формулы IIb, где R3=F, Cl, Br, О-алкил или S-алкил, в виде желтых твердых веществ (24 b).
Получение соединений согласно изобретению, в которых пиридиновый радикал содержит или простой эфирный (R3=OR10), тиоэфирный (R3=SR10), или амино (R3=NR4R10) заместитель, осуществляют в соответствии со схемой 4 или схемой 5 через соответствующие 2-галогенпиридил-замещенные имидазолтионы (способ С, см. ниже).
2) Получение 2-тиоимидазольных соединений
Соединения 2-имидазолтиона формулы II, полученные в соответствии со способом А или В путем замещения атома серы во 2-положении, преобразуют в соединения формулы I согласно изобретению. Замещение, как иллюстративно показано для некоторых соединений на схеме 3, проводят обычным образом с использованием реакции нуклеофильного замещения. В данном случае соединение IIa или IIb подвергают взаимодействию с R2-X в инертном полярном растворителе, таком как спирт. Х представляет собой легко замещаемую группу, такую как Hal, в частности Cl, Br, I, метилсульфонил, тозил и т.д. Подходящие способы известны специалисту в данной области и описаны, например, в WO 00/17192, EP 0372445 и патенте США 4440776. Соединения R2-X являются известными или могут быть получены известными способами, как описано, например, в WO 00/17192.
Схема 3
3. Замещение серы алкилгалогенидами и арилгалогенидами или спиртовыми сульфонатами.
3.1.
Способ С
Соединения согласно изобретению, в которых R3 представляет собой амино заместитель (R3=NR4R10), получают из 2-тиоимидазолов с использованием 4(5)-(2-галогенпиридин-4-ил) замещения. Способ (способ С) проиллюстрирован на схеме 4 с использованием в качестве примера 2-бензиламино (R3=NH-CH2-Ph), где R1=п-фторфенил.
Исходные вещества (Ib) могут быть получены описанным выше способом.
Схема 4
4.1. 4-(2-Аминипиридин-4-ил)-замещенные 2-тиоимидазолы
4.2. 4-(2-Арилоксипиридин-4-ил)-замещенные 2-тиоимидазолы
4.3. 4-(2-Арилтиопиридин-4-ил)-замещенные 2-тиоимидазолы
4.4. 4-(2-Арилсульфонилпиридин-4-ил)-замещенные 2-тиоимидазолы
Целесообразно проводить реакцию в рассматриваемом амине, который предпочтительно используют в количестве от 5 до 20 мольных эквивалентов на мольный эквивалент соединения (Ib). Температура реакции обычно колеблется от 100 до 200°С. При желании, также возможно использование инертного растворителя, такого как диоксан, диметилформамид, диэтилацетамид, тетраэтилмочевина, метилпирролидон и т.д., и подходящих вспомогательных добавок, таких как карбонаты щелочных металлов или галогениды одновалентной меди (для нейтрализации высвобождающегося количества кислоты или для катализа элиминирования галогена).
Соединения согласно изобретению, в которых R3 представляет собой алкоксильный заместитель или алкилтио заместитель (R3=O-C1-C6-алкил, S-C1-C6-алкил), могут быть получены не только способом В (исходя из подходящим образом замещенных пиколинов), но и способом С, исходя из 4(5)-(2-галогенпиридин-4-ил)-замещенных 2-тиоимидазолов.
Способ D
Соединения согласно изобретению, в которых R3 представляет собой алкоксильный заместитель (R3=O-C1-C6-алкил), могут быть получены не только способом В или С, но также и способом D, исходя из 4(5)-(2-галогенпиридин-4-ил)-замещенных 2-тиоимидазолов. Способ проиллюстрирован на схеме 5 с использованием в качестве примера 2-изопропилоксипиридиновых соединений (R3=ОСН(СН3)2), где R1=п-фторфенил.
Исходные вещества (Ib) могут быть получены описанным выше способом.
Схема 5
4-(2-Алкоксипиридин-4-ил)-замещенные 2-тиоимидазолы
Целесообразно проводить реакцию в спирте, который предпочтительно используют в количестве от 5 до 20 мольных эквивалентов на мольный эквивалент соединения (Ib), в случае низших спиртов также вплоть до ста мольных эквивалентов, в присутствии сильной кислоты, такой как HCl или трифторуксусная кислота, метансульфоновая кислота и т.д. Температура реакции обычно находится в диапазоне температур кипения низших спиртов, в случае высших спиртов в диапазоне от 100 до 200°С. Было установлено, что выгодным является, например, насыщение спирта газообразным HCl или повторное насыщение в процессе реакции.
Альтернативно, замещение фтора на алкоксильную группу во 2-положении пиридильного заместителя может быть осуществлено на более ранней стадии синтеза, например, на стадии оксимов кетонов или аминокетонов. В таких случаях реакции протекают в условиях, сопоставимых с условиями, только что описанными для промежуточного соединения Ib (22c).
Способы Е, F и G
Соединения согласно изобретению, в которых R3 представляет собой амидный заместитель (R3=NR7COR10), во-первых, получают из 4(5)-(2-галогенпиридин-4-ил)-замещенных 2-тиоимидазолов. Способ (способ Е) проиллюстрирован на схеме 6.1 с использованием в качестве примера 2-бензоиламидо (R3=NHCOPh), R1=п-фторфенил. Во-вторых, после гидролиза амидов до аминозамещенных (R3=NR7Н, NHR10) 2-тиоимидазолов и их повторного ацилирования или преобразования в амиды, мочевины и уретаны, могут быть получены дополнительные амидные заместители (способ F). Это проиллюстрировано на схеме 6.2. В третьих, 2-аминопиридиновые соединения-предшественники могут быть получены из 4(5)-(2-галогенпиридин-4-ильных) соединений через 4(5)-(2-азидопиридин-4-ильные) соединения (способ G). В таком варианте галоген нуклеофильно замещают азидом щелочного металла и азидную группу преобразовывают в аминогруппу способами восстановления, см. схему 6.3.
Способ Н
Данный интересный вариант также открывает доступ к алкилированным аминам из альдегидных или кетонных соединений-предшественников. Если преобразование азидогруппы в аминогруппу проводить в условиях гидрирования с использованием катализатора гидрирования в присутствии данных альдегидов и кетонов, получают алкилированные амины, где R3=NH-CH2-B или NHCH(алкил)-В (способ Н, схема 6.4). Такой же результат получают, когда азид расщепляют фосфином с получением фосфимида, и данные имиды, полученные реакцией аза-Виттига с альдегидом (или кетоном), восстанавливают в амины с использованием комплексных гидридов (способ Н, схема 6.5).
Исходные вещества (Ib) могут быть получены описанным выше способом.
Схема 6
6.1. 4(2-Амидопиридин-4-ил)-замещенные 2-тиоимидазолы
Целесообразно проводить реакцию в рассматриваемом амиде, который, предпочтительно, используют в количестве от 5 до 20 мольных эквивалентов на мольный эквивалент соединения (Ib). Температура реакции обычно колеблется от 100 до 200°С. При желании, также возможно использование инертного растворителя, такого как диоксан, диметилформамид, диэтилацетамид, тетраэтилмочевина, метилпирролидон и т.д., и подходящих вспомогательных добавок, таких как карбонаты щелочных металлов или галогениды одновалентной меди (для нейтрализации высвобождающегося количества кислоты или для катализа элиминирования галогена).
2-Аминопиридиновые соединения могут быть получены из 2-амидоацилпиридинов путем гидролиза (6.2) или, кроме того, замещением на азид в 2-фторзамещенных соединениях и последующим восстановлением 2-азидопиридинов (6.3), например, гидрированием на палладие-на-угле в спиртовых растворителях.
Возможны дальнейшие преобразования полученных аминов (Ik, Id) посредством получения производных (способ F). При этом используются реакции аминов Id и Ik как с ангидридами кислот, так и с хлорангидридами кислот с получением дополнительных амидов, а также реакции с хлорформиатными сложными эфирами с получением уретанов, с изоцианатами с получением мочевин и с ацилизоцианатами с получением ацилмочевин. Образование данных производных проиллюстрировано на схеме 7.
Схема 7
Преобразование аминов (Ik, Id) в амиды, уретаны и мочевины
Соединения согласно изобретению демонстрируют иммуномодулирующую и ингибирующую высвобождение цитокина активность in vitro и in vivo. Цитокины представляют собой белки, такие как TNF-α и IL-β, которые играют важную роль в многочисленных воспалительных заболеваниях. В свете их ингибирующего высвобождение цитокина действия соединения согласно изобретению являются подходящими для лечения нарушений, которые связаны с расстройством иммунной системы. Они являются подходящими, например, для лечения аутоиммунных заболеваний, рака, ревматоидного артрита, подагры, септического шока, остеопороза, невропатической боли, распространения ВИЧ, слабоумия при ВИЧ, вирусного миокардита, инсулинзависимого диабета, перидонтальных нарушений, рестеноза, алопеции, уменьшения количества Т-клеток, связанного с ВИЧ-инфекцией или СПИДом, псориаза, острого панкреатита, реакций отторжения аллогенных трансплантатов, аллергической пневмонии, артериосклероза, рассеянного склероза, кахексии, болезни Альцгеймера, инсульта, приступов язвенного колита, болезни Крона, воспалительного заболевания кишечника (ВЗК), ишемии, застойной сердечной недостаточности, легочного фиброза, гепатита, глиобластомы, синдрома Гуйлайна-Барра, системной красной волчанки, респираторного дистресс-синдрома у взрослых (ARDS) и респираторного дистресс-синдрома.
Соединения согласно изобретению можно вводить или в качестве индивидуальных терапевтически активных соединений, или в виде смеси с другими терапевтически активными соединениями. Соединения можно вводить сами по себе; однако, обычно, их вводят в состав лекарственного средства и вводят в виде фармацевтических композиций, т.е. в виде смесей активных соединений с подходящими фармацевтическими носителями или разбавителями. Соединения или композиции можно вводить перорально или парентерально; предпочтительно их вводят в виде пероральных препаративных лекарственных форм.
Тип фармацевтической композиции или носителя, или разбавителя зависит от желаемой формы введения. Пероральные композиции, например, могут быть представлены в виде таблеток или капсул и могут включать в себя обычные эксципиенты, такие как связующие вещества (например, сироп, аравийская камедь, желатин, сорбит, трагакант или поливинилпирролидон), наполнители (например, лактоза, сахар, кукурузный крахмал, фосфат кальция, сорбит или глицерин), глиданты (например, стеарат магния, тальк, полиэтиленгликоль или диоксид кремния), разрыхляющие вещества (например, крахмал) или смачивающие агенты (например, лаурилсульфат натрия). Жидкие пероральные препараты могут иметь вид водных или масляных суспензий, растворов, эмульсий, сиропов, эликсиров или спреев и тому подобное. Они также могут представлять собой сухой порошок, влагосодержание которого восстанавливают с использованием воды или другого подходящего носителя. Такие жидкие препараты могут включать обычные добавки, например, суспендирующие агенты, вкусовые агенты, разбавители или эмульгаторы. Для парентерального введения возможно применение растворов или суспензий с обычными фармацевтическими носителями.
Соединения или композиции согласно изобретению можно вводить млекопитающим (человек или животное) в дозе от примерно 0,5 мг до 100 мг на кг массы тела в сутки. Их можно вводить в виде одной отдельной дозы или в виде множества доз. Спектр активности соединений в качестве ингибиторов высвобождения цитокинов был исследован с использованием приведенной ниже системы испытаний, как описано C.Donat и S.Laufer в Arch.Pharm.Pharm.Med.Chem., 333, suppl.1, 1-40, 2000.
Испытание in vivo с использованием цельной крови человека
Исследуемое вещество добавляли к образцам калий-EDTA цельной крови человека (по 400 мкл каждый) и образцы предварительно инкубировали в инкубаторе с CO2 (5% CO2; 95% насыщенный влагой воздух) при 37°С в течение 15 минут. Образцы затем стимулировали 1 мкг/мл LPS (E.coli 026:B6) при 37°С в инкубаторе с CO2 (5% CO2; 95% насыщенный влагой воздух) в течение 4 часов. Реакцию останавливали, помещая образцы на лед, добавляя DPBS буфер и затем центрифугируя при 1000 g в течение 15 минут. Затем с использованием ELISA определяли количество IL-1β и TNF-α в супернатанте плазмы.
Тест in vitro с использованием PBMCs
1) Моноядерные клетки (PBMCs) из калий-ЭДТА цельной крови человека, разведенной 1:3, выделяли градиентным по плотности центрифугированием (Histopaque®-1.077). Клетки промывали дважды буфером DPBS, повторно суспендировали в макрофаговой среде SFM и доводили до числа клеток 1×106 клеток/мл.
Полученную суспензию PBMCs (образец в каждом случае 390 мкл) и исследуемое вещество предварительно инкубировали при 37°С в инкубаторе с CO2 (5% CO2; 95% насыщенн