Популяция стволовых кроветворных клеток и ее применение
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и может быть использовано для получения популяции трансфицированных стволовых кроветворных клеток отрицательной линии дифференцировки, выделенных из костного мозга млекопитающего. Полученная популяция содержит эндотелиальные клетки-предшественники и нацелена на активированные астроциты сетчатки. Клетки популяции стволовых клеток трансфицированы ДНК, кодирующей антиангиогенный фрагмент Т2-фрагмента TrpRS триптофан-РНК-синтазы. В полученной популяции от 50% до 85% клеток популяции стволовых клеток экспрессируют CD31, от 70% до 75% клеток экспрессируют c-kit, от 4% до 8% клеток экспрессируют Sca-1 и от 2% до 4% клеток экспрессируют Flk-1/KDR. Изобретение позволяет эффективно лечить дегенеративные сосудистые заболевания глаз путем подавления ангиогенеза сетчатки в глазу пациента. 2 н.п. ф-лы, 14 ил., 3 табл.
Реферат
Ссылки на родственные патентные заявки
В соответствии с данной заявкой на патент испрашивается приоритет предварительной заявки на патент № 60/398522, поданной 25 июля 2002, и Предварительной Заявки на патент № 60/467051, поданной 2 мая 2003, каждая из которых включена в настоящее описание во всей своей полноте в качестве ссылки.
Заявление интересов правительства
Часть работы, изложенной в настоящем описании, была поддержана грантом № СА92577 National Cancer Institute и грантами № EY11254, EY12598 и EY125998 National Institutes of Health. Правительство Соединенных Штатов имеет определенные права на настоящее изобретение.
Область техники, к которой относится изобретение
Настоящее изобретение относится к выделенным стволовым кроветворным клеткам млекопитающих (СКК Lin-) без маркеров дифференцировки, выделенным из костного мозга. Изобретение также относится к лечению сосудистых заболеваний глаза путем введения СКК Lin-, и трансфицированной СКК Lin- в сетчатке.
Уровень техники
Возрастная дегенерация желтого пятна (ARMD) и диабетическая ретинопатия (DR) являются главными причинами потери зрения в индустриально развитых странах, что является результатом аномальной неоваскуляризации сетчатки. Хотя сетчатка состоит из хорошо определенных слоев нервных, глиальных и сосудистых элементов, относительно слабые нарушения, наблюдаемые в сосудах, такие как пролиферация или отек, могут приводить к значительному снижению зрительной функции. Врожденные дегенерации сетчатки, такие как пигментная дегенерация сетчатки (RP), также связаны с сосудистыми нарушениями, такими как сужение артерий и атрофия сосудов. Несмотря на то что в идентификации факторов, содействующих развитию ангиогенеза и подавляющих его, достигнут большой прогресс, в настоящее время отсутствует способ лечения, в частности, лечения сосудистых заболеваний глаз.
В течение многих лет было известно, что популяция стволовых клеток существует в кровотоке и костном мозге нормального взрослого. Различные субпопуляции таких стволовых клеток могут дифференцироваться на гемопоэтическую положительную линию дифференцировки (Lin+) или на негемопоэтическую линию без маркеров дифференцировки (Lin-). Кроме того, недавно было показано, что популяция стволовых кроветворных клеток без маркеров дифференцировки содержит эндотелиальные клетки-предшественники (EPC), способные к образованию кровеносных сосудов in vitro и in vivo. Asahara et al. Science 275, 964-7 (1997). Такие клетки могут участвовать в нормальном и патологическом постнатальном ангиогенезе (см. Lyden et al. Nat. Med. 7, 1194-201 (2001); Kalka et al. Proc Natl. Acad. Sci. U.S.A. 97, 3422-7 (2000); и Kocher et al. Nat. Med. 7, 430-6 (2001)), а также в дифференцировке в различные типы неэндотелиальных клеток, включая гепатоциты (см. Lagasse et al. Nat. Med. 6, 1229-34 (2000)), микроглию (см. Priller et al. Nat. Med. 7, 1356-61 (2002)), кардиомиоциты (см. Orlic et al. Proc. Natl. Acad. Sci. U.S.A. 98, 10344-9 (2001)) и эпителий (см. Lyden et al. Nat. Med. 7, 1194-201 (2001)). Несмотря на то, что такие клетки могут быть использованы в различных экспериментальных моделях ангиогенеза, механизм нацеливания EPC на новую сосудистую сеть неизвестен, и не установлена стратегия, которая бы эффективно увеличивала количество клеток, которые вносят вклад в конкретную сосудистую сеть.
Раскрытие изобретения
Настоящее изобретение относится к популяциям выделенных стволовых кроветворных клеток млекопитающих без маркеров дифференцировки (СКК Lin-), выделенных из костного мозга, которые содержат эндотелиальные клетки-предшественники (EPC, известные как эндотелиальные клетки-предшественники при дифференцировке), которые избирательно нацелены на активированные астроциты сетчатки. По меньшей мере, 50% клеток популяций выделенных СКК Lin- настоящего изобретения содержат клеточные маркеры CD31 и c-kit.
EPC в популяциях СКК без маркеров дифференцировки настоящего изобретения в значительной степени включены в развитие сосудов сетчатки и остаются устойчиво включенными в неоваскуляризацию глаза. Популяции выделенных СКК отрицательной линии дифференцировки настоящего изобретения могут быть использованы для восстановления и стабилизации дегенерирующей сосудистой сети сетчатки у млекопитающих. В одном из вариантов популяций выделенных СКК Lin- настоящего изобретения клетки трансфицируют терапевтически полезным геном. Трансфицированные клетки можно селективно нацеливать на новую сосудистую сеть и подавлять новое образование сосудов без воздействия на уже образованные сосуды при помощи клеточной генной терапии. Клетки из популяции выделенных СКК без маркеров дифференцировки настоящего изобретения, которые трансфицированы геном, кодирующим подавляющие ангиогенез белки, пригодны для модуляции аномального роста кровеносных сосудов при заболеваниях, таких как ARMD, DR и некоторых видов дегенерации сетчатки, связанных с аномальной сосудистой сетью.
Конкретным преимуществом методов лечения глаз при помощи популяции выделенных СКК Lin- настоящего изобретения является эффект сосудисто-трофического и нейротрофического восстановления, наблюдаемый в глазах, подвергнутых терапии при помощи введения СКК Lin- в стекловидное тело. В глазах, подвергнутых терапии выделенными СКК Lin- настоящего изобретения, сохранены нейроны сетчатки и фоторецепторы и сохранена зрительная функция.
Настоящее изобретение также относится к способу выделения популяций стволовых кроветворных клеток без маркеров дифференцировки, содержащих эндотелиальные клетки-предшественники из костного мозга, предпочтительно костного мозга взрослого.
Краткое описание чертежей
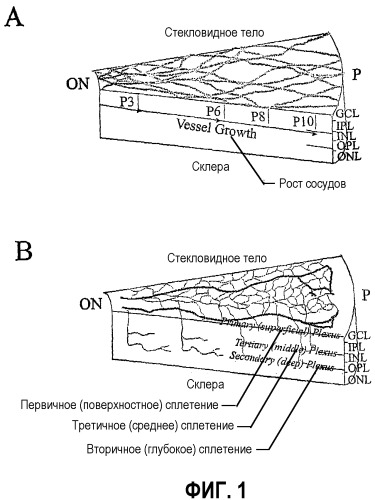
На фиг.1 (A и B) схематично изображены диаграммы развития сетчатки мыши. (А) Развитие первичного сплетения. (B) Вторая фаза образования сосудов сетчатки. СКК, слой ганглиозных клеток; IPL, внутренний плексиформный слой; INL, внутренний нуклеарный слой; OPL, наружный плексиформный слой, ONL, наружный нуклеарный слой, RPE, пигментный эпителий сетчатки; ON, зрительный нерв; P, периферия.
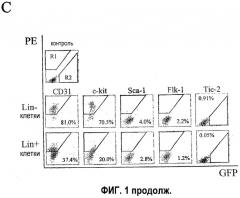
На фиг.1С показан процесс получения цитометрических характеристик выделенных СКК Lin+ и СКК Lin- клеток, выделенных из костного мозга. Верхний ряд: двумерная гистограмма не меченных антителом клеток, в которых R1 определяет количественно определенную область положительного PE-окрашивания; R2 обозначает положительные GFP; средний ряд: клетки СКК Lin- (С57В/6) и нижний ряд: клетки СКК Lin+ (С57В/6), причем каждая линия клеток помечена связанными с РЕ антителами к Sca-1, c-kit, Flk1/KDR, CD31. Данные Tie-2 получены от мышей Tie-2-GFP. Проценты обозначают процент клеток, меченных положительно, от общей популяции СКК Lin- и СКК Lin+.
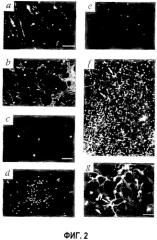
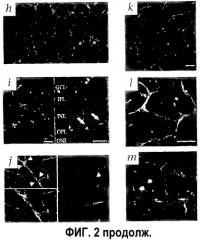
На фиг.2 изображено приживление трансплантированных клеток СКК Lin- в развивающейся сетчатке мыши. (а) Через четыре дня после инъекции (Р6) клетки СКК Lin- eGFP+, инъецированные в стекловидное тело, прикрепляются и дифференцируются на сетчатке. (b) СКК Lin- (В6.129S7-Gtrosa26 мышей, окрашенные β-gal антителом) размещаются перед сосудистой сетью, окрашенной антителом коллагена IV (звездочка показывает верх сосудистой сети). (с) Большинство из клеток СКК Lin+ (eGFP+) через четыре дня после инъекции (Р6) были неспособны к дифференцировке. (d) eGFP+ брыжейки мышиных EC на четвертый день после инъекции (Р6). (е) СКК Lin- (eGFP+), инъецированные в глаза взрослой мыши. (f) Небольшое увеличение СКК Lin- eGFP+ (стрелки), направляющихся и дифференцирующихся по ранее образованной матрице астроцитов в GFAP-GFP трансгенной мыши. (g) Более сильное увеличение связи между СКК Lin- (eGFP) и нижележащим астроцитом (стрелки). (h) Неинъецированный GFAP-GFP трансгенный контроль. (i) Четыре дня после инъекции (Р6), СКК Lin- eGFP+ клетки мигрировали и подвергались дифференцировке в области будущего глубокого сплетения. Левая фигура фиксирует активность СКК Lin- клеток во всей образованной сетчатке; правая фигура показывает расположение клеток Lin- (стрелки) в сетчатке (верх - сторона стекловидного тела, низ - сторона склеры). (j) Двойное мечение антителами α-CD31-PE и α-GFP-alexa 488. Через семь дней после инъекции инъецированные СКК Lin- (eGFP), красные) были включены в сосудистую сеть (CD31). Треугольные стрелки показывают области включения. (k) СКК Lin- eGFP+ клетки сосудов на четырнадцатый день после инъекции (Р17). (l и m) Инъекция в кровеносные сосуды родамина-декстрана показала, что сосуды были неповрежденными и функциональными как в первичном (l), так и в глубоком сплетении (m).
На фиг.3 (а и b) показано, что СКК Lin- eGFP+ клетки вернулись к глиозу (показанному при помощи GFAP экспрессии астроцитов, дальнее изображение слева), показанному как при помощи повреждения, индуцированного лазером (а), так и механически (b) индуцированным повреждением в сетчатке взрослого (звездочка указывает на участок повреждения). Дальние изображения справа представляют собой более высокое увеличение, показывающее тесную связь СКК Lin- и астроцитов. Шкала калибровки = 20 мкМ.
На фиг.4 показано, что СКК Lin- клетки восстановили сосудистую сеть дегенеративной сетчатки мыши. (a-d) Сетчатки на 27 день после инъекции (Р33), окрашенные коллагеном IV; (а) и (b) сетчатки, инъецированные СКК Lin+ клетками (Balb/c), не показали различий в сосудистой сети нормальных FVB мышей; (с) и (d) сетчатки, инъецированные СКК Lin- клетками (Balb/c), продемонстрировали богатые сосудами сети, аналогичные мышам дикого типа; (а) и (с) замороженные секции целой сетчатки (верх - сторона стекловидного тела, низ - сторона склеры), окрашенные DAPI; (b) и (d) глубокое сплетение сетчатки целиком; (е) гистограмма, иллюстрирующая увеличение в сосудистой сети глубокого сосудистого сплетения, сформированного в сетчатке, инъецированной СКК Lin- клетками (n=6). Протяженность глубокой васкуляризации сетчатки была количественно измерена путем вычисления общей длины сосудов на каждом изображении. Сравнивали среднее значение общая длина сосудов/максимальное увеличение области (в микронах) для СКК Lin-, СКК Lin+ или контрольных сетчаток. (f) Сравнение длины глубокого сосудистого сплетения после инъекции СКК Lin- (R, правый глаз) или СКК Lin+ (L, левый глаз) клеток от rd/rd мыши. Показаны результаты по шести независимо выбранным мышам (каждый цвет обозначает отдельную мышь). (g) и (h) СКК Lin- клетки также (Balb/c) восстановленной rd/rd сосудистой сети при проведении инъекции в глаза Р15. Показано промежуточное и глубокое сосудистое сплетение сетчаток, инъецированных клетками СКК Lin- (G) или СКК Lin+ (Н) (через один месяц после инъекции).
На фиг.5 показаны фотографии ткани сетчатки мышей: (а) глубокий слой сетчатки целиком (rd/rd мышь), пять дней после инъекции (Р11) СКК Lin- eGFP+ (зеленый). (b) и (с) Р60 сосудистая сеть сетчатки мышей Tie-2-GFP (rd/rd), которые получили инъекцию Balb/cLin- клеток (А) или СКК Lin+ клеток (В) на Р6. Сосудистая сеть окрашена антителами CD31 (красный), и только эндогенные эндотелиальные клетки имеют зеленый цвет. Стрелки указывают на сосуды, окрашенные CD31, но не GFP. (d) α-SMA окрашивание инъецированной СКК Lin- и контрольной сетчатки.
На фиг.6 показано, что СКК Lin-, трансфицированные T2-TrpRS, подавляли развитие сосудистой сети сетчатки мыши. (а) Схематичное представление человеческой TrpRS, T2-TrpRS и T2-TrpRS с Igk сигнальной последовательностью в конце аминокислотной цепи. (b) Сетчатки, инъецированные Lin- клетками, трансфицированными T2-TrpRS, экспрессируют T2-TrpRS белок in vivo. 1, рекомбинант T2-TrpRS, продуцируемый в E. coli; 2, рекомбинант T2-TrpRS, продуцируемый в E. coli; 3, рекомбинант T2-TrpRS, продуцируемый в E. coli; 4, контрольная сетчатка; 5, сетчатка, инъецированная СКК Lin- + pSecTag2A (только вектор); 6, сетчатка, инъецированная СКК Lin- + pKLe135 (Igk-T2-TrpRS в pSecTag). (а); эндогенная TrpRS b; рекомбинантная T2-TrpRS с; T2-TrpRS сетчатки, инъецированной СКК Lin-). (c-f) Непрезентативные первичное (поверхностное) и вторичное (глубокое) сплетения инъецированных сетчаток, семь дней после инъекции; (с) и (d), глаза, инъецированные СКК Lin-, трансфицированными пустой плазмидой, развивались нормально; (d) и (f), большинство глаз, инъецированных СКК Lin-, трансфицированными T2-TrpRS, продемонстрировало подавление глубокого сплетения; (с) и (е), первичное (поверхностное) сплетение; (d) и (f), вторичное (глубокое) сплетение). Слабый контур сосудов, наблюдаемый в F, представляет собой изображения с "просочившейся кровью" первичной сети сосудов, показанных на (е).
На фиг.7 показана последовательность ДНК, кодирующая T2-TrpRS, меченная His6, SEQ ID NO:1.
На фиг.8 показана аминокислотная последовательность T2-TrpRS, меченная His6, SEQ ID NO:2.
На фиг.9 представлены фотографии и электроретинограммы (ERG) сетчаток мышей, чьи глаза были инъецированы СКК Lin- настоящего изобретения и СКК Lin+ (контроль).
На фиг.10 изображены статистические графики, показывающие корреляцию между восстановлением нейронов (ось у) и восстановлением сосудов (ось x) как для промежуточного (Int.), так и для глубокого сосудистых слоев глаз rd/rd мышей, обработанных СКК Lin-.
На фиг.11 изображены статистические графики, показывающие корреляцию между восстановлением нейронов (ось у) и восстановлением сосудов (ось x) для глаз rd/rd мышей, обработанных СКК Lin+.
Фиг.12 является гистограммой длины сосудов (ось у) в произвольных относительных единицах для глаз rd/rd мышей, обработанных СКК Lin- (темные полосы), и необработанных (светлые полосы) глаз rd/rd мышей во временных графиках через 1 месяц (1М), 2 месяца (2М) и 6 месяцев (6М) после инъекции.
Фиг.13 включает в себя три гистограммы количества ядер во внешнем нейронном слое (ONR) rd/rd мышей через 1 месяц (1М), 2 месяца (2М) и 6 месяцев (6М) после инъекции и показывает значимое увеличение количества ядер для глаз, обработанных СКК Lin- (темные полосы), относительно контрольных глаз, обработанных СКК Lin+ (светлые полосы).
На фиг.14 изображены графики количества ядер во внешнем нейронном слое для отдельных rd/rd мышей, сравнивающие правый глаз (R, обработанный СКК Lin-) относительно левого глаза (L, контрольного глаза, обработанного СКК Lin+), на временных графиках (после инъекции) через 1 месяц (1М), 2 месяца (2М) и 6 месяцев (6М); каждая линия на данном графике дает сравнение глаз отдельной мыши.
Осуществление изобретения
Настоящее изобретение относится к популяции выделенных стволовых кроветворных клеток млекопитающих, лишенных маркеров дифференцировки, выделенной из костного мозга, содержащей эндотелиальные клетки-предшественники. Популяции выделенных СКК Lin- настоящего изобретения предпочтительно содержат СКК, в которых, по меньшей мере, примерно 50% клеток содержат антигены клеточных маркеров CD31 и c-kit. В предпочтительном варианте осуществления, по меньшей мере, примерно 75% клеток СКК содержат маркеры CD31, более предпочтительно примерно 81% клеток. В другом предпочтительном варианте осуществления, по меньшей мере, примерно 65% клеток содержат клеточные маркеры c-kit, более предпочтительно примерно 70% клеток.
В особенно предпочтительном варианте осуществления популяций выделенных СКК Lin- настоящего изобретения от примерно 50% до примерно 85% клеток содержат CD31 маркер, от примерно 70% до примерно 75% клеток содержат c-kit маркер, от примерно 4% до примерно 8% клеток содержат Sca-1 маркер, и от примерно 2% до примерно 4% клеток содержат Flk1/KDR маркер.
Популяции выделенных СКК Lin- настоящего изобретения также могут содержать до примерно 1% клеток, имеющих маркер антигена Tie-2.
В предпочтительных вариантах осуществления популяции выделенных СКК Lin- настоящего изобретения выделены из костного мозга мыши или человека, предпочтительно из костного мозга человека.
Популяции выделенных СКК Lin- настоящего изобретения избирательно нацелены и включаются в новую сосудистую сеть сетчатки при проведении инъекции в стекловидное тело глаза видов млекопитающих, у которых выделены клетки.
Популяции выделенных СКК Lin- настоящего изобретения содержат EPC клетки, которые дифференцируются в эндотелиальные клетки и генерируют структуры сосудистой сети в сетчатке. Более конкретно, композиции СКК Lin- настоящего изобретения пригодны для лечения неоваскуляризации сетчатки и дегенеративных заболеваний сосудов сетчатки и для восстановления поврежденных сосудов сетчатки.
Настоящее изобретение также относится к способу лечения глазных заболеваний у пациента, предусматривающему выделение из костного мозга пациента популяции стволовых кроветворных клеток без маркеров дифференцировки, которая содержит эндотелиальные клетки-предшественники, и проведение инъекции в стекловидное тело глаза пациента выделенных стволовых клеток в количестве, достаточном для остановки заболевания. Настоящее изобретение может быть использовано для лечения глазных заболеваний, таких как дегенеративные заболевания сетчатки, дегенеративные заболевания сосудов сетчатки, ишемические ретинопатии, сосудистые геморрагии, просачивание сосудов и хориоидопатии. Примеры таких заболеваний включают в себя возрастную мышечную дегенерацию (ARMD), диабетическую ретинопатию (DR), предполагаемый гистоплазмоз глаза (POHS), ретинопатию недоношенных (ROP), серповидно-клеточную анемию и пигментный ретинит, а также нарушения сетчатки.
Такое количество стволовых клеток, инъецированных в глаз, является эффективным для остановки болезненного состояния глаза пациента. Например, такое количество клеток может быть эффективным для репарации повреждения сетчатки глаза пациента, стабилизации новой сосудистой сети сетчатки, созревания новой сосудистой сети сетчатки и предупреждения или репарации просачивания сосудов и сосудистой геморрагии.
Клетки, находящиеся в популяции выделенных СКК Lin- настоящего изобретения, могут быть трансфицированы терапевтически применимыми генами, такими как гены, кодирующие антиангиогенные белки, для использования в клеточной генной терапии глаз.
Трансфицированные клетки могут включать в себя любые гены, которые являются терапевтически пригодными для лечения заболеваний сетчатки. Предпочтительно, трансфицированные клетки в популяциях СКК Lin- настоящего изобретения включают в себя гены, кодирующие антиангиогенный белок, белок или фрагмент белка, такой как TrpRS или их антиангиогенные фрагменты, такие как их Т1 и Т2 фрагменты, которые более подробно описаны в совместно заявленной и совместно рассматриваемой заявке на патент США № 10/080839, включенной в данное описание во всей своей полноте в качестве ссылки.
Настоящее изобретение также относится к способу выделения популяции стволовых кроветворных клеток без маркеров дифференцировки, содержащей эндотелиальные клетки-предшественники, из костного мозга. Способ определяет этапы, на которых (а) извлекают костный мозг у млекопитающего; (b) отделяют множество моноцитов от костного мозга; (с) моноциты метят панелью линии антител, связанных с биотином, к CD45, CD3, Ly-6G, CD11 и TER119; и (d) удаляют из множества моноцитов моноциты, которые являются положительными к CD45, CD3, Ly-6G, CD11 и TER-119, для обеспечения популяции стволовых кроветворных клеток без маркеров дифференцировки, содержащей эндотелиальные клетки-предшественники.
Настоящее изобретение также относится к способам лечения ангиогенных заболеваний глаз введением композиций трансфицированных СКК Lin- настоящего изобретения путем инъекции клеток в стекловидное тело глаза. Такие композиции трансфицированных СКК Lin- содержат СКК Lin-, трансфицированные терапевтически полезным геном, таким как ген, кодирующий антиангиограммный продукт гена.
Предпочтительно, по меньшей мере, примерно 1×105 СКК Lin- клеток или трансфицированных СКК Lin- клеток вводят путем инъекции в стекловидное тело глаза, подверженного дегенеративному заболеванию сетчатки. Количество клеток, которое должно быть инъецировано, может зависеть от тяжести дегенерации сетчатки, возраста пациента и других факторов, которые очевидны любому специалисту в области лечения заболеваний сетчатки. СКК Lin- могут быть введены одной дозой или путем введения большого числа доз за некоторый период времени, как определяет врач при назначении лечения.
Популяции СКК Lin- настоящего изобретения являются пригодными для лечения повреждения сетчатки и дефектов сетчатки, включая разрыв или деградацию сосудистой сети сетчатки.
Популяции трансфицированных СКК Lin- настоящего изобретения являются пригодными для доставки терапевтически полезных генов в сетчатку, более конкретно, в сосудистую сеть сетчатки.
В предпочтительном варианте осуществления способа доставки генов настоящего изобретения, клетки в популяциях СКК Lin- настоящего изобретения трансфицированы геном, кодирующим антиангиогенный белок, таким как антиангиогенный фрагмент триптофан-РНК-синтетазы (TrpRS). Более конкретно, предпочтительные фрагменты TrpRS включают в себя Т1 и Т2 фрагменты TrpRS. Трансфицированные клетки в композициях СКК Lin-, кодирующих антиангиогенный пептид настоящего изобретения, являются пригодными для лечения заболевания сетчатки, включающего в себя аномальное развитие сосудов, такое как диабетическая ретинопатия и подобные заболевания.
Способы
Пример 1. Выделение клеток и обогащение; приготовление СКК Lin- популяций А и В.
Общая методика. Все оценки in vivo выполнены согласно правилам NIH Guide for the Care and Use of Laboratory Animals, а оценочные процедуры были одобрены The Scripps Research Institute (TSRI, La Jolla, CA) Animal Care and Use Committee. Клетки костного мозга извлекали из B6.129S7-Gtrosa26, Tie-2GFP, ACTbEGFP, FVB/NJ (rd/rd мыши) или Balb/cDYJ взрослых мышей (The Jackson Laboratory, ME).
Затем отделяли моноциты путем разделения в градиенте плотности, используя HISTOPAQUE® градиент полисахарозы (Sigma, St. Louis, MO) и метили панелью линии антител, связанных с биотином, (CD45, CD3, Ly-6G, CD11, TER-119, Pharmingen, San Diego, CA) для отбора Lin-. Клетки (Lin+) положительной линии дифференцировки отделяли и удаляли из популяции СКК Lin-, используя устройство магнитного разделения (сортировщик AUTOMACS™, Miltenyi Biotech, Auburn, CA). Полученную в результате популяцию СКК Lin-, содержащую эндотелиальные клетки-предшественники, дополнительно характеризовали, используя калибровочный поточный цитометр FACS™ (Becton Dickinson, Franklin Lakes, NJ), используя следующие антитела: Sca-1, связанные с РЕ, c-kit, KDR и CD31 (Pharmingen, San Diego, CA). Клетки костного мозга Tie-2-GFP использовали для определения характеристик Tie-2.
Для получения эндотелиальных клеток взрослой мыши хирургическим путем извлекли брыжеечную ткань из ACTbEGFP мыши и помещали в коллагеназу (Worthington, Lakewood, NJ) для расщепления ткани с последующей фильтрацией, используя 45-микронный фильтр. Фильтрат собирали и инкубировали в среде для роста эндотелиальных клеток (Clonetics, San Diego, CA). Эндотелиальные характеристики подтверждали путем обнаружения морфологического галечного вида, окрашивания CD31 mAb (Pharmingen) и исследования культур на образование трубчатых структур в матриксе MATRIGEL™ (Beckton Dickinson, Franklin, Lakes, NJ).
Популяция А СКК Lin-. Клетки костного мозга извлекали из ACTbEGFP мышей при помощи общей методики, описанной выше. Клетки СКК Lin- характеризовали при помощи калибровочного поточного цитометра для антигенов-маркеров клеточной поверхности CD31, c-kit, Sca-1, Flk-1 и Tie-2. Результаты показаны на фиг.1с. Примерно 81% СКК Lin- показали CD31 маркер, примерно 70,5% СКК Lin- показали c-kit маркер, примерно 4% СКК Lin- показали Sca-1 маркер, примерно 2,2% СКК Lin- показали Flk-1 маркер и примерно 0,91% СКК Lin- показали Tie-2 маркер. Напротив, СКК Lin+, которые выделяли из этих клеток костного мозга, значимо отличались профилем меченых клеток (т.е. CD31: 37,4%; c-kit: 20%; Sca-1: 2,8%; Flk-1: 0,05%).
Популяция В СКК Lin-. Клетки костного мозга извлекали из BalbC, ACTbEGFP и C3H мышей при помощи общей методики, описанной выше. Клетки СКК Lin- анализировали на наличие маркеров клеточной поверхности (Sca1, KDR, cKit, CD34, CD31 и различные интегрины: α1, α2, α3, α4, α5, α6, αМ, αV, αX, αIIb, β1, β2, β3, β4, β5 и β7). Результаты представлены в таблице 1.
| Таблица 1Характеристики популяции В СКК Lin- | |
| Клеточные маркеры | СКК Lin- |
| α1 | 0,10 |
| α2 | 17,57 |
| α3 | 0,22 |
| α4 | 89,39 |
| α5 | 82,47 |
| α6 | 77,70 |
| αL | 62,69 |
| αM | 35,84 |
| αX | 3,98 |
| αV | 33,64 |
| αIIb | 0,25 |
| β1 | 86,26 |
| β2 | 49,07 |
| β3 | 45,70 |
| β4 | 0,68 |
| β5 | 9,44 |
| β7 | 11,25 |
| CD31 | 51,76 |
| CD34 | 55,83 |
| Flk-1/KDR | 2,95 |
| c-kit | 74,42 |
| Sca-1 | 7,54 |
Пример 2. Введение клеток в стекловидное тело.
Делали надрез века тонким лезвием для вскрытия глазного яблока с Р2 по Р6. Затем инъецировали в стекловидное тело популяцию А СКК без маркеров дифференцировки настоящего изобретения (приблизительно 105 клеток в примерно от 0,5 мкл до примерно 1 мкл среды для клеточной культуры), используя игольчатый шприц N33 (Hamilton, Reno, NV).
Пример 3. Трансфекция EPC.
СКК Lin- (популяцию А) трансфицировали ДНК, кодирующей Т2 фрагмент TrpRS, также содержащей tag His6 (SEQ ID NO:1, фиг.7), используя реагент трансфекции FuGENE™ (Roche, Indianapolis, IN) согласно протоколу производителя. Клетки из композиции СКК Lin- (примерно 106 клеток на мл) суспендировали в среде opti-MEM® (Invitrogen, Carlsbad, CA), содержащей фактор стволовых клеток (Pepro Tech, Rocky Hill, NJ). Затем добавляли смесь ДНК (примерно 1 мкг) и реагент FuGENE (примерно 3 мкл), и смесь инкубировали при 37°С в течение примерно 18 часов. После инкубации клетки промывали и собирали. Соотношение трансфекции этой системы составило приблизительно 17%, что подтверждали FACS анализом. Продукцию Т2 подтверждали вестерн-блоттингом. Аминокислотная последовательность Т2-TrpRS, меченного His6, показана как SEQ ID NO:2, фиг.8.
Пример 4. Иммуногистохимия и конфокальный анализ.
Сетчатки собирали в различных временных точках и готовили либо для приготовления препарата целиком, либо для приготовления замороженных срезов. Для целых препаратов сетчатки фиксировали 4% параформальдегидом и блокировали 50% фетальной телячьей сывороткой (FBS) и 20% нормальной козьей сывороткой в течение 1 часа при комнатной температуре окружающей среды. Сетчатки обрабатывали для первичных антител и обнаруживали вторичными антителами. Используемыми первичными антителами были: антитела против коллагена IV (Chemicon, Temecula, CA), β-gal (Promega, Madison, WI), GFAP (Dako Cytomation, Carpenteria, CA), α-актина гладкой мускулатуры (α-SMA, Dako Cytomation). Используемые вторичные антитела были связаны либо с Alexa 488, либо с флуоресцентными маркерами 594 (Molecular Probes, Eugene, OR). Изображения получали, используя конфокальный микроскоп MRC 1024 (Bio-Rad, Hercules, CA). Трехмерные изображения получали, используя программное обеспечение LASERSHARP® (Bio-Rad) для исследования трех различных слоев развития сосудов во всей сетчатке препарата. Различия в интенсивности точек GFP между усиленным GFP (eGFP) мышей и GFAP/wtGFP мышей, различаемых при помощи конфокальной микроскопии, использовали для создания трехмерных изображений.
Пример 5. Количественный анализ ангиогенеза сетчатки in vivo.
Для анализа T2-TrpRS первичное и глубокое сплетения реконструировали из трехмерных изображений. Первичное сплетение подразделяли на две категории: нормальное развитие, или задержанное развитие сосудов. Категории подавления развития глубоких сосудов интерпретировали на основании процента подавления сосудов, включая следующие критерии: полное подавление образования глубокого сплетения относили к категории "полное", нормальное развитие сосудов (включающее в себя подавление меньше 25%) относили к категории "нормальное" и остаток относили к категории "частичное". Для восстановленных данных rd/rd мыши фиксировали четыре отдельные области глубокого сплетения в каждой, целиком препарированной сетчатке, используя 10× линзу. Для каждого изображения вычисляли общую длину сосудистой сети, суммировали и сравнивали между группами. Для получения точной информации СКК Lin- инъецировали в один глаз, а СКК Lin+ - в другой глаз одной и той же мыши. Неинъецированные контрольные сетчатки были взяты от того же самого помета.
Пример 6. Модели повреждения взрослой сетчатки
Создавали лазерные и рубцовые модели, либо используя диодный лазер (150 мВт, 1 секунда, 50 мм), либо механически путем прокалывания сетчатки иглой N27. Через пять дней после повреждения инъецировали клетки, используя способ введения в стекловидное тело. Глаза собирали спустя пять дней.
Пример 7. Нейротрофическое восстановление регенерации сетчатки
Стволовые кроветворные клетки без маркеров дифференцировки (СКК Lin-), выделенные из взрослого костного мозга, имели сосудисто-трофический и нейротрофический эффект в мышиной модели дегенерации сетчатки. В стекловидное тело правого глаза 10-дневной мыши инъецировали примерно 0,5 микролитров, содержащих примерно 105 СКК Lin- настоящего изобретения, и спустя 2 месяца оценивали наличие сосудистой сети в сетчатке и число ядер нейронного слоя. Левый глаз той же самой мыши инъецировали примерно таким же количеством СКК Lin+ в качестве контроля и проводили такую же оценку. Как показано на фиг.9, в глазу, обработанном СКК Lin-, сосудистая сеть сетчатки выглядит почти нормально, внутренний нуклеарный слой был почти нормальным, а внешний нуклеарный слой (ONL) имел от примерно 3 до примерно 4 слоев ядер. Напротив, контралатеральный глаз, обработанный СКК Lin+, имел явно атрофический средний сосудистый слой сетчатки, полностью атрофический внешний сосудистый слой сетчатки; внутренний нуклеарный слой был явно атрофическим, а внешний нуклеарный слой был полностью отсутствующим. Это было убедительно проиллюстрировано на 3 мыши и 5 мыши. У 1 мыши эффект восстановления отсутствовал, и это имело место для приблизительно 15% инъецированных мышей.
При исследовании зрительной функции при помощи электроретинограмм (ERG), наблюдали восстановление положительных ERG, когда наблюдали как сосудистое, так и нейронное восстановление (мыши 3 и 5). При отсутствии сосудистого и нейронного восстановления положительных ERG не наблюдали (мышь 1). Такая корреляция между сосудистым и нейронным восстановлением глаза rd/rd мыши при помощи СКК Lin- настоящего изобретения продемонстрирована при помощи графика регрессионного анализа, показанного на фиг.10. Связь между нейронным (ось y) и сосудистым (ось x) восстановлением наблюдали для промежуточного типа сосудистой сети (r=0,45) и для глубокой сосудистой сети (r=0,67).
На фиг.11 показано отсутствие какой-либо статистически значимой корреляции между нейронным и сосудистым восстановлением при помощи СКК Lin-. Сосудистое восстановление количественно измеряли, и данные представлены на фиг.12. Данные для мышей через 1 месяц (1М), 2 месяца (2М) и 6 месяцев (6М) после инъекции, представленные на фиг.12, показывают, что длина сосудов значительно увеличена в глазах, обработанных СКК Lin- настоящего изобретения (темные полосы), относительно длины сосудов в необработанных глазах тех же самых мышей (светлые полосы), в частности, через 1 месяц и 2 месяца после инъекции. Эффект нейротрофического восстановления количественно измеряли путем подсчета ядер во внутреннем и внешнем нуклеарных слоях через два месяца после инъекции СКК Lin- или СКК Lin+. Результаты представлены на фиг.13 и фиг.14.
Результаты
Развитие сосудов сетчатки мыши; модель ангиогенеза глаза.
Мышиный глаз обеспечивает общепризнанную модель для изучения развития сосудов сетчатки у млекопитающих, такую как развитие сосудов у человека. Во время развития сосудистой сети сетчатки мыши кровеносные сосуды сетчатки, запускаемые ишемией, развиваются в тесной связи с астроцитами. В третьем триместре развития плода человека, или у новорожденного грызуна, такие глиальные элементы мигрируют в сетчатку с оптического диска на слой ганглиозных клеток и распространяются радиально. Поскольку сосудистая сеть сетчатки мыши развивается, эндотелиальные клетки используют эти уже созданные матрицы астроцитов для определения сосудистой структуры сетчатки (см. фиг.1 а и b). На фиг.1 (а и b) показаны схематичные диаграммы развивающейся сетчатки мыши. На фиг.1а показано развитие первичного сплетения (темные полоски вверху слева на диаграмме), наложенные на матрицы астроцитов (светлые линии), тогда как на фиг.1b изображена вторая фаза образования сосудов сетчатки. На фигурах GCL означает слой ганглиозых клеток; IPL означает внутренний плексиформный слой; INL означает внутренний нуклеарный слой; OPL означает наружный плексиформный слой, ONL означает наружный нуклеарный слой, RPE означает пигментный эпителий сетчатки; ON означает зрительный нерв; P означает периферию.
При рождении сосудистая сеть сетчатки фактически отсутствует. На 14 постнатальный день (Р14) сетчатка имеет развитый сложный первичный (поверхностный) и вторичный (глубокий) слои сосудов сетчатки одновременно с появлением зрения. Сначала, спицеобразные перипапиллярные сосуды растут радиально на сети ранее существовавших астроцитов в направлении к периферии, постепенно становясь связанными путем образования капиллярного сплетения. Такие сосуды растут как монослой внутри нервного волокна в течение Р10 (фиг.1а). Между Р7-Р8 коллатеральные ветки начинают выпускать отростки из этого первичного сплетения и проникать внутрь сетчатки во внешний плексиформный слой, где они формируют вторичное, или глубокое, сплетение сетчатки. К Р21 вся сеть подвергается экстенсивной реконструкции, и на внутренней поверхности внутреннего нуклеарного слоя образуется третичное, или промежуточное, сплетение (фиг.1b).
Модель ангиогенеза сетчатки новорожденной мыши полезна для изучения роли СКК во время ангиогенеза глаза по нескольким причинам. В такой физиологически релевантной модели матрица крупных астроцитов существует до появления эндогенных кровеносных сосудов, что позволяет оценить роль нацеливания клетка-клетка во время процесса неоваскуляризации. Дополнительно, такой совместимый и воспроизводимый процесс васкуляризации сетчатки новорожденного известен как запускаемый гипоксией, в этом отношении имеющий сходство со многими заболеваниями сетчатки, в которых, как известно, играет роль ишемия.
Обогащение эндотелиальных клеток-предшественников (EPC) из костного мозга
Хотя экспрессия маркеров клеточной поверхности оценена в значительной степени на популяции EPC, найденных в препаратах СКК, маркеры, которые однозначно идентифицируют EPC, все еще недостаточно определены. Для обогащения EPC клетки, положительные к маркерам гемопоэтической линии дифференцировки (Lin+), т.е. В-лимфоциты (СD45), Т-лимфоциты (CD3), гранулоциты (Ly-6G), моноциты (CD11) и эритроциты (TER-119), были очищены из мононуклеарных клеток костного мозга. Для дальнейшего обогащения EPC использовали антиген Sca-1. Сравнение результатов, полученных после инъекции в стекловидное тело одинакового количества либо Lin-Sca-1+ клеток, либо Lin- клеток, не показало различий между двумя группами. Фактически, если были инъецированы только Lin-Sca-1+ клетки, наблюдали более сильное включение в развитие кровеносных сосудов.
СКК Lin- настоящего изобретения обогащали EPC, основываясь на функциональном анализе. Более того, популяции СКК Lin+ функционально вели себя совершенно по-другому, чем популяции СКК Lin-. Также оценивали эпитопы, обычно используемые для идентификации EPC, для каждой фракции (основываясь на ранее описанных исследованиях определения характеристик in vitro). Поскольку ни один из этих маркеров не связан только с Lin- фракцией, все в СКК Lin- увеличилось от примерно 70 до примерно 1800% по сравнению с СКК Lin+ фракцией (фиг.1с). На фиг.1с показано получение потоковых цитометрических характеристик клеток, разделенных СКК Lin- и СКК Lin+, выделенных из костного мозга. В верхнем ряду фиг.1с показана двумерная гистограмма стволовых кроветворных клеток, не меченных антителами клеток. R1 обозначает количественно определяемую область положительного PE-окрашивания; R2 обозначает положительные GFP. Двумерные гистограммы СКК Lin- показаны в среднем ряду, а двумерные гистограммы СКК Lin+