Способ переработки сульфидного минерального сырья и концентратов
Иллюстрации
Показать всеИзобретение относится к гидрометаллургической технологии и служит для извлечения цветных, редких и благородных металлов из сульфидного минерального сырья и концентратов. Техническим результатом изобретения является создание условий наиболее полного извлечения металлов с исключением образования элементарной серы. Способ включает окисление исходного сырья в виде пульпы с использованием окисляющих агентов, содержащих окислы азота, и регенерацию низших окислов азота до высших окислением. При этом пульпу подвергают окислению в условиях контроля кислотности пульпы с постоянной нейтрализацией образующейся в результате окисления сульфидов серной кислоты до уровня кислотности, при котором не происходит образование элементарной серы, при использовании в качестве нейтрализаторов природных или искусственных веществ, выбранных из СаСО3, MgCO3, Са(ОН)2, CaO, NaOH, CaHPO4 в зависимости от необходимости образования продуктов с заданными физико-химическими свойствами: фильтруемостью, сгущаемостью, нерастворимостью мышьяка, нетоксичностью. Окисление производят при перемешивании, обеспечивающем достаточный массообмен и эффективное протекание химических реакций в температурном диапазоне 20-90°С, преимущественно в интервале 65-85°С. 8 з.п. ф-лы, 3 ил.
Реферат
Способ относится к гидрометаллургической технологии и служит для извлечения цветных, редких и благородных металлов из сульфидного минерального сырья и концентратов.
Практика переработки сульфидных руд основана на том, что значительные количества цветных, редких и благородных металлов входят в структуру сульфидных минералов и без окисления сульфидов не могут быть извлечены. Богатые руды подвергают окислению напрямую, из бедных обычно выделяют гравио- и флотоконцентраты, в которые переходит основное количество сульфидных минералов.
Известные способы окисления сульфидных руд и концентратов, такие как обжиг, окисление в автоклавах под давлением, окисление азотной кислотой, бактериальное окисление и другие, имеют серьезные недостатки, препятствующие их дальнейшему распространению в современной промышленной практике.
Наиболее близким к предлагаемому изобретению является известный способ гидрометаллургического извлечения металлов из руд, которая описана в заявке РСТ №94/17216, МПК: С22В 3/44, 3/06, 3/08, 3/00, 15/00, дата публикации 4.08.1994, и заключается в окислении сульфидных минералов азотной кислотой. При окислении сульфидных минералов концентрированной азотной кислотой наблюдается эффект термического разложения азотной кислоты, катализируемый катионами переходных металлов, переходящими в раствор из концентрата. Это приводит к необходимости расходования 3-6 весовых количеств кислоты от теоретически необходимого, что делает окисление экономически непригодным. Кроме этого в растворе после окисления концентратов азотной кислотой содержится очень большое количество нитратов, что является препятствием для их безопасного сброса в окружающую среду.
Известны технологии, снижающие расход азотной кислоты для окисления концентратов за счет подачи в реактор окисления чистого кислорода для регенерации окислов азота в азотную кислоту непосредственно в реакторе. Одна из таких технологий описана в заявке РСТ №97/11202, МПК: С22В 3/06, 11/00, дата публикации: 27.03.97. Однако эти технологии вследствие термодинамических причин приводят к окислению части сульфидной серы до элементарной, которая экранирует поверхность золота и других благородных металлов и снижает их дальнейшее извлечение.
Общим признаком прототипа и заявляемого технического решения является наличие этапа окисления сульфидного минерального сырья азотной кислотой. Под действием азотной кислоты металл переходит в раствор, что облегчает его извлечение.
Заявляемое техническое решение описывает технологию, которая позволяет:
1. Окислить сульфидные минералы, содержащиеся в рудах и концентратах, с целью дальнейшего наиболее полного извлечения цветных, редких и благородных металлов (известными способами).
2. Окисление сульфидных минералов произвести в условиях, исключающих образование элементарной серы, с одновременным гидролизом трехвалентного железа в соединения, связывающие мышьяк в водонерастворимую форму.
3. Использовать окислы азота в качестве катализатора окисления сульфидов, при этом регенерацию окислов азота из низших форм валентности в высшие производить воздухом или кислородом.
4. Соединения азота как катализаторы окисления сульфидов использовать в наиболее активной форме, а именно в виде азотистой кислоты и ее окислов.
Целью изобретения является создание условий наиболее полного извлечения металлов с исключением образования элементарной серы.
Сущность заявляемого технического решения заключается в том, что способ переработки сульфидного минерального сырья и концентратов включает окисление исходного сырья в виде пульпы с использованием окисляющих агентов, содержащих окислы азота, и регенерацию низших окислов азота до высших окислением, причем пульпу подвергают окислению в условиях контроля кислотности пульпы с постоянной нейтрализацией образующейся в результате окисления сульфидов серной кислоты до уровня кислотности, при котором не происходит образование элементарной серы, при использовании в качестве нейтрализаторов природных или искусственных веществ, выбранных из СаСО3, MgCO3, Ca(OH)2, CaO, NaOH, CaHPO4 в зависимости от необходимости образования продуктов с заданными физико-химическими свойствами: фильтруемостью, сгущаемостью, нерастворимостью мышьяка, нетоксичностью; при этом окисление производят при перемешивании, обеспечивающем достаточный массообмен и эффективное протекание химических реакций в температурном диапазоне 20-90°С, преимущественно в интервале 65-85°С. После окисления исходного сырья производят абсорбцию окислов азота растворами солей одновалентной меди. Поддержание необходимой температуры осуществляют путем отвода от реакторов окисления тепла, выделяемого при окислении сульфидов. Отношение жидкой и твердой фаз при окислении поддерживают от 1:1 до 5:1, в зависимости от эффективности образования необходимых осадков и протекания реакций окисления сульфидов, а в качестве окисляющих агентов используют азотную и азотистую кислоту, а также их окислы, преимущественно азотистую кислоту HNO2 и ее окисел N2О3, при этом для регенерации окислов азота из NO до N2О3 их окисляют с использованием воздуха или кислорода. Регенерацию NO кислородом осуществляют при температуре 15-25°С в отдельном регенерационном окислителе, что позволяет регенерировать NO в N2О3 и избежать накопления азотной кислоты в пульпе. После окисления окислов азота воздухом производят их абсорбцию для отделения их от инертного азота воздуха растворами серной кислоты с преимущественной концентрацией 75-98%, а после абсорбции производят денитрацию серной кислоты путем нагрева преимущественно до температуры не более 250°С или введением денитрующих веществ, таких как спирты, формальдегид и химические восстановители. После абсорбции окислов азота растворами солей одновалентной меди производят денитрацию растворов солей одновалентной меди путем дозированной подачи сжатого воздуха с одновременным нагреванием раствора и в присутствии в растворах стабилизаторов, препятствующих окислению меди из одновалентной в двухвалентную, в качестве которых используют трибутилфосфат или адиподинитрил, или восстановители - формальдегид или гидразин.
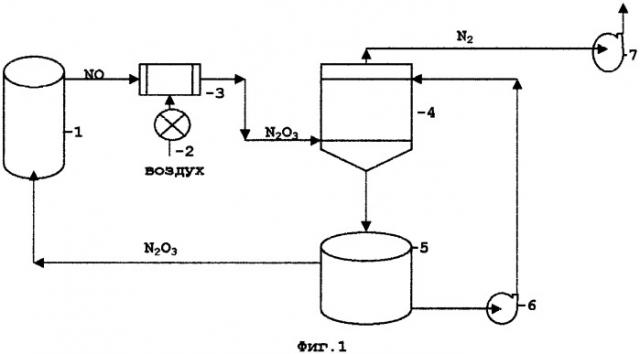
Для пояснения сущности заявляемого технического решения приведены технологические схемы, проиллюстрированные Фиг.1-3. На технологической схеме Фиг.1 изображена принципиальная аппаратурная схема окисления сульфидных руд и концентратов с регенерацией окислов азота воздухом и абсорбцией серной кислотой, где:
1 - реактор окисления сульфидных руд и концентратов
2 - воздуходувка
3 - окислитель
4 - абсорбер
5 - денитратор
6 - насос
7 - вентилятор.
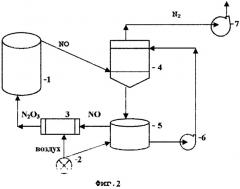
На технологической схеме Фиг.2 изображена принципиальная аппаратурная схема окисления сульфидных руд и концентратов с абсорбцией окиси азота солями меди и регенерацией воздухом, где:
1 - реактор окисления сульфидных руд и концентратов
2 - воздуходувка
3 - окислитель
4 - абсорбер
5 - денитратор
6 - насос
7 - вентилятор.
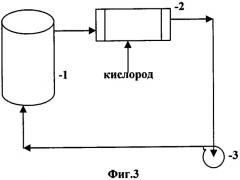
На технологической схеме Фиг.3 изображена принципиальная аппаратурная схема окисления сульфидных руд и концентратов с регенерацией окислов азота кислородом, где:
1 - реактор окисления сульфидных руд и концентратов
3 - окислитель
6 - насос.
Описание технологического процесса.
Принципиальная аппаратурная схема окисления сульфидных руд и концентратов с регенерацией окислов азота воздухом и абсорбцией серной кислотой приведена на Фиг.1. Окисление сульфидных минералов происходит в реакторе 1, оснащенном устройством для перемешивания пульпы. Газы из верхней части реактора, состоящие в основном из NO, поступают в окислитель 3, куда от воздуходувки 2 через регулятор поступает воздух в количестве, необходимом для окисления NO до состояния N2O3. После окислителя нитрозные газы поступают в абсорбер 4, где происходит абсорбция нитрозного газа раствором серной кислоты, после чего азот вентилятором 7 удаляется в атмосферу, а насыщенная нитрозными газами серная кислота поступает в денитратор 5. В денитраторе в результате нагрева и взаимодействия со специальными химическими добавками серная кислота выделяет в газовую фазу поглощенные ею в абсорбере нитрозные газы, которые поступают в реактор окисления сульфидов. После денитрации серная кислота насосом 6 перекачивается в абсорбер 4 для продолжения абсорбции нитрозных газов.
Принципиальная аппаратурная схема окисления сульфидных руд и концентратов с абсорбцией окиси азота солями меди и регенерацией воздухом приведена на Фиг.2. Окисление сульфидных минералов происходит в реакторе 1, оснащенном устройством для перемешивания пульпы. Газы из верхней части реактора, состоящие в основном из NO, поступают в абсорбер 4, где происходит абсорбция окиси азота NO раствором солей меди, после чего азот вентилятором 7 удаляется в атмосферу, а насыщенный окисью азота раствор солей меди поступает в денитратор 5. В денитраторе в результате окисления NO и взаимодействия со специальными химическими добавками раствор солей меди выделяет в газовую фазу поглощенную в абсорбере окись азота NO, которая поступает в окислитель 3, куда от воздуходувки 2 через регулятор поступает воздух в количестве, необходимом для окисления NO до состояния N2O3. Из окислителя 3 нитрозные газы поступают в реактор окисления сульфидов.
Принципиальная аппаратурная схема окисления сульфидных руд и концентратов с регенерацией окислов азота кислородом приведена на Фиг.3. Окисление сульфидных минералов происходит в реакторе 1, оснащенном устройством для перемешивания пульпы. Газы из верхней части реактора, состоящие в основном из NO, поступают в окислитель 3, куда подается чистый кислород, в количестве, необходимом для образования N2O3. Регенерированные окислы азота насосом 6 перекачиваются в реактор окисления сульфидов.
Окисление сульфидных руд и концентратов производится при выполнении и контроле за следующими условиями:
1. Контроль за кислотностью пульпы производится таким образом, чтобы концентрация свободной серной кислоты, образующейся при окислении сульфидной серы, не превышала 10-20 г/л пульпы. Это достигается введением в пульпу, по мере необходимости, веществ являющихся нейтрализаторами кислотности. Такими веществами могут быть СаСО3, MgCO3, CaO, Ca(OH)2, CaHPO4, NaOH и другие природные или искусственные нейтрализаторы кислотности. При выборе конкретного вещества-нейтрализатора учитывается необходимость образования осадков-продуктов нейтрализации пульпы и гидролиза трехвалентного железа с заданными свойствами: сгущаемостью, фильтруемостью, нерастворимостью мышьяка, сурьмы и других вредных веществ, содержащихся в осадках. Указанный режим позволяет окислить всю сульфидную серу до сульфатной без образования элементарной формы. Одновременно мышьяк, сурьма и другие вредные для технологии и окружающей среды элементы переводятся в водонерастворимое состояние.
2. Процесс окисления в реакторе организован таким образом, что окисляющим агентом является азотистая кислота HNO2 и ее окисел N2O3, а для регенерации этой кислоты и ее окисла используется кислород воздуха. Для реализации этого газы, отходящие из реактора окисления сульфидных концентратов (Фиг.1, поз.1), состоящие в основном из NO, поступают в окислительный объем (Фиг.1, поз.3), куда с учетом анализа газовой смеси дозируется воздух из расчета окисления NO до N2O3 по реакциям:
2NO+O2=2NO2
NO2+NO=N2O3
Образующаяся в результате окисления NO кислородом воздуха NO2 при температуре менее 140°С склонна к полимеризации с образованием N2O3. Вследствие этого в газовой среде после смешения NO с кислородом воздуха будет устанавливаться химическое равновесие между NO, O2, NO2, N2O3 и инертным азотом воздуха, константа равновесия реакции полимеризации двуокиси азота:
В области низких концентраций NO2 определяется по формуле:
Если концентрация С (объем.%) NO2>10%, константа равновесия выражается следующими эмпирическими уравнениями:
25°С Ка=0,1426-0,7588 CN2O4
35°С Ка=0,3183-1,591 CN2O4
45°С Ка=0,6706-3,382 CN2O4
где CN2O4 - содержание окислов азота, пересчитанное на N2O4, моль/литр
где PNO2 и PN2O4 - парциальное давление газов, атм.
Константа скорости реакции образования N2O3:
определяется следующими эмпирическими уравнениями:
25°С Kb=2,105-45,63 CN2O3
35°С Kb=3,673-78,11 CN2O3
45°С Kb=6,88-196,4 CN2O3
где CN2O3 - содержание NO, NO2, N2O4 в пересчете на N2O3, моль/литр
Проведенные термодинамические расчеты для разных по составу газовых смесей при различных температурах и давлениях показывают, что практически невозможно подобрать условия, при которых образовывалась бы только N2O3. Присутствие в газовых смесях таких окислов азота, как NO2 и N2O4, приводит в дальнейшем к образованию в реакторе окисления азотной кислоты, что является нежелательным в рамках нашей технологии.
Настоящая технология позволяет решить эту проблему:
Для отделения окислов азота, образующихся в окислителе (Фиг.1, поз.3), от атмосферного азота и других инертных газов, содержащихся в газовой смеси, окислы азота абсорбируются раствором серной кислоты в абсорбере (Фиг.1, поз.4). При поглощении серной кислотой двуокиси азота NO2 протекают следующие реакции:
2NO2+H2SO4=HNSO5+HNO3
Образующаяся азотная кислота HNO3 в сильнокислой среде серной кислоты взаимодействует с HNSO5 по реакции:
HNSO5+HNO3=H2SO4+2NO2
Таким образом, абсорбция NO2 и N2O4 серной кислотой неэффективна, поскольку приводит к образованию исходных веществ.
Абсорбция серной кислотой окислов азота в форме N2O3 очень эффективна, поскольку взаимодействие протекает полностью, с образованием HNSO5:
N2O3+H2SO4=HNSO5+HNO3
2HNO3=H2O+N2O3
Таким образом, окислы азота в форме N2O3 полностью поглощаются растворами серной кислоты.
Растворимость NO в растворах серной кислоты незначительна и при температуре 20°С и нормальном давлении составляет:
| Концентрация H2SO4 | % | 100 | 45 | 24 | 0 |
| Содержание NO | % | 0,0025 | 0,002 | 0,005 | 0,009 |
Приведенные выше данные показывают, что при поступлении смеси газов, состоящих из NO, NO2, N2O3, N2O4 и инертных газов, в абсорбер необратимо взаимодействовать с серной кислотой будет только N2O3. Вследствие этого концентрация N2O3 будет снижаться и химические реакции пойдут в сторону его образования. Скорости газовых реакций очень высоки и равновесие в системе устанавливается через 0,1-0,5 с, что позволяет за время пребывания газов в абсорбере поглотить окислы азота в форме N2O3.
3. Для уменьшения потери окислов азота с отходящими газами, обусловленной парциальным давлением окислов азота над серной кислотой, абсорбция нитрозных газов производится серной кислотой с концентрацией 75-98%. Целесообразность применения растворов серной кислоты с указанными пределами концентраций определяется степенью гидролиза нитрозилсерной кислоты HNSO5 в растворах H2SO4 и, следовательно, давлением окислов азота над поверхностью H2SO4.
| Концентрация H2SO4 % | 98 | 95 | 92 | 90 | 87 | 80 | 70 | 57 |
| % гидролиза HNSO5 | 1,1 | 4 | 7,3 | 12,4 | 19,4 | 27,7 | 49,8 | 100 |
4. Насыщенная нитрозными газами серная кислота поступает в денитратор (Фиг.2, поз.5), где происходит термическое и химическое разложение нитрозилсерной кислоты HNSO5 с образованием исходной кислоты и азотистой кислоты HNO2. Разложение происходит в основном под действием нагрева, но с целью денитрации серной кислоты могут применяться химические денитраторы, такие как спирты, формальдегиды и другие химические восстановители. Под действием высокой температуры (до 250°С) и химических веществ нитрозилсерная кислота и азотистая кислота разрушаются с выделением N2O3, который в свою очередь при этой температуре дает эквимолекулярную смесь NO и NO2. Смесь этих газов подается в реактор окисления (Фиг.2, поз.1), где происходит окисление сульфидных концентратов азотистой кислотой, образующейся при взаимодействии нитрозных газов с водой пульпы.
В целях экономии высокотемпературных энергоносителей, которые должны использоваться при нагреве нитрозилсерной кислоты до 250°С, вместо серной кислоты в технологии регенерации окислов азота могут использоваться растворы солей меди. Известно, что водные растворы солей одновалентной меди хорошо растворяют окись азота NO. На схеме, изображенной на Фиг.2, газы, отходящие из реактора окисления сульфидных руд и концентратов (Фиг.2, поз.1) и состоящие в основном из NO, поглощаются в абсорбере (Фиг.2, поз.4) раствором солей одновалентной меди. В качестве активных соединений для абсорбции окислов азота могут использоваться хлориды, сульфаты, аммиачные и другие водорастворимые соли одновалентной меди. Насыщенный окисью азота раствор одновалентной меди поступают в денитратор (Фиг.2, поз.5), в который из воздуходувки (Фиг.2, поз.2) дозировано подается сжатый воздух, возможно с одновременным нагреванием раствора. Окись азота NO окисляется в растворенном виде до формы N2O3, которая не абсорбируется раствором одновалентной меди и отгоняется в окислитель (Фиг.2, поз.3). В окислителе происходит окончательная корректировка степени окисления NO до формы N2O3, после чего нитрозные газы поступают в реактор окисления (Фиг.2, поз.1). Денитрованный раствор солей меди из денитратора (Фиг.2, поз.5) насосом (Фиг.2, поз.6) перекачивается на орошение абсорбера (Фиг.2, поз.4). Нейтральный азот воздуха, не растворившийся в растворе солей меди, высасывается вентилятором (Фиг.2, поз.7) и выбрасывается в атмосферу. Растворы одновалентной меди могут содержать стабилизаторы, препятствующие окислению меди из одновалентной в двухвалентную, так как растворы двухвалентной меди не являются эффективными растворителями NO. В качестве стабилизаторов могут применяться такие известные вещества, как трибутилфосфат и адиподинитрил, а также другие восстановители - формальдегид, гидразин и другие.
В случае применения для регенерации NO чистого кислорода аппаратурная схема значительно упрощается, поскольку отсутствует необходимость выводить из системы инертный азот воздуха. При этом наличие отдельного регенерационного окислителя (Фиг.2, поз.3) является существенным элементом нашей новой технологии, так как это позволяет регенерировать NO в N2О3 и избежать накопления азотной кислоты в пульпе. Подача кислорода прямо в реактор окисления вызовет параллельное образование азотной и азотистой кислоты, т.к. условия окисления концентратов (65-85°С) и условия регенерации азотной кислоты различаются по температуре и давлению.
Примеры конкретного выполнения заявляемого способа:
1. Окислению с использованием аппаратурной схемы согласно Фиг.1 подвергалась медная руда со следующим составом: пирит - 80%, халькипирит - 4%, сфалерит и галенит - 1%, кварц - 7%, хлорит - 2%, серецит - 2%, барит, эпидот - до 1%. Химический состав руды: медь - 1,54%, цинк - 0,46%, сера - 42,4%, железо - 40,6%, окись кремния - 9,8%, окись алюминия - 2,4%, окись магния - 0,42%, окись кальция - 0,1%, окись калия - 0,22%, окись натрия - 0,12%, золото - 1,4 г/т, серебро 13 г/т.
Продолжительность процесса окисления составила 4 часа, при температуре процесса в реакторе окисления 75°С. Оборот окиси азота в расчете на NO составил 940 грамм/кг руды за время проведения процесса. Температура в абсорбере (Фиг.1, поз.4) поддерживалась на уровне 26°С, температура в денитраторе (Фиг.1, поз.5) на уровне 130°С, для усиления денитрациии использовался этиловый спирт в количестве 2 мл на литр денитруемого раствора серной кислоты. Нейтрализация образующейся серной кислоты производилась введением в пульпу раствора Са(ОН)2 до уровня остаточной кислотности 5 г/л по серной кислоте. В результате ведения процесса окисления с контролем за кислотностью пульпы образования элементарной серы не наблюдалось. По данным химического анализа содержание сульфидной серы в кеке после завершения процесса составило 1,6%. Переход меди в раствор составил 98,5% от исходного содержимого в руде, цинка - 97% от исходного содержимого в руде. После промывки и нейтрализации проводили цианирование кека. Извлечение золота составило 94%, серебра 91% от исходного содержания в руде.
2. Окислению с использованием аппаратурной схемы согласно Фиг.2 подвергался смешанный флотоконцентрат, имеющий следующий состав: медь - 22,5%, цинк - 3,9%, сера сульфидная - 40%, железо - 32,6%, окись кремния - 0,5%, окись алюминия - 0,4%, свинец - 0,18%, углерод органический - 0,22%, золото - 10,6 г/т, серебро 71,4 г/т.
Продолжительность процесса окисления составила 6 часов, при температуре процесса в реакторе окисления 80°С. Оборот окиси азота в расчете на NO составил 1670 грамм/кг руды за время проведения процесса. Температура в абсорбере (Фиг.1, поз.4) поддерживалась на уровне 26°С, температура в денитраторе (Фиг.1, поз.5) на уровне 70°С, в качестве стабилизатора раствора хлористой меди использовался формальдегид в количестве 0,7 г/литр раствора. Нейтрализация образующейся серной кислоты производилась введением в пульпу раствора Са(ОН)2 до уровня остаточной кислотности 3 г/л по серной кислоте. В результате ведения процесса окисления с контролем за кислотностью пульпы образования элементарной серы не наблюдалось. По данным химического анализа содержание сульфидной серы в кеке после завершения процесса составило 2,1%. Переход меди в раствор составил 99,1% от исходного содержимого в руде, цинка - 98,3% от исходного содержимого в руде. После промывки и нейтрализации проводили цианирование кека. Извлечение золота составило 97%, серебра 94% от исходного содержания в руде.
3. Окислению с использованием аппаратурной схемы согласно Фиг.3 подвергалась пирротиновая руда следующего состава: пирритин - 67,2%, халькопирит - 11,1%, пентландит - 9,5%, магнетит - 5,7%, нерудные минералы - 5,7%, титаномагнетит - 0,2%. Химический состав: окись кремния - 1,6%, окись алюминия - 1,85%, железо - 52,1%, сера сульфидная - 30,8%, окись кальция - 1,03%, окись магния - 0,33%, окись натрия - 0,17%, окись калия - 0,14%, окись марганца - 0,11%, медь - 3,67%, никель - 4,2%, кобальт - 1310 г/тонну, платина - 1,5 г/т, палладий - 2,2 г/т.
Продолжительность процесса окисления составила 4,4 часа при температуре процесса в реакторе окисления 75°С. Расход кислорода на окисление руды составил 340 грамм/кг руды за время проведения процесса. Нейтрализация образующейся серной кислоты производилась введением в пульпу раствора Са(ОН)2 до уровня остаточной кислотности 7 г/л по серной кислоте, для комплексообразующих свойств в раствор было добавлено 50 г/литр NaCl. В результате ведения процесса окисления с контролем за кислотностью пульпы образования элементарной серы не наблюдалось. По данным химического анализа содержание сульфидной серы в кеке после завершения процесса составило 1,1%. Переход меди в раствор составил 94,3%, никеля - 96,3%, кобальта - 93,3%, платины - 91,4%, палладия - 95,2% от исходного содержания в руде.
1. Способ переработки сульфидного минерального сырья и концентратов, включающий окисление исходного сырья в виде пульпы с использованием окисляющих агентов, содержащих окислы азота, и регенерацию низших окислов азота до высших окислением, отличающийся тем, что пульпу подвергают окислению в условиях контроля кислотности пульпы с постоянной нейтрализацией образующейся в результате окисления сульфидов серной кислоты до уровня кислотности, при котором не происходит образование элементарной серы, при использовании в качестве нейтрализаторов природных или искусственных веществ, выбранных из СаСО3, MgCO3, Ca(OH)2, СаО, -NaOH, CaHPO4 в зависимости от необходимости образования продуктов с заданными физико-химическими свойствами: фильтруемостью, сгущаемостью, нерастворимостью мышьяка, нетоксичностью, при этом окисление производят при перемешивании, обеспечивающем достаточный массообмен и эффективное протекание химических реакций в температурном диапазоне 20-90°С, преимущественно в интервале 65-85°С.
2. Способ по п.1, отличающийся тем, что поддержание необходимой температуры осуществляют путем отвода от реакторов окисления тепла, выделяемого при окислении сульфидов.
3. Способ по п.1 или 2, отличающийся тем, что отношение жидкой и твердой фаз при окислении поддерживают от 1:1 до 5:1, в зависимости от эффективности образования необходимых осадков и протекания реакций окисления сульфидов.
4. Способ по п.1, отличающийся тем, что в качестве окисляющих агентов используют азотную и азотистую кислоту, а также их окислы, преимущественно азотистую кислоту HNO2 и ее окисел N2О3, при этом для регенерации окислов азота из NO до N2O3 их окисляют с использованием воздуха или кислорода.
5. Способ по п.4, отличающийся тем, что после окисления окислов азота воздухом производят их абсорбцию для отделения их от инертного азота воздуха растворами серной кислоты с преимущественной концентрацией 75-98%.
6. Способ по п.5, отличающийся тем, что после абсорбции производят денитрацию серной кислоты путем нагрева преимущественно до температуры не более 250°С или введением денитрующих веществ, таких как спирты, формальдегид и химические восстановители.
7. Способ по п.1, отличающийся тем, что после окисления исходного сырья производят абсорбцию окислов азота растворами солей одновалентной меди.
8. Способ по п.7, отличающийся тем, что после абсорбции окислов азота растворами солей одновалентной меди производят денитрацию растворов солей одновалентной меди путем дозированной подачи сжатого воздуха с одновременным нагреванием раствора и в присутствии в растворах стабилизаторов, препятствующих окислению меди из одновалентной в двухвалентную, в качестве которых используют трибутилфосфат или адиподинитрил, или восстановители - формальдегид или гидразин.
9. Способ по п.4, отличающийся тем, что регенерацию NO кислородом осуществляют при температуре 15-25°С в отдельном регенерационном окислителе, что позволяет регенерировать NO в N2O3 и избежать накопления азотной кислоты в пульпе.