Применение (2-имидазолин-2-иламино) хиноксалинов для лечения деменции и болезни паркинсона
Иллюстрации
Показать всеИзобретение относится к способам лечения нейродегенеративного состояния головного мозга, такого как болезнь Паркинсона и болезнь Альцгеймера, и способам предотвращения гибели или дегенерации нервных клеток. Млекопитающему вводят терапевтически эффективное количество композиции, содержащей бримонидин или его фармацевтически приемлемую соль. Изобретение позволяет лечить или предотвращать дегенерацию нервных клеток за счет нейропротекторного действия бримонидина в отношении нейронов головного мозга. 2 н. и 4 з.п. ф-лы, 1 ил., 2 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способам защиты нервных клеток, в частности клеток центральной нервной системы млекопитающих, от повреждений при ишемическом инсульте, в том числе от токсического действия глютамата и от апоптоза. Способы, являющиеся предметом настоящего изобретения, заключаются в применении агониста альфа-2 рецепторов адреналина бримонидина для предотвращения повреждения и гибели нервных клеток при болезни Паркинсона и болезни Альцгеймера.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к фармацевтическим композициям, включающим соединения, которые способны воздействовать на альфа-2 адренергические рецепторы. Кроме того, настоящее изобретение включает в себя способы лечения различных заболеваний и состояний, в том числе заболеваний и состояний, вызванных нарушениями центральной нервной системы.
Адренергические рецепторы человеческого организма являются интегральными мембранными белками и подразделяются на два больших класса: альфа- и бета-адренорецепторы. Оба типа рецепторов обеспечивают работу периферического отдела симпатической нервной системы, связывая катехоламины, норэпинефрин и эпинефрин.
Норэпинефрин выделяется адренергическими нервными окончаниями, а эпинефрин - мозговым веществом надпочечников. Сродство адренергических рецепторов к данным веществам является одним из принципов классификации: альфа-адренорецепторы связывают норэпинефрин более активно, чем эпинефрин, и гораздо активнее, чем синтетическое соединение изопротеренол. Обратная закономерность характерна для бета-адренорецепторов. Во многих тканях реакции, такие как сокращение гладкой мускулатуры, на активацию альфа-адренорецепторов и бета-адренорецепторов являются разнонаправленными.
Впоследствии функциональное различие между альфа- и бета-адренорецепторами было детально изучено в ходе фармакологических исследований с использованием различных лабораторных животных и источников тканей. Альфа- и бета-адренорецепторы были дополнительно разделены на подтипы: альфа-1, альфа-2, бета-1 и бета-2.
Кроме того, было установлено, что эти рецепторы также могут существовать в различных вариантах: альфа-2 рецепторы подразделяются на подтипы альфа-2А, альфа-2В и альфа-2С.
Были установлены функциональные различия между альфа-1 и альфа-2 рецепторами и описаны соединения, обладающие специфическим сродством к ним.
Так, публикация WO 92/00073 содержит описание R(+) энантиомера теразозина, избирательно взаимодействующего с адренергическими рецепторами подтипа альфа-1. Избирательность действия данного соединения на альфа-1 и альфа-2 рецепторы имеет большое значение, поскольку стимуляция альфа-2 рецепторов подавляет секрецию эпинефрина и норэпинефрина, а подавление активности альфа-2 рецепторов повышает секрецию этих гормонов. Таким образом, использование неселективных альфа-адреноблокаторов (например, феноксибензамина и фентоламина) ограничено их способностью посредством стимуляции α2-адренорецепторов повышать уровень катехоламинов в плазме крови, что приводит к известным физиологическим изменениям (увеличение частоты сердечных сокращений и стимуляция сокращения гладкомышечных клеток). Важно, что избирательность действия веществ в отношении альфа-1 и альфа-2 рецепторов определяется константой KD, которая позволяет лишь сопоставить степень сродства веществ к рецепторам без учета фактического биологического эффекта от активации сравниваемых рецепторов.
Напротив, способ определения избирательности действия агонистов альфа-рецепторов включает в себя испытание RSAT (Технология отбора и амплификации рецепторов), описанное Messier с соавторами. High Throughput Assays Of Cloned Adrenergic, Muscarinic, Neurokinin And Neurotrophin Receptors In Living Mammalian Cells, Pharmacol. Toxicol. 76:308-11 (1995), и адаптированное для изучения альфа-2 рецепторов. Данная работа включена в данное описание посредством ссылки. Данный способ позволяет определить вклад рецептора в уменьшение контактного торможения, которое приводит к избирательной пролиферации клеток, несущих на себе данный рецептор, в смешанной популяции всех клеток. Увеличение числа клеток определяется по содержанию маркерного гена, внесенного в клетки путем трансфекции (например, гена бета-галактозидазы, активность которой можно легко определить на пластине с 96 лунками). Рецепторы, активирующие G-белок, Gq, усиливают этот ответ. Альфа-2 рецепторы, которые обычно связаны с Gi-белком, активируют ответ согласно RSAT при взаимодействии с гибридным Gq-белком, который несет на себе домен узнавания рецептора Gi, т.н. Gq/i5 2 [Conklin и соавт., Substitution Of Three Amino Acids Switches Receptor Specificity Of Gqa To That Of Gia, Nature 363: 274-6. (1993)]. Данная работа включена в данное описание посредством ссылки.
Агонисты альфа-адренорецепторов эффективны для лечения различных заболеваний и патологических состояний. Такие вещества, как, например, клонидин, применяются в качестве системных и глазных антигипертензивных агентов, агентов для лечения аддиктивных состояний, таких как курение и токсикомания, а также для лечения дисменореи. Другой агонист альфа-адренорецепторов - тизанидин - используется для уменьшения спастического компонента при рассеянном склерозе посредством снижения мышечного тонуса. По данным некоторых исследований вещества этой группы обладают и некоторой анальгетической активностью.
Несмотря на эффективность, использование этих средств часто сопровождается выраженными побочными эффектами, включающими в себя седацию, сердечно-сосудистые расстройства (гипотензия и урежение пульса), а также головокружение, что ограничивает показания к их назначению. В частности, кривые терапевтической и седативной дозы этих препаратов часто перекрещиваются, т.е. седативный эффект начинает проявляться при той же дозе, что и терапевтический (например, гипотензивный или анальгетический) in vivo.
Такие соединения, как клонидин, тизанидин и дексмедетомидин описываются в литературе как агонисты альфа-2 рецепторов адреналина, что во многом основано на результатах исследования рецепторного связывания, см. Hieble et al., J.Med Chem. 38: 3415 (September 1, 1995); Ruffolo, et al., J.Med. Chem. 38: 3681 (September 15, 1995) - обе работы включены в данное описание посредством ссылки. Хотя эти вещества являются агонистами альфа-2 рецепторов, однако то, что эти вещества также обладают значительной активностью в отношении альфа-1 рецепторов, не является принятым. Взаимное влияние активации альфа-1 рецепторов и альфа-2 рецепторов также не является общепризнанным или общеизвестным.
Напротив, вещество бримонидин и его 2-инидазолин-2-илиминовые производные, обладающие схожими свойствами (см. ниже), относятся к агонистам альфа-2 рецепторов и гораздо активнее взаимодействуют с альфа-2 рецепторами, чем с альфа-1 рецепторами.
Расстройства ЦНС относятся к неврологическим заболеваниям. Причиной некоторых из них считают дефицит холинергических, дофаминергических, адренергичесих и/или серотонинергических эффектов. Наиболее распространенными расстройствами ЦНС являются пресенильная деменция (начало болезни Альцгеймера), сенильная деменция (деменция Альцгеймеровского типа) и паркинсонизм, включая болезнь Паркинсона.
Существующее представление о болезни Альцгеймера основано на том, что в некоторых отделах мозга больных (например, в гиппокампе и в коре больших полушарий) наблюдается гибель нервных клеток. Исследованиями, проведенными в 1970-х гг., установлено, что некоторые из погибающих нейронов являются холинергическими (т.е. взаимодействуют посредством нейротрансмиттера ацетилхолина, который разрушается под действием фермента ацетилхолинэстеразы [Jones, et al., Intern. J.Neurosci. 50: 147 (1990); Perry, Br. Med. Bull. 42: 63 (1986); Sitaram, et al., Science 201: 274 (1978)].
Препараты, появившиеся на рынке в течение последнего десятилетия (например, такрин и донепезил), относятся к ингибиторам ацетилхолинэстеразы. Предотвращая распад ацетилхолина, эти вещества замедляют прогрессирование болезни Альцгеймера в начальной стадии. Однако после окончательной гибели холинергических нейронов и отсутствии выработки ацетилхолина эти препараты становятся неэффективными.
Помимо гибели нейронов в головном мозге больных происходит образование белковых кластеров. Последние могут накапливаться как внутри нейронов, так и в межклеточном пространстве. Внутриклеточные кластеры также именуются нейрофибриллярными клубочками и выглядят как спирально сплетенные парные волокна. Исследования показали, что эти клубочки состоят из тау-протеина. Этот белок играет значительную роль, так как связывается с тубулином, из которого образуются микротрубочки. Содержание нейрофибриллярных клубочков коррелирует с тяжестью заболевания.
Внеклеточные белковые кластеры, или бляшки, состоят из отложений β-амилоидного белка. Расположенные рядом с ними нейроны часто выглядят набухшими и деформированными, а амилоидные бляшки окружены воспалительной микроглией. Микроглия, являющаяся частью иммунной системы головного мозга, вероятно, предназначена для разрушения погибших нейронов и удаления их фрагментов, а, возможно, и самих бляшек.
Неизвестно, нормально ли функционируют нейроны в области бляшки или рядом с ней, поскольку плотность бляшек лишь слабо коррелирует с тяжестью деменции. Кроме того, бляшки обнаруживаются у большинства пожилых людей, независимо от того, есть ли у них болезнь Альцгеймера. Тем не менее, их высокое содержание в гиппокампе и коре больших полушарий специфично для болезни Альцгеймера, и они появляются задолго до обнаружения нейрофибриллярных клубочков.
Бета-амилоидные бляшки содержат фрагмент интегрального мембраного белка, который называют белком-предшественником бета-амилоида (ВАРР), содержащий 42 аминокислоты. Этот фрагмент образуется в ходе двухэтапного протеазного расщепления белка ВАРР: сначала бета-секретазой, а затем - гамма-секретазой. Обычным продуктом расщепления белка бета-секретазой и гамма-секретазой является кислый пептид из 40 аминокислотных остатков, который, в отличие от 42-аминокислотного кислого пептида, не участвует в развитии болезни Альцгеймера.
Болезнь Паркинсона (БП) - это инвалидизирующее заболевание неизвестной этиологии, которое характеризуется тремором и ригидностью мышц. Особенностью данного заболевания является дегенерация дофаминергических нейронов (т.е., нейронов, выделяющих дофамин), особенно в черной субстанции и в вентральных отделах покрышки моста среднего мозга [Rinne, et al., Brain Res. 54: 167 (1991) and Clark, et al., Br.J.Pharm. 85: 827 (1985)]. Черная субстанция участвует в координации нейрональных сигналов, контролирующих движения и положение тела. В вентральных отделах покрышки моста содержатся нейроны, окончания которых проецируются на префронтальную кору, которая связана с высшими когнитивными функциями.
Было создано несколько препаратов для лечения БП. Одним из них является SINEMET®, выпускающийся в форме таблеток с замедленным высвобождением, содержащий смесь карбидопа и леводопа [DuPont Merck Pharmaceutical Co.]. Другим препаратом для лечения БП является ELDEPRYL® - таблетки, содержащие селефилина гидрохлорид [Somerset Pharmaceuticals, Inc.]. Еще одно средство - PARLODEL® - таблетки бромокриптина мезилата [Sandoz Pharmaceuticals Corporation]. Berliner и соавт. (патент США №5210076) предложили способ лечения БП и других нейродегенеративных заболеваний с помощью меланина. Однако ни один их этих препаратов не предотвращает гибель нервных клеток.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Несмотря на известный нейропротекторный эффект бримонидина и его производных в отношении зрительного нерва, клеток сетчатки и нейронов спинного мозга в зоне повреждения при его местном или системном введении, эти препараты ранее не предлагалось использовать для лечения нейродегенеративных заболеваний головного мозга, таких как болезнь Альцгеймера и болезнь Паркинсона, отчасти из-за существования гематоэнцефалического барьера, а также из-за значительного седативного эффекта, характерного для существующих агонистов альфа-адренорецепторов (клонидина, тизанидина и дексметатомидина). Таким образом, седативный эффект этих препаратов при системном введении в терапевтической дозе существенно ограничивает их практическое использование в качестве средств для парентерального или перорального введения.
Авторы изобретения неожиданно обнаружили, что бримонидин и его производные при системном введении обладают нейропротекторным эффектом в отношении нейронов головного мозга. Бримонидин и его производные характеризуются гораздо большим терапевтическим окном между нейропротекторной и седативной активностью по сравнению с большинством существующих агонистов альфа-адренорецепторов.
Бримонидин и его терапевтический эффект описаны в работе Danielewicz и соавт. (патенты США №3890319 и 4029792). В этих патентах бримонидин раскрыт как регулятор сердечно-сосудистой системы, имеющий следующую формулу:
где 2-имидазолин-2-иламиногруппа может быть присоединена к хиноксалину в положении 5-, 6-, 7- или 8-; х, у и z могут быть присоединены в положениях 5-, 6-, 7- или 8- и могут представлять собой водород, галоген, C1-5алкил, C1-5алкокси или трифторметил; R является водородом, С1-5алкилом или C1-5алкокси в положении 2- или 3-, или может отсутствовать. Указанные соединения могут быть синтезированы в соответствии с методами, описанными в патентах США 3890319 и 4029792, которые включены в данное описание посредством ссылки. В работе "Влияние агониста альфа-2 адренорецепторов с относительной избирательностью действия на зрительную систему у кошек, кроликов и обезьян", Current Eye Rsrch., 5, (9), pp.665-676 (1986), J.A.Burke и соавт. показали, что производное хиноксалина бримонидин, формула которого представлена ниже, эффективно снижает внутриглазное давление у кроликов, кошек и обезьян. Исследуемые вещества наносились местно на роговицу животных.
Известно, что агонист альфа-2 адренорецепторов бримонидин защищает клетки сетчатки глаза, в том числе фоторецепторы и ганглионарные клетки, от повреждения при глаукоме, пигментной дистрофии и возрастной дегенерации желтого пятна при местном или системном применении (патент США 6194415).
Первый аспект настоящего изобретения относится к способам лечения нейродегенеративных заболеваний головного мозга, включающим введение в головной мозг млекопитающего терапевтически эффективного количества бримонидина.
Бримонидин обладает менее выраженной активностью в отношении альфа-1 рецепторов, чем другие хорошо известные агонисты альфа-2 рецепторов. Хотя эти агонисты рассматриваются как селективные агонисты альфа-2 рецепторов, на самом деле все эти соединения обладают более высокой активностью в отношении альфа-1А рецепторов, чем в отношении какого-либо подтипа альфа-2 рецепторов. В отличие от них, бримонидин по меньшей мере в 5,5 раз более активен в отношении каждого из подтипов альфа-2 рецепторов, чем в отношении альфа-1А рецептора. Представленные ниже данные были получены с помощью вышеупомянутого испытания RSAT.
| Таблица 1 | ||||
| Соединение | ЕС50 | |||
| 1А | 2А | 2В | 2С | |
| Клонидин | 13 | 13 | 22 | 65 |
| Тизанидин | 351 | 207 | 127 | 1693 |
| Дексмедетомидин | 11 | 2 | 2 | 1 |
| Бримонидин | 850 | 17 | 60 | 33 |
Авторы изобретения также обнаружили, что для бримонидина характерно широкое терапевтическое окно (т.е. большой диапазон между минимальной дозой, вызывающей терапевтический эффект за счет связывания с альфа-2-адренорецепторами, и дозой, вызывающей седативный эффект) по сравнению с другими соединениями, обладающими более высокой активностью по отношению к альфа-1-адренорецептором.
Так, например, терапевтический и седативный эффекты тизанидина и клонидина проявляются при дозе около 100 мкг/кг при внутрибрюшинном введении. Напротив, у бримонидина терапевтическая доза составляет от 10 мкг/кг, а седативный эффект проявляется при дозе от 30 мкг/кг. Таким образом, бримонидин может использоваться в качестве нейропротектора для системного введения с меньшим риском чрезмерного седативного действия.
Эффективность действия, опосредуемого рецепторами того или иного подтипа, в соответствии с изобретением определяли с помощью описанного выше способа RSAT.
Авторы предполагают, что уменьшение стимуляции альфа-1 рецепторов вызывает снижение 50% эффективной концентрации (ЕС50) бримонидина, что обеспечивает терапевтический эффект при более низкой концентрации препарата, т.е. данный препарат обладает более выраженной активностью в отношении альфа-1 рецепторов по сравнению с другими аналогичными соединениями без изменения зависимости седативного эффекта от дозы.
В другом аспекте настоящее изобретение относится к способам предотвращения гибели или дегенерации нервных клеток, которые подходят к области головного мозга, включающей голубое пятно, или отходят от нее, включающим введение терапевтического количества бримонидина в указанные клетки.
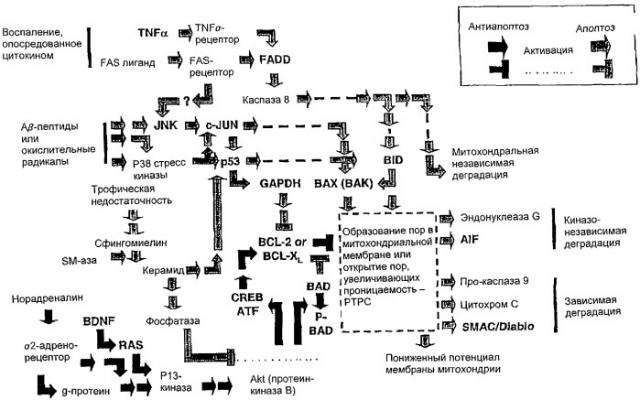
Этот способ особенно эффективен для профилактики заболевания, т.е. до начала гибели нейронов и в стадии, предшествующей прогрессированию болезни Альцгеймера или болезни Паркинсона. Не желая ограничиваться какой-либо конкретной теорией механизма нейропротективного эффекта соединений изобретения, авторы предполагают, что бримонидин при использовании его в способах изобретения может стимулировать образование определенных факторов группы bcl-2; повышенная экспрессия этих факторов регистрируется как повышенная экспрессия мРНК, кодирующей их образование; эти факторы (bcl-2 и bcl-XL) могут подавлять процесс апоптоза и уравновешивать эффект факторов апоптоза из группы bcl-2 (bad и bax), которые образуются в результате губительных воздействий на нервные клетки. Таким образом, считают, что соединения изобретения, которые обладают нейропротективным эффектом, могут использоваться в комбинации с другими соединениями, которые ингибируют гибель клетки. Эти соединения, ингибирующие гибель клетки, включают в себя антагонисты NMDA-рецепторов, особенно мемантин, блокирующий цитотоксический эффект повышенной концентрации глутамата; ингибиторы синтетазы оксида азота; ингибиторы свободных радикалов и блокаторы кальциевых каналов.
Для введения бримонидина в мозг млекопитающего может использоваться любой подходящий путь введения. Среди млекопитающих предпочтительным является человек. При выборе пути введения необходимо стремиться к тому, чтобы достигнуть максимального положительного эффекта, т.е. низкой эффективной концентрации и малой частоты побочных эффектов.
В соответствии с предложенной схемой бримонидин может назначаться перорально, парентерально, внутривенно, подкожно и посредством других путей системного введения. Препараты назначают в эффективной терапевтической дозе изолированно или в комбинации с другими фармацевтически приемлемыми носителями или наполнителями.
В зависимости от предполагаемой схемы лечения терапевтическая доза бримонидина может содержаться в любой приемлемой лекарственной форме (таблетки, свечи, пилюли, капсулы, порошки, микстуры, растворы, растворы для внутривенного введения, настои, суспензии, эмульсии, аэрозоли и пр.). Предпочтительным является однократный режим введения точной дозы препарата, а также введение лекарственной формы с замедленным высвобождением, обеспечивающей длительное и управляемое действие. Желательно, чтобы лекарственная форма включала в себя фармацевтически приемлемый наполнитель, активное соединение или соединения, а также другие лекарственные средства, носители, адъюванты и пр.
В твердых лекарственных формах могут использоваться нетоксичные носители, например маннитол, лактоза, крахмал, стеарат магния, натриевая соль сахарина, полиаклиленгликоли, тальк, целлюлоза, глюкоза, сахароза и карбонат магния, обладающие соответствующей степенью очистки. Примером твердой лекарственной формы по изобретению является суппозиторий, содержащий пропиленгликоль в качестве носителя.
Жидкие лекарственные формы могут представлять собой растворы или суспензии, содержащие одно или несколько активных соединений, а также адъюванты и носители, такие как вода, солевой раствор, водный раствор декстрозы, глицерин, этанол и пр. При необходимости лекарственная композиция может включать в себя небольшое количество вспомогательных веществ, таких как увлажнители, эмульгаторы, буферные агенты и пр. Примерами таких вспомогательных веществ являются ацетат натрия, монолаурат сорбитана, триэтаноламин, ацетат натрия, триэтаноламина олеат и пр. Способы приготовленя подобных лекарственных форм хорошо известны специалистам, например из Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, Pa., 16th Edition, 1980. Состав композиции во всех случаях должен содержать одно или несколько соединений изобретения в количестве, достаточном для достижения необходимого терапевтического эффекта.
Парентеральное введение как правило осуществляется путем инъекций (подкожных, внутримышечных или внутривенных). Формы для инъекций представляют собой либо обычные формы (растворы или суспензии, порошки для приготовления растворов или суспензий), либо эмульсии или растворы для вливаний. Подходящими наполнителями для них являются вода, солевой раствор, декстроза, глицерин, этанол и пр. Кроме того, при необходимости фармацевтическая композиция для инъекций или вливаний может содержать небольшое количество нетоксичных вспомогательных веществ, таких как увлажнители, эмульгаторы, буферные вещества и пр.
Количество вводимого бримонидина зависит от эффекта, который следует достичь, вида млекопитающего, тяжести и природы заболевания, способа введения, фармакодинамики используемого вещества или веществ, а также от мнения лечащего врача. В общем случае терапевтически эффективная доза составляет от 0,5-1 до 100 мг/кг/сутки.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение относится к способам лечения нейродегенеративных заболеваний головного мозга, включающим введение в головной мозг млекопитающего терапевтически эффективного количества бримонидина или его фармацевтически активной соли.
Авторы изобретения обнаружили, что бримонидин обладает необычно высокой способностью предотвращать повреждение и гибель нейронов, в том числе апоптоз, по сравнению с веществами, являющимися агонистами альфа-1 адренорецепторов. Не желая ограничиваться теорией, авторы считают, что стимуляция альфа-1 адренорецепторов накладывается на нейропротекторное действие альфа-2 адренорецепторов и снижает седативный эффект таких агентов, как клонидин и тизанидин, так, что величина ЕС50 таких препаратов является такой же или отличается не более, чем в 3 раза от эффективной нейропротекторной дозы этих веществ. Так, нейропротекторный эффект неселективных агентов, таких как клонидин, тизанидин, дексметатомидин, наблюдается при концентрации, которая способна вызвать седацию или является токсической.
Отчасти по этой причине препараты, действующие на альфа-адренорецепторы, ранее широко не применялись в качестве нейропротекторов и использовались только для местного (локального) применения, например в офтальмологии, что исключало их системное действие.
Авторы объясняют нейропротекторный эффект бримонидина стимуляцией альфа-2В и/или альфа-2С рецепторов. Считается, что количество рецепторов данного типа в головном мозге невелико. Однако авторы обнаружили, что способ, являющийся предметом данного изобретения, обеспечивает нейропротекторный эффект в отношении нейронов, окончания которых подходят к голубому пятну - области, которая в первую очередь поражается болезнью Альцгеймера. Таким образом, применение бримонидина будет полезным при предотвращении гибели нейронов при таких нейродегенеративных состояниях, как болезнь Альцгеймера и болезнь Паркинсона.
Связь глаукомы с болезнью Альцгеймера
Не желая ограничиваться теорией, авторы изобретения представляют гипотезу, объясняющую эффективность бримонидина как нейропротектора при болезни Альцгеймера и болезни Паркинсона.
По данным последних исследований, при болезни Альцгеймера (БА) происходит гибель ганглионарных клеток сетчатки (ГКС) и их аксонов. Амилоидные β-пептиды и фосфорелированный тау-протеин играют роль в очаговой гибели нейронов и накопления белка при БА. В погибших при глаукоме ГКС такой белок отсутствует. Механизмом гибели нейронов при БА и при глаукоме является апоптоз, хотя пути передачи сигнала для деградации нейронов при этих состояниях различны. При БА происходит гибель норадренергических нейронов голубого пятна, аксоны которых оканчиваются в различных отделах мозга. Это приводит к очаговому снижению концентрации норадреналина (НА) и нейрональных альфа-2 рецепторов. Активация альфа-2 рецепторов подавляет нейрональный апоптоз посредством механизмов передачи сигнала, опосредованных протеинкиназой В. Снижение иннервации НА может способствовать нейрональному апоптозу как при БА, так и при глаукоме. Агонисты альфа-2 рецепторов адреналина обладают способностью замедлять процесс гибели нейронов при обоих состояниях благодаря компенсированию снижения иннервации НА.
Нейродегенеративные заболевания чаще приводят к инвалидизации, чем к смерти больного. Их длительное и прогрессирующее течение имеет большое социально-экономическое значение в нашем обществе, что во многом объясняется числом специалистов, участвующих в лечении таких больных. Глаукома соответствует критериям типичного нейродегенеративного заболевания. При этом заболевании происходит постепенная и прогрессирующая гибель ганглионарных клеток сетчатки (ГКС), часто сопровождающаяся повышением внутриглазного давления (ВГД). Гибель нейронов при глаукоме не ограничивается только областью сетчатки и может захватывать латеральное коленчатое ядро и даже зрительную кору. Патогенез нейродегенерации при глаукоме до конца не ясен. Существуют данные о снижении скорости аксонального транспорта белков в ГКС вследствие компрессии аксонов зрительного нерва на уровне решетчатой пластинки. Трофические факторы (например, мозговой нейротрофический фактор - МНТФ) посредством ретроградного транспорта поступают из окончаний аксонов ГКС в тела нейронов, что является необходимым условием жизнедеятельности ГКС. Сдавление или разрушение аксонов ГКС может снижать концентрацию трофических факторов, вызывая гибель ГКС вследствие их недостаточного питания. В других исследованиях установлено, что возможными факторами, способствующими гибели нейронов при глаукоме, являются локальная ишемия (гипоксия), активация рецепторов глутамата, усиленное образование окислительных радикалов под действием оксида азота, активация рецепторов иммунной системы.
Связь глаукомы и болезни Альцгеймера (БА)
Как и при глаукоме, возможными факторами, способствующими гибели нейронов при БА, являются трофическая недостаточность, повреждающий эффект свободных радикалов, гипоксия и иммунные механизмы. Главным образом при БА страдают нейроны коры, гиппокампа, септальной и таламической областей, а также ствола мозга, но может наблюдаться и гибель ГКС. Гистологические исследования сетчатки и зрительных нервов свидетельствуют об атрофии и гибели ГКС и их аксонов. По данным ряда исследований, потеря аксонов зрительного нерва у больных БА становится значимой при среднем числе аксонов 68/1000 мкм2, что составляет меньше половины от нормального показателя (116/1000 мкм2). Значение имеет и размер аксона: как при БА, так и при глаукоме главным образом страдают крупные аксоны. В других исследованиях зрительных нервов при БА не было обнаружено признаков дегенерации аксонов ГКС. Различные результаты этих исследований трудно адекватно оценить из-за небольшого числа больных и малого размера контрольной группы (7 и 10 человек); степень прогрессирования БА в этих исследованиях не была стандартизирована и, вероятнее всего, различалась; кроме того, различались и способы гистологической оценки и подсчета аксонов. Исследования отличались и по способам прижизненного измерения толщины волокон и деформации нейрональных окончаний у больных БА. Результаты варьировали от полного отсутствия глаукоматозных изменений до выраженных изменений, степень которых коррелировала с уровнем когнитивных нарушений. Наиболее убедительное доказательство наличия связи между БА и глаукомой было получено в крупном исследовании, проведенном Bayer и соавт. Авторы показали, что приблизительно у 26% больных БА (n=112) имелись глаукоматозные изменения сетчатки, в частности сужение полей зрения и деформация нейронов, а в контрольной группе (n=116) аналогичные изменения наблюдались лишь в 5% случаев.
Нейрофибриллярные клубочки (НФК) и амилоидные бляшки являются патологическими признаками нейродегенерации при БА. Белок-предшественник амилоида (БПА) является мембранным протеином, который при расщеплении альфа-секретазой и гидролазой бета-амилоида (ГБА) образует пептиды sAPPα и Aβ1-40. Основным производным БПА в большинстве клеток является sAPPα. Более крупная форма Аβ-пептида - Аβ1-42 - склонна к агрегации и является основным компонентом ядра амилоидных бляшек. Нарушение процессов модификации и деградации БПА, вероятно, способствует повышению концентрации Аβ1-42 пептида при БА. Пептид Аβ1-42 токсичен для клеток в культуре и, возможно, вызывает гибель нейронов при БА. Генетическими исследованиями установлено, что мутации БПА являются вероятным пусковым фактором в патогенезе БА. Другие гены (например, презенилин 1 и 2 - PS 1/2 или аполипопротеин Е (АПО-Е) также способствуют прогрессированию БА за счет повышения уровня белка Аβ.
Основным компонентом НФК является тау-протеин (белок, связанный с микротрубочками). При БА происходит накопление тау-протеина высокой степени фосфорелирования, который образует агрегаты в филаментах тела нейрона. Фосфорелированный тау-протеин, по-видимому, обладает низкой способностью связываться с микротрубочками и образует агрегаты с белками нейрофиламентов, что приводит к образованию НФК. Фосфорелированный тау-протеин вероятно играет решающую роль в токсическом действии Аβ, и пептид Аβ1-42, возможно, способствует агрегации тау-протеина и гиперфосфорелированию тау-протеинкиназой II. Оба белка, пептид Аβ1-42 и фосфорелированный тау-протеин, таким образом, способствуют образованию другого продукта, обладающего нейротоксичным действием.
По данным исследований, в сетчатке при возрастной атрофии, пигментной ретинопатии и возрастной дегенерации желтого пятна отмечается некоторое повышение иммунореактивности в отношении тау-протеина, БПА и Аβ-пептида. Эти сдвиги не сопровождаются формированием НФК или амилоидных бляшек. Аналогичным образом, иммуноцитохимическое повышение иммунореактивности в отношении БПА в ГКС было отмечено в исследовании с моделированием внутриглазной гипертензии у крысы. При иммуноблоттинге сетчатки крыс с внутриглазной гипертензией было обнаружено, что повышенная иммунореактивность сопровождается снижением длины БПА и увеличением фрагментов, содержащих Аβ. Было высказано предположение о том, что компрессия аксонов ГКС при глаукоме способствует развитию аномальных белков нейрофиламентов и повреждению нейронов, вызванному Aβ-пептидом. Несмотря на аномалии БПА, Аβ-пептида и тау-протеина при моделировании глаукомы у крыс и при других заболеваниях сетчатки, потеря аксонов зрительного нерва и дегенерация ГКС при БА не приводит к формированию НФК или амилоидных бляшек. Таким образом, остается неясным, является ли дегенерация ГКС при БА результатом аномалий БПА или тау-белка, которые, по-видимому, лежат в основе гибели нейронов центральной нервной системы при БА.
Апоптоз как возможный механизм гибели нейронов при глаукоме и БА.
Процесс гибели клетки, называемый апоптозом, по-видимому, вносит вклад в гибель нейронов при глаукоме и БА.
Апоптоз - это процесс постепенного разрушения клетки, который заключается в уменьшении объема ядра и цитоплазмы за счет расщепления нуклеиновых кислот и белков цитоскелета эндонуклеазами и протеазами. Несмотря на то, что результаты проведенных исследований свидетельствуют о роли апоптоза в процессе гибели нейронов при глаукоме или БА, ряд авторов оспаривали этот тезис. Различие во взглядах во многом объясняется различными морфологическими критериями апоптоза и/или различной интерпретацией результатов расщепления ядерной ДНК по данным исследования с маркировкой концевых участков деоксиуридин трифосфатом с помощью деоксинуклеотидил трансферазы (TUNEL-способа). Разрушение ядра при апоптозе трудно идентифицировать при микроскопическом исследовании вследствие сморщивания и разрушения пораженных нейронов. Процесс разрушения занимает около 24 часов в культуре клеток и несколько дней в нативной нервной ткани. Таким образом, у больных с длительно текущими заболеваниями при одномоментном исследовании лишь небольшое число нейронов содержит признаки апоптоза.
Для выявления расщепления ядерной ДНК как маркера апоптозной деградации можно использовать электрофорез ДНК в геле или электрофорез в переменном поле. Эти способы позволяют оценить состояние ДНК в гомогенизированных образцах тканей. При этом необходимо, чтобы в образцах содержалось 105 и более клеток в стадии апоптоза. С учетом длительного течения БА или глаукомы каждый день лишь небольшое число нейронов будет содержать разрушающиеся ядра, т.е. в гомогенизате ткани мозга или сетчатки фрагментированная ДНК будет присутствовать в недостаточном количестве. Маркировка 3'-конца ДНК с помощью d-UTP, соединенного с флуорохромом применяется для выявления признаков фрагментации ДНК in situ в срезах тканей или в образцах мозга и сетчатки, полученных при патологоанатомическом исследовании. Ядра ГКС, визуализируемые при TUNEL-исследовании, обнаруживаются в сетчатке человека при глаукоме, а также при моделировании глаукомы у животных. Небольшой процент ядер, визуализируемых при TUNEL-исследовании, по-видимому, объясняется постепенной гибелью ГКС при глаукоме. Количество TUNEL-положительных нейронов при БА варьирует по данным различных исследований: некоторые авторы обнаруживали большое число таких нейронов при БА, другие не отмечали увеличения их процентного содержания по сравнению с контрольной группой больных, соответствующих опытной группе по возрасту. Кроме того, в ряде работ обнаруживался необычно высокий уровень TUNEL-положительных нейронов в головном мозге больных БА, например, в коре головного мозга до 25% нейронов визулизировались при TUNEL-исследовании.
Различные результаты TUNEL-исследования при БА вероятно объясняются методологическими трудностями в процессе маркировки ДНК, особенно при работе с образцами нервной ткани, полученными при патологоанатомическом исследовании: 1) помимо эндонуклеаз, повреждение ДНК вызывают кислородные радикалы, что также может давать положительное окрашивание при TUNEL-исследовании; 2) ложноположительные результаты могут быть следствием слишком длительной или недостаточной фиксации тканей; 3) клетки, входящие в фазу митоза, могут окрашиваться положительно; 4) характер расщепления ДНК зависит от типа эндонуклеаз, что заметно отражается на результатах исследования; 5) результаты TUNEL-исследования зависят от концентрации бивалентных катионов (например, Mg2+ или Со2+). Таким образом, несмотря на то, что TUNEL-исследование применяется для выявления признаков апоптоза, его результаты необходимо оценивать с осторожностью. TUNEL-исследование ДНК может применяться в комбинации с другими маркерами гибели клеток (в частности, с красителями, обладающими сродством к ДНК и позволяющими визуализировать конденсацию хроматина, а также с иммуноцитохимическими способами выявления белков, являющихся маркерами распада клеток.
Процессы передачи сигнала при апоптозе у больных глаукомой и БА
Процессы передачи сигнала при апоптозе могут быть условно разделены на три этапа: 1) премитохондриальный этап, 2) митохондриальный этап и 3) постмитохондриальный этап (этап разрушени