Способ создания модели для оценки жизнеспособности трахеи и щитовидной железы после периода аноксии и реперфузии
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к экспериментальной хирургии. Выделяют тиреотрахеальный комплекс с питающими сосудами, прекращают кровоснабжение на участке тиреотрахеального комплекса с последующим восстановлением кровотока и оценкой изменений в органе. При этом выделяют тиреотрахеальный комплекс с прилежащими сосудами, производят иссечение участка левой сонной артерии краниально выше отхождения щитовидной артерии, каудально - на уровне 8 полукольца трахеи, протезируют дефект левой сонной артерии сосудистым протезом с последующим пуском кровотока, пережимают правую сонную артерию краниально выше отхождения щитовидной артерии, каудально на уровне 8 полукольца трахеи, пересекают трахею краниально на уровне перстнетрахеальной мембраны, каудально между 8 и 9 хрящевыми полукольцами, выполняют латерализацию правой голосовой складки, накладывают перстнетрахеальный и трахеотрахеальный анастомозы, отжимают правую сонную артерию, иссекают сосудистый протез слева, накладывают анастомоз между иссеченным участком левой сонной артерии и центральным концом оставшейся левой сонной артерии. Способ позволяет более адекватно оценить жизнеспособность трахеи и щитовидной железы после периода аноксии и реперфузии с минимальной травмой для животного. 5 ил.
Реферат
Изобретение относится к области экспериментальных исследований в хирургии, в частности к способу создания модели для оценки жизнеспособности трахеи и щитовидной железы после периода аноксии и реперфузии на модели крупных лабораторных животных.
Замещение протяженных участков трахеи при ее поражении в настоящее время представляет собой трудную задачу в хирургии. Использование синтетических, полусинтетических и биологических протезов приводит к высокой частоте послеоперационных осложнений и летальности, в связи с чем их применение в клинике не может быть рекомендовано. Перспективным представляется использование трахеи с сохраненными источниками кровоснабжения и кровооттока, однако, по данным литературы, экспериментальных данных недостаточно для внедрения этого метода в клиническую практику. С целью решения базисных вопросов трансплантации, в частности связанных с устойчивостью структур органа к аноксии и реперфузии, предложена модель для оценки возможности пересадки тиреотрахеального комплекса после периода аноксии и реперфузии.
В экспериментальной хирургии при исследовании жизнеспособности тиреотрахеального трансплантата после периода аноксии и реперфузии известен способ создания модели Genden и соавт. (Genden ЕМ, Gannon PJ, Smith S, Keck N, Deftereos M, Urken ML. Microvascular transfer of long tracheal autograft segments in the canine model. Laryngoscope. 2002 Mar; 112(3):439-44), когда выделяется участок трахеи с питающими сосудами и иссекается с сохранением одной щитовидной артерии, участка внутренней яремной вены и паратрахеальной клетчатки, из паратрахеальной клетчатки выделяются и сохраняются возвратные гортанные нервы, после чего участок трахеи извлекается из организма экспериментального животного и помещается в охлажденный раствор Рингера на необходимый срок в соответствии с задачей эксперимента. По окончанию срока ишемии выполняется имплантация трансплантата реципиенту путем наложения двух трахеотрахеальных анастомозов, имплантации одной щитовидной артерии в сонную артерию, наложения венозного анастомоза.
Однако известный способ не позволяет адекватно оценить аноксические и реперфузионные повреждения тиреотрахеального трансплантата, так как:
1. сохраняется только один из двух источников кровоснабжения трахеи;
2. возможно нарушение анастомотической сосудистой сети стенки исследуемого участка трахеи в процессе выделения возвратных гортанных нервов;
3. тиреотрахеальный трансплантат извлекается из организма подопытного животного и в течение периода аноксии выдерживается в условиях, отличных от условий организма, что противоречит цели эксперимента - определению устойчивости органа к тепловой аноксии;
4. извлечение участка трахеи из организма повышает риск инфицирования операционной области.
Задачей изобретения является создание более адекватной модели для исследования аноксических и реперфузионных повреждений тиреотрахеального трансплантата, снижение травматизма операции за счет отсутствия венозных анастомозов.
Поставленная цель достигается тем, что в способе создания модели для исследования аноксических и реперфузионных повреждений тиреотрахеального комплекса выделяют тиреотрахеальный комплекс с прилежащими сосудами, производят иссечение участка левой сонной артерии краниально выше отхождения щитовидной артерии, каудально - на уровне 8 полукольца трахеи, протезируют дефект левой сонной артерии сосудистым протезом с последующим пуском кровотока, пережимают правую сонную артерию краниально выше отхождения щитовидной артерии, каудально на уровне 8 полукольца трахеи, пересекают трахею краниально на уровне перстнетрахеальной мембраны, каудально между 8 и 9 хрящевыми полукольцами, выполняют латерализацию правой голосовой складки, накладывают перстнетрахеальный и трахеотрахеальный анастомозы, отжимают правую сонную артерию, иссекают сосудистый протез слева, накладывают анастомоз между иссеченным участком левой сонной артерии и центральным концом оставшейся левой сонной артерии.
Предложенный способ и признаки, отличающие его от известных в медицинской и патентной литературе, не обнаружены, что позволяет сделать вывод о соответствии его критерию "новизна".
Практически способ осуществляется следующим образом: создают доступ путем полной срединной цервикотомии, отводят кнаружи прямые мышцы шеи, выделяют непарную щитовидную вену, сонные артерии, комплекс трахея-щитовидные железы-сосуды отделяют на всем протяжении от прилежащих анатомических структур, сохраняют паратрахеальную клетчатку, пережимают и пересекают левую общую сонную артерию на уровне 8 полукольца трахеи и на уровне средней трети щитовидного хряща краниальнее отхождения щитовидной артерии, замещают дефект левой сонной артерии сосудистым протезом с пуском кровотока по нему, перевязывают краниальный конец иссеченного участка левой сонной артерии, временно пережимают его каудальный конец, пережимают правую общую сонную артерию на уровне 8 полукольца трахеи и выше отхождения правой щитовидной артерии, пересекают трахею на уровне перстнетрахеальной мембраны и между 8 и 9 полукольцами, пережимают щитовидные вены. Именно прекращение кровоснабжения щитовидной железы и участка трахеи путем выключения из кровотока участков сонных артерий выше и ниже отхождения щитовидных артерий позволяет начать заданный период аноксии, протезирование одной из сонных артерий позволяет избежать осложнений, связанных с ишемией головного мозга. Тщательное выделение трахеи с прилежащими сосудами и щитовидной железой необходимо для сохранения паратрахеальной клетчатки, в которой локализуется анастомотическая сеть трахеи. При этом высока вероятность повреждения возвратных гортанных нервов, поэтому с целью профилактики нарушения дыхания вследствие пареза голосовых складок выполняют латерализацию правой голосовой складки лигатурным методом. Пережатие щитовидных вен позволяет избежать ретроградного тока крови в стенке трахеи.
Проводят заданный период аноксии, по завершению которого восстанавливают целостность дыхательной трубки наложением перстнетрахеального и трахеотрахеального анастомозов, производят реперфузию путем отжатия и пуска кровотока правой сонной артерии, щитовидных вен. Затем пережимают левую сонную артерию выше и ниже сосудистого протеза, иссекают протез, перевязывают краниальную культю левой сонной артерии, сопоставляют и сшивают каудальную культю левой сонной артерии с каудальным концом ее ранее иссеченного участка, производят пуск кровотока в левую сонную артерию, а через нее - в левую щитовидную артерию, дренируют и послойно ушивают операционную рану. Последствия реперфузионного синдрома после заданного периода аноксии оцениваются через неделю после проведенной операции. Для этого выполняется эвтаназия лабораторного животного в соответствии с действующими правилами и международными требованиями по защите животных. Производится забор тиреотрахеального комплекса с последующей макроскопической оценкой и микроскопическим исследованием ткани стенки трахеи и щитовидной железы.
Предлагаемый способ реализован в представленном примере.
Эксперимент.
Объект - беспородная собака, кобель, ≈1,5 лет, массой 24 кг.
Премедикация - атропин сульфат 0,7 мг внутримышечно, рометар 40 мг внутримышечно, реланиум 5 мг внутримышечно.
Фиксация животного на операционном столе в положении лежа на спине, катетеризация периферической вены.
Вводный наркоз - кетамин 25 мг внутривенно.
Оротрахеальная интубация, искусственная вентиляция легких.
Подготовка зоны операции - бритье, обработка йодонатом.
Базисный наркоз - кетамин, фентанил, дроперидол.
Протокол операции
15.12.05 г. Продольный разрез по средней линии шеи. Выделены и отведены латерально прямые мышцы шеи. На передней стенке трахеи между медиальными краями грудино-подъязычных мышц определяется непарная щитовидная вена, по своему ходу она получает мышечные ветви на всем протяжении. После электрокоагуляции и лигирования мышечные ветви пересечены. Вышеуказанные мышцы разведены латерально. Выделены общие сонные артерии без нарушения контакта со стенкой трахеи. Тупым путем и с использованием электрокоагуляции трахея с прилежащими общими сонными артериями отделена от пищевода. Комплекс трахея-щитовидные железы-сосуды отделен на всем протяжении от прилежащих анатомических структур.
После пережатия пересечена левая общая сонная артерия на уровне 8 полукольца трахеи и на уровне средней трети щитовидного хряща гортани (выше отхождения щитовидной артерии). Образовавшийся дефект левой сонной артерии замещен сосудистым протезом №6, пущен кровоток - пульсация сосуда удовлетворительная. Краниальный конец культи иссеченной сонной артерии прошит и перевязан, каудальный временно пережат сосудистым зажимом.
Пережата правая общая сонная артерия на уровне 8 полукольца трахеи и на уровне средней трети щитовидного хряща гортани (выше отхождения щитовидной артерии).
Рассечена трахея краниально - на уровне перстнетрахеальной мембраны, каудально - между 8 и 9 полукольцами трахеи.
Начат период аноксии.
С целью профилактики послеоперационного пареза голосовых складок выполнена их латерализация по Лихтенбергу (методика адаптирована к условиям эксперимента).
Период аноксии трансплантата - 6 часов.
По окончанию периода аноксии сняты зажимы с правой сонной артерии, пульсация удовлетворительная. Начат период реперфузии. Выполнено два трахеальных анастомоза следующим образом: мембранозная часть ушита непрерывным викриловым швом, хрящевая часть - отдельными узловыми викриловыми швами. Герметизм анастомозов проверен под уровнем жидкости - просачивания воздуха нет. Иссечен сосудистый протез. Краниальный конец левой общей сонной артерии прошит и перевязан. Выполнен анастомоз каудальной культи с иссеченным отрезком левой общей сонной артерии. Пуск кровотока - пульсация удовлетворительная. При осмотре через операционную рану отмечается гиперемия перитрахеальной клетчатки. Пересечена одна из веточек непарной щитовидной вены в области трахеального аутотрансплантата, отмечено поступление крови.
Операционная рана ушита послойно с оставлением дренажа в ретротрахеальном пространстве.
Наблюдение. В послеоперационном периоде проводилась антибактериальная, анальгетическая терапия. 18.12.05 г. дренаж удален.
С 19.12.05 г. отмечается стридорозное дыхание.
Реперфузия трансплантата - 7 суток (15.12.05 - 22.12.05).
22.12.05 г. Под наркозом на самостоятельном дыхании сняты швы, разведена послеоперационная рана. При ревизии анастомозы трахеи и сосудистые анастомозы состоятельны. Пульсация сонных и щитовидных артерий хорошо определяется. На участке трахеи, подвергшемся ишемии, перитрахеальная клетчатка инфильтрирована, отечна, кровоточива. В инфильтрат вовлечены прилегающие сосуды и щитовидные железы. Пересечена трахея на уровне грудного отдела и гортань на уровне нижней трети щитовидного хряща. Эвтаназия животного внутривенным введением ардуана 4 мг на фоне тотальной внутривенной анестезии.
Макроскопическая оценка препарата: ригидность хрящевых полуколец на уровне трансплантата снижена, отмечается сужение просвета трахеи. Слизистая тусклая. На мембранозной части разрастание грануляционной ткани. Взят материал для гистологического исследования - нативная трахея (контроль) - 1.1, трахея ишемизированной области (опыт) - 2.1, участок щитовидной железы - 2.2.
При гистологическом исследовании: 1.1 - эпителий сохранен, частично отсутствуют реснички, умеренное воспаление, хрящ не изменен; 2.1 - очаги однорядного эпителия, выраженная лейкоцитарная инфильтрация всей стенки трахеи, в наружном слое - организация фибрина, формирование рубцово-грануляционной ткани с воспалительной инфильтрацией, хрящ не изменен; 2.2 - отек стромы железы, полнокровие сосудов, вокруг железы - организация фибрина с лейкоцитарной инфильтрацией. В сохранившемся эпителии - набухание фолликулов. В сосудах - набухание эндотелия, местами - слущивание в просвет.
Анализ полученного результата: после 6-часового периода аноксии с последующей реперфузией в тиреотрахеальном аутотрансплантате отмечаются дистрофические и воспалительные изменения, что подтверждено гистологическим исследованием. Отсутствие тромбоза сонных и щитовидных сосудов указывает на то, что обозначенные изменения произошли вследствие аноксического повреждения в соответствии с обозначенными условиями, а не вторичного тромбоза питающей трансплантат сосудистой ножки в послеоперационном периоде. Локальность изменений в зоне вмешательства при удовлетворительном состоянии нативной трахеи исключает инфекцию как доминирующую причину выявленных изменений. Удовлетворительное состояние хряща как в опытном, так и в контрольном участках трахеи может указывать на относительную устойчивость хрящевой ткани к ишемии, что, по-видимому, обусловлено низким уровнем метаболических процессов в ней.
Таким образом, предлагаемый способ позволяет создать более адекватную модель для исследования таких повреждающих факторов как аноксия и реперфузия на тиреотрахеальный трансплантат, что позволит решить вопросы об очередности изъятия органа в условиях мультиорганного забора и возможности использования органного комплекса от трупного донора.
Выполнение способа поясняется чертежами.
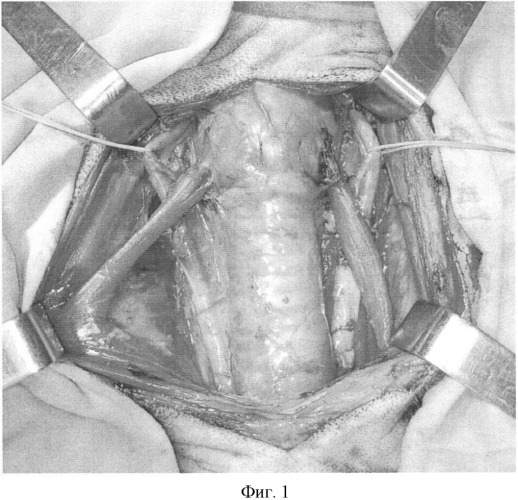
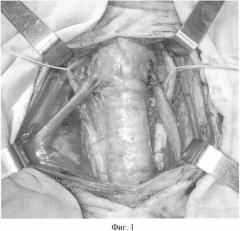
Фиг.1. Выделен тиреотрахеальный комплекс с прилежащими сосудами.
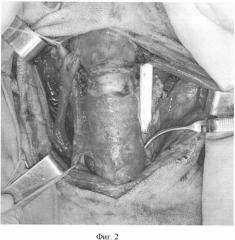
Фиг.2. Иссечен и протезирован участок левой сонной артерии, пережат участок правой сонной артерии.
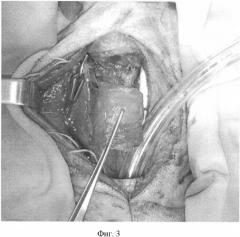
Фиг.3. Пересечена трахея на уровне перстнетрахеальной мембраны и между 8 и 9 хрящевыми полукольцами.
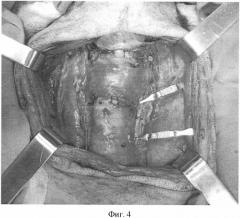
Фиг.4. Реперфузия тиреотрахеального комплекса путем пуска кровотока правой сонной артерии, наложены ларинготрахеальный и трахеотрахеальный анастомозы, иссечен сосудистый протез, наложен анастомоз между иссеченным участком левой сонной артерии и центральным концом оставшейся левой сонной артерии.
Фиг.5. Макроскопическая оценка тиреотрахеальных комплексов после трех- и шестичасового периодов аноксии с последующей реперфузией.
Способ создания модели для оценки жизнеспособности трахеи и щитовидной железы после периода аноксии и реперфузии, включающий выделение тиреотрахеального комплекса с питающими сосудами, прекращение кровоснабжения на участке тиреотрахеального комплекса с последующим восстановлением кровотока и оценкой изменений в органе, отличающийся тем, что выделяют тиреотрахеальный комплекс с прилежащими сосудами, производят иссечение участка левой сонной артерии краниально выше отхождения щитовидной артерии, каудально - на уровне 8 полукольца трахеи, протезируют дефект левой сонной артерии сосудистым протезом с последующим пуском кровотока, пережимают правую сонную артерию краниально выше отхождения щитовидной артерии, каудально на уровне 8 полукольца трахеи, пересекают трахею краниально на уровне перстнетрахеальной мембраны, каудально между 8 и 9 хрящевыми полукольцами, выполняют латерализацию правой голосовой складки, накладывают перстнетрахеальный и трахеотрахеальный анастомозы, отжимают правую сонную артерию, иссекают сосудистый протез слева, накладывают анастомоз между иссеченным участком левой сонной артерии и центральным концом оставшейся левой сонной артерии.