Имплантаты с fk506
Иллюстрации
Показать всеИзобретение относится к медицине, конкретно к имплантатам, в частности, внутрикавернозным или интраваскулярным имплантатам, предпочтительно для лечения или профилактики коронарных или периферических сужений или закупорок сосудов, в частности, сужений, или, соответственно, стенозов или рестенозов, предпочтительно для профилактики рестеноза, которые в химически ковалентно или нековалентно связанной или физически фиксированной форме содержат FK506, к способу их получения и их применению. Применение имплантатов приводит у уменьшению очагов воспаления. 6 н. и 46 з.п. ф-лы, 7 ил., 10 табл.
Реферат
Изобретение относится к имплантатам, в частности, внутрикавернозным или интраваскулярным имплантатам, предпочтительно для лечения или профилактики коронарных или периферических закупорок сосудов или сужений сосудов, в особенности сужений, соответственно, стенозов или рестенозов, предпочтительно для профилактики рестеноза, которые содержат FK506 в химически ковалентно или нековалентно связанной или физически фиксированной форме, к способу их получения и их применению.
Возникновение артериосклеротических патологических изменений в артериальных кровеносных сосудах является заболеванием, лежащим в основе широкого круга клинических симптомов, которые простираются от стенокардии через синдром Шарко вплоть до инфаркта миокарда и ишемического инсульта, всех, базирующихся на атеромном образовании и/или вызванных стенозом повреждениях. Понятие "вызванные стенозом повреждения" означает локальное уменьшение просвета сосуда до менее чем 60-70 % его нормального диаметра, что в свою очередь приводит к отчетливому снижению снабжения соответствующей ткани кислородом и питательными веществами. Хотя фармакотерапия (статин, ингибиторы ангиотензинконвертирующих ферментов, блокаторы gpIIa/IIIb и активаторы плазминогена), в частности, в области сердечно-сосудистых заболеваний, в течение последних десятилетий показала хорошие терапевтические успехи, все еще необходимы хирургические вмешательства (операции шунтирования и т.д.) в случае многих пациентов, у которых обнаружена полная ишемическая картина болезни. Впрочем, эти операции являются относительно сложными и дорогостоящими и они связаны с риском тяжелых осложнений.
Для предотвращения возникновения ишемических болезней сердца разработаны минимально инвазивные хирургические способы. Изобретение чрескожной внутрипросветной ангиопластики венечных сосудов сердца (Percutaneous Transluminal Coronary Angioplasty (РТСА)) в конце 70-х годов явилось большим прорывом в кардиологии. В случае РТСА используют надувные баллоны, которые продвигают вплоть до вызванного стенозом повреждения в коронарных артериях. Эти баллоны затем надувают в соответствующих заданных положениях и достигают расширения стенозированной области. Подобный способ действия можно применять также в случае дилатации каротидных или периферических артерий.
Несмотря на это, относительно скоро было установлено, что у относительно большого числа подвергнутых РТСА пациентов в местах, которые были расширены с помощью баллонного катетера, развился повторный стеноз. При этом было обнаружено, что этот так называемый рестеноз возникает за счет новообразования васкулярной "архитектуры" тканевых слоев. Изобретение трубчатых васкулярных металлических имплантатов, так называемых стентов, улучшает ситуацию в случае внутрипросветной обработки стеноза. При клинических исследованиях (Serruys и др., N. Engl. J. Med., 331, 489-495 (1994)) было обнаружено, что применением стентов в расширенных с помощью баллона местах можно уменьшать появление рестеноза от примерно 45% до примерно 30%. Хотя это нужно рассматривать уже как значительное улучшение в случае предотвращения остаточного рестеноза, все еще имеется отчетливое стремление к терапевтическим улучшениям. При детализированных исследованиях патофизиологии рестеноза в случае стента обнаружено, что он отличается от индуцированного РТСА рестеноза. Воспалительные реакции, гиперпролиферация и иммиграция гладкомышечных клеток (smooth muscle cells (SMCs)) являются важными факторами образования неоинтимы, которые приводят к рестенозу в случае стента. В случае животной модели рестеноза и даже в случае человеческой ткани установлено, что гиперпролиферация SMCs сопровождается инфильтрацией ткани около креплений стента за счет макрофагов и Т-клеток (Grewe и др., J. Am. Coll. Cardiol., 35, 157-163 (2000)). По аналогии с другими клиническими показаниями, в случае которых играют роль воспалительные реакции и гиперпролиферация клеток и которые можно контролировать путем медикаментозной обработки, также пытались лечить рестеноз путем фармакотерапии. Выбранные биологически активные вещества вводили либо перорально или внутривенно, либо с помощью перфорированного катетера в место действия. К сожалению, вплоть до настоящего времени ни одно из этих биологически активных веществ решающим образом не смогло уменьшить рестеноз (Gruberg и др., Exp. Opin. Invest. Drugs, 9, 2555-2578 (2000)).
Прямое выделение фармакологически активных веществ покрытыми биологически активным веществом стентами в данном случае представляет собой выбранный метод. Опыты на животных и первые результаты клинических испытаний покрытых биологически активным веществом стентов производят впечатление, что замедленное высвобождение иммуносупрессивных или антипролиферативных биологически активных веществ может снижать риск рестеноза. Паклитаксел, цитостатическое биологически активное вещество, и рапамицин, иммуносупрессивное и цитостатическое биологически активное вещество тестировали в опытах на животных. Оба соединения ингибируют образование неоинтимы (Herdeg и др., Semin Intervent Cardiol., 3, 197-199 (1998); Hunter и др., Adv. Drug. Delivery Rev., 26, 199-207 (1997); Burke и др., J. Cardiovasc. Pharmacol., 33, 829-835 (1999); Gallo и др., Circulation, 99, 2164-2170 (1999)). Несмотря на это, спустя 6 месяцев после имплантации покрытых паклитакселом стентов в случае свиней наблюдали прекращение действия (Heldman, International Local Drug Delivery Meeting and Cardiovascular Course on Radiation, Женева, 25-27 января 2001 г.). Рапамицин показал хорошую эффективность с полным прекращением рестеноза при первых клинических применениях (Sousa и др., Circulation, 103, 192-195 (2001)). С другой стороны, по-видимому, это происходит совместно с замедленным излечением поврежденной за счет баллонной ангиопластики и имплантации стента стенки сосуда.
Вообще говоря, очень важным является равновесие между излечением артериальной стенки сосуда после ангиопластики и имплантации стента, с одной стороны, и сдерживанием образования неоинтимы. Для достижения этого равновесия нужно использовать биологически активные вещества, которые селективно интерферируют со специфическими механизмами, приводящими к образованию неоинтимы.
Поэтому задачей изобретения являлось получение имплантатов с благоприятными свойствами для лечения и профилактики рестеноза.
Объектом изобретения вследствие этого является имплантат, содержащий FK506 в химически ковалентно или нековалентно связанной или физически фиксированной форме, а также, в случае необходимости, по меньшей мере, одно другое биологически активное вещество.
При этом в случае каждого, указанного в рамках настоящего изобретения биологически активного вещества, включая биологически активное вещество FK506, имеет значение то, что понятие "биологически активное вещество" включает также непосредственные производные биологически активного вещества, а также биологически активное вещество во всех его видах, как соли, энантиомеры, рацематы, основания или свободные кислоты, а также их смеси.
Предпочтительно, когда имплантатом является внутрикавернозный, предпочтительно интраваскулярный, имплантат.
При этом под термином "внутрикавернозный" понимают как находящийся внутри полости, в частности, внутри полого органа или полых органов, таких как кровеносные сосуды, пищеводы, мочеточники, желчные протоки, и т.д.
Под термином "интраваскулярный" нужно понимать, в частности, использование в кровеносном сосуде.
Также предпочтительно, когда имплантат пригоден для лечения или профилактики коронарных или периферических сужений или закупорок сосудов, в частности, сужений или стенозов или рестенозов, предпочтительно для профилактики рестеноза.
Поэтому особенно предпочтительным является внутрикавернозный, предпочтительно интраваскулярный, имплантат для лечения или профилактики коронарных или периферических сужений или закупорок сосудов, в частности, сужений или стенозов или рестенозов, предпочтительно для профилактики рестеноза, содержащий FK506 в химически ковалентно или нековалентно связанной или физически фиксированной форме, а также, в случае необходимости, по меньшей мере, одно другое биологически активное вещество.
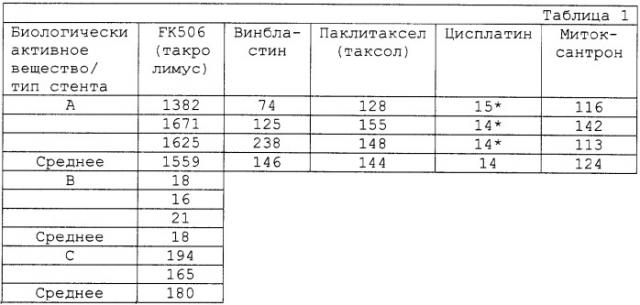
Макролидный антибиотик FK506 (такролимус; [3S-[3R*[E(1S*,3S*,4S*)],4S*,5R*,8S*,9E,12R*,14R*,15S*,16R*,18S*, 19S*,26aR*]]-5,6,8,11,12,13,14,15,16,17,18,19,24,25,25,26,26a-гексадекагидро-5,19-дигидрокси-3-[2-(4-гидрокси-3-метоксициклогексил)-1-метилентенил]-14,16-диметокси-4,10,12,18-тетраметил-8-(2-пропенил)-15,19-эпокси-3Н-пиридо[2,1-c][1,4]оксаазациклотрикозин-1,7,20,21(4Н,23Н)-тетрон; фирма Merck; номер по каталогу 9000) представляет собой созданное для трансплантационной медицины биологически активное вещество. FK506 ингибирует выделение интерлейкина-2 (IL-2) и -интерферона (IFN-) из Т-клеток и при этом блокирует отторжение имплантата (трансплантата) (Wiederrecht и др., Ann. NY Acad. Sci., 696, 9-19 (1993)). FK506 исследовали также в SMC-культурах в отношении ингибирования пролиферации гладкомышечных клеток (Mohacsi и др., J. Heart. Lung Transplant., 16, 484-492 (1997); Marx и др., Circulation Res., 76, 412-417 (1995)) и их миграции (Poon и др., J. Clin. Invest., 98, 2777-2283 (1996)). В общем, FK506 из-за его незначительной потенции различными исследователями был оценен как непригодный для профилактики рестеноза (Mohacsi и др. (1997); Poon и др. (1996); Marx и др. (1995); Dell, Curr. Med. Chem., 5, 179-194 (1998)). Mohacsi и др. обнаружили полумаксимальное ингибирование SMC-пролиферации между 100 нмоль и 1 мкмоль, в то время как Marx и др. при концентрациях вплоть до 123 нмоль не наблюдали никакого эффекта. В противоположность этому, рапамицин при ингибировании пролиферации SMC-культур активен в наномолярной области концентраций.
Исходя из этого уровня техники, использование именно FK506 для торможения рестеноза, казалось вообще не предвещало успеха (Mohacsi и др. (1997); Poon и др. (1996)). Однако, в противоположность мнению специалистов, неожиданно оказалось, что в частности, использование FK506 в качестве части стента, а также других имплантатов очень эффективно при лечении и профилактике рестеноза. Прямое локальное применение FK506 является благоприятным для предотвращения рестеноза и действие очень сбалансировано, так как оно позволяет осуществляться хорошей реэндотелиализации поврежденной стенки сосуда.
Не предполагая этого с самого начала, это, пожалуй, может объясняться иммуномодуляторной активностью FK506, которая проявляется в полумаксимальном ингибировании высвобождения IL-2 при концентрациях около 0,1 нмоль (Kino и др., J. Antibiot., 40, 1256-1265 (1987)) и ингибирующем воздействии на SMC-пролиферацию при концентрациях около 300-500 нмоль. Соответственно, поэтому использование FK506 является благоприятным.
При этом под стенозом понимают закупорку или сужение сосуда и под рестенозом понимают повторное возникновение стеноза.
Далее, в настоящем контексте под термином "содержащий" понимают, в том числе, также, например, нековалентно-связанное покрытие.
Далее, в настоящем контексте термин "периферический" относится к сосудам или другим полым органам вне сердца и венечных сосудов сердца.
Под выражением "химически нековалентно связанный" нужно понимать, в частности, связи за счет взаимодействий, такие как водородные мостики, гидрофобные взаимодействия, ван-дер-Ваальсовы силы и т.д.
Под выражением "физически фиксированный" нужно понимать, например, включение, например, через мембрану в отверстии или стерический захват благодаря выбору размеров отверстий и т.д.
Под имплантатом нужно понимать любую форму искусственного объекта, который вводят (также только ограниченно по времени). В частности, при этом речь идет о внутрикавернозных, например, интраваскулярных, имплантатах. Примерами являются стенты, трансплантаты, стент-трансплантаты, трансплантат-соединители, мандрены, катетерные насосы или катетеры.
Под стентом понимают, в смысле настоящего изобретения, продолговатый, полый внутри имплантат, по меньшей мере, с двумя отверстиями и чаще всего с круглым или эллиптическим, однако, также с любым другим поперечным сечением (чаще всего из металла, однако, в случае необходимости, также из синтетических материалов или полимеров) предпочтительно перфорированной, решеткообразной структуры, который имплантируют в сосуды, в частности, в кровеносные сосуды, чтобы сохранять их открытыми или нормально функционирующими.
Под трансплантатом понимают, в смысле настоящего изобретения, продолговатый, полый внутри имплантат, по меньшей мере, с двумя отверстиями и чаще всего с круглым или эллиптическим, однако, также с любым другим поперечным сечением и, по меньшей мере, с одной гомогенной или, в случае необходимости, тканой из различных жгутов, плотной и непроницаемой для корпускулярных компонентов крови и/или для воды полимерной поверхностью, который служит, в общем, в качестве протеза сосуда и который используют чаще всего в случае поврежденных сосудов или вместо сосудов.
Под стент-трансплантатом понимают, в смысле настоящего изобретения, сочетание стента с трансплантатом. Соответственно, стент-трансплантат по своей сути представляет собой усиленный стентом протез сосуда (трансплантат, см. выше), причем полимерный слой является гомогенным или, в случае необходимости, тканым из различных жгутов, плотным и непроницаемым для корпускулярных компонентов крови и/или для воды. В более узком смысле, это стент, который, по меньшей мере, на 20 % поверхности имплантата обладает одним перфорированным (решеткообразным), предпочтительно металлическим, наружным слоем и, по меньшей мере, одним, находящимся внутри или снаружи этого наружного слоя, гомогенным или, в случае необходимости, тканым из различных жгутов, плотным и непроницаемым для корпускулярных компонентов крови и/или для воды полимерным слоем, а также в случае необходимости (в случае находящегося снаружи перфорированного слоя) другим, находящимся внутри полимерного слоя, перфорированным (решеткообразным), предпочтительно металлическим, внутренним слоем или находящимся снаружи или вне перфорированного слоя гомогенным или, в случае необходимости, тканым из различных жгутов, плотным и непроницаемым для корпускулярных компонентов крови и/или для воды полимерным слоем.
Под трансплантат-соединителем понимают, в смысле настоящего изобретения, имплантат, который связывает, по меньшей мере, два полых органа, сосуда или трансплантата, состоит из предназначенных для трансплантатов или стент-трансплантатов материалов и/или имеет определенную для них структуру и, соответственно, имеет, по меньшей мере, два, предпочтительно три или четыре отверстия, в частности, имеет асимметрическую "Т"-форму.
Под катетером понимают, в смысле настоящего изобретения, трубчатый инструмент для введения в полые органы. В более узком, предпочтительном смысле, имеются направляющие катетеры, катетеры для ангиографии или баллонные катетеры.
Под катетерным насосом понимают, в смысле настоящего изобретения, снабженный на его верхушке пропеллером катетер, который может поддерживать помпаж миокарда.
Существует другой предпочтительный вариант выполнения предлагаемого согласно изобретению имплантата, когда имплантат имеет, по меньшей мере, один(одну), состоящий(щую) из металла или сплава металлов, гомогенный(ную) или образованный(ную) из различных жгутов, плотный(ную) или перфорированный(ную) слой или поверхность.
Под металлом или сплавом металлов, в смысле настоящего изобретения, нужно понимать, в частности, сталь, или стальные сплавы, однако, также никель или никелевые сплавы, причем понятие металл уже с самого начала также охватывает сплавы металлов.
Под термином "перфорированный" нужно понимать, в частности, решеткообразные, тканые или плетеные структуры.
Существует другой предпочтительный вариант выполнения предлагаемого согласно изобретению имплантата, когда имплантат имеет, по меньшей мере, один(одну), состоящий(щую) из полимера, гомогенный(ную) или образованный(ную) из различных жгутов, плотный(ную) или перфорированный(ную) слой или поверхность.
Согласно предпочтительному варианту выполнения имплантат имеет, по меньшей мере, один полимерный слой, который полностью или частично покрывает состоящий(щую) из металла или сплава металлов, гомогенный(ную) или образованный(ную) из различных жгутов, плотный(ную) или перфорированный(ную) слой или поверхность, предпочтительно состоящую из металла или сплава металлов, в случае необходимости, решеткообразную, структуру.
Согласно особенно предпочтительного варианту выполнения имплантат имеет, по меньшей мере, один(одну), состоящий(щую) из металла или сплава металлов, гомогенный(ную) или образованный(ную) из различных жгутов, плотный(ную) или перфорированный(ную) слой или поверхность и, по меньшей мере, один(одну), состоящий(щую) из полимера, гомогенный(ную) или образованный(ную) из различных жгутов, плотный(ную) или перфорированный(ную) слой или поверхность.
При этом особенно предпочтительно, когда в случае этого имплантата состоящий(щая) из металла или сплава металлов слой или поверхность представляет собой состоящую из металла или сплава металлов, в случае необходимости, решеткообразую структуру и/или состоящий(щая) из полимера слой или поверхность является гомогенной плотной или тканой и/или водонепроницаемой и/или корпускулонепроницаемой и/или последовательность слоев или поверхностей снаружи внутрь представляет собой металл-полимер, полимер-металл, металл-полимер-металл или полимер-металл-полимер и/или либо состоящий(щая) из полимера слой или поверхность нехимически (ковалентно или нековалентно) связан (связана) с состоящим(щей) из металла или сплава металлов слоем или поверхностью, либо состоящий(щая) из полимера слой или поверхность посредством клея связан (связана) с состоящим(щей) из металла или сплава металлов слоем или поверхностью.
Далее, предпочтительно, когда применяемый в рамках имплантатов полимер выбирают из дакрона; растяжимого или нерастяжимого политетрафторэтилена (PTFE/тефлон); или полиуретана; предпочтительно из растяжимого или нерастяжимого политетрафторэтилена (PTFE); или полиуретана; в частности, из PTFE.
Также предпочтительным вариантом осуществления изобретения является вариант, когда имплантат представляет собой стент, стент-трансплантат, трансплантат, трансплантат-соединитель, мандрен, катетер или катетерный насос, предпочтительно стент, стент-трансплантат, трансплантат или трансплантат-соединитель, в частности, стент или стент-трансплантат.
Особенно предпочтительно, когда предлагаемый согласно изобретению имплантат покрыт FK506.
Локальное применение FK506 достигается путем прямого выделения из нагруженной биологически активным веществом поверхности коронарного или периферического стента. Нагруженная биологически активным веществом поверхность стента может достигаться путем применения различных технологических приемов. Любой из этих приемов можно осуществлять таким образом, что биологически активное вещество выделяется из поверхности либо за короткий промежуток времени (часы), либо в течение длительного периода времени (дни). Кинетику высвобождения можно приспосабливать тем, что на поверхности производятся специфические модификации, такие как, например, гидрофобные или гидрофильные боковые цепи полимерного носителя или керамическая поверхность. Также эти поверхности, со своей стороны, можно снова модифицировать на поверхности, например, благодаря Si-группам на слое из оксида алюминия.
Кинетику высвобождения можно приспосабливать тем, что используют специфические полимеры, блоксополимеры, смеси полимеров, привитые сополимеры, индивидуально или в виде слоистой структуры. Для регулирования кинетики высвобождения особенно пригодно применение нанокапсул и/или липосом и вышеописанных комбинаций полимеров. Под нанокапсулами понимают, в общем, покрытие оболочкой мицеллярных систем или коллоидальных твердых веществ до получения ультратонких частиц с твердым покрытием. Заключенные в оболочку частицы, размер которых находится в области нанометров, растворяются с образованием коллоидных растворов. Наноинкапсулированные биологически активные вещества таким образом можно использовать с отсроченной эффективностью. Липосомы получают, в общем, из фосфолипидов путем диспергирования в водных средах и в этой связи они представляют интерес, так как гидрофильные биологически активные вещества можно вводить в водный внутренний объем, а также в водные промежуточные слои, а гидрофобные биологически активные вещества можно встраивать в липидные слои. Если используются нанокапсулы и/или липосомы различного состава, то их можно нагружать различными биологически активными веществами и таким образом целенаправленно высвобождать комбинацию биологически активных веществ.
Керамическое покрытие
Покрытие из оксида алюминия (заявки на патенты ФРГ 19855421 и 19910188; Международная заявка WO-00/25841) с пористой поверхностью можно нагружать FK506 в количествах от 10 мкг до 10 мг либо путем окунания, напыления, либо подходящей технологией. Доза биологически активного вещества зависит от рода сосуда-мишени и от состояния пациента и выбирается так, что в достаточной степени ингибируется пролиферация, миграция и ответ Т-клеток, не мешая процессу излечивания. FK506 можно применять в виде водного или органического раствора, например, в диметилсульфоксиде, диметилформамиде и этаноле. После напыления или окунания (в случае необходимости, при слабом вакууме) обработанный стент высушивают и процесс повторяют 2-10 раз. Другая возможность нанесения состоит в прямом нанесении раствора биологически активного вещества на тент-жгуты с помощью микропипетки или автоматического устройства для дозирования. После последней стадии высушивания стент можно промывать в течение одной минуты при комнатной температуре в воде или в изотоническом солевом растворе и затем снова высушивать. Содержание биологически активного вещества после извлечения его с помощью пригодного растворителя определяют стандартными методами (высокоэффективная жидкостная хроматография (HPLC), масс-спектрометрия с жидкостной хроматографией (LC-MS)). Кинетики высвобождения можно измерять при применении стандартной аппаратуры для определения высвобождения. Нанесение керамического покрытия можно комбинировать с нанесением полимерного (в случае необходимости, биоразлагаемого) покрытия.
Впрочем, аналогично можно использовать любой вид покрытий из оксида металла, в частности, например, из оксида иридия, как описывается в патенте США 6245104-В1. Соответственно, любое упоминание оксида алюминия в дальнейшем нужно понимать так, что под ним нужно подразумевать также другие оксиды металлов, как, например, оксид иридия.
Мембрана из политетрафторэтилена (PTFE): стент-трансплантат
В этом случае используют сопоставимый с вышеописанным прием. FK506 вносят в углубления пористой мембраны из PTFE.
Общее полимерное покрытие
Для нагружения биологически активным веществом пригодны различные полимеры: полиметакрилаты, полиуретановые покрытия, PTFE-покрытия, покрытия из гидрогеля. Биологически активное вещество можно либо наносить на конечную поверхность (см. выше), либо добавлять прямо в полимеризационный раствор. В остальных деталях этот технологический прием соответствует уже описанным выше приемам.
Можно использовать различные полимеры, а также их комбинации в виде смесей полимеров, систем со слоистой структурой, блоксополимеров, привитых сополимеров. Пригодными полимерами являются следующие: полиакрилаты и полиметакрилаты, силиконы, как, например, полидиметилсилоксан, сложный полиметиленмалоновый эфир, простые полиэфиры, сложные полиэфиры, биорезорбируемые полимеры, полимеры из виниловых мономеров, как, например, поливинилпирролидон и простые виниловые эфиры, поли-цис-1,4-бутадиен, поли-цис-1,4-изопрен, поли-транс-1,4-изопрен, а также вулканизированные продукты, полиуретаны, поликарбамиды, полиамиды, полиимиды, полисульфоны, а также биополимеры, как, например, целлюлоза и ее производные и протеины и фибриновый клей. Особенно интересные свойства проявляют гидрогели, которые из-за их высокого водопоглощения в качестве самого крайнего наружного (top coat) слоя обладают очень хорошей гемосовместимостью. Согласно настоящему изобретению можно использовать гидрогели, как, например, полиакриламид, полиакриловая кислота, полимеры с атомом кислорода в качестве гетероатома в основной цепи, как, например, полиэтиленоксид, полипропиленоксид, политетрагидрофуран. Биологически активное вещество можно либо наносить на конечную поверхность, либо вводить в нанокапсулы и/или вносить в липосомы. Биологически активное вещество, однако, также может находиться непосредственно в полимеризационном растворе или в растворе полимера. В случае некоторых систем полимер/биологически активное вещество, биологически активное вещество можно иммобилизировать путем набухания.
Механический прием
Механический прием основывается на углублениях, которые создают с помощью лазера на укосинах стента. Эти углубления затем можно заполнять FK506. Механический (углубления) прием можно комбинировать с нанесением полимерного, в случае необходимости, биоразлагаемого покрытия, которое само нагружено биологически активным веществом. После первоначального высвобождения из полимерного покрытия биологически активное вещество может в течение длительного периода времени высвобождаться из заполненных биологически активным веществом углублений. В остальных деталях этот технологический прием соответствует уже описанным выше приемам.
Соответственно, имеется другой предпочтительный вариант выполнения предлагаемого согласно изобретению имплантата, когда имплантат имеет керамическое покрытие, в частности, из оксида алюминия, с которым связан FK506.
Другой предпочтительный вариант выполнения предлагаемого согласно изобретению имплантата представляет собой вариант, когда имплантат обладает полимерным покрытием, в частности, из полиметакрилатов, полиуретана, PTFE, гидрогеля или смеси гидрогель/полиуретан, в частности, из PTFE, с которым связан FK506 или в котором растворен FK506 перед нанесением покрытия.
Имеется другой предпочтительный вариант выполнения предлагаемого согласно изобретению имплантата, когда металл имплантата имеет выполненные с помощью лазера углубления, которые заполнены FK506. При этом особенно благоприятно, когда снабженный заполненными FK506 углублениями металл или, по меньшей мере, углубления покрывают биологически разлагаемым полимерным материалом, причем, в случае необходимости, FK506 связывается с полимерным покрытием или перед полимеризацией покрытия FK506 растворен в полимерном материале.
Согласно другому, очень благоприятному варианту выполнения предлагаемого в изобретении имплантата, имплантат получают способом, при котором
а) используют имеющий, по меньшей мере, один(ну), состоящий(щую) из металла или сплава металлов, гомогенный(ную) или образованный(ную) из различных жгутов, плотный(ную) или перфорированный(ную) слой или поверхность имплантат по любому из п.п. 4, 6 или 7-10, на который наносят керамическое покрытие, в частности, из оксида алюминия; или
b) используют имеющий, по меньшей мере, один(ну), состоящий(щую) из полимера, гомогенный(ную) или образованный(ную) из различных жгутов, плотный(ную) или перфорированный(ную) слой или поверхность имплантат по любому из п.п. 5-10; или
c) используют имплантат по любому из п.п. 1-10, который покрывают с помощью полимерного или полимеризующегося на поверхности покрытия, в частности, из полиметакрилатов, полиуретана, PTFE, гидрогеля или смеси гидрогель/полиуретан; или
d) используют имплантат по любому из п.п. 4, 6 или 7-10, по меньшей мере, с одним(ной), состоящим(щей) из металла или сплава металлов, гомогенным(ной) или образованным(ной) из различных жгутов, плотным(ной) или перфорированным(ной) слоем или поверхностью, в котором(рой) с помощью лазера выполняют углубления, которые заполняют FK506, и затем на имплантат наносят полимерное или полимеризующееся на поверхности биоразлагаемое покрытие;
e) затем имплантат согласно а), b), c) или d) вводят в контакт с раствором FK506 в водном или органическом растворителе, например, путем обрызгивания, напыления или погружения, в случае необходимости, в вакууме;
f) после этого, в случае необходимости, имплантат высушивают, предпочтительно вплоть до удаления растворителя из стадии е);
g) затем, в случае необходимости, повторяют стадию е), в случае необходимости, с последующей стадией f), предпочтительно многократно, в частности, 1-5 раз, а также,
h) после этого, в случае необходимости, имплантат одно- или многократно промывают водой или изотоническим солевым раствором; и
i) затем, в случае необходимости, высушивают.
При этом предпочтительно, когда при изготовлении этого, таким образом получаемого согласно изобретению имплантата на стадии е) FK506 растворяют в спирте, предпочтительно в этаноле, в частности, в концентрации 0,5-5 г/л FK506 в этаноле, и/или на стадии е) имплантат вводят в контакт с раствором FK506 в водном или органическом растворителе, в вакууме, предпочтительно в течение ночи, путем погружения, и/или не осуществляют стадию f) и/или стадию g), и/или в стадии h) имплантат многократно промывают солевым раствором, и/или на стадии i) имплантат высушивают в течение ночи.
Согласно альтернативному, особенно предпочтительному варианту осуществления изобретения предпочтительно, когда при изготовлении этого, получаемого как описано выше согласно изобретению имплантата на стадии е) имплантат, предпочтительно стерильный, вносят в предпочтительно стерильный сосуд с герметизирующейся по окончании перфорации, перфорируемой крышкой, например, в склянку для инъекций, сосуд заполняют раствором FK506, предпочтительно стерильным, закрывают его с помощью герметизирующейся по окончании перфорации, перфорируемой крышки, путем перфорации через крышку вставляют тонкую, предпочтительно стерильную, воздухопроницаемую вентиляционную трубку, например, канюлю, создают вакуум и предпочтительно раствор FK506 перемешивают и затем, предпочтительно по истечении примерно 12 часов, тонкую, предпочтительно стерильную, воздухопроницаемую вентиляционную трубку удаляют, и/или на стадии е) FK506 растворяют в спирте, предпочтительно в этаноле, в частности, в концентрации 3,3 мг FK506 в 1 мл этанола, и/или имплантат вплоть до использования оставляют в предпочтительно стерильном закрытом стеклянном сосуде согласно стадии е), и/или стадии f)-i) не осуществляют.
Согласно другому, очень благоприятному варианту выполнения предлагаемого согласно изобретению имплантата имплантат получают способом, при котором перед образованием, по меньшей мере, одного (одной), состоящего(щей) из полимера, плотного(ной) или перфорированного(ной) слоя или поверхности или полимерного покрытия имплантата FK506 растворяют в полимеризационном материале.
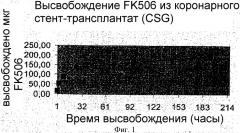
Далее, особенно предпочтительно, когда FK506 высвобождается после имплантации предлагаемого согласно изобретению имплантата. При этом особенно благоприятно, когда высвобождение происходит с задержкой. При этом особенно предпочтительным вариантом осуществления изобретения является вариант, когда FK506 высвобождается из имплантата в течение периода времени 24 часа, предпочтительно 48 часов, в частности, в течение более, чем 96 часов, после имплантации. В особенности также благоприятно, когда FK506 высвобождается из имплантата после имплантации: а) в течение < 48 часов, или b) в течение, по меньшей мере, 48 часов, предпочтительно в течение, по меньшей мере, 7 дней, в частности, в течение, по меньшей мере, 2-21 дней; или с) имплантат проявляет оба вида высвобождения а) и b).
Непосредственно последнего варианта можно достигать тогда, когда выбирают два различных вида покрытия - связывание или физическую фиксацию. Примером являются "запечатанные" с помощью нагруженных FK506 биоразлагаемых мембран углубления, выполненные с помощью лазера, с FK506. После быстрого высвобождения из мембраны происходит длительное высвобождение из углублений.
Следующим предпочтительным вариантом осуществления изобретения является вариант, когда в имплантате содержится, по меньшей мере, одно другое биологически активное вещество, предпочтительно фармацевтическое биологически активное вещество, в частности, другое биологически активное вещество, выбираемое из следующих биологически активных веществ, или их производных:
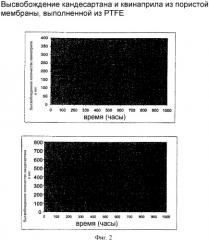
(группа 1): молсидомин, линсидомин, нитропруссид натрия, нитроглицерин или общие доноры NO; стимуляторы растворимой гуанилатциклазы (sGC/растворимая гуанилатциклаза), например, BAY 41-2272 (5-(циклопропил-2-[1-(2-фторбензил)-1Н-пиразоло[3,4-n]пиридин-3-ил]пиримидин-4-иламин); гидралазин; верапамил, дилтиазем, нифедипин, нимодипин или другие блокаторы Са2+-канала; каптоприл, эналаприл, лизиноприл, квинаприл или другие ингибиторы ангиотензинконвертирующих ферментов; лосартан, кандесартан, ирбесартан, валсартан или другие антагонисты ангиотензин II-рецептора;
(группа 2): дексаметазон, бетаметазон, преднизон или другие кортикостероиды; 17-бета-эстрадиол; циклоспорин; микофеноловая кислота; VEGF, активаторы VEGF-рецептора; траниласт; мелоксикам, целебрекс, виокс или другие антагонисты СОХ-2; индометацин, диклофенак, ибупрофен, напроксен или другие ингибиторы СОХ-1; ингибиторы активатора-1 плазминогена или серпинен; ингибиторы тромбина, например, гирудин, гирулог, агратробан, РРАСК или интерлейкин-10;
(группа 3): рапамицин, SDZ RAD (40-О-(2-гидроксиэтил)рапамицин) или другие производные рапамицина; антагонисты PDGF; паклитаксел или 7-гексаноилтаксол; цисплатин; винбластин; митоксантрон; комбретастатин А4; топотекан; метотрексат; флавопиридол;
актиномицин D; реопро/абциксимаб или пробукол.
При этом особенно предпочтительным является то, что, когда другое биологически активное вещество выбирают из группы 1, оно высвобождается из имплантата в течение первых 24-72 часов после имплантации, и/или, когда другое биологически активное вещество выбирают из группы 2, оно высвобождается из имплантата в течение первых 48 часов - 21 дня после имплантации, и/или, когда другое биологически активное вещество выбирают из группы 3, оно высвобождается из имплантата в течение времени от 14 дней до трех месяцев после имплантации.
Следующим объектом изобретения является способ получения предлагаемого согласно изобретению имплантата, при котором перед образованием, по меньшей мере, одного (одной), состоящего(щей) из полимера, плотного(ной) или перфорированного(ной) слоя или поверхности или полимерного покрытия имплантата FK506 растворяют в полимеризационном материале.
Еще одним объектом изобретения является способ получения предлагаемого согласно изобретению имплантата со следующими стадиями:
а) используют имеющий, по меньшей мере, один(ну), состоящий(щую) из металла или сплава металлов, гомогенный(ную) или образованный(ную) из различных жгутов, плотный(ную) или перфорированный(ную) слой или поверхность имплантат по любому из п.п. 4, 6 или 7-10, на который наносят керамическое покрытие, в частности, из оксида алюминия; или
b) используют имеющий, по меньшей мере, один(ну), состоящий(щую) из полимера, гомогенный(ную) или образованный(ную) из различных жгутов, плотный(ную) или перфорированный(ную) слой или поверхность имплантат по любому из п.п. 5-10; или
c) используют имплантат по любому из п.п. 1-10, который покрывают с помощью полимерного или полимеризующегося на поверхности покрытия, в частности, из полиметакрилатов, полиуретана, PTFE, гидрогеля или смеси гидрогель/полиуретан; или
d) используют имплантат по любому из п.п. 4, 6 или 7-10, по меньшей мере, с одним(ной), состоящим(щей) из металла или сплава металлов, гомогенным(ной) или образованным(ной) из различных жгутов, плотным(ной) или перфорированным(ной) слоем или поверхностью, в котором(рой) с помощью лазера выполняют углубления, которые заполняют FK506, и затем на имплантат наносят полимерное или полимеризующееся на поверхности, предпочтительно биоразлагаемое покрытие;
e) затем имплантат согласно а), b), c) или d) вводят в контакт с раствором FK506 в водном или органическом растворителе, например, путем обрызгивания, напыления или погружения, в случае необходимости, в вакууме;
f) после этого, в случае необходимости, имплантат высушивают, предпочтительно вплоть до испарения растворителя из стадии е);
g) затем, в случае необходимости, повторяют стадию е), в случае необходимости, с последующей стадией f), предпочтительно многократно, в