Дозированные формы анестезирующих средств с длительным высвобождением для обезболивания
Иллюстрации
Показать всеИзобретение относится к области фармацеи, а именно к дозированным формам с длительным высвобождением. Раскрыты системы и наборы для доставки лекарственных средств, высвобождающие анестетик кратковременного действия, такой как бупивакаин. Раскрыты также способы введения и приготовления таких систем. Системы доставки лекарственных средств включают кратковременно действующий гелевый носитель и анестезирующее средство, растворенное или диспергированное в гелевом носителе. Гелевый носитель содержит биоэродируемый биологически совместимый полимер со средней молекулярной массой от 3000 до 10000 и несмешивающийся с водой растворитель в количестве, эффективном для пластификации полимера и образования геля с полимером. Одним из способов измерения эффективности системы доставки лекарственных средств является коэффициент эффективности, который для достижения желательного профиля высвобождения может регулироваться, например, составом гелевого носителя. Использование изобретения обеспечивает эффективное обезболивание у субъектов, например, для устранения послеоперационной боли за счет высвобождения заданного количества анестезирующего средства кратковременного действия в оперируемую область в течение продолжительного периода времени. 5 н. и 29 з.п. ф-лы, 15 ил.
Реферат
Настоящая заявка является частичным продолжением патентной заявки США с регистрационным No.10/606969, поданной 25 июня 2003 года и включенной в данное описание посредством ссылки, для которой испрошен приоритет по предварительной заявке США с регистрационным No. 60/391867, поданной 25 июня 2002 года и включенной в данное описание посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к дозированным формам с длительным высвобождением и наборам, содержащим анестезирующее средство для применения в требуемом участке воздействия. Настоящее изобретение также относится к способам приготовления и введения дозированных форм.
УРОВЕНЬ ТЕХНИКИ
Обезболивание, например устранение послеоперационной боли, для пациента является важным шагом на пути к выздоровлению. Несмотря на то что для каждого пациента существует много факторов, влияющих на оптимальность обезболивающей терапии, существует настоятельная необходимость в легко применяемых средствах.
Одним из способов устранения послеоперационной боли является использование местных анестетиков, например, бупивакаина. Бупивакаин - местный анестетик продолжительного действия, вводящийся путем локальной инфильтрации для блокады периферических нервов и эпидуральной блокады каудального и люмбального отделов. Как общепринято в данной области техники, для лечения послеоперационной боли подходит бупивакаина гидрохлорид, например, в виде единственного раствора для парентерального введения, в виде раствора для инъекций с глюкозой и в комбинации с адреналином.
Послеоперационная боль, сопровождающая все типы манипуляций, такие как большие оперативные вмешательства (например, торакотомия, пластика аорты, резекция кишки), средние оперативные вмешательства (например, кесарево сечение, экстирпация матки, аппендэктомия), и малые оперативные вмешательства (например, ушивание грыжи, лапароскопия, артроскопия, биопсия молочной железы) может быть изнурительной и требовать обезболивания в течение трех-пяти дней после операции. Однако местная анестезия раствором, например, 0,5% бупивакаина гидрохлорида с адреналином обеспечивает местную аналгезию только на период примерно от четырех до девяти часов. Поэтому стандартная послеоперационная терапия, использующая анестезирующие средства, такие как бупивакаин, требует или их частой инъекции или постоянного внутривенного вливания.
Остается большая потребность в системах доставки лекарственных средств, содержащих анестезирующее средство, способных обеспечить длительное высвобождение при краткой продолжительности действия. Также существует необходимость в отдельном введении систем доставки анестезирующего средства, обеспечивающих длительное высвобождение в течение нескольких дней.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении представлены системы доставки лекарственных средств и наборы, которые высвобождают анестезирующие средства кратковременного действия, такие как бупивакаин. Также раскрываются способы введения и приготовления таких систем. В соответствии с настоящим изобретением системы доставки лекарственных средств, например дозированные формы с длительным высвобождением, содержат гелевый носитель кратковременного действия и анестезирующее средство, растворенное или диспергированное в гелевом носителе. Гелевый носитель содержит низкомолекулярный биоэродируемый биологически совместимый полимер и несмешивающийся с водой растворитель в количестве, эффективном для пластификации полимера и образования геля с полимером. В некоторых случаях наряду с несмешивающимся с водой растворителем используется составной растворитель.
Дозированные формы согласно настоящему изобретению имеют преимущество над обычным системным обезболиванием, требующим или частых инъекций, или постоянного внутривенного вливания раствора. Например, в отношении послеоперационного обезболивания системы доставки лекарственных средств по настоящему изобретению, способные высвобождать заданное количество анестезирующего средства, такого как бупивакаин, в оперированную область в течение продолжительного периода времени, имеют преимущество над стандартной системной послеоперационной обезболивающей терапией, предусматривающей частые инъекции или постоянное внутривенное вливание. Преимущество также достигается однократностью введения дозированных форм по настоящей заявке. С другой стороны, предполагается также, что дозированные формы по настоящему изобретению могут вводиться в виде повторных доз.
Задачей настоящего изобретения является разработка дозированных форм анестезирующих средств кратковременного действия с длительным высвобождением, например, бупивакаина, которые могут применяться для обезболивания у субъектов, например для устранения послеоперационной боли. Коэффициентом эффективности, служащим одним из способов измерения эффективности системы доставки лекарственных средств, является отношение максимальной достигнутой концентрации полезного вещества (Cmax), например анестетика, вскоре после введения дозированной формы, и средней концентрации полезного вещества, измеряемой в течение заданного отрезка времени после достижения максимальной концентрации (Cсредняя), например между 2 и 9 днями после введения. Коэффициент эффективности может регулироваться составом гелевого носителя для достижения желательного профиля высвобождения. Соотношение полимера и растворителя в гелевом носителе может влиять на коэффициент эффективности так же, как и выбор несмешивающегося с водой растворителя или смесей растворителей, составных растворителей и/или выбор наполнителя. Кроме того, на коэффициент эффективности может также влиять молекулярная масса полимера и/или средний размер частиц полезного вещества. На основе потребностей субъекта можно специально задавать коэффициенты эффективности, а также введение полезного вещества, и коэффициенты эффективности могут варьировать от приблизительно 1 до приблизительно 200. В некоторых случаях коэффициенты эффективности могут варьировать от приблизительно 5 до приблизительно 100.
Как правило, для послеоперационного обезболивания желательно доставить лекарственное средство с достижением достаточно высокого Cmax анестезирующего средства для практически немедленного обезболивания и затем поддерживать стабильный уровень анестезирующего средства в течение определенного времени. В этом случае может быть желателен более высокий коэффициент эффективности. Однако в других ситуациях для уменьшения потенциальных побочных эффектов высокой дозировки лекарственного средства может быть полезно поддержание строго контролируемого уровня активного вещества как в циркулирующей крови, так и его локального распределения в тканях. Для таких ситуаций может быть желателен более низкий коэффициент эффективности. Также по причине индивидуальных различий у пациентов и терапевтической необходимости желательно регулировать коэффициент эффективности дозированной формы доставки лекарственного средства.
Что касается выполняемого в соответствии с настоящим изобретением соотношения между полимером и растворителем, рассматривались соотношения с примерными интервалами от 5:95 и до 90:10, примерными интервалами от 20:80 и до 80:20 и/или примерными интервалами от 30:70 и до 75:25.
Дозированные формы кратковременного действия с длительным высвобождением, например гелевые композиции для инъекций с замедленным всасыванием (гелевые депо-композиции), описанные в совместно рассматриваемой заявке США с регистрационным No. 10/606969, включенной в настоящий документ посредством ссылки, могут обеспечивать как системную, так и локальную доставку полезного вещества у субъекта в течение короткого промежутка времени. В частности, кратковременно действующие дозированные формы с длительным высвобождением могут высвобождать полезное вещество, например анестетик, такой как бупивакаин, в течение приблизительно двух недель или менее после введения их субъекту, получающему лечение. В других вариантах осуществления настоящего изобретения регулируется высвобождение в течение периода, равного приблизительно семи дням или меньше. Тем не менее, в других вариантах осуществления возможно регулирование высвобождения полезного вещества в период от приблизительно 24 часов до семи дней.
При том что для использования в настоящем изобретении не ограничивается выбор подходящих анестезирующих средств, в патенте США No.6432986, на который ссылается настоящее изобретение, приводится несколько примеров: в одном аспекте настоящего изобретения анестезирующее средство выбирается из группы, состоящей из бупивакаина, лево-бупивакаина, ропивакаина, лево-ропивакаина, тетракаина, этидокаина, лево-этидокаина, декстро-этидокаина, лево-мепивакаина и их комбинации. В других аспектах анестезирующее средство содержит бупивакаин.
В дополнительных аспектах настоящего изобретения приблизительно 7 мас.% или менее от массы растворителей гелевого носителя при 25°C может смешиваться с водой. В одном из вариантов осуществления настоящего изобретения дозированная форма не содержит растворителей, имеющих смешиваемость с водой более 7 мас.% при 25°C. При том что для настоящего изобретения подходит много растворителей, в одном аспекте настоящего изобретения растворитель выбран из группы, состоящей из ароматических спиртов, низших алкиловых эфиров ариловых кислот, низших аралкиловых эфиров ариловых кислот; арилкетонов, аралкилкетонов, низших алкилкетонов, низших алкиловых эфиров лимонной кислоты и их комбинаций. Пригодные растворители, используемые в настоящем изобретении, включают бензиловый спирт, бензилбензоат, этилбензоат, триацетин и их смеси, но не ограничены вышеперечисленными.
Дополнительные вышеупомянутые аспекты настоящего изобретения включают дозированные формы с длительным высвобождением, дополнительно содержащие составные растворители, выбираемые из группы, состоящей из триацетина, диацетина, трибутирина, триэтилцитрата, трибутилцитрата, ацетилтриэтилцитрата, ацетилтрибутилцитрата, триэтилглицеридов, триэтилфосфата, диэтилфталата, диэтилтартрата, минерального масла, полибутена, силиконовой жидкости, глицерина, этиленгликоля, полиэтиленгликоля, октанола, этиллактата, пропиленгликоля, пропиленкарбоната, этиленкарбоната, бутиролактона, этиленоксида, пропиленоксида, N-метил-2-пирролидона, 2-пирролидона, глицеролформаля, метилацетата, этилацетата, метилэтилкетона, диметилформамида, диметилсульфоксида, тетрагидрофурана, капролактама, децилметилсульфоксида, олеиновой кислоты и 1-додецилазациклогептан-2-она и их комбинаций.
В других вариантах осуществления настоящего изобретения гелевый носитель содержит полимер на основе молочной кислоты или сополимер молочной кислоты и гликолевой кислоты (PLGA). В других вариантах осуществления используются полимеры на основе капролактона. Полимеры могут также быть выбраны из группы, состоящей из полилактидов, полигликолидов, поли(капролактона), полиангидридов, полиаминов, полиамидоэфиров, полиортоэфиров, полидиоксанонов, полиацеталей, поликеталей, поликарбонатов, полифосфоэфиров, полиэфиров, полибутилентерефталата, полиортокарбонатов, полифосфазенов, сукцинатов, поли(яблочной кислоты), поли(аминокислот), поливинилпирролидона, полиэтиленгликоля, полигидроксицеллюлозы, полисахаридов, хитина, хитозана, гиалуроновой кислоты и сополимеров, тройных сополимеров и их смесей. Полимеры, используемые в настоящем изобретении, могут содержать эфирную концевую группу или концевую группу с карбоновой кислотой. К тому же полимеры могут иметь среднюю молекулярную массу в промежутке от приблизительно 1000 до приблизительно 10000, в промежутке от приблизительно 3000 до приблизительно 10000, в промежутке от приблизительно 3000 до приблизительно 8000, в промежутке от приблизительно 4000 до приблизительно 6000 и/или приблизительно 5000.
Дозированные формы в соответствии с настоящим изобретением содержат от приблизительно 0,1% до приблизительно 50% массы анестезирующего средства, от приблизительно 0,5% до приблизительно 40% массы анестезирующего средства, и/или от приблизительно 1% до приблизительно 30% массы анестезирующего средства.
Другие аспекты настоящего изобретения включают частицы анестезирующего средства, имеющие средний размер частиц менее чем приблизительно 250 мкм, от приблизительно 5 мкм до 250 мкм, от приблизительно 20 мкм до приблизительно 125 мкм и/или от приблизительно 38 мкм до приблизительно 63 мкм.
К тому же дополнительные аспекты в соответствии с настоящим изобретением включают вышеупомянутые дозированные формы с длительным высвобождением, содержащие по меньшей мере одно из следующего: наполнитель, такой как стеариновая кислота, эмульгирующее средство, порообразующее средство, модулятор растворимости для анестезирующего средства и вещество, изменяющее осмотическое давление (осмотический агент).
Другие варианты осуществления настоящего изобретения включают дозированные формы с длительным высвобождением анестезирующего средства, содержащие гелевый носитель кратковременного действия, содержащий сополимер на основе молочной кислоты с низкой молекулярной массой и несмешивающийся с водой растворитель в количестве, эффективном для пластификации полимера и при этом для образования геля с ним; анестезирующее средство, содержащее бупивакаин, где анестезирующее средство растворено или диспергировано в гелевом носителе; и регулируемый коэффициент эффективности для достижения профиля высвобождения; где средняя молекулярная масса полимера на основе молочной кислоты составляет от приблизительно 3000 до приблизительно 10000.
Дополнительные варианты осуществления настоящего изобретения включают дозированные формы с длительным высвобождением анестезирующего средства, содержащие гелевый носитель кратковременного действия, который включает сополимер молочной кислоты и гликолевой кислоты (PLGA) с низкой молекулярной массой и несмешивающийся с водой растворитель в количестве, эффективном для пластификации полимера и при этом для образования геля с ним; анестезирующее средство, содержащее бупивакаин, где анестезирующее средство растворено или диспергировано в гелевом носителе; и регулируемый коэффициент эффективности для достижения профиля высвобождения; где средняя молекулярная масса сополимера составляет от приблизительно 3000 до приблизительно 10000.
Настоящее изобретение также включает способы лечения локальной боли у субъекта с использованием дозированной формы с длительным высвобождением, причем способы включают введение дозированной формы кратковременного действия с длительным высвобождением, содержащей гелевый носитель, который включает биоэродируемый биологически совместимый полимер с низкой молекулярной массой и несмешивающийся с водой растворитель в количестве, эффективном для пластификации полимера и, таким образом, для образования геля; и анестезирующее средство, растворенное или диспергированное в гелевом носителе.
Другие способы включают лечение послеоперационной локальной боли у субъекта с использованием дозированной формы с длительным высвобождением, причем способы включают введение дозированной формы кратковременного действия с длительным высвобождением, содержащей гелевый носитель, который включает биоэродируемый биологически совместимый полимер на основе молочной кислоты или сополимер молочной кислоты и гликолевой кислоты (PLGA), с низкой молекулярной массой и несмешивающийся с водой растворитель в количестве, эффективном для пластификации полимера и, таким образом, для образования геля; анестезирующее средство, содержащее бупивакаин, растворенный или диспергированный в гелевом носителе; и имеющий регулируемый коэффициент эффективности для достижения профиля высвобождения.
Дозированные формы по настоящему изобретению могут вводиться однократно или повторно. Дозированные формы могут применяться местно в случае локальной боли. В других аспектах настоящего изобретения дозированная форма вводится в виде инъекции в область локализации боли. Анестезирующее средство может доставляться системно или локально. Доставка анестезирующего средства также может проводиться к нескольким участкам, например многократно вокруг области локализации боли.
Другой аспект настоящего изобретения включает способы изготовления дозированной формы с длительным высвобождением, при этом способ включает изготовление гелевого носителя кратковременного действия, содержащего низкомолекулярный биоэродируемый биологически совместимый полимер и несмешивающийся с водой растворитель в количестве, эффективном для пластификации полимера и, таким образом, для образования геля с целью создания раствора или геля полимера/растворителя; уравновешивание раствора или геля полимера/растворителя до получения прозрачного гомогенного раствора или геля, например, при температуре в пределах от комнатной температуры до 65°C; растворение или диспергирование анестезирующего средства в растворе или геле полимера/растворителя; смешивание анестезирующего средства и раствора или геля полимера/растворителя для образования дозированной формы с длительным высвобождением; и регулирование коэффициента эффективности для достижения профиля высвобождения.
Также в соответствии с настоящим изобретением представлены наборы для введения длительно доставляемого анестезирующего средства субъекту с локальной болью, содержащие гелевый носитель кратковременного действия, который содержит биоэродируемый биологически совместимый полимер с низкой молекулярной массой и несмешивающийся с водой растворитель в количестве, эффективном для пластификации полимера и для образования геля; анестезирующее средство, растворенное или диспергированное в гелевом носителе; и, необязательно, одно или более из следующих: наполнитель, такой как стеариновая кислота, эмульгирующее средство, порообразующее средство, модулятор растворимости для анестезирующего средства, необязательно связанный с анестезирующим средством, и вещество, изменяющее осмотическое давление; где по меньшей мере анестезирующее средство, необязательно связанное с модулятором растворимости, сохраняется отдельно от растворителя до момента введения анестезирующего средства субъекту.
Эти и другие варианты осуществления будут очевидны для специалистов в данной области техники с учетом их раскрытия в данном документе.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
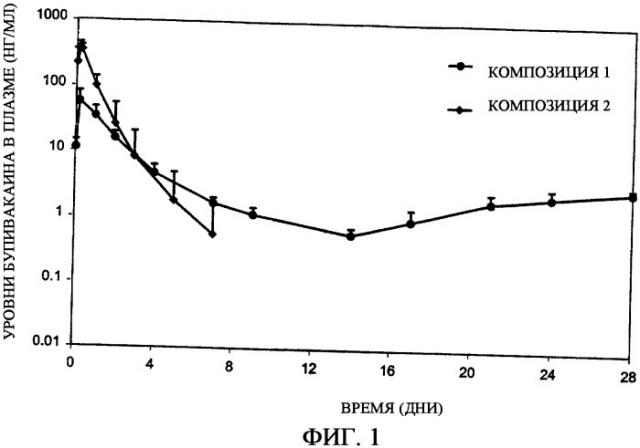
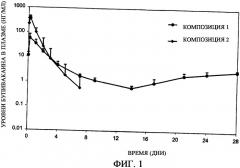
Фиг.1 представляет собой график, иллюстрирующий профиль высвобождения бупивакаина гидрохлорида in vivo, полученный при использовании композиций с замедленным всасыванием (депо-композиций) по настоящему изобретению (композиции 1-2).
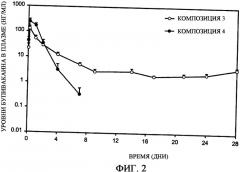
Фиг.2 представляет собой график, иллюстрирующий профиль высвобождения основы бупивакаина in vivo, полученный при использовании композиций с замедленным всасыванием по настоящему изобретению (композиция 3-4).
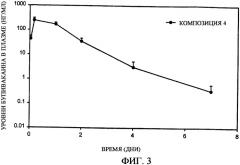
Фиг.3 представляет собой график, иллюстрирующий начальную часть профиля высвобождения (до 7 дня) основы бупивакаина in vivo, полученный при использовании композиции с замедленным всасыванием по настоящему изобретению (композиция 4).
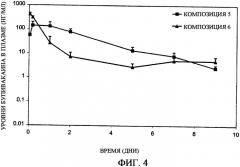
Фиг.4 представляет собой график, иллюстрирующий профиль высвобождения бупивакаина in vivo, полученный при использовании композиций с замедленным всасыванием по настоящему изобретению (композиции 5-6).
Фиг.5 представляет собой график, иллюстрирующий профиль высвобождения бупивакаина in vivo, полученный при использовании композиций с замедленным всасыванием по настоящему изобретению (композиции 6-7).
Фиг.6 представляет собой график, иллюстрирующий профиль высвобождения бупивакаина in vivo, полученный при использовании композиций с замедленным всасыванием по настоящему изобретению (композиции 7-8).
Фиг.7 представляет собой график, иллюстрирующий профиль высвобождения бупивакаина in vivo, полученный при использовании композиций с замедленным всасыванием по настоящему изобретению (композиции 8-9).
Фиг.8 представляет собой график, иллюстрирующий профиль высвобождения бупивакаина in vivo, полученный при использовании композиций с замедленным всасыванием по настоящему изобретению (композиции 10-11).
Фиг.9 представляет собой график, иллюстрирующий профиль высвобождения бупивакаина in vivo, полученный при использовании композиций с замедленным всасыванием по настоящему изобретению (композиции 10, 12).
Фиг.10 представляет собой график, иллюстрирующий начальную часть (до 4 дня) профиля высвобождения бупивакаина in vivo, полученный при использовании композиций с замедленным всасыванием по настоящему изобретению (композиции 10, 12).
Фиг.11 представляет собой график, иллюстрирующий профиль высвобождения бупивакаина in vivo, полученный при использовании композиций с замедленным всасыванием по настоящему изобретению (композиции 12, 13).
Фиг.12 представляет собой график, иллюстрирующий начальную часть (до 4 дня) профиля высвобождения бупивакаина in vivo, полученный при использовании композиций с замедленным всасыванием по настоящему изобретению (композиции 12, 13).
Фиг.13 представляет собой диаграмму дифференциальной сканирующей калориметрии (ДСК) низкомолекулярных PLGA с эфирной концевой группой, применяемых для различных композиций по настоящему изобретению (композиции 2, 4, 5, 6 и 7).
Фиг.14 представляет собой диаграмму ДСК низкомолекулярных PLGA с карбоксильной концевой группой, применяемых для различных композиций по настоящему изобретению (композиции 8 и 13).
Фиг.15 представляет собой график, иллюстрирующий in vitro профиль распада полимеров PLGA с вариабельной молекулярной массой и с различными концевыми группами.
ПОДРОБНОЕ ОПИСАНИЕ
В настоящем изобретении представлены системы доставки лекарственных средств и наборы, которые высвобождают анестезирующее средство кратковременного действия, такое как бупивакаин. Также рассматриваются способы введения и изготовления таких систем. Системы доставки лекарственных средств в соответствии с настоящим изобретением включают гелевый носитель кратковременного действия и анестезирующее средство, растворенное или диспергированное в гелевом носителе. Гелевый носитель содержит биоэродируемый биологически совместимый полимер с низкой молекулярной массой и несмешивающийся с водой растворитель в количестве, эффективном для пластификации полимера и образования геля с полимером. В некоторых случаях используется составной растворитель наряду с несмешивающимся с водой растворителем. Коэффициент эффективности, который является одним из способов измерения эффективности системы доставки, может регулироваться, например, составом гелевого носителя для достижения желательного профиля высвобождения. Соотношение полимера и растворителя в гелевом носителе так же, как и выбор несмешивающегося с водой растворителя или смесей растворителей, составного растворителя и/или выбор наполнителя, может влиять на коэффициент эффективности. Кроме того, на коэффициент эффективности может также влиять молекулярная масса полимера и/или средний размер частиц полезного вещества. Коэффициенты эффективности так же, как и введение полезного вещества, могут быть специально заданы на основе потребностей субъекта и могут варьировать от приблизительно 1 до приблизительно 200. В некоторых случаях коэффициенты эффективности могут варьировать от приблизительно 5 до приблизительно 100.
Для послеоперационного обезболивания обычно желательно доставить лекарственное средство с достижением достаточно высокого Cmax анестезирующего средства для практически немедленного обезболивания и затем поддерживать стабильный уровень анестезирующего средства в течение определенного времени. В этом случае может быть желателен более высокий коэффициент эффективности. Однако в других ситуациях для уменьшения потенциальных побочных эффектов высокой дозировки лекарственного средства может быть полезно поддержание строго контролируемого уровня активного вещества как в циркулирующей крови, так и его локального распределения в тканях. Для таких ситуаций может быть желателен более низкий коэффициент эффективности. Также по причине индивидуальных различий у пациентов и терапевтической необходимости желательно регулировать коэффициент эффективности дозированной формы доставки лекарственного средства.
В целом, композиции настоящего изобретения являются гелеподобными и по существу образуют гомогенную непористую структуру по всему объему имплантата при имплантации и в течение доставки лекарственного средства даже при его затвердевании. Кроме того, в то время как полимерный гелевый имплантат будет медленно затвердевать при попадании в водную среду, затвердевший имплантат может удерживать эластичную (мягкую) композицию с температурой стеклования Tg ниже 37°C.
Когда композиция предназначена для имплантации посредством инъекции, вязкость может необязательно модифицироваться эмульгаторами и/или тиксотропными добавками для получения гелевой композиции, имеющей достаточно низкую вязкость, допускающую прохождение гелевой композиции через иглу. Также наряду с обычными фармацевтическими наполнителями и другими добавками, которые не изменяют полезное вещество по настоящему изобретению, к системам имплантации для обеспечения желательного профиля высвобождения из систем имплантации могут быть добавлены порообразующие средства и модуляторы растворимости полезного вещества. Добавление модулятора растворимости к системе имплантации позволяет использовать растворитель, имеющий растворимость 7% или более, для системы имплантации с минимальными выбросами и поддерживать доставку при конкретных обстоятельствах. Однако в настоящее время в системе имплантации предпочтительно использовать по меньшей мере один растворитель, имеющий растворимость в воде менее 7 мас.%, независимо от того, присутствует ли единственный растворитель или как часть смеси растворителей. Также выявлено, что при использовании смесей растворителей, включающих растворитель, имеющий растворимость в воде 7 мас.% или менее, и одного или более смешивающихся растворителей, необязательно имеющих более высокую растворимость, системы имплантации проявляют ограниченное поглощение воды и минимальные выбросы и достигаются стабильные характеристики доставки.
Определения
В описании и формуле настоящего изобретения будет использоваться следующая терминология в соответствии с нижеизложенными определениями.
Формы единственного числа включают в себя ссылки на множественное число, если из контекста явно не следует иначе. Таким образом, например, ссылка на "растворитель" включает в себя единственный растворитель, а также смесь двух или более различных растворителей, ссылка на "анестетик (анестезирующее средство)" включает единственное анестезирующее средство, а также два или более различных анестезирующих средства в комбинации, и т.п.
Термин "коэффициент эффективности" определяется как отношение Cmax/Cсредняя. Сmax - это максимальная достигнутая концентрация полезного вещества, например анестезирующего средства, вскоре после введения дозированной формы. Cсредняя - это средняя концентрация полезного вещества, измеряемая в течение заданного отрезка времени после достижения максимальной концентрации, основанная на продолжительности высвобождения дозированной формы. Например, для дозированной формы с высвобождением в течение семи дней Cmax измеряется через 1 час, и Cсредняя измеряется в течение более 1 дня и до 7 дней.
Фраза "растворенный или диспергированный" подразумевает охват всех средств определения присутствия полезного вещества в гелевой композиции и включает раствор, дисперсию, суспензию и т.п.
Термин "системный" в отношении доставки или введения полезного вещества субъекту означает, что полезное вещество поддается обнаружению на биологически значимом уровне в плазме крови субъекта.
Термин "местный" в отношении доставки или введения полезного вещества субъекту означает, что полезное вещество доставляется в локализованную область у субъекта, но не поддается обнаружению на биологически значимом уровне в плазме крови субъекта.
Термины "кратковременный период" или "кратковременная продолжительность действия" используются взаимозаменяемо и относятся к периоду времени, за который происходит высвобождение полезного вещества из гелевой композиции замедленного всасывания по настоящему изобретению, который в целом будет равен двум неделям или менее, предпочтительно от приблизительно 24 часов до приблизительно 2 недель, предпочтительно приблизительно 10 дням или короче; предпочтительно приблизительно 7 дням или короче, более предпочтительно от приблизительно 3 дней до приблизительно 7 дней.
Термин "гелевый носитель" обозначает композицию, образованную смесью полимера и растворителя в отсутствие полезного вещества.
Термин "модулятор растворимости" в отношении полезного вещества обозначает вещество, которое может изменить растворимость полезного вещества, со ссылкой на полимерный растворитель или воду, в отличие от растворимости полезного вещества в отсутствие модулятора. Модулятор может увеличивать или замедлять растворимость полезного вещества в растворителе или воде. Однако в присутствии высоко водорастворимых полезных веществ модулятор растворимости в целом будет веществом, замедляющим растворимость полезного вещества в воде. Эффекты модуляторов растворимости полезного вещества могут быть результатом взаимодействия модулятора растворимости с растворителем или непосредственно с полезным веществом, а именно с формированием комплексов, или и с тем и другим. Для вышеперечисленных целей при «связывании» модулятора растворимости с полезным веществом предполагаются все вышеупомянутые наблюдающиеся взаимодействия или образования. Модуляторы растворимости по ситуации могут быть смешаны с полезным веществом раньше его комбинирования с вязким гелем или могут быть добавлены к вязкому гелю раньше добавления полезного вещества.
Термины "субъект" и "пациент" в отношении введения композиции по настоящему изобретению обозначают животное или человека.
Так как все растворители, по меньшей мере на молекулярном уровне, являются растворимыми в воде (то есть смешивающимися с водой) с некоторым очень ограниченным исключением, термин "несмешивающийся", используемый в настоящем изобретении, обозначает, что 7 мас.% или меньше, предпочтительно 5 мас.% или меньше растворителя растворяются или смешиваются с водой. Для раскрытия этого термина принято, что значения растворимости растворителя в воде будут определяться при 25°C. Так как в целом подтверждается, что определение значений растворимости не всегда может проводиться при одинаковых условиях, пределы растворимости, о которых в настоящем изобретении говорится как о проценте по массе, смешивающемся или растворимом в воде, не могут быть абсолютными в части диапазона или в верхнем пределе. Например, если в настоящем изобретении говорится о верхнем пределе растворимости растворителя в воде как о "7 мас.%" и не представлено никаких дополнительных ограничений на растворитель, считается, что растворитель триацетин, который имеет подтвержденную водорастворимость 7,17 граммов на 100 мл воды, будет включен в пределы 7%. Предел растворимости в воде менее 7 мас.%, используемый в настоящем изобретении, не включает в себя растворитель триацетин или растворители, имеющие растворимость в воде, равную или больше, чем у триацетина.
Термин "биоэродируемый" относится к материалу, который постепенно разлагается, растворяется, гидролизуется и/или разрушается in situ. В целом "биоэродируемые" полимеры по настоящему изобретению - это полимеры, которые являются гидролизуемыми и подвергаются биоэродированию in situ прежде всего путем гидролиза.
Термин "низкомолекулярный (НМ) полимер (полимер с низкой молекулярной массой)" относится к биоэродируемым полимерам, имеющим среднюю молекулярную массу в пределах от приблизительно 1000 до приблизительно 10000; предпочтительно от приблизительно 3000 до приблизительно 10000; более предпочтительно от приблизительно 3000 до приблизительно 8000, более предпочтительно от приблизительно 4000 до приблизительно 8000; и более предпочтителен низкомолекулярный полимер, имеющий молекулярную массу приблизительно 7000, приблизительно 6000, приблизительно 5000, приблизительно 4000 и приблизительно 3000 при определении гель-проникающей хроматографией (ГПХ).
Полимер, растворитель и другие вещества по настоящему изобретению должны быть "биологически совместимыми"; это означает, что они не должны вызывать некроз и вызывать допустимые реакции раздражения или воспаления в среде применения. Среда применения - это жидкая среда, она может содержать подкожный, внутримышечный, внутрисосудистый (сосуды с высоким и низким кровотоком), интрамиокардиальный, адвентициальный, внутриопухолевый или интрацеребральный участки, область раны, герметичные суставные щели или полости тела человека или животного.
Термин "алкил", используемый в настоящем изобретении, относится к группе насыщенных углеводородов, обычно, но необязательно содержащей от 1 до приблизительно 30 атомов углерода, таких как метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, октил, децил, и т.п., а также циклоалкильные группы, такие как циклопентил, циклогексил и т.п. В целом, хотя и необязательно, алкильные группы по настоящему изобретению содержат от 1 до приблизительно 12 атомов углерода. Термин "низший алкил" предназначен для алкильной группы размером от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода. "Замещенный алкил" относится к алкилу, замещенному одной или более группой заместителя, а термины "гетероатом-содержащий алкил" и "гетероалкил" относятся к алкилу, в котором по меньшей мере один атом углерода замещен гетероатомом. Если не определено иначе, термины "алкил" и "низший алкил" включают линейный, разветвленный, циклический, незамещенный, замещенный и/или гетероатом-содержащий алкил или низший алкил.
Термин "арил", используемый в настоящем изобретении, если не определено иначе, относится к ароматическому заместителю, содержащему единственное ароматическое кольцо или множественные ароматические кольца, конденсированные вместе, связанные ковалентной связью или привязанные к общей группе, такой как метиленовой или этиленовой функциональной группе. Арильные группы содержат предпочтительно одно ароматическое кольцо или два соединенных или связанных ароматических кольца, например фенил, нафтил, дифенил, дифенилэфир, дифениламин, бензофенон, и т.п., и наиболее предпочтительно моноциклические арильные группы. "Замещенный арил" относится к арильной функциональной группе, замещенной одной или более группой заместителей, и термины "гетероатом-содержащий арил" и "гетероарил" относятся к арилу, в котором по меньшей мере один атом углерода заменен гетероатомом. Если не обозначено иначе, термин "арил" включает в себя группы гетероарила, замещенного арила и замещенного гетероарила.
Термин "аралкил" относится к алкильной группе, замещенной на арильную группу, в которой алкил и арил определены выше. Термин "гетероаралкил" относится к алкильной группе, замещенной на гетероарильную группу. Если не обозначено иначе, термин "аралкил" включает в себя группы гетероалкила и замещенного аралкила, а также незамещенные аралкильные группы. В целом термин "аралкил" в настоящем изобретении относится к группам арилзамещенных низших алкилов, предпочтительно фенилзамещенной группе низших алкилов, таких как бензил, фенетил, 1-фенилпропил, 2-фенилпропил, и т.п.
I. Инъецируемые композиции с замедленным всасыванием (депо-композиции):
Как описано выше, инъецируемые композиции с замедленным всасыванием для доставки полезных веществ за короткий период времени могут быть образованы в виде вязких гелей до введения депо-композиции субъекту. Вязкий гель способствует обеспечению адекватных профилей дос