Белки, индуцирующие множественную устойчивость растений к фитопатогенам и вредителям
Иллюстрации
Показать всеИзобретение относится к области биохимии и биотехнологии и может быть использовано в растениеводстве. Из клеток микроорганизма Pseudomonas fluorescence выделен новый белок (MF3), обладающий способностью повышать устойчивость растений к инфекционным болезням и растительным паразитам. Клонирован ген mf3, определена полная кодирующая белок последовательность и сконструированы экспрессирующие векторы, включающие указанную последовательность или ее часть, кодирующую фрагмент MF3, который сохраняет защитные свойства полноразмерного белка. Путем введения созданных векторных конструкций в клетки организмов-хозяев получены культуры растительных клеток, экспрессирующие MF3, устойчивые к инфекционным болезням и/или растительным паразитам трансгенные растения, а также штаммы микроорганизмов, продуцирующие рекомбинантные белки. Очищенный белок MF3 или его активный фрагмент по изобретению предлагается использовать в составах для защиты растений от патогенов и вредителей. 8 с. и 1 з.п. ф-лы, 1 ил., 24 табл.
Реферат
Настоящее изобретение относится к области сельского хозяйства и огородничества, в особенности к защите растений от вирусов, бактерий, грибов или других паразитов. В частности, изобретение описывает бактериальные белки, вызывающие общую устойчивость растений к микробным патогенам и вредителям.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Патогенные микроорганизмы и вредители ответственны за существенные экономические потери в сельскохозяйственном производстве во всем мире. Современные методы контроля фитопатогенов и вредителей имеют каждый свои серьезные недостатки. В принципе, селекция новых сельскохозяйственных сортов, которые генетически более устойчивы к патогенам, может предотвратить потери урожая. На практике, однако, каждый новый сорт в конечном счете теряют свои преимущества, так как патогенны постепенно преодолевают эту устойчивость. Применение синтетических неприродных химических средств защиты представляет значительный риск для экологии. Только сравнительно недавно начали использовать похожие вещества природного происхождения. Однако такие природные вещества дороги, их распыление требует применения специальных устройств и является трудоемким процессом.
В течение последних двадцати лет для придания растениям устойчивости к вирусным патогенам были разработаны новые подходы, использующие трансгенные растения с чужеродными генами. Как правило, в таких растениях экспрессировали определенные вирусные гены (например, ген белка оболочки). К сожалению, приобретенная устойчивость эффективна только против определенного вирусного штамма, которым растение было «вакцинировано». Например, устойчивость к Y-вирусу картофеля была не эффективна против вирусных штаммов, которые отличались от использованного штамма всего на 22% на нуклеотидном уровне. Поэтому этот вид устойчивости имел ограниченное практическое применение, так как при изменении климатических условий и других факторов доминируют различные патогены. Фермеры ожидают, что их инвестиции в дорогостоящий семенной материал должны быть выгодными каждый год, а не только в определенные годы. Тем не менее, из-за отсутствия более универсальных решений такая ограниченная устойчивость была получена к различным вирусам в широком кругу сельскохозяйственных культур. Также ситуация должна учитывать растущую значимость общественного мнения и опасения относительно использования трансгенных растений: выгоды должны быть достаточно значимыми, чтобы перевесить обеспокоенность общества.
Системная приобретенная устойчивость (SAR) впервые описана Честер (1933). SAR - обычная защитная реакция, когда растение системно производит различные защитные молекулы, такие как лигнин, фитоалексины и PR-белки, чтобы предотвратить распространение патогенов (см. Обзор Sticher et al. 1997, Ann.Rev.Phytopathol. 35, 235-270). SAR может быть вызвана в течение нескольких часов многими патогенами, а затем устойчивость длится в течение нескольких недель. SAR - реакция устойчивости, зависящая от салициловой кислоты, но первичная роль салициловой кислоты до сих пор не ясна (Ryal et al. 1996, Plant Cell 8, pp.1809-1819). Распространение патогена ограничено небольшим количеством клеток растения, в которых индуцируется SAR; поэтому болезнетворные микроорганизмы, практически, не могут повредить растение.
Тогда как существует огромная потребность в быстром получении новых сортов растений с высокой устойчивостью к различным болезням и вредителям и с высокой экологической безопасностью, до сих пор не было предложено ни одного ясного решения этой проблемы.
Настоящее изобретение предлагает совершенно новую концепцию увеличения устойчивости растения, основанную на удивительной находке, что определенный бактериальный белок, названный как MF3, может вызывать в растениях системную устойчивость широкого спектра, включающую устойчивость к вирусам, бактериям, грибам и таким вредителям, как Колорадский картофельный жук и нематоды. Широкий защитный потенциал белка MF3 показан на экспериментальных результатах, подтверждающих формулу изобретения, что белок может вызывать полный спектр устойчивости растения к патогенам и вредителям. Хотя действие открытого нами белка в растениях напоминают эффекты SAR, никакой механистической связи между ними не вырисовывается.
Ранее мы обнаружили другой белок с совершенно другой структурой, чем MF3; этот белок выделен из штамма Bacillus thuringiensis (MF2, Djavakhia V., et al. US 6,528,480). Трансгенные растения табака, экспрессирующие MF2, обладали усиленной устойчивостью к вирусам и грибам (вирус мозаики табака и Alternaria longipes соответственно). В настоящем изобретении мы предлагаем полностью различный бактериальный белок с улучшенной активностью и значительно более широкими приложениями. Поэтому настоящее изобретение обеспечивает существенное усовершенствование нашего предыдущего изобретения, показывая, что новая молекула может вызывать множественную устойчивость растений к фитопатогенам, включая микроорганизмы, а также насекомых и нематод, в особенности, которые известны как опасные паразиты растений. Мы также показываем, что MF3 может быть использован как индуктор устойчивости в различных трансгенных растениях без любой потери урожайности.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ.
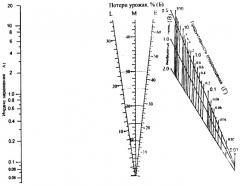
Чертеж. Номограмма для определения потерь урожая картофеля от фитофтороза в результате преждевременного отмирания листьев.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Ключевой аспект активной защиты организма против вторжения микробов или других патогенов - способность различать свои компоненты от чужих. В растениях устойчивость, базирующаяся на узнавании патогенов, наиболее полно и успешно изучена в случае наличия специфических генов устойчивости, которые придают растениям устойчивость к специфическим расам патогенов. Было показано, что некоторые из этих генов устойчивости участвуют в хемовосприятии факторов, специфически присущих конкретным штаммам патогенов, кроме того, у растений есть система более широкого контроля, базирующая на чувствительном восприятии факторов, характерных для целых групп или классов микроорганизмов, и растения отвечают на эти общие элиситоры активацией сигнальных путей для того, чтобы запустить защитные механизмы.
Возможные примеры элиситоров белковой природы описаны в настоящем изобретении. Известны примеры белков, активирующие устойчивость. Однако эти белки были выделены из зараженных тканей растений, и они специфически действуют только в определенной паре патоген-хозяин, что является существенным отличием от настоящего изобретения. Кроме того, в отличие от известных белков и механизмов устойчивости в настоящем изобретении мы представляем бактериальный белок, названный MF3, с новой энзиматической активностью; этот белок не участвует ни в одном известном процессе фитопатогенеза. Обработка растительных тканей раствором этого белка приводит к активации механизма устойчивости.
Очевидна полезность MF3 при создании трансгенных растений с низким уровнем экспрессии этого белка. Главное преимущество использования - это производство MF3 в больших количествах и его введение в растительные клетки в подобранных составах с помощью соответствующих методов.
Методы получения трансгенных растений хорошо известны по учебникам, а первые трансгенные растения известны еще с 80-х годов прошлого столетия. Генетическая инженерия помогла исследователям понять глубины фундаментальных процессов, которые управляют развитием растений, а первые такие генетически модифицированные растения уже коммерциализованы и сейчас широко используются.
Одно из самых многообещающих направлений, которые открывает техника переноса генов, - устойчивость к болезням. Захватывающие результаты были достигнуты в создании растений, устойчивых к вирусам; это важный вопрос, потому что в настоящее время не существует прямых методов обработки растений, зараженных вирусом. Эксперименты с генетически модифицированными растениями показали, что экспрессия вирусных генов, как правило, придает устойчивость только к тем же самым вирусным штаммам (см. обзор Baulcombe, 1994). В каждом из этих случаев проблема ограниченной устойчивости вызывает беспокойство при практическом использовании этих растений. Проблема может быть преодолена путем использования генов факторов, вызывающих множественную устойчивость растений, факторов, описанных в настоящем изобретении.
Мы выделили белок MF2 из штамма Bacillus thuringiensis, который индуцировал устойчивость растений к вирусным и грибковым инфекциям (Djavakhia V., и др., патент США 6528480). В настоящем изобретении мы с удивлением обнаружили, что не только Bacillus thuringiensis может содержать такой индуктор. Используя определенные новые методы анализа к очень большому количеству почвенных микробов, мы сумели выделить из штамма Pseudomonas fluorescence новый индуктор MF3. Оказалось, что этот индуктор при чрезвычайно низкой концентрации вызывает общую устойчивость у различных растений не только к вирусной, но также и к бактериальной, и к грибковой инфекциям.
Позже было показано, что MF3 вызывает устойчивость даже к нематоде и насекомым как при прямом введении MF3 в растения через кутикулу листа, так и в эндогенном виде при его синтезе в трансгенных растениях. Структуры белков MF2 и MF3 не имеют никаких очевидных гомологичных последовательностей. Единственная общая черта - оба белка термостабильны. Их молекулярные массы также отличаются: MF2 имеет молекулярный вес 7239 Дальтон; молекулярная масса MF3 - порядка 17600 Дальтон. MF3 - это новая белковая последовательность, как оказалось, наиболее близко напоминает фермент пептидил-пролил-цис-транс-изомеразу SlyD из Pseudomonas aeruginosa.
Пептидил-пролил-цис-транс-изомеразы играют ключевую роль в фосфорилировании белков животных (см. обзор Zavyalov, V. et al. APMIS Vol.103, pp.401-415, 1995). Поскольку могут существовать общие молекулярные связи или корреляции между механизмами устойчивости у животных и в растениях, возможно, что MF3 является ключевым фактором механизма устойчивости растений и имеет, таким образом, общую ценность как молекулярный инструмент. Следовательно, MF3 может быть использован в решении различных проблем фитопатологии.
Препараты MF3 могут эффективно использоваться в технологии культуры меристемы для получения чистого вещества, без микробов ростков, опрыскивая культуру меристемы надлежащим соединением MF3, или при использовании MF3, или его активных пептидов, возможно в комбинации с термообработкой клеточных культур. Использование этого экологически чистого, нефитотоксичного вещества могло бы быть эффективным для клонального размножения безмикробных побегов различных сельскохозяйственных растений. Знание структуры MF3 обеспечивает возможность для получения генетических конструкций для того, чтобы создать трансгенные растения, устойчивые к вирусным и другим болезням.
Очевидны преимущества трансгенных растений, содержащих MF3. Известно, что трансгенные растения, содержащие часть вирусного генома, как правило, специфически устойчивы только к близкородственным вирусам. Микроорганизм, используемый согласно настоящему изобретению, не имеет никакой очевидной структурной связи. Мы показываем здесь, что MF3 индуцирует неспецифическую устойчивость растений табака к вирусу табачной мозаики (TMV), к вирусу Х картофеля (PVX) и к вирусу Y картофеля (PVY). Более того, обработка растений картофеля MF3 приводит к индуцированию устойчивости к фитофторозу, вызываемому Phytophthora infestans. Было также показано, что обработка клубней картофеля MF3 индуцирует устойчивость к бактериальной мягкой мокрой гнили (Erwinia carotovora). Кроме того, MF3 индуцирует устойчивость растений риса к пирикуляриозу риса - болезни, вызываемой Pyricularia oryzae. MF3 также индуцирует устойчивость растений пшеницы к Fusarium culmorwn and Septoria nodorum. Как показано в специальных примерах, индуцируется также устойчивость к нематодам и насекомым. С высокой степенью вероятности устойчивость проявляется по отношению к насекомым на разных возрастных стадиях, таких как яйца, личинки и взрослые особи. Эти различные возрастные формы атакуют разные части растения (н-р, корни, листья). Аналогично, как показано в специальных примерах, у широкого круга растений формируется устойчивость после in vitro или in vivo введения MF3 в их клетки или в межклеточное пространство. Следует специально отметить, что MF3 может также иметь специфические рецепторы внутри растительной ткани. Поэтому настоящее изобретение нужно рассматривать как создание универсальной защиты растений от различных растительных паразитов и болезней.
Последовательность ДНК, кодирующая белок MF3, может быть клонирована в любой вектор для клонирования и/или экспрессии в любом организме от бактерий до высших эукариот, включая растения, с помощью обычно используемых методов генетической инженерии, как описано, например, в J.Sambrook, E.F.Fritsch and T.Maniatis, Molecular Cloning: A Laboratory Manual, 2nd ed. (Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press, 1989). Мы клонировали ген, кодирующий белок MF3, и определили его нуклеотидную последовательность. Также мы определили аминокислотную последовательность белка MF3. На основании этих результатов был сконструирован штамм Escherichia coli - супер-продуцент белка MF3.
Следующая цель настоящего изобретения - метод выделения и очистки белков, обладающих антивирусной, антибактериальной, фунгицидной, общей антимикробной, антинематодной и инсектицидной активностями, из предпочтительно генетически модифицированного микроба, экспрессирующего вышеназванный(ые) белок(ки). Такой метод состоит из:
а) культивирование микробного штамма-продуцента и экстракция из клеток в соответствующем буферном растворе при повышенной температуре, предпочтительно на кипящей водяной бане, для того чтобы исключить основную часть температурочувствительных веществ из экстракционной среды;
в) осаждение неочищенного MF3 полипептида при низкой температуре с соответствующим осадителем, чтобы исключить органические соединения низкой молекулярной массы из белковой фракции;
г) фракционирование растворенного осадка согласно п.в) с помощью анион-обменной колоночной хроматографии и сбор фракций с антимикробной, антинематодной и/или инсектицидной активностями:
д) проведение электрофоретического анализа в ПААГ белковых фракций с антивирусной, антибактериальной, фунгицидной, антинематодной и/или инсектицидной активностями согласно п.в);
е) рефолдинг белка, элюированного из геля.
Принимая во внимание, что вышеописанный предпочтительный метод очистки антимикробного белка может быть модифицирован, существенные особенности метода должны включать термообработку при температуре между 60-110°С. Также одинаково существенны методы измерения вышеназванных биологических активностей в различных фракциях. Различные применения антимикробных белков не требуют чистого белка в виде, как описано в предпочтительном методе очистке. На стадии термообработки микробные клетки такие, как Pseudomonas fluorescence, экстрагируют предпочтительно с калийфосфатным буфером рН7,4, содержащим EDTA, PMSF (phenyl methyl sulphonyl fluoride), b-меркаптоэтанол и Triton Х-100 (polyoxyethylene ether). Осаждение предпочтительно выполнять при температуре между 2°С и 6°С с охлажденным во льду хлороформом, и/или пропанолом и/или раствором сульфата аммония.
Следующий объект изобретения - использование MF3 в качестве защитного средства растения от различных микробов. MF3 предпочтительно используется в составе смесей веществ, включающих стабилизаторы, носители и/или адъюванты. Поскольку MF3 относительно устойчив, такие добавки главным образом предназначены для помощи активным ингредиентам переносить активный белок или его активные фрагменты в клетки растения и/или делать их (белки) доступными для рецепторов. Техника составления составов для различных растительных протектантов хорошо известна и описана (N.M.Golishin, 1982).
Мы показали защитные свойства MF3 на растениях табака против вируса табачной мозаики (VTM), вируса Х картофеля (PVX) и вируса Y картофеля (PVY). Мы также показали защитную (протекторную) активность на растениях картофеля против Phytophthora infestans и Erwinia carotovora, на растениях риса против Pyricularia oiyzae и на растениях пшеницы против Fusarium culmorum и Septoria nodorum, a также против типа Nematoda. В тестах использовали штамм 197 Pseudomonas fluorescence из Всероссийской Микробиологической Коллекции. Это один из бактериальных штаммов, выделенных на корневых волосках растений пшеницы в поле одной из ферм в Одинцовском районе в Московской области.
Хотя MF3 выделен из определенного микробного штамма, следует полагать, что родственные активные белки могут производиться также другими организмами, и эти белки также покрываются (включаются) в соответствии с настоящим изобретением. Принимая во внимание, что последовательность MF3 напоминает структуру известного фермента, ферментативная активность не обязательно требуется для заявленной биологической активности MF3. Напротив, потому что MF3 может быть подвергнут специфическому протеолизу или кипячению с сохранением заявленной активности, более вероятно, что другие биологические свойства MF3 обеспечивают возникновение защиты растения.
Изобретение далее иллюстрировано, но не ограничено, следующими примерами определенных воплощений изобретения.
ПРИМЕР 1. Культуральные и морфологические признаки Pseudomonas fluorescence штамм 197
Изолят культивируется на синтетической среде, содержащей 20 г/л пептона, 2,5 г/л K2HPO4, 6 г/л MgSO4, 20 г/л глюкозы. При инкубации в течение 18 часов при 28°С на агаризованной культуральной среде бактерии образуют маленькие (1,5-2 мм) сферические колонии с гладкими краями и матовой поверхностью. При инкубации в течение 18 часов при 28°С в жидкой среде при качании бактерии достигают плотности 1010 клеток/мл. Бактерии производят зеленовато-желтый прозрачный и способный флюоресцировать пигмент. Клетки - грамотрицательные, представляют собой короткие, маленькие малоподвижные палочки со жгутиками. Оптимальная температура роста для штамма 197 - это 28°С, минимальная - +4°С, а максимальная - +43°С. Оптимум рН - около 7,0. Бактерии не фиксируют атмосферный азот и не используют соединения с одним атомом углерода в качестве источника углерода. Источником углерода для бактерий служат сахароза, глюкоза, глицерин и/или другие соединения, содержащие более одного атома углерода. Бактерия является хемо-органотрофом, аэробом, содержит оксидазы и каталазы. Метаболизм - дыхательный, но не ферментативный. Результаты морфологического, культурального, физиологического и биохимического анализов позволили нам заключить, что выделенный штамм принадлежит к виду Pseudomonas fluorescence (Cion, 1948; The shorter Bergey's manual of determinative bacteriology, 1980).
После культивирования при оптимальных условиях (см. выше) бактериальные клетки собирали центрифугированием при 6000 об/мин в течение 15 минут при комнатной температуре (Sorvall-RC28S centrifuge, rotor GS-3) и дважды промывали дистиллированной водой. Клетки ресуспендировали в 50 мМ калийфосфатном буфере, рН 7,0, содержащем 1 мМ EDTA, чтобы конечная концентрация была 4-5×1010 клеток/мл. Суспензию прогревали на бане с кипящей водой в течение 20 мин и затем центрифугировали при 6000g в течение 15 минут, чтобы убрать бактериальные клетки и клеточный дебрис. Супернатант последовательно обрабатывали 1 объемом (вес/объем) холодного хлороформа и 2 объемами (вес/объем) холодного пропанола. Осадок удаляли центрифугированием в течение 15 минут при 6000g. Супернатант смешивали с холодным пропанолом так, чтобы конечная концентрация пропанола была 5 объемов. Осадок собирали центрифугированием при 10000g в течение 20 минут, а затем растворяли в 0,1М буфере Tris-HCl (рН 7,0), содержащем 0,1М NaCl, 1 мМ EDTA и 1% Triton X-100. Получающийся материал после этого прогревали в течение 2 минут в бане с кипящей водой и после охлаждения наносили на колонку с Сефадексом G-50 (1,2×90 см), уравновешенным тем же буфером. Активные фракции объединяли, упаривали и затем для осаждали, добавляя 5 объемов холодного этанола. На следующей стадии очистки проводили вертикальный гель-электрофорез в полиакриламидном геле, описанный Лэммли (1970), за исключением того, что разделяющий гель и буфер содержали Triton Х-100 вместо додецил-сульфата натрия. Использовали 20% полиакриламидный гель, содержащий 0,1% Triton X-100. Вымывание активных полос было сделано возобновлением гель-электрофореза. Для визуализации белковых полос гель окрашивался раствором Coomassie Brilliant Blue R-250. Количество белка определялось по методу Брэдфордта (1976) с бычим сывороточным альбумином в качестве стандарта.
Следующие примеры служат иллюстрацией определенных аспектов настоящей заявки. Очищенный кипяченный экстракт штамма Р. fluorescence 197 использовался в этих экспериментах. Следует отметить, что препарат может быть также получен из генетически модифицированных организмов-продуцентов таких, например, как Е. coli, описанный далее.
ПРИМЕР 2. Защитные свойства белка MF3 против вируса табачной мозаики (TMV) на растениях табака
Все штаммы и микробов, и нематод, а также сорта растений были из коллекции культур Всероссийского научно-исследовательского института фитопатологии, Голицино, Московская область, Российская Федерация. Полученный экспериментальный материал подвергался математической обработке методом статистического анализа при 95% уровне достоверности.
Растения табака (Nicotiana tabacum var. Virginia и Nicotiana glutinosa) выращивали до стадии шести листьев (около 3-х недель) в горшках с почвой в камере искусственного климата с относительной влажностью (RH) 60% и температурой 24°С при 12-часовой длине дня и ночи. Листья растений табака инокулировали кисточкой для рисования с карборундом в качестве абразива. Каждая половинка листа 3-недельных растений табака протиралась карборундом с 50 мкл экстракта Р.fluorescence. В качестве контроля брались листья растений, обработанные с таким же объемом буфера. Через два дня эти же листья были протерты с суспензией вируса табачной мозаики (0,3 мкг/мл в 10 мМ калийфосфатном буфере (рН 7,0); брали 0,3 мл/половина листа). Количество инфекционных повреждений (некрозов) на каждой половинке листа подсчитывали через 3 дня. Развитие болени измерялось как отношение числа повреждений в опыте к контролю. Результаты эксперимента показаны в Таблице 1. Очищенный экстракт из Р.fluorescence показал на растениях табака защитный эффект против TMV инфекции.
| Таблица 1 | |||
| Антивирусная активность MF3 на растениях табака | |||
| Вид табака | Число повреждений | ||
| 1-й лист | 2-й лист | 3-й лист | |
| N.glutinosa | 0/9 | 0/41 | 1/10 |
| N.tabacum var. Virginia | 0/63 | 0/106 | 0/29 |
ПРИМЕР 3. Системный характер активности MF3 против вируса табачной мозаики на растениях табака
Растения табака (Nicotiana tabacum var. Virginia и Nicotiana glutinosa) выращивали до стадии шести листьев (около 3-х недель) в горшках с почвой в камере искусственного климата с относительной влажностью (RH) 60% и температурой 24°С при 12-часовой длине дня и ночи. Два нижних листа на растении были протерты с карборундом кисточкой для рисования с 50 мкл раствора MF3. Два дня спустя те же и верхние листья были инокулированы суспензией вируса табачной мозаики. В контроле листья растений обрабатывали буфером. Результаты эксперимента представлены в Таблице 2.
| Таблица 2 | ||||||
| Количество повреждений на листьях всего тестируемого растения, предварительно обработанного раствором MF3. Показана системная антивирусная активность MF3 | ||||||
| Нижние листья обработаны с MF3 | Нижние листья обработаны | |||||
| Растение | №1 | №2 | №3 | №4 | №5 | №6 |
| Верхние | 0 | 1 | 0 | 570 | 585 | 388 |
| Нижние | 4 | 3 | 0 | 270 | 185 | 43 |
ПРИМЕР 4. Активность MF3 против Pyricularia oryzae на растениях риса
Был использован природный изолят Н-5-3 of Pyricularia oryzae Cav. Грибок культивировался при 28°С на агаризованной минимальной среде, содержащей 3 мг/мл гидролизата казеина (Sigma). Споры (конидии) 10-дневной культуры промывались с дистиллированной водой при 4°С. Примесь мицелия удаляли фильтрованием через нетканный фильтр (Miracloth, Calbiochem-Boehring Corp.) и через два слоя стальных сит (размер пор 50 мкм). Суспензия спор промывали двойным центрифугированием в течение 15 минут при 7000g и ресуспендировали в дистиллированной воде. Концентрацию спор определяли подсчетом в гемоцитометре под микроскопом.
Для анализа использовали растения риса (Oryza saliva L. of cv. Sha-tiao-tsao), чувствительные к вынеупомянотому штамму грибка. Растения выращивали до стадии четырех листьев (около 13-15-ти дней) в горшках с почвой в камере искусственного климата с относительной влажностью (RH) 95% и температурой 30°С днем и 23°С ночью при 12-часовой длине дня и ночи. Для освещения (20 клюкс) использовали 10 кВт ксеноновые лампы (DKsT-10000) с водяным фильтром. Растения риса опрыскивали суспензией спор (100000 спор/мл, 5 мл/горшок). Обработанные растения инкубировали в течение 18-24 часов во влажной камере в темноте при 23°С, а затем переносили на свет в камеру искусственного климата для наблюдения за развитием симптомов заболевания в течение 10 дней. Чтобы оценить жизнеспособность инокулята, каплю суспензии спор инкубировали в течение 15 часов в иммунологической плашке в темноте при 23°С. Затем подсчитывали проростание спор. Раствор препаратов MF3 в буфере добавляли в инокулят со спорами. Контрольные образцы содержали равный объем буфера.
Все препараты MF3 в использованных концентрациях не подавляли прорастание в воде спор Р.oiyzae. В то же время добавление препаратов в инокуляты защищало растения риса от болезни в значительной степени.
| Таблица 3 | ||||
| Антипирикуляриозная активность различных бактериальных препаратов Psendomonas | ||||
| Бактериальный препарат | Белок (мкг/м л) | Количеств о растений (шт.) | Тип инфекции число повреждений × тип | Развитие болезни (%) |
| Кипяченый экстракт | 90 | 22 | 1×0; 10×0.1; 3×1; 8×2 | 30 |
| Осажденный | 50 | 24 | 17×0.1; 3×1 | 6.5 |
| 20 | 26 | 1×01; 1×2; 1×0.1; 1×2; | 9.1 | |
| 5 | 25 | 1×0.1; 2×1; 12×1; 2×3 | 27 | |
| Фракции с колонки Сэфалекс G-50 | 3 | 22 | 5×1; 10×0.1; 2×2 | 15 |
| контроль | 0 | 23 | 1×0.1; 4×1; 13×2; 5×3 | 70 |
| *Тип инфекции определяли согласно Latterel et al., 1964. |
Развитие болезни вычисляли по формуле:
R - развитие болезни (%);
а - количество инфицированных
растений;
b - тип инфекции;
N - общее количество растений;
3 - высший тип инфекции.
ПРИМЕР 5. Активность MF3 против Septoria nodorum на растениях пшеницы
Использовали природный изолят Septoria nodorum. Растения пшеницы (Мироновская 808) выращивали до стадии двух листов (около 13-15-дней) в горшках с почвой в камере искусственного климата.
Срезанные листья пшеницы помещали в чашки Петри, содержащие 2% агар и 40 мг/л бензимидазола. На верхнюю часть каждого листа капали 5 мкл MF3 (в концентрации 1,25 мг/мл и 2,5 мг/мл), а на нижнюю часть каждого листа - 5 мкл буфера (для контроля). Через два дня все капли с листьев удаляли с помощью стерильной марли и наносили по 5 мкл суспензии спор (106 /мл). Чашки Петри помещали в темную комнату на один день, а затем переносили на свет (8-10 klux) под 10 кВт ксеноновую лампу (DKsT-10000) при температуре 20-22°С и длине светового дня 16 часов. Симптомы заболевания анализировали через 7 дней.
| Таблица 4 | |||
| Активность MF3 против Septoria nodorum ш на срезанныз листьях пшеницы | |||
| контроль/ эксперимент | Белок (мг/мл) | Степень болезни, (балл) | Ингибирование болезни, (%) |
| эксперимент - 1 | 1.25 | 0.9 | 69.2±16 |
| контроль - 1 | 0.0 | 3.1 | 0.0 |
| эксперимент - 2 | 2.5 | 1.2 | 59.2±13 |
| контроль - 2 | 0.0 | 3.2 | 0.0 |
Как видно по результатам в Таблице 4, MF3 защищает листья растений пшеницы от поражения Septoria nodorum в значительной степени.
ПРИМЕР 6. Заражение зерновки пшеницы бактериями Pseudomonas fluorescence штамм 197 вместе с Fusarium culmorum (W.G.Sm) Sacc. и стимуляция роста растений
Инокулят патогена был получен из 10-дневной культуры двух изолятов F.culmorum, которые выращивали на картофельно-декстрозном агаре. Концентрация конидий в суспензии была примерно 2×106 /мл. Тест проводили на растениях пшеницы Мироновская 808. Обработка зерновки пшеницы суспензией клеток Pseudomonas fluorescence штамм 197 или очищенным экстрактом из бактериального штамма защищала семена пшеницы от F. culmorum, вызывающей корневые гнили пшеницы, при смешенном заражении на рулонах бумаги для прорастания в лабораторных экспериментах (см. детали ниже).
Бактерии культивировали на следующей среде:
2 г/л гидролизата казеина, 10 г/л сахарозы, 3 г/л дрожжевого экстракта, 2,5 г/л NaNO3,
0,5 г/л MgSO4*7H2O, 1 г/л КН3PO4, 20 г/л агар в дистиллированной воде.
Бактерии использовали на 6-й день культивирования. Концентрация клеток в использованной суспензии была 107-108 кл/мл.
Зерновку озимой пшениы стерилизовали в 96% этаноле 1 минуту, затем промывали в стерильной воде, помещали во влажные чашки Петри и инкубировали 24 часа при 23-24°С. Затем проросшие зерна переносили в другие чашки Петри (по 30 зерен на чашку) и смачивали их суспензией конидий F. culmorum и/или клетками штамма 197. Общий объем суспензии - 10 мл/чашка (5 мл суспензии F.culmorum и 5 мл суспензии клеток штамма 197 при смешенном заражении или 5 мл одной из суспензий и 5 мл стерильной воды при раздельном заражении).
Через 24 часа зерна помещали между двумя листами (16×8 5 см и 6×85 см) сухой бумаги для прорастания (30 зерен на пару листов), которые затем покрывали стерильной полиэтиленовой пленкой (6×90 см) и скручивали в рулон. По три рулона/реплика было использовано в каждой обработке. Рулоны помещали в отдельные сосуды, смачивали водой и инкубировали в темноте при 22-23°С в течение 6 дней. Затем рулоны переносили на лабораторный стол и инкубировали при 19-20°С и 12-часовом дне в течение 6 дней. Рулоны смачивали водой по мере их высыхания. Затем определяли количество проросших зерен, измеряли длину побегов и самого длинного из корней и их сухой вес.
| Таблица 5 | |||||
| Количество проросших зерен, длина побегов, корней и сухой вес при раздельном и смешанном заражении F.culmorum и штаммом 197 | |||||
| Обработка (состав инокулята) | Количество проросших зерен | Длина (см) | Сухой вес (мг) | ||
| Побег | Корень | Побег | Корень | ||
| контроль | 25.7 | 15.5 | 16.1 | 9.2 | 6.2 |
| F.culmorum | 17.0 | 10.4 | 12.8 | 5.8 | 4.3 |
| F.culmorum ++ st. -197(107) | 17.7 | 12.9 | 15.5 | 7.7 | 5.4 |
| F.culmorwn ++ str. -197(108) | 18.3 | 12.7 | 15.0 | 7.1 | 5.1 |
| Str. 197(108) | 28.7 | 16.0 | 17.1 | 9.6 | 7.1 |
| HCP0,95 | 2.0 | 0.8 | 0.9 | 1.0 | 0.5 |
| * - наименьшее среднее отклонение при 95% уровне достоверности. |
Анализ данных в Таблице 5 свидетельствует о том, что штамм 197 существенно уменьшает развитие болезни. Длина побегов была на 22-23%, максимальная длина корней на 18-21%, сухой вес побегов на 22-23%, а сухой вес корней на 19-26% больше при смешанном заражении, чем при заражении только F.culmorum. He было существенной разницы между обработками бактериями в концентрациях 107-108 кл/мл при смешанном заражении.
При оценке влияния клеточного экстракта Pseudomonas fluorescence штамм 197 бактерии культивировали в жидкой среде, содержащей 20 г/л пептона, 2,5 г/л KH2PO4, 6 г/л MgSO4×7H2O, 20 г/л сахарозы, и использовали на второй день культивирования. Концентрация суспензии была около 1010 клеток/мл.
MF3 готовили следующим образом: бактериальные клетки промывали дважды водой и суспендировали в 10 мМ натрийфосфатном буфере (рН 7,5), чтобы концентрация клеток была более чем в 10 раз выше, чем в культуральной среде. Затем суспензию кипятили в течение 30 минут на бане с кипящей водой. Клеточный дебрис убирали центрифугированием, а супернатант использовали в эксперименте, предварительно разведя его в 15 раз.
Нестерильные зерна пшеницы помещали в мелкую посуду (90 зерен на сосуд) и заливали 5 мл клеточной суспензии, или клеточного экстракта Pseudomonas fluorescence, или стерильной воды, и инкубировали при 20°С в течение 5 часов. Затем добавляли в сосуды 5 мл суспензии спор F.culmorum (2×106 спор/мл) или 5 мл стерильной воды в зависимости от эксперимента. После 24-часовой инкубации в сосудах зерна помещали между двумя (16×85 см и 6×85 см) сухой бумаги для прорастания (30 зерен на пару листов), которые затем покрывали стерильной полиэтиленовой пленкой (6×90 см) и скручивали в рулон. По три рулона/реплика было использовано в каждой обработке. Рулоны помещали в отдельные сосуды, смачивали водой и инкубировали в темноте при 22-23°С в течение 6 дней. Затем рулоны переносили на лабораторный стол и инкубировали при 19-20°С и 12-часовом дне в течение 6 дней. Рулоны смачивали водой по мере их высыхания. Количество проросших зерен, длина побегов и самого длинного из корней и их сухой вес представлены в Таблице 6.
| Таблица 6 | |||||
| Количество проросших зерен, длина побегов, корней и их сухой вес при раздельном и смешанном заражении зерен пшеницы F.culmorum и клеточной суспензией Pseudomonas fluorescence (str.197) или ее экстрактом | |||||
| Опыт | Количество проросших зерен | длина (см) | Сухой вес (мг | ||
| побеги | корни | побеги | корни | ||
| контроль | 25.0 | 16.1 | 17.2 | 11.5 | 5.5 |
| F.culmorum | 18.7 | 10.3 | 12.2 | 5.9 | 3.0 |
| F.culmoiiimJr MF3 | 18.0 | 12.1 | 14.3 | 7.3 | 3.7 |
| F.culmorwn ++ Str.197 | 18.7 | 12.2 | 13.0 | 7.3 | 3.4 |
| MF3 | 24.3 | 17.2 | 17.2 | 12.5 | 5.7 |
| str. 197 | 25.3 | 18.5 | 18.6 | 14.1 | 5.7 |
| HCP0,95 | 4.4 | 0.8 | 1.1 | 1.0 | 0.6 |
Длина побегов была на 17.3-18.6%, максимальная длина корней на 6.6-17.4%, сухой вес побегов на 23.1-23.6%, а сухой вес корней на 12.3-24.3% больше при смешанном заражении, чем при заражении только F.culmorum. Длина побегов и вес проростков, обработанных клеточным экстрактом Pseudomonas fluorescence (str.197), были на 14.7% и 22.0%, соответственно, больше, чем в контроле.
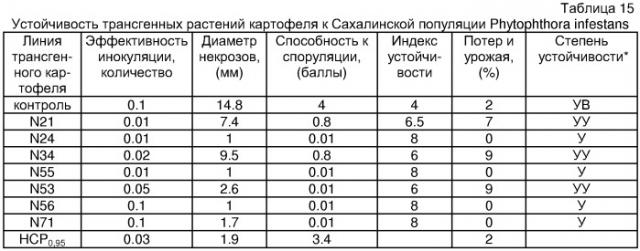
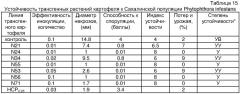
ПРИМЕР 7. Защитная активность MF3 против фитофтороза
В тесте использовали природный изолят Phytophtora infestans и растения картофеля сорт «Лорх». Чтобы исследовать влияние обработки препаратами штамма 197 на инфекцию Ph.infestans, клубни картофеля смачивали бактериальной суспензией (107 кл/мл). Через 7-10 дней эти клубни высаживали в теплицу. Листья с выросших растений картофеля срезали и заражали вирулентной расой Ph.infestans, чтобы определить степень проникновения, скорость развития симптомов, интенсивность споруляции и скорость колонизации клубней. Листья, срезанные с растений, полученных из необработанных перед посадкой клубней, использовали как контроли.
Интенсивность проникновения измеряли, заражая нижнюю сторону срезанных листьев картофеля путем опрыскивания суспензией спор Ph.iInfestans (103 спор/мл) с последующей инкубацией в течение 2-3-дней при 18-20°С во влажной камере. Далее определяли количество повреждений на см2 поверхности листа. Результаты типичного эксперимента представлены в Таблице 7.
| Таблица 7 | ||||||
| Количество повреждений поверхности листа растений картофеля, зараженных Ph. infestans | ||||||
| образец | количество повреждений на см2 | m±(P=0.95) | ||||
| Листья с необработанных растений | 6.5 | 9.2 | 6.7 | 7.1 | 10.3 | 8.0±2.1 |
| Листья с обработаных растений | 1.4 | 3.3 | 2.6 | 1.5 | 3.0 | 2.4+1.1 |
Для определения скорости развития повреждений нижнюю сторону срезанных листьев картофеля заражали каплей суспензии спор Ph.infestans (около 103 спор/мл). Скорость развития симптомов определяли, измеряя диаметр повреждений на 4-й или 5-й день после заражения. Результаты анализа представлены в Таблице 8.
| Таблица 8 | ||||||
| Диаметр повреждений, образующихся после заражения Ph. infestans на листьях картофеля растений | ||||||
| Диаметр повреждений листа | m±(Р=0.95) | |||||
| Листья необработанных растений | 39 | 41 | 38 | 43 | 37 | 39.6+5.4 |
| Листья обработанных MF3 растений | 5 | 4 | 6 | 5 | 3 | 4.6±2.9 |
Интенсивность споруляции определяли, вычисляя количество спор, образуемых при единичном повреждении. Заражение проводили аналогично описанному выше тесту. На 5-й ден