Альдегидные производные сиаловой кислоты, способы их получения, конъюгаты альдегидных производных сиаловой кислоты и фармацевтическая композиция на их основе
Иллюстрации
Показать всеИзобретение относится к альдегидным производным и конъюгатам ди-, олиго- или полисахарида, имеющим общую формулу (I),к способам их получения и фармацевтической композиции, обладающей способностью длительное время удерживаться в кровотоке, на их основе.
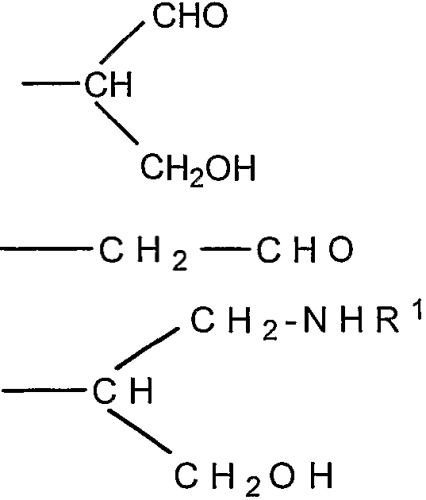
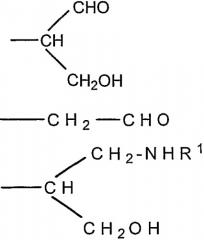
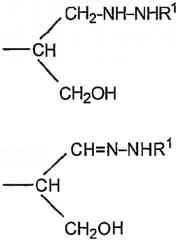
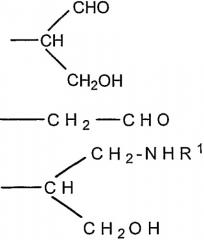
где R представляет собой -СН(СНО)СН2ОН, -СН2СНО, -CH(СН2NHR1)СН2ОН, -CH(CH2NHNHR1)CH2OH, -CH(CH=NNHR1)CH2OH, -CH2CH2NHR1, -CH2CH=N-NHR1, -CH2CH2NHNHR1; R1 представляет собой полипептид или белок; GlyO представляет собой звено сиаловой кислоты; R3 представляет собой Н; R4 представляет собой ОН; п равно 2 и более. 5 н. и 15 з.п. ф-лы, 7 табл., 22 ил.
Реферат
Настоящее изобретение относится к производным соединений, таких как полисахариды, имеющие по крайней мере терминальные сиаловые звенья и предпочтительно состоящие из звеньев сиаловой кислоты, содержащих альдегидную группу для реакции с субстратами на восстанавливающем терминале и способам их получения. Производные пригодны для превращения в другие реакционно-активные производные и для конъюгации с такими субстратами, содержащими аминогруппу, как пептиды, белки, лекарственные препараты, системы для доставки лекарственных препаратов (например, липосомы), вирусы, клетки, например животные клетки, микроорганизмы, синтетические полимеры и т.д.
Полисиаловые кислоты (PSA) представляют собой природные неразветвленные полимеры сиаловой кислоты, вырабатываемые определенными штаммами бактерий и в определенных клетках у млекопитающих (Roth et al., 1993). Их можно получать с различной степенью полимеризации, от n = примерно 80 или более остатков сиаловой кислоты до n=2, неполным кислотным гидролизом или расщеплением нейраминидазами, или фракционированием природных вырабатываемых бактериями видов полимера. Состав различных полисиаловых кислот также изменяется таким образом, что существуют гомополимерные формы, т.е. альфа-2,8-связанная полисиаловая кислота, включающая капсульный полисахарид штамма К1 E. coli и В-группы менингококков, который также обнаруживают в эмбриональной форме молекулы клеточной адгезии нейрона (N-CAM). Также существуют гетерополимерные формы, такие как чередующаяся альфа-2,8 альфа-2,9 полисиаловая кислота штамма К92 E. coli и полисахариды С группы N. meningitidis. Сиаловую кислоту также можно обнаружить в чередующихся сополимерах с мономерами, отличающимися от сиаловой кислоты, таких как группа W135 или группа Y N. meningitidis. Полисиаловые кислоты обладают важным биологическим действием, включая уклонения патогенных бактерий от иммунной системы и системы комплемента и регуляцию глиоцетарной адгезивности незрелых нейронов в ходе эмбрионального развития (где полимер обладает антиадгезивным действием) [Muhlenhoff et. al., 1998; Rutishauser, 1989; Troy, 1990, 1992; Cho and Troy, 1994], хотя рецепторы полисиаловых кислот у млекопитающих не известны. Альфа-2,8-связанная полисиаловая кислота штамма К1 E. coli также известна как «коломиновая кислота» и ее (различной длины) используют в качестве примера настоящего изобретения.
Среди бактериальных полисахаридов альфа-2,8 связанная форма полисиаловой кислоты представляет собой единственную неиммуногенную (не вызывающую ни ответа Т-клеток, ни образования антител у млекопитающих, даже при конъюгации с иммуногенными носителями белками), что может отражаться на ее статусе как полимера млекопитающих (так же, как и бактериального). Более короткие формы полимера (до n=4) обнаруживают в ганглиозидах клеточной поверхности, которые широко распространены в организме и считаются эффективными для сообщения и поддержания иммунологической толерантности по отношению к полисиаловой кислоте. В последние годы биологические свойства полисиаловых кислот, в особенности биологические свойства альфа-2,8 связанной гомополимерной полисиаловой кислоты, были использованы для модификации фармакокинетических свойств белковых или низкомолекулярных молекул лекарственных веществ [Gregoriadis, 2001; Jain et al., 2003; US-A-5846951, WO-A-0187922]. Получение производных полисиаловой кислоты приводит к сильному улучшению с точки зрения периода полувыведения некоторого ряда терапевтических белков, включая каталазу и аспарагиназу [Fernandes and Gregoriadis, 1996 and 1997], а также делает возможным использование таких протеинов несмотря на ранее существовавшие антитела, возникшие как нежелательное (и в некоторых случаях неизбежное) следствие предшествующего воздействия терапевтического белка [Fernandes and Gregoriadis, 2001]. Во многих отношениях модифицированные свойства полисиалилированных белков сравнимы с белками, производными полиэтилен гликоля (PEG). Например, и в том и в другом случае увеличивается период полувыведения и белки и пептиды являются более стабильными по отношению к протеолитическому расщеплению, но сохранение биологической активности кажется большим у PSA по сравнению с PEG [Hreczuk-Hirst et al., 2002]. Также возникают вопросы об использовании PEG с терапевтическими агентами, которые следует вводить постоянно, поскольку PEG подвергается только очень медленному биологическому разрушению [Beranova et al., 2000] и формы с высокой молекулярной массой имеют тенденцию накапливаться в тканях [Bendele et al., 1998; Convers et al., 1997]. Было обнаружено, что полиэтиленгликолированные белки приводят к образованию анти-PEG антител, которые могут также влиять на время задержки конъюгата в кровотоке [Cheng et al., 1990]. Несмотря на то, что PEG исторически используют в качестве парентерально вводимого полимера, конъюгированного с лекарственными препаратами, требуется лучшее понимание его иммунотоксикологии, фармакологии и метаболизма [Hunter and Moghimi, 2002; Brocchini, 2003]. Также существуют сомнения по поводу использования PEG в терапевтических агентах, которые могут требовать высокой дозировки, поскольку аккумуляция PEG может приводить к токсичности. Следовательно, альфа-2,8-связанная полисиаловая кислота (PSA) предлагает привлекательную альтернативу PEG, представляя собой иммунологически невидимый биологически разрушаемый полимер, являющийся естественной частью человеческого организма, и который разрушается тканевыми нейроаминидазами до сиаловой кислоты, нетоксичного сахарида.
Группа заявителей описала в предшествующих научных публикациях и выданных патентах пользу от применения природных полисиаловых кислот для улучшения фармакокинетических свойств белковых терапевтических агентов [Gregoriadis, 2001; Fernandes and Gregoriadis, 1996, 1997, 2001; Gregoriadis et al., 1993, 1998, 2000; Hreczuk-Hirst et al., 2002; Mital, 2004; Jain et al., 2003, 2004; US-A-05846951; WO-A-0187922]. Теперь заявители описывают новые производные PSA, которые делают возможными новые композиции и способы получения PSA-производных белков (и других форм терапевтического агента). Эти новые вещества и способы в особенности применимы для получения PSA-производных терапевтических агентов, предназначенных для использования у человека и животных, в которых основную важность представляет собой химическое и молекулярное определение лекарственных объектов из-за требований безопасности, медицинской этики и распорядительных органов (Управление по контролю за продуктами и лекарствами США (FDA), EMEA).
Ранее были описаны способы для присоединения полисахаридов к терапевтическим агентам, таким как белки [Jennings and Lugowski, 1981; US-A-5846951; WO-A-0187922]. Некоторые из этих способов зависят от химического производного «не восстанавливающего» конца полимера для получения альдегидного остатка, реакционно-способного по отношению к белку (фиг.1). Это происходит потому что восстанавливающий конец PSA и других полисахаридов имеет низкую реакционную способность по отношению к белкам в мягких условиях, необходимых для сохранения белковой конформации и химической целостности PSA и белка в ходе конъюгации. Невостанавливающее терминальное звено сиаловой кислоты, поскольку оно содержит вицинальные диолы, может быть легко (и селективно) окислено периодатом с получением моноальдегидной формы, которая является в значительной степени более реакционно-активной по отношению к белкам и которая включает пригодный реакционно-способный элемент для присоединения белков посредством восстановительного аминирования и других химических реакций. Заявители ранее описывали это в US-A-5846951 и WO-A-0187922. Реакция проиллюстрирована на фиг.1, где
а) показывает окисление коломиновой кислоты (альфа-2,8 связанной полисиаловой кислоты E. coli) периодатом натрия с получением реакционно-способного в отношении белков альдегида на невосстанавливающем конце и
b) показывает селективное восстановление основания Шиффа цианборгидридом натрия с получением стабильной необратимой ковалентной связи с аминогруппой белка.
Из различных способов, которые были описаны для присоединения полисиаловых кислот к терапевтическим агентам [US-A-5846951; WO-A-0187922], ни один из них не является специально предназначенным для конъюгирования по восстанавливающему концу из-за его низкой реакционной способности по отношению к терапевтическим белкам. Хотя реакция теоретически пригодная, достижение приемлемых выходов конъюгата посредством реакции белков с полукеталем восстанавливающего конца PSA требует времени реакции, которое не представляется благоприятным для стабильности белка. Во-вторых, необходимы концентрации реагента (избытка полимера), которые могут быть недостижимыми или экономически невыгодными. Тем не менее, несмотря на неэффективность этой реакции, заявители заметили, что она приводит к побочным продуктам в ходе реакций конъюгации, предназначенных для получения конъюгатов с белком посредством введенного альдегида на (противоположном) невосстанавливающем конце полимера. Потенциал таких побочных продуктов очевиден в опубликованных исследованиях по каталазе, инсулину и аспарагиназе [Fernandes and Gregoriadis, 1996, 1997, 2001; Jain et al. 2003], в которых полукеталь природной (химически не модифицированной) формы полимера дает начало белковым конъюгатам с низкой степенью эффективности (менее 5% белка становится производными, см. далее ниже в примерах сравнения и таблице 1) в ходе восстановительного аминирования.
Реакционная активность восстанавливающего конца коломиновой кислоты, хотя и низкая по отношению к белковым мишеням, достаточна для того, чтобы причинять беспокойство при производстве химически определенных конъюгатов такого типа для того, чтобы быть предпочтительными с точки зрения распорядительных органов при терапевтическом использовании у человека и животных. В отличие от природного полимера коломиновой кислоты, который в слабой степени является монофункциональным, форма PSA, окисленная периодатом (имеющая альдегид на одном конце и полукеталь на другом), неизбежно приводит к получению комплекса продуктов, которые серьезно затрудняют задачу получения молекулярно определенных и фармацевтически приемлемых конъюгатов (фиг.2). Фиг.2а представляет собой принципиальную схему, показывающую образование побочных продуктов в ходе полисиалилирования (исходный способ). Фиг.2b представляет собой более подробную принципиальную схему, показывающую образование побочных продуктов в ходе полисиалилирования (исходный способ), конкретно
i) асимметрического димера;
ii) линейного полимера;
iii) разветвленного полимера и
iv) различных более сложных структур.
С первого взгляда казалось бы простым очистить ожидаемый реакционный продукт от различных побочных продуктов, описанных на фиг.2, однако не существует способов прямой очистки, поскольку физико-химические свойства ожидаемых форм (размер, заряд и т.д.) являются в значительной степени одинаковыми, в действительности почти идентичными по сравнению с намеченными формами продукта. Это исключило бы необходимость очистки ожидаемых типов из реакционной смеси такими способами как ионообменная хроматография и гельпроникающая хроматография (которые разделяют на основе заряда и размера соответственно) и исключило бы многие другие способы очистки. В настоящий момент заявители решили указанные проблемы разработкой нового способа конъюгации полисахаридов, содержащих группы сиаловой кислоты на восстанавливающем терминальном конце, с белками, в соответствии с чем низкая реакционная способность восстанавливающего конца может быть использована как благоприятное воздействие, которое исключает сложность получения продукта, описанную на Фиг 2(b) при использовании установленного способа (фиг.1) восстановительного аминирования белков с окисленной периодатом природной коломиновой кислотой.
Jennings and Lugovski в патенте США 4356170 описывают получение производных бактериальных полисахаридов с белками за счет активированного восстанавливающего терминального звена, включающее стадию предварительного восстановления и затем стадию окисления. Они предлагают этот подход в том случае, если терминальное восстанавливающее звено представляет собой N-ацетил маннозамин, глюкозу, глюкозамин, рамнозу и рибозу.
В Европейской заявке на патент EP-A-0454898 аминогруппу белка связывают с альдегидной группой, полученной восстановлением и частичным окислением восстанавливающего терминального остатка сахара глюкозаминогликана. Глюкозаминогликаны, обработанные таким образом, включают гиалуроновую кислоту, хондроитинсульфат, гепарин, гепаринсульфат и дерматансульфат. Ни одно из указанных соединений не содержит звена сиаловой кислоты на восстанавливающем терминальном конце.
В изобретении обеспечивается новый способ получения альдегидного производного сиаловой кислоты, в котором исходное вещество, содержащее звено сиаловой кислоты на своем восстанавливающем терминальном конце, подвергают последовательным стадиям:
a) восстановления до восстановленного раскрытого кольца восстановливающего терминального звена сиаловой кислоты с образованием вицинальной диольной группы; и
b) селективного окисления вицинальной диольной группы, полученной в стадии а) с получением альдегидной группы.
Исходное вещество предпочтительно представляет собой ди-, олиго-, или полисахарид, хотя изобретение может иметь применение и для других исходных веществ.
Исходное вещество, используемое в способе по изобретению, должно предпочтительно содержать звено сиаловой кислоты на восстанавливающем терминальном конце, присоединенное к соседнему звену посредством восьмого атома углерода. В стадии b) 6,7-диольную группу окисляют с образованием альдегида при 7 атоме углерода.
В альтернативном варианте осуществления, в котором звено сиаловой кислоты на восстанавливающем терминальном конце связано с соседним звеном посредством 9 углеродного атома, в стадии b) получают 7,8-диольную группу и окисляют с получением альдегида при 8 атоме углерода.
В способе по изобретению, в котором исходное вещество представляет собой ди-, олиго- или полисахарид, предпочтительно, чтобы исходное вещество имело на невосстанавливающем конце терминальную сахаридную группу, содержащую вицинальную диольную группу, и в котором исходное вещество подвергают предварительной стадии перед стадией а), селективного окисления вицинальной диольной группы до альдегида, в соответствии с чем в стадии а) альдегид также восстанавливают до образования гидроксигруппы, которая не является частью вицинальной диольной группы. Изобретение в особенности приемлемо в том случае, если терминальное звено восстанавливающего конца исходного вещества представляет собой звено сиаловой кислоты. В альтернативном варианте осуществления исходное вещество может иметь вицинальную диольную группу, которая остается в таком виде на невосстанавливающем терминальном сахаридном звене исходного вещества для стадии а). Она не будет модифицирована стадией восстановления, но будет окислена на стадии окисления с образованием альдегидной группы. Продукт будет бифункциональным и может проявлять полезные терапевтические активности из-за его способности сшивать субстраты по реакции обеих альдегидных групп с приемлемыми функциональными группами субстрата.
Согласно второму аспекту изобретения обеспечивают новый способ, в котором сиаловую кислоту исходного вещества, имеющего терминальную сиаловую кислоту на невосстанавливающем терминальном конце, подвергают следующим стадиям:
c) стадии селективного окисления невосстанавливающего терминального звена сиаловой кислоты в 7,8-вицинальную диольную группу для образования 7-альдегида; и
d) стадию восстановления 7-альдегидной группы до соответствующего спирта.
Этот аспект изобретения обеспечивает производные сиаловой кислоты, которые имеют пассивированный невосстанавливающий терминальный конец, делающим возможным активацию восстанавливающего терминального конца для последующей реакции. Активация может представлять собой восстановление/окисление, например, первого аспекта изобретения с необязательными последующими стадиями превращения альдегидной группы в другую группу, такими как аминирование с образованием амина. Могут быть разработаны другие стадии для активации восстанавливающего терминального конца.
Предпочтительно этот второй аспект изобретения представляет собой часть способа, в котором исходное вещество имеет восстанавливающее терминальное звено и впоследствии требует быть конъюгированным с другой молекулой посредством указанного звена. В таком способе восстанавливающее терминальное звено обычно активируют, например, реакцией, которая бы иным способом активировала часть невосстанавливающих терминальных звеньев сиаловой кислоты, в том случае, если она не приводит к пассивации. Такая реакция, например, представляет собой селективное окисление вицинального диольного фрагмента и ее проводят после стадии d).
В изобретении предпочтительное полисахаридное исходное вещество может содержать в молекуле звенья, отличные от сиаловой кислоты. Например, звенья сиаловой кислоты могут чередоваться с другими сахаридными звеньями. Предпочтительно однако, чтобы полисахарид содержал в значительной степени только звенья сиаловой кислоты. Предпочтительно они соединены 2→8 и/или 2→9.
Предпочтительно полисахаридное исходное вещество имеет по крайней мере 2, более предпочтительно по крайней мере 5, более предпочтительно по крайней мере 10, например по крайней мере 50 сахаридных звеньев. Например, полисахарид может включать по крайней мере 5 звеньев сиаловой кислоты.
Полисиаловую кислоту можно получать из любого источника, предпочтительно природного источника, такого как бактериальный источник, например E. coli K1 или K92, менингококков группы В, или даже коровьего молока, или N-CAM полимер сиаловой кислоты может быть гетерополимерным, таким как группа 135 или группа V N. meningitides. Полисиаловая кислота может быть в форме соли или свободной кислоты. Она может быть в гидролизованной форме, такой, чтобы молекулярная масса уменьшалась после выделения из бактериального источника. Полисиаловая кислота может быть веществом с широким диапазоном молекулярных масс, таким, чтобы полидисперсность составляла более 1,3, например составляла 2 или более. Предпочтительно полидисперсность молекулярной массы составляет менее 1,2, например составляет до 1,01.
Часть полисиаловых кислот, с широким диапазоном молекулярной массы, может быть фракционирована с низкими полидисперсностями, т.е. на фракции с различными значениями средней молекулярной массой. Фракционирование представляет собой предпочтительно анионообменную хроматографию при элюировании подходящим основным буфером. Заявители обнаружили пригодную анионообменную среду i) препаративную среду, такую как сильное ионообменное вещество на основе активированной агарозы, содержащей в боковых группах четвертичный аммониевый ион (т.е. сильное основание). Элюционный буфер не реакционно-активен и предпочтительно является летучим, так что желаемый продукт можно выделять из основания каждой фракции выпариванием. Пригодными примерами являются амины, такие как триэтаноламин. Выделение может представлять собой, например, лиофильную сушку. Способ фракционирования пригоден для полисиаловой кислоты в качестве исходного вещества так же, как и для ее производных. Технологический способ можно, таким образом, использовать до или после необходимых стадий способа по изобретению.
Заявители считают, что впервые ионообменную хроматографию применяют для получения фракций ионных полисахаридов с молекулярной массой более примерно 5 кДа, в особенности полисиаловой кислоты с такой молекулярной массой (MW). Согласно дополнительному аспекту настоящего изобретения обеспечивают способ для фракционирования части ионизируемого полисахарида с молекулярной массой (MW) выше чем 5 кДа при использовании ионообменной хроматографии с элюционным буфером основания или кислоты, которое предпочтительно является летучим. Предпочтительно полисахарид содержит группы карбоновых кислот и ионный обмен представляет собой анионный обмен. Предпочтительно элюционный буфер содержит амин, более предпочтительно триэтаноламин. Более предпочтительно полисахарид выделяют из фракции при помощи лиофильной сушки. Этот способ можно применять для фракционирования коломиновой кислоты (CA), содержащей другие реакционно-активные фрагменты (имид малеиновой кислоты или иодацетат и т.д.) или другие природные (например, декстрансульфат) или синтетические (например, полиглутаминовая кислота, полилизин в последнем случае при использовании катионообменной хроматографии) заряженные полимеры. Заявители полагают, что также впервые ионообменную хроматографию (IEC) используют для разделения ионных полисахаридов в сочетании с технологическими способами осаждения и/или способами ультрафильтрации. Способы IEC должны удалять также побочные продукты получения как эндотоксины, которые остаются в коммерчески доступных PSA и СА.
В предварительной стадии окисления и стадии с) селективное окисление следует предпочтительно проводить при таких условиях, чтобы в значительной степени не происходило расщепления в средней части основной углеводородной цепи длинноцепного (полимерного) исходного вещества, чтобы не происходило уменьшения молекулярной массы. Можно использовать ферменты, отвечающие за проведение этой стадии. Наиболее удобно, чтобы окисление представляло собой химическое окисление. Реакцию можно проводить с иммобилизированными реагентами, такими как перрутенат на основе полимера. Наиболее прямой способ проводят с растворенными реагентами. Окислитель представляет собой перрутенат или, предпочтительно, периодат. Окисление можно проводить периодатом при концентрации в диапазоне от 1 мМ до 1 М, при рН в диапазоне от 3 до 10, температуре в диапазоне от 0 до 60°С в диапазоне от 1 минуты до 48 часов.
В способе стадия а) представляет собой стадию, в которой звено сиаловой кислоты на восстанавливающем конце восстанавливают. Обычно звено на восстанавливающем конце исходного вещества находится в форме кетального кольца и восстановление в стадии а) раскрывает кольцо и восстанавливает кетон до спирта. Таким образом, гидроксильная группа при 6-углеродном атоме представляет собой часть вицинального диольного фрагмента.
При подходящих условиях восстановление (для стадий а) и d)) можно использовать водород с катализаторами или предпочтительно гидриды, такие как бор. Они могут быть иммобилизированными, как, например, Amberlite (торговая марка) - боргидрид на подложке. В качестве восстанавливающего агента предпочтительно используют гидриды щелочных металлов, такие как боргидрид натрия при концентрации в диапазоне от 1 мкМ до 0,1 М, при рН в диапазоне от 6,5 до 10, при температуре в диапазоне от 0 до 60°С в диапазоне от 1 минуты до 48 часов. Условия реакции выбирают таким образом, чтобы боковые карбоксильные группы исходного вещества не восстанавливались. Когда предварительная стадия окисления проведена, полученную альдегидную группу восстанавливают до спиртовой группы, не являющейся частью вицинальной диольной группы. Другими пригодными восстанавливающими агентами являются цианоборгидрид в кислых условиях, например цианоборгидрид на полимерной подложке или цианоборгидрид щелочного металла, L-аскорбиновая кислота, мета-бисульфит натрия, L-селектрид, триацетоксиборгидрид и т.д.
Между любой предварительной стадией окисления и стадией восстановления а) и после стадии b), и между стадией окисления с) и стадией восстановления d), и между стадией d) и любой последующей стадией окисления соответствующий интермедиат должен быть отделен от соответствующих окисляющих и восстанавливающих агентов соответственно перед последующей стадией. Если стадию проводят в жидкой фазе, отделение можно проводить обычными способами, такими как расходование избытка окисляющего агента при использовании этиленгликоля, диализ полисахарида и ультрафильтрация для концентрирования водного раствора. Смесь продуктов из стадии восстановления вновь можно разделять диализом и ультрафильтрацией. Можно предложить реакции, проводимые при использовании иммобилизованных окисляющих или восстанавливающих реагентов, приводящие к прямой изоляции продукта.
Стадию селективного окисления, стадию b) удобно проводить при условиях, сходных со стадией предварительного окисления, как описано выше. Таким же образом, окисляющий агент следует расходовать перед выделением продукта при использовании этиленгликоля. Затем продукт выделяют такими подходящими способами, как диализ и ультрафильтрация.
Способ по первому аспекту изобретения и предпочтительного варианта осуществления второго аспекта, который включает последующую стадию окисления после стадии d) для активирования восстановливающего терминального сахаридного звена, приводит к получению активированного производного, содержащего реакционно-активный альдегидный фрагмент, полученный из восстановливающего терминального конца. Предпочтительный способ, включающий окисление, затем восстановление, затем стадию окисления, приводит к получению активированного продукта, имеющего один реакционно-активный альдегидный фрагмент. Если не проводят предварительной стадии окисления и исходное вещество содержит невосстанавливющее терминальное звено, которое содержит вициальную диольную группу (например, сиаловую кислоту), продукт будет содержать альдегидную группу на каждом из терминальных концов, которые могут использоваться.
Альдегидные группы пригодны для конъюгации с субстратами, содержащими аминогруппу, или гидразиновыми соединениями. Способы, в которых активированный продукт из стадии окисления в последствие конъюгирует с субстратом, образуют дополнительный аспект изобретения. Предпочтительно за реакцией конъюгации, как описано в предшествующих публикациях заявителей, как описано выше, которая включает конъюгацию с амином с образованием основания Шиффа, предпочтительно следует восстановление с образованием вторичного аминового фрагмента. Способ в особенности ценен для белков, которые могут быть модифицированы, в которых аминогруппа представляет собой эпсилон-аминогруппу лизиновой группы или N-терминальную аминогруппу. Способ в особенности ценен для белков, которые могут быть модифицированы, или пептидных терапевтически активных агентов, таких как цитокины, гормоны роста, ферменты, гормоны, антитела или фрагменты. В качестве альтернативы способ может быть использован для получения производных систем доставки лекарств, таких как липосомы, например, реакцией альдегида с аминогруппой компонентов, образующих липосому. Другие системы доставки лекарств описаны в более ранней заявке заявителя US-A-5846951. Другие вещества, которые могут быть модифицированы, включают вирусы, микроорганизмы, клетки, включая клетки животных, и синтетические полимеры.
В качестве альтернативы субстрат может содержать гидразиновую группу, в таком случае продукт представляет собой гидразон. Его можно восстанавливать при желании для дополнительной стабильности до алкил гидразида.
В другом предпочтительном варианте осуществления за стадией окисления b) или последующей стадией окисления d) следует реакция одной или каждой из альдегидной групп с соединением посредством линкера, включающим аминогруппу или гидразидную группу и другую функциональную группу, пригодную для селективного получения производного белков или других терапевтически активных соединений, или систем доставки лекарств. Такой линкер может, например, включать соединение, содержащее заместитель функциональной группы для специфической реакции с сульфогидрильными группами и двухосновную органическую группу, соединяющими амин или гидразидную группу и функциональную группу. В реакции остатка альдегида с амино- или гидразидной группой образуется реакционно-активный конъюгат, пригодный для связывания с субстратом, содержащим тиольную (сульфогидрильную) группу. Такие конъюгаты обладают особой ценностью для селективного или сайт-специфического получения производных белков и пептидов.
Получение производных белков и систем доставки лекарств может приводить к увеличению периода полувыведения, улучшенной стабильности, пониженной иммуногенности и/или контролю растворимости и, следовательно, биологической доступности и фармакокинетических свойств или может улучшать растворимость активных веществ или вязкость растворов, содержащих производное активного вещества.
Согласно изобретению также обеспечивают новое соединение, которое представляет собой альдегидное производное ди-, олиго- или полисахарида, включающего фрагменты сиаловой кислоты, в которых терминальное звено восстанавливающего конца представляет собой OR-группу, в которой R выбирают из
-CH2CH2NHR1, CH2CH=N-NHR1 и CH2CH2NHNHR1, в которых R1 представляет собой Н, С1-24 алкил, арил С2-6 алканоил или полипептид, или белок, связанный через N-терминальный конец или аминогруппу боковой цепи лизинового остатка, систему доставки лекарств, или органическую группу, содержащую функциональный заместитель, адаптированный для реакции с сульфогидрильной группой и, предпочтительно, чтобы терминальный фрагмент на невосстанавливающем конце был пассивирован.
Новое соединение может включать среднюю часть цепи из сахаридных звеньев между двумя терминальными звеньями. Звенья средней части цепи состоят исключительно из звеньев сиаловой кислоты или, в качестве альтернативы, могут включать другие сахаридные звенья в дополнение к терминальным звеньям, которые получают из звеньев сиаловой кислоты. Соединение может быть обычно получено, как описано выше в отношении первого аспекта изобретения.
Новое соединение может быть полисиалилированным субстратом, включающим по крайней мере одну группу полисиаловой кислоты (полисахаридную), конъюгированную с каждой молекулой субстрата конъюгация, включая связь вторичного амина, гидразона или алкилгидразида через восстанавливающий терминальный конец полисиаловой кислоты и в значительной степени не содержащая сшивок невосстанавливающего конца полисиаловой кислоты с другой молекулой или субстратом. Субстрат может представлять собой, например, биологически активное соединение, например фармацевтически активное соединение, в особенности пептидный или белковый терапевтический агент, или систему доставки лекарств. Такие активные вещества широко описаны ниже.
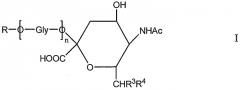
Новое соединение может иметь общую формулу I
в котором R выбран из
-CH2CH2NHR1, CH2CH=N-NHR1 и CH2CH2NHNHR1, в которых R1 представляет собой Н, С1-24 алкил, арил С2-6 алканоил или полипептид, или белок, связанный через N-терминальный конец или γ-аминогруппу лизинового остатка, систему доставки лекарств, или органическую группу, содержащую функциональный заместитель, адаптированный для реакции с сульфогидрильной группой;
R3 и R4 выбраны из
i) R3 представляет собой Н и R4 представляет собой ОН;
ii) где R представляет собой СН(СН2ОН)СН2ОН или -СН2СНО, R3 и R4 вместе составляют =О;
iii) где R представляет собой CH(CH2OH)CH2NHR1 или -CH2CH2NHR1, R3 представляет собой H и R4 представляет собой -NHR1;
iv) где R представляет собой -CH(CH2OH)CH2NHNHR1 или -CH2CH2NHNHR1, R3 представляет собой H и R4 представляет собой -NHNHR1; или
v) -CHCH=N-NHR1, R3 и R4 вместе составляют =N-NHR1; Ас представляет собой ацетил,
n представляет собой 0 или более; и
GlyO представляет собой глюкозильную группу.
Если R представляет собой группу
соединение общей формулы I представляет собой полисахарид, который является производным полисиаловой кислоты, имеющим альдегидную группу на восстанавливающем терминальном звене.
Если R представляет собой группу
CH2CH=N-NHR1 или CH2CH2NHNHR1 соединение представляет собой конъюгат, образованный реакцией альдегидного производного полисиаловой кислоты с гидразидом R1NHNH2. Гидразид предпочтительно представляет собой ацильный гидразид (R1 содержит терминальную карбонильную группу).
Если R представляет собой группу
соединение представляет собой конъюгат, образованный реакцией альдегидного производного полисиаловой кислоты с первичной амино группой, содержащей соединение R1NH2.
R1 может представлять собой остаток пептида или белкового терапевтического агента, например антитела или фрагмента, фермента или другого биологически активного соединения, как описано выше. Группа R1 может включать линкерный фрагмент между активным соединением и полисиаловой кислотой.
В качестве альтернативы R1 может представлять собой остаток линкерного реагента, например, для получения производного полисиаловой кислоты, пригодного для конъюгации с группами, отличающимися от аминогрупп или гидразидов, на активных соединениях. Примеры представляют собой линкерные реагенты формулы
что представляет собой N-соединения имида малеиновой кислоты, в которых R2 представляет собой двухосновную органическую группу, например арилен олиго(алкокси)алкан, или, предпочтительно, алкандиильную группу, например С2-12-алкандиильную группу.
Настоящее изобретение наиболее применимо, если новое соединение является монофункциональным и пассивировано на терминальном звене невосстанавливающего конца. В таких соединениях R3 представляет собой Н и R4 представляет собой ОН. R может принимать любые значения, указанные выше. Глюкозильные группы, предпочтительно, включают звенья сиаловой кислоты и, более предпочтительно, состоят только из таких звеньев, связанных 2-8 или 2-9, например чередованием 2-8/2-9 друг с другом.
Изобретение дополнительно обеспечивает композиции, включающие новые соединения и разбавитель, а также фармацевтические композиции, включающие новые соединения, в которых R1 обладает биологической активностью, и фармацевтически приемлемый наполнитель. Фармацевтические композиции можно вводить перорально, внутривенно, внутрибрюшинно, внутримышечно, подкожно, интраназально, внутрикожно, местно или внутритрахеально.
Во втором аспекте изобретения обеспечивают новое соединение, которое представляет собой продукт способа, согласно второму способу аспекта, которое имеет общую формулу II
в которой
Ас представляет собой ацетил;
m составляет 0 или больше;
Gly1О представляет собой гликозил; и
R5 представляет собой органическую группу, предпочтительно восстановленную форму терминального восстанавливающего сахаридного звена, его окисленное производное, которое представляет собой альдегид или продукт реакции такого альдегида, который, например, представляет собой амин или гидразид.
Предпочтительно R5 выбирают из тех же групп, что и R выше. В качестве альтернативы R5 представляет собой группу III, соединенную через один углерод, 8 или 9, с
(посредством чего другой из углеродов, 8 или 9, замещен гидроксилом:
которое представляет собой продукт восстановления с открытием цикла восстанавливающей терминальной сиаловой кислоты.
Предпочтительно группы Gly1O включают звенья сиаловой кислоты, наиболее предпочтительно состоят из звеньев сиаловой кислоты. Значение m предпочтительно равно 2 или более, более предпочтительно составляет 5-1000, например 10-500, боле