Дедифференцированные программируемые стволовые клетки моноцитарного происхождения и их получение и применение
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и может быть использовано для получения взрослых дедифференцированных, программируемых стволовых клеток из моноцитов человека. Моноциты культивируют в культуральной среде, которая содержит M-CSF и IL-3. Полученные дедифференцированные, программируемые стволовые клетки используют для получения фармацевтических композиций и для получения клеток-мишеней и ткани-мишени. Изобретение позволяет быстро и доступно получить безопасный для пациента материал для заместительной клеточной терапии. 20 н. и 19 з.п. ф-лы, 11 ил., 1 табл.
Реферат
Данное изобретение относится к дедифференцированным программируемым взрослым стволовым клеткам, полученным из моноцитов человека, а также их получению и применению для получения клеток и тканей тела. Согласно особенно предпочтительному варианту осуществления данного изобретения эти клетки являются аутологичными стволовыми клетками человека, т.е. эта клетка моноцитарного происхождения происходит из пациента, который подлежит лечению стволовой клеткой, полученной из этой исходной клетки, и/или клетками тела, продуцируемыми из этой стволовой клетки.
В существующем состоянии данной области термин «стволовые клетки» обозначает клетки, которые (а) имеют способность самообновления и (b) способность образования, по меньшей мере, одного и, часто, ряда типов специализированных клеток вследствие их способности асимметричного деления (см. Donovan P.J., Gearhart J., Nature 414: 92-97 (2001)). Термин «плюрипотентные» означает стволовые клетки, которые могут быть по существу дифференцированы во все возможные типы клеток тела человека и животного. Такие стволовые клетки могли быть до сих пор получены только из эмбриональной ткани или эмбриональной карциномы (опухоли яичка) (см. Donovan P.J., Gearhart J., loco citato). Применение эмбриональных стволовых клеток было предметом широкого публичного обсуждения, в частности, в Германии и считается крайне проблематичным. Наряду с этическими и юридическими проблемами, связанными с эмбриональными стволовыми клетками, терапевтическое применение таких клеток также сталкивается с трудностями. По своей природе эмбриональные стволовые клетки получают из организмов-доноров, которые являются гетерологичными относительно потенциальных реципиентов дифференцированных клеток или дифференцированной ткани (далее называемых соматическими клетками-мишенями или соматической тканью-мишенью), развивающихся из этих клеток. Таким образом, ожидается, что такие клетки-мишени будут запускать немедленную иммунологическую реакцию у потенциальных реципиентов в форме отторжения.
Стволовые клетки могут быть также выделены из различных тканей взрослых, т.е. из дифференцированных индивидуумов. Такие стволовые клетки называют в существующем состоянии данной области «мультипотентными взрослыми стволовыми клетками». В организме они играют роль в регенерации и гомеостазе тканей. Существенное различие между эмбриональными плюрипотентными стволовыми клеткам и взрослыми мультипотентными стволовыми клетками заключается в количестве дифференцированных тканей, которые могут быть получены из соответствующих клеток. Предположительно это обусловлено тем фактом, что плюрипотентные стволовые клетки происходят из сперматозоидов или из клеток, которые продуцируют сперматозоиды, тогда как взрослые мультипотентные стволовые клетки происходят из тела или сомы взрослых индивидуумов (Donovan P.J., Gearhart J., loco citato, Page 94), которые не способны к образованию сперматозоидов.
Однако реальные проблемы, связанные с получением и использованием взрослых стволовых клеток, заключаются в редкости этих клеток. Так, в костном мозге, стволовые клетки присутствуют только в отношении 1:10000, в периферической крови 1:250000 и в печени в отношении 1:100000. Таким образом, получение таких стволовых клеток является очень дорогим и напряженным для пациента. Кроме того, генерирование больших количеств клеток, требующихся для клинической терапии, вряд ли до сих пор возможно с разумными расходами.
Это идет в разрез с постоянно увеличивающейся потребностью в возможностях лечения разрушенной ткани в форме «конструирования ткани» или в виде клеточной терапии, в рамках которой должны восполняться клетки кожи, мышц, сердечной мышцы, печени, островковые клетки, нервные и нейронные клетки, клетки кости и хряща, эндотелиальные и жировые клетки.
В этой связи, поддающееся предвидению развитие профиля возраста и заболеваний населения в западном мире является критическим, ведущим к ожиданию решительного перелома в следующие 10 лет в секторе здоровья и охраны здоровья западно-европейского населения, в том числе населения США и Канады. Только в Федеральной Республике Германии демографическое развитие предполагает 21%-ный рост населения в возрастной группе 45-64 лет и 26%-ный рост в возрастной группе более 65 лет. Это должно неизбежно привести к изменению в структуре пациентов и спектре заболеваний, требующих лечения. Предсказуемо, что заболевания сердечно-сосудистой системы (высокое давление, инфаркт миокарда), сосудистые заболевания, обусловленные артериосклерозом и метаболическими заболеваниями, метаболические заболевания, такие как сахарный диабет, заболевания, связанные с метаболизмом печени, заболевания почек, а также заболевания скелетной системы, вызываемые связанной с возрастом дегенерацией, и дегенеративные заболевания головного мозга, вызываемые потерями нервных и глиальных клеток, будут встречаться чаще и требовать новаторских концепций лечения.
Эти факты объясняют масштабное национальное и международное исследования и рост усилий со стороны вовлеченных в эти исследования специалистов для получения стволовых клеток, которые могут быть программируемыми для развития в дифференцированные клетки, типичные для тканей (печени, кости, хряща, мышц, кожи и т.д.).
Таким образом, проблема, лежащая в основе данного изобретения, состоит в создании доступных взрослых стволовых клеток, генерирование которых не приводит ни к каким этическим и/или юридическим (правовым) проблемам, которые являются легко доступными для планируемого терапевтического применения в количествах, требуемых для этого, и при позволительных затратах на получение и которые, при использовании в качестве «клеточных терапевтических средств», не дают побочных вредных действий, не говоря уже о клеточном отторжении и индукции опухолей, в частности злокачественных опухолей, у рассматриваемого пациента.
Согласно данному изобретению эта проблема решается получением дедифференцированных программируемых клеток из моноцитов человека, которые, для целей данного изобретения, называются далее «стволовыми клетками». Термин «дедифференцировка» известен лицам с квалификацией в данной области, см. Weissman I.L., Cell 100: 157-168, Fig. 4 (2000). Он означает регресс взрослой, уже специализированной (дифференцированной) клетки тела в статус стволовой клетки, т.е. клетки, которая, в свою очередь, может быть превращена (программирована) в ряд типов клеток. Неожиданно было продемонстрировано, что способ данного изобретения приводит к дедифференцировке моноцитов. Стволовые клетки, полученные этим путем, могут быть превращены (программированы) в большое число различных клеток-мишеней/тканей-мишеней, как видно из примеров. Стволовые клетки данного изобретения экспрессируют, кроме поверхностного антигена CD14, характерного для дифференцированных моноцитов, по меньшей мере один, предпочтительно два или три, типичный маркер плюрипотентности CD90, CD117, CD123 и CD135. Особенно предпочтительным образом стволовые клетки, продуцируемые в соответствии с данным изобретением, экспрессируют поверхностный антиген CD14, а также четыре маркера плюрипотентности CD90, CD117, CD123 и CD135, см. пример 2, таблицу 1. Предпочтительно стволовые клетки данного изобретения экспрессируют моноцит-специфический антиген CD14 и по меньшей мере один маркер плюрипотентности, выбранный из группы, состоящей из CD117, CD123 и CD135. Более предпочтительно стволовые клетки данного изобретения несут антиген CD14 в комбинации, по меньшей мере, с маркерами плюрипотентности CD123 и/или CD135. Менее чем 3%, предпочтительно менее чем 1%, стволовых клеток данного изобретения экспрессируют антиген CD34. Наиболее предпочтительно ни одна из стволовых клеток данного изобретения не экспрессирует антиген CD34. Таким образом, впервые сделаны доступными взрослые стволовые клетки, которые могут быть в пределах короткого времени перепрограммированы предпочтительно в аутологичные ткани.
Генерирование стволовых клеток в соответствии с данным изобретением является совершенно безвредным для пациента и - в случае аутологичного использования - сравнимо с получением собственной крови в качестве донорской крови. Количество стволовых клеток (108-109 клеток), требуемое для обычных случаев терапии (см. выше), может быть сделано доступным с приемлемыми расходами в пределах 10-14 дней после взятия крови. Кроме того, клеточный продукт, предназначенный для этого лечения, в случае аутологичного использования, не приводит к какой-либо иммунологической проблеме в виде отторжения клеток, так как клетки и реципиент предпочтительно являются генетически идентичными.
Стволовые клетки данного изобретения оказались также безопасными в экспериментах на животных и в культуре в отношении возникновения злокачественности, т.е. был получен результат, который только и мог ожидаться вследствие моноцитарного происхождения клетки, из которой происходят стволовые клетки в соответствии с данным изобретением.
Основные стадии способа данного изобретения для получения дедифференцированных программируемых стволовых клеток, происходящих из моноцитов человека, включают в себя:
(а) выделение моноцитов из крови человека;
(b) размножение моноцитов в подходящем культуральном сосуде, содержащем среду для культуры клеток, которая содержит колониестимулирующий фактор макрофагов (далее называемый M-CSF);
(с) культивирование моноцитов в присутствии интерлейкина-3 (IL-3); и
(d) получение дедифференцированных программируемых стволовых клеток человека отделением этих клеток от культуральной среды.
Согласно особенно предпочтительному варианту осуществления этого способа M-CSF и IL-3 одновременно добавляют в среду культуры клеток на стадии b).
Однако можно также добавлять сначала только M-CSF в среду культуры клеток на стадии b), чтобы заставить моноциты размножаться, и затем добавлять IL-3 в среду культуры клеток.
Наконец, способ на стадии b) может проводиться таким образом, что моноциты сначала размножают в среде культуры кулеток, содержащей только M-CSF, затем эту среду отделяют от клеток и затем используют вторую среду культуры клеток, которая содержит IL-3.
Согласно предпочтительному варианту осуществления данного изобретения культуральную среду стадии b) отделяют от клеток, прикрепленных ко дну культурального сосуда, и дедифференцированные программируемые стволовые клетки получают отделением клеток от дна и выделением этих клеток.
Согласно предпочтительному варианту осуществления данного изобретения клетки дополнительно культивируют в присутствии соединения серы. Это культивирование проводят в отдельной стадии способа, которая следует за стадией b), описанной выше. Однако она может также проводиться на стадии b) дополнительным добавлением соединения серы в культуральную среду, предпочтительно уже в начале культивирования.
Способ данного изобретения неожиданно приводит к дедифференцировке моноцитов, при которой взрослые стволовые клетки, происходящие из этой дедифференцировки, наряду с поверхностным антигеном CD14, типичным для дифференцированных моноцитов, экспрессируют также, по меньшей мере, один или несколько, предпочтительно все, маркеры плюрипотентности CD90, CD117, CD123 и CD135 (см. таблицу 1). Предпочтительно стволовые клетки данного изобретения экспрессируют мембраносвязанный моноцит - специфический поверхностный антиген CD14 и по меньшей мере один из маркеров плюрипотентности, выбранный из группы, состоящей из CD117, CD123 и CD135. Более предпочтительно стволовые клетки данного изобретения несут антиген CD14 в комбинации, по меньшей мере, с маркером плюрипотентности CD123 и/или CD135. Менее чем 3%, предпочтительно менее чем 1%, стволовых клеток данного изобретения экспрессируют антиген CD34. Наиболее предпочтительно ни одна из стволовых клеток данного изобретения не экспрессирует антиген CD34. Экспрессия соответствующих маркеров (поверхностных антигенов) может быть доказана с использованием коммерчески доступных антител, специфических в отношении соответствующих подлежащих детектированию антигенов, с использованием стандартных процедур иммуноанализа, см. пример 2.
Поскольку клетки, во время процесса размножения и дедифференцировки, прикрепляются ко дну соответствующей культуральной чашки, необходимо отделять эти клетки от культуральной среды из стадии b) и отделять их от дна после завершения дедифференцировки. Согласно предпочтительному варианту осуществления данного изобретения супернатант культуры клеток отбрасывают перед отделением клеток, прикрепившихся ко дну, и затем эти прикрепившиеся клетки предпочтительно промывают свежей культуральной средой. После промывания свежую культуральную среду снова добавляют к клеткам, прикрепившимся ко дну, и затем следует стадия освобождения клеток от дна (см. пример 13).
Согласно предпочтительному варианту осуществления данного изобретения клетки приводят в контакт с биологически хорошо переносимым органическим растворителем в конце стадии с) и перед стадией d). Биологически хорошо переносимым органическим растворителем может быть спирт с 1-4 атомами углерода, причем предпочтительным является применение этанола.
В следующем варианте осуществления в конце стадии с) и перед стадией d) клетки приводят в контакт с паровой фазой биологически хорошо переносимого органического растворителя.
Кроме того, это отделение проводят также механически, но предпочтительным является ферментативный способ отделения, например, с использованием трипсина.
Дедифференцированные программируемые стволовые клетки, полученные таким образом, плавающие свободно в среде, могут либо непосредственно переноситься в процесс перепрограммирования, либо выдерживаться в культуральной среде в течение нескольких дней; в последнем случае предпочтительно к среде добавляют цитокин или LIF (фактор ингибирования лейкоза) во избежание преждевременной потери программируемости (см. Donovan P.J., Gearhart J. loco citato, page 94). Наконец, эти клетки могут быть подвергнуты глубокому замораживанию с целью хранения без потери программируемости.
Стволовые клетки данного изобретения отличаются от плюрипотентных стволовых клеток эмбрионального происхождения, известных до сих пор, и от известных взрослых стволовых клеток из различных тканей тем, что, наряду с мембраносвязанным моноцит-специфическим поверхностным антигеном CD14, они несут, по меньшей мере, один маркер плюрипотентности из группы, состоящей из CD90, CD117, CD123 и CD135, на их поверхности. Предпочтительно стволовые клетки данного изобретения несут мембраносвязанный моноцит-специфический антиген CD14 и по меньшей мере один из маркеров плюрипотентности, выбранный из группы, состоящей из CD117, CD123 и CD135. Более предпочтительно стволовые клетки данного изобретения несут антиген CD14 в комбинации, по меньшей мере, с маркером плюрипотентности CD123 и/или CD135. Менее чем 3%, предпочтительно менее чем 1%, стволовых клеток данного изобретения экспрессируют антиген CD34. Наиболее предпочтительно ни одна из стволовых клеток данного изобретения не экспрессирует антиген CD34.
Стволовые клетки, получаемые способом данного изобретения, могут быть перепрограммированы в любые клетки тела. Способы перепрограммирования стволовых клеток известны в существующем уровне данной области, см., например, Weissman I.L., Science 287: 1442-1446 (2000) и Insight Rewier Articles Nature 414: 92-131 (2001), и справочник «Methods of Tissue Engineering», Eds. Atala A., Lanza R.P., Academic Press, ISBN 0-12-436636-8; Library of Congress Catalog Card No. 200188747.
Дифференцированные выделенные соматические клетки-мишени и/или ткань-мишень, полученные перепрограммированием стволовых клеток в соответствии с данным изобретением, несут, кроме того, мембраносвязанный маркер CD14 дифференцировки моноцитов. Кроме того, менее чем 3%, предпочтительно менее чем 1%, этих соматических клеток-мишеней и/или этих тканей-мишеней данного изобретения экспрессируют антиген CD34. Наиболее предпочтительно ни одна из этих клеток или тканей не экспрессирует антиген CD34. Как показано в примере 11, гепатоциты, которые получают из стволовых клеток в соответствии с данным изобретением, экспрессируют поверхностный маркер CD14, который является типичным для моноцитов, тогда как в то же самое время они продуцируют белок альбумин, который является типичным для гепатоцитов. Таким образом, гепатоциты, происходящие из стволовых клеток данного изобретения, могут быть отличены от природных гепатоцитов. Таким же образом, мембраносвязанный поверхностный маркер CD14 детектировали на продуцирующих инсулин клетках, которые происходили из стволовых клеток данного изобретения (пример 9).
В одном варианте осуществления данного изобретения дедифференцированные программируемые стволовые клетки используют для продуцирования in vitro клеток-мишеней и ткани-мишени (см. примеры). Таким образом, дифференцированные, выделенные клетки ткани, которые получены дифференцировкой (перепрограммированием) стволовых клеток в соответствии с данным изобретением и которые несут мембраносвязанный поверхностный антиген CD14, являются также предметом данного изобретения.
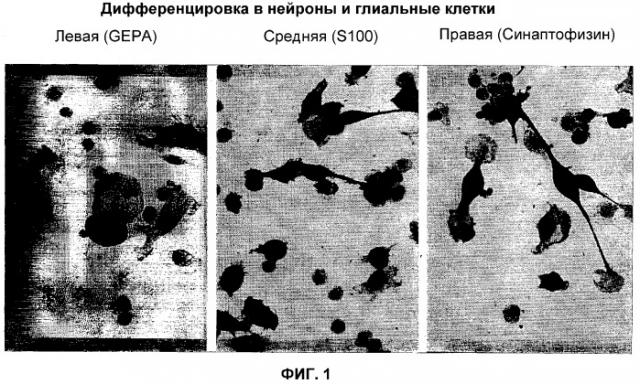
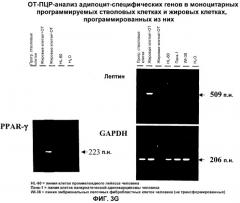
Стволовые клетки данного изобретения, предпочтительно, просто и достоверно дифференцируются in vitro в желаемые клетки-мишени, такие как, например, адипоциты (см. пример 6), нейроны и глиальные клетки (см. пример 3), эндотелиальные клетки (см. пример 5), кератиноциты (см. пример 8), гепатоциты (см. пример 7) и островковые клетки (островки Лангерганса, см. пример 9) посредством выращивания этих стволовых клеток в среде, которая содержит супернатант культуральной среды, в которой инкубируются соответствующие клетки-мишени и/или их фрагменты (см. примеры 6-8). Этот супернатант называется далее «кондиционированной клетками-мишенями средой».
Таким образом, для дифференцировки (перепрограммирования) дедифференцированных стволовых клеток в соответствии с данным изобретением может быть использована следующая процедура, в которой
а) ткань, которая содержит желаемые клетки-мишени или которая состоит из желаемых клеток-мишеней, измельчают;
b) получают клетки ткани (клетки-мишени) и/или их фрагменты;
с) клетки-мишени и/или их фрагменты инкубируют в подходящей культуральной среде;
d) супернатант этой культуральной среды собирают во время инкубирования и после инкубирования в качестве кондиционированной клетками-мишенями среды; и
е) для перепрограммирования/дифференцировки дедифференцированных стволовых клеток в желаемые клетки-мишени или ткань-мишень эти стволовые клетки выращивают в присутствии кондиционированной клетками-мишенями среды.
В качестве культуральной среды могут быть использованы стандартные среды для культуры клеток (см. примеры). Эти среды обычно содержат факторы роста, такие как, например, эпидермальный фактор роста.
Инкубирование клеток-мишеней и/или их фрагментов («осадка клеток») может проводиться на протяжении 5-15, предпочтительно 10 дней. Супернатант, т.е. кондиционированную клетками-мишенями среду, удаляют в каждом случае после 2-4 дней и заменяют свежей средой. Полученные таким образом супернатанты могут быть отфильтрованы при стерильных условиях по отдельности или в объединенном виде и храниться при приблизительно -20°С или использоваться сразу для программирования стволовых клеток. Как показано выше, программирование стволовых клеток в желаемые клетки-мишени проводят выращиванием стволовых клеток в присутствии среды, кондиционированной соответствующими клетками-мишенями (см. примеры). Эта среда для выращивания предпочтительно дополнительно содержит специфический для клеток-мишеней фактор, такой как, например, «фактор роста гепатоцитов» или «фактор роста кератиноцитов» (см. примеры).
В одном варианте осуществления данного изобретения дедифференцированные программируемые стволовые клетки данного изобретения используют per se для приготовления фармацевтической композиции для получения in vivo клеток-мишеней и ткани-мишени.
Такие фармацевтические препараты могут содержать стволовые клетки данного изобретения, суспендированные в физиологически хорошо переносимой среде. Подходящими средами являются, например, ЗФР (забуференный фосфатом солевой раствор) или физиологический солевой раствор с 20% раствором альбумина человека и т.п.
Эти фармацевтические препараты содержат жизнеспособные дедифференцированные программируемые стволовые клетки в соответствии с данным изобретением, которые имеют на их поверхности поверхностный маркер CD14 и по меньшей мере один или более из маркеров мультипотентных стволовых клеток CD90, CD117, CD123, и/или CD135, в количестве по меньшей мере 1, 2, 3, 4, 5, 6, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или 50%, предпочтительно 60 или 70%, особенно предпочтительно 80 или 90% и очень предпочтительно 100%, относительно общего количества клеток, присутствующих в препарате, и необязательно дополнительные фармацевтически хорошо переносимые адъюванты и/или вещества-носители.
Препараты стволовых клеток могут также содержать жизнеспособные дедифференцированные программируемые стволовые клетки в соответствии с данным изобретением, которые имеют на их поверхности поверхностный маркер CD14 и по меньшей мере один или более из маркеров мультипотентных стволовых клеток CD90, CD117, CD123, и/или CD135, в количестве по меньшей мере 1, 2, 3, 4, 5, 6, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58 или 59%, предпочтительно, по меньшей мере, 60%, относительно общего количества клеток, присутствующих в препарате; предпочтительными являются суспензии клеток в среде для культуры клеток или среде для транспорта хорошо переносимой клетками, такой как, например, ЗФР или RPMI и т.д., или глубоко замороженные препараты клеток в подходящей среде для хранения, такой как RPMI, с 50% раствором альбумина человека и 10% ДМСО.
Количество жизнеспособных клеток и, следовательно, доля их в композициях, описанных выше, может быть определено оптически с использованием «способа вытеснения красителя трипанового синего», так как жизнеспособные клетки могут быть отличены оптически от нежизнеспособных клеток с использованием этого красителя.
Как правило, для клинического применения неважно, если некоторые из клеток, присутствующих в фармацевтическом препарате, не удовлетворяют критериям дедифференцированных программируемых стволовых клеток данного изобретения, при условии, что присутствует достаточное количество функциональных стволовых клеток. Однако можно также элиминировать не-дедифференцированные клетки при помощи способов, известных в существующем состоянии данной области, на основе поверхностных маркеров, типичных для дедифференцированных клеток данного изобретения, в таких препаратах, так что они содержат желаемые клетки по существу в чистом виде. Одним примером подходящего способа является «Immuno magnetic bead sorting» («Иммуносортинг с использованием магнитных гранул»), см. Romani et al., J. Immunol. Methods 196: 137-151 (1996).
Кроме того, стволовые клетки имеют способность спонтанной дифференцировки in vivo посредством прямого контакта с группой клеток специфического типа в клетки этого типа. Способы получения ткани с использованием клеток, которые могут быть передифференцированными («конструирование тканей»), известны в данной области. Например, Wang, X. et al. («Liver repopulation and correction of metabolic liver disease by transplanted adult mouse pancreatic cells». Am. J. Pathol. 158 (2): 571-579 (2001)) показали, что даже некоторые взрослые клетки поджелудочной железы мышей способны превращаться, у мышей с FAH-(фумароилацетоацетатгидролаза)-недостаточностью, в гепатоциты, которые могут полностью компенсировать данный метаболический дефект в этих животных. Другим примером являются эксперименты Lagasse et al., «Purified hematopoietic stem cells can differentiate into hepatocytes in vivo», Nature Medicine, 6 (11): 1229-1234 (2000). Эти авторы показали, что гемопоэтические стволовые клетки из костного мозга были способны после переноса in vivo в мышей с FAH-недостаточностью превращаться в гепатоциты, которые после этого могли компенсировать данный метаболический дефект; см. также обзор Grompe M., «Therapeutic Liver Repopulation for the Treatment of Metabolic Liver Diseases». Hum. Cell, 12: 171-180 (1999).
Особенно предпочтительными формами применения для in vivo-дифференцировки дедифференцированных стволовых клеток в соответствии с данным изобретением являются инъекция, инфузия или имплантация стволовых клеток в одну ассоциацию специфических клеток в теле, чтобы позволить этим стволовым клеткам дифференцироваться в ней посредством прямого контакта с этой ассоциацией клеток в клетки данного клеточного типа. Для инъекции или инфузии эти клетки могут вводиться в ЗФР (забуференном фосфатом солевом растворе).
Предпочтительными примерами релевантных показаний в этой связи являются цирроз печени, недостаточность поджелудочной железы, острая или хроническая почечная недостаточность, пониженное гормональное функционирование, инфаркт миокарда, легочная эмболия, инсульт и кожное повреждение.
Поэтому предпочтительным вариантом осуществления данного изобретения является использование дедифференцированных программируемых стволовых клеток для получения различных фармацевтических композиций для лечения цирроза печени, недостаточности поджелудочной железы, острой или хронической почечной недостаточности, пониженного гормонального функционирования, инфаркта миокарда, легочной эмболии, инсульта и кожного повреждения.
Для терапевтического применения клеток-мишеней, получаемых из стволовых клеток данного изобретения, доступны ряд концепций (см. выше Science 287: 1442-1446 (2000) и Nature 414: 92-131 (2001)).
Следующее предпочтительное применение относится к инъекции дедифференцированных стволовых клеток данного изобретения в перитонеум (брюшину), так что они дифференцируют в ней перитонеальные клетки вследствие влияния окружающих их клеток в. В случае перитонеального диализа пациентов с почечной недостаточностью, эти клетки могут принимать на себя функцию почки посредством их полупроницаемой мембраны и отдавать независимо от почки отработанные вещества в перитонеум, откуда они могут быть удалены посредством диализа.
Таким образом, эти дифференцированные, выделенные, соматические клетки-мишени и/или ткань-мишень, которые образуются посредством перепрограммирования стволовых клеток и характеризуются мембраносвязанным антигеном CD14, также являются предметом данного изобретения. Эти соматические клетки-мишени и/или ткань-мишень, предпочтительно, включают в себя адипоциты, нейроны и глиальные клетки, эндотелиальные клетки, кератиноциты, гепатоциты и островковые клетки.
Однако эти клетки могут также вводиться непосредственно в орган, который должен быть восстановлен. Введение может проводиться через матриксные конструкции, которые покрыты соответствующими дифференцированными клетками или клетками, способными к дифференцировке. Эти матриксные конструкции являются, как правило, биодеградируемыми, так что они исчезают из тела, в то время как заново введенные клетки растут вместе с присутствующими клетками. С этой точки зрения рассматриваются, например, клеточные, предпочтительно, аутологичные трансплантаты островковых клеток, гепатоцитов, жировых клеток, кожных клеток, мышц, сердечных мышц, нервов, костей, эндокринных клеток и т.д. для восстановления, например, после частичной хирургической резекции органа, для восстановления, например, после травмы или для поддерживающего применения, например, в случае отсутствующей или недостаточной функции органа.
Стволовые клетки данного изобретения и клетки-мишени, полученные из них, могут быть также использованы для покрытия имплантируемых материалов, для увеличения биосовместимости. Таким образом, имплантируемые материалы, которые покрыты дедифференцированными, программируемыми стволовыми клетками или соматическими клетками-мишенями и/или тканью-мишенью, являются также предметом данного изобретения. Согласно одному варианту осуществления данного изобретения этими имплантируемыми материалами являются протезы. В особенно предпочтительных вариантах осуществления данного изобретения эти протезы являются клапанами сердца, протезами сосудов, протезами костей и суставов.
Имплантируемые материалы могут быть также искусственными и/или биологическими материалами-носителями, которые содержат дедифференцированные программируемые стволовые клетки или клетки-мишени. В этой связи материалы-носители могут быть сумками или камерами для имплантации в тело человека.
В одном варианте данного изобретения такую сумку, содержащую островковые клетки, которые являются дифференцированными соматическими клетками данного изобретения, используют для получения фармацевтической конструкции для применения в качестве искусственной камеры-депо для доставки инсулина.
Согласно следующему варианту осуществления данного изобретения сумку или камеру, содержащую адипоциты, которые являются дифференцированными соматическими клетками в соответствии с данным изобретением, используют для получения искусственного полимера, заполненного адипоцитами, в качестве фармацевтической конструкции для конструирования молочной железы после хирургического вмешательства и в случае других показаний пластической и/или косметической коррекции.
Кроме того, системы полупроницаемых камер-депо, содержащих эндокринные клетки очень широко варьирующегося происхождения, могут быть использованы in vivo для лечения эндокринных, метаболических или гемостатических нарушений. Примерами таких эндокринных клеток являются клетки, которые продуцируют тироксин, стероиды, ADH (антидиуретический гормон), альдостерон, мелатонин, серотонин, адреналин, норадреналин, TSH (тиреотропин), LH (лютеинизирующий гормон), FSH (фолликулостимулирующий гормон), лептин, холецистокинин, гастрин, инсулин, глюкагон или факторы свертывания.
Таким образом, имплантируемые материалы, которые являются системами полупроницаемых камер-депо, содержащими выделенные дифференцированные соматические клетки-мишени данного изобретения, также являются предметом данного изобретения. Эти полупроницаемые камеры-депо используют в различных вариантах данного изобретения для приготовления фармацевтической конструкции для лечения in vivo эндокринных, метаболических мили гемостатических нарушений.
Кроме того, клетки-мишени, полученные из стволовых клеток в соответствии с данным изобретением, могут быть использованы в качестве культур клеток в биореакторах вне тела, например, для проведения реакций детоксикации. Эта форма применения особенно предпочтительна в случае острых условий, например, в случае острой печеночной недостаточности в качестве биореактора гепатоцитов.
Получение вышеописанных конструкций и проведение соответствующего терапевтического способа уже было описано много раз в данной области, см., например, обзор Lalan S., et al. «Tissue engineering and its potential impact on surgery», World J. Surg. 25: 1458-1466 (2001); Nasseri B.A., et al., «Tissue engineering: an evolving 21st-century science to provide replacement for reconstruction and transplantation», Surgery 130: 781-784 (2001) и Fuchs J.R., et al. «Tissue engineering: a 21st century solution to surgical reconstruction», Ann. Thorac. Surg. 72: 577-591 (2001).
Наконец, плюрипотентные стволовые клетки данного изобретения открывают широкое поле для трансгенной модификации и терапии. Согласно предпочтительному варианту осуществления данного изобретения дедифференцированные программируемые стволовые клетки per se или соматические клетки-мишени и/или ткань-мишень, в конечном счете дифференцированные из них, трансфицируют одним или несколькими генами. Таким путем один или несколько генов, которые необходимы для поддержания метаболизма некоторых органов, таких как, например, печень или почки, восстанавливаются и/или поддерживаются или повторно вводятся. Например, стволовые клетки или происходящие из них гепатоциты могут быть трансфицированы геном FAH (фумароилацетоацетатгидролаза). В модели мыши с FAH-недостаточностью инъекция внутрь селезенки 1000 FAH-положительных донорских гепатоцитов была достаточной для полного повторного «заселения» печени после 6-8 недель и полной компенсации в отношении метаболического дефекта, ведущего к циррозу печени (см. Grompe M., et al., Nat. Genet. 12: 266 ff. (1996)).
Таким образом, трансфекцией стволовых клеток или соответствующих клеток-мишеней, полученных из этих стволовых клеток программированием (например, гемопоэтических клеток, гепатоцитов, клеток яичника, мышечных клеток, нервных клеток, нейронов, глиальных клеток, хрящевых или костных клеток и т.д.), «генами устойчивости к множественным лекарственным средствам» была сделана доступной продолжительная радикальная химиотерапия в случае злокачественных заболеваний посредством восстановления соответствующих гемопоэтических клеток или устойчивости к облучению, которые могут быть получены.
Данное изобретение подробно объясняется следующим образом.
Исходным материалом для способа данного изобретения являются моноциты из крови человека. Предпочтительно они являются аутологичными моноцитами, т.е. моноцитами, которые происходят из крови пациента, который должен лечиться стволовыми клетками данного изобретения или клетками-мишенями, полученными из них.
Для получения моноцитов кровь может быть сначала, после стандартной обработки антикоагулянтом известным образом, предпочтительно центрифугированием, разделена на плазму, и лейкоциты, и эритроциты. После центрифугирования плазма должна находиться в супернатанте; под ней лежит слой, который содержит все лейкоциты. Этот слой называют также «лейкоцитной пленкой». Под ним лежит фаза, содержащая эритроциты (гематокрит).
Затем «лейкоцитную пленку» выделяют и разделяют для получения моноцитов, например, центрифугированием с использованием известного процесса. В соответствии с предпочтительным вариантом способа слой «лейкоцитной пленки» наносят в виде покрытия на среду для разделения лимфоцитов (например, Ficoll Hypaque) и центрифугируют. Последующим центрифугированием и промыванием получают фракцию моноцитов из этой крови (см. пример 1).
Примерами альтернативных способов получения моноцитов из цельной крови являются «Сортинг клеток с активацией флуоресценции» (FACS), «Сортинг с иммуно-магнитными гранулами» (см. Romani et al., J. Immunol. Methods 196: 137-151 (1996) и «Активированный магнитом сортинг клеток» (MACS) или так называемый «Способ розеткообразования» (см. Gmelig-Meyling F., et al., «Simplified procedure for the separation of human T and non-T cells», Vox Sang. 33: 5-8 (1977)).
Согласно данному изобретению моноциты могут быть получены из любой выделенной крови человека, и эта кровь может также происходить из таких органов, как селезенка, лимфатические узлы или костный мозг. Получение моноцитов из органов рассматривается, в частности, в тех случаях, когда отделение моноцитов из крови человека, например, в случае анемии или лейкоза, не является возможным или может дать недостаточные количества, и в случае аллогенного применения, если, в рамках удаления множественных органов, селезенка является доступной в качестве источника для выделения моноцитов.
Для получения достаточного количества стволовых клеток в соответствии с данным изобретением сначала необходимо размножить моноциты. Для этой цели могут быть использованы среды для выращивания, подходящие для моноцитов, где согласно данному изобретению указанная среда содержит M-CSF (колониестимулирующий фактор макрофагов). M-CSF (также называемый CSF-1) получают из моноцитов, фибробластов и эндотелиальных клеток. Концентрация M-CSF в культуральной среде может быть равна 2-20 мкг/л, предпочтительно 4-6 мкг/л и особенно предпочтительно 5 мкг/л.
На моноцитах M-CSF связывается со специфическим с-Fms-рецептором (также называемым CSF-1R), который присутствует исключительно на поверхности моноцитов и связывает только M-CSF (Sherr C.J., et al., Cell 41 (3): 665-676 (1985)). Так как специфическое взаимодействие между M-CSF и этим рецептором индуцирует деление моноцитов, среда, в которой культивируют моноциты, содержит M-CSF или его аналог, который может связываться с этим рецептором и активировать его. Другие факторы роста, такие как GM-CSF (колониестимулирующий фактор гранулоцитов-моноцитов) и G-CSF (колониестимулирующий фактор гранулоцитов), являются непригодными, так как вследствие отсутствия аффинности в отношении c-Fms-рецептора они неспособны индуцировать деление моноцитов.
В особенно предпочтите