Фотохимическая интернализация для доставки молекул в цитозоль
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии и может быть использовано в медицине. В одном варианте способа введения молекулы в цитозоль клетки переносимую молекулу приводят в контакт с клеткой после инкубирования ее с фотосенсибилизирующим средством и облучения. В другом варианте этого способа переносимую молекулу приводят в контакт с клеткой после инкубирования ее с фотосенсибилизирующим средством и либо во время, либо после облучения. На основе данного способа разработаны способы лечения или профилактики заболевания, расстройства или инфекции у пациента, способы генной терапии, способы лечения рака и способ стимуляции иммунного ответа у пациента. С помощью данного способа также получены клетка-переносчик терапевтической переносимой молекулы и клетка, презентирующая антигенную молекулу. Применение изобретения позволяет снизить уровень фотохимических повреждений переносимой молекулы и широко варьировать время введения переносимой молекулы относительно времени облучения клетки, содержащей фотосенсибилизирующее средство. 11 н. и 42 з.п. ф-лы, 25 ил., 1 табл.
Реферат
Настоящее изобретение относится к улучшенному способу введения молекул в цитозоль клеток с использованием фотосенсибилизирующего средства и облучения клеток светом с длиной волны, эффективной для активации фотосенсибилизирующего средства.
Большинство молекул не способны легко проникать через клеточные мембраны. Способы введения молекул в цитозоль живых клеток представляют собой полезный инструмент для изучения биологических процессов и манипуляции ими. В число наиболее часто используемых в настоящее время способов входят микроинъекции, слияние, опосредованное гемолизированными эритроцитами, и липосомное слияние, осмотический лизис пиносом, введение соскобом, электропорация и опосредованная фосфатом кальция и вирусом трансфекция. Указанные методики используются для исследования клеток в культуре, хотя во многих случаях они могут оказаться непрактичными, поскольку занимают много времени, неэффективны или могут индуцировать гибель значительной части клеток. В этой связи, подобные методики не оптимальны для использования в биологических или медицинских исследованиях или в терапии, где требуется, чтобы клетки оставались жизнеспособными и/или функциональными.
Хорошо известно, что порфирины и многие другие фотосенсибилизирующие соединения могут индуцировать цитотоксические эффекты в клетках и тканях. Указанные эффекты основаны на том факте, что при воздействии света фотосенсибилизирующее соединение может становиться токсичным или может высвобождать токсичные вещества, такие как синглетный кислород или другие окислительные радикалы, которые повреждают компоненты клеток или биомолекулы, включая мембраны клеток и клеточные структуры, причем такие клеточные или мембранные повреждения могут постепенно приводить к гибели клеток. Указанные эффекты использовались при лечении различных аномалий или расстройств, включая, в особенности, неопластические заболевания. Такой метод получил название фотодинамической терапии (ФДТ(PDT)) и включает введение фотосенсибилизирующих (фотохимиотерапевтических) агентов в пораженный участок тела с последующим воздействием активирующего света, с тем, чтобы активировать фотосенсибилизирующие средства и перевести их в цитотоксическую форму, при этом пораженные клетки гибнут или снижается их пролиферативный потенциал. Известны фотосенсибилизирующие средства, которые локализуются предпочтительно или селективно в желательном целевом участке, например в опухоли или другом поражении.
Известен перечень фотосенсибилизирующих средств, включающий, прежде всего, псоралены, порфирины, хлорины и фталоцианины. Подобные лекарственные средства становятся токсичными под воздействием света.
Фотосенсибилизирующие средства могут проявлять свое действие посредством множества механизмов, непосредственно или опосредованно. Так, например, некоторые фотосенсибилизаторы становятся токсичными непосредственно при активации светом, тогда как другие действуют посредством генерирования токсичных продуктов, например, окисляющих агентов, таких как синглетный кислород, или других получаемых из кислорода свободных радикалов, которые являются чрезвычайно разрушительными в отношении клеточных материалов и биомолекул, таких как липиды, белки и нуклеиновые кислоты.
Порфириновые фотосенсибилизаторы действуют опосредованно за счет генерирования токсичных форм кислорода и рассматриваются как особенно благоприятные кандидаты для проведения ФДТ. Порфирины представляют собой естественные предшественники в синтезе гема. В частности, гем образуется в том случае, когда железо (Fe3+) включается в фотопорфирин IX (PpIX) за счет действия фермента феррохелатазы. PpIX представляет собой чрезвычайно мощный фотосенсибилизатор, тогда как гем не оказывает фотосенсибилизирующего действия. В технике известно множество порфириновых или связанных с порфирином фотосенсибилизаторов, и все они описаны в литературе.
Цитотоксическое действие большинства сенсибилизаторов, используемых для проведения ФДТ, осуществляется в основном через образование синглетного кислорода под действием света на фотосенсибилизаторы. Указанный реакционноспособный промежуточный продукт имеет очень короткое время жизни в клетках (<0,04 мксек). Таким образом, первичный цитотоксический эффект ФДТ осуществляется во время воздействия света, и он очень близок к участкам образования 1О2. 1О2 вступает в реакцию с сопутствующим окислением с белками (гистидин, триптофан, метионин, цистеин, тирозин), ДНК (гуанин), ненасыщенными жирными кислотами и холестерином. Одним из достоинств ФДТ является то, что ткани, не подвергающиеся воздействию света, остаются незатронутыми, то есть достигается селективный эффект ФДТ. Имеется обширный документальный материал, связанный с использованием ФДТ для разрушения нежелательных клеточных популяций, например неопластических клеток. В патентной литературе описано большое число фотодинамических соединений, которые действуют сами по себе или в виде конъюгатов с нацеливающими агентами, например с иммуноглобулинами, имеющими сродство к рецепторным детерминантам неопластических клеток, что делает такой комплекс более специфичным к указанным клеткам. Некоторые фотохимические соединения, такие как производные гематопорфиринов, имеют также свойственную им способность локализоваться в клетках злокачественных опухолей. Такие способы и соединения описаны в патенте Норвегии №173319 и в заявках на патент Норвегии №№900731, 176645, 176947, 180742, 176786, 301981, 300499 и 891491.
В документе WO 93/14142 описана система доставки лекарств, которая включает противораковое средство и фотоактивируемое вещество (то есть фотосенсибилизатор), которые присоединяются к сополимерным носителям. При введении указанный комплекс поступает внутрь клетки посредством пиноцитоза или фагоцитоза и локализуется внутри эндосом и лизосом. В лизосомах связь между антинеопластическим средством и полимером гидролизуется, что создает условие для пассивной диффузии указанного средства через мембрану лизосомы в цитозоль. Использование указанного способа таким образом, ограничено низкомолекулярными соединениями, которые способны диффундировать через мембрану лизосом. После некоторого промежутка времени, необходимого для диффузии, применяют источник света с соответствующей длиной волны и энергией для активации фотоактивируемого соединения. Комбинированный эффект воздействия противоракового агента и фотоактивируемого соединения разрушает соответствующую клетку. ФДТ методы, подобные описанным выше, направлены, таким образом, на разрушение клеточных структур, ведущее к гибели клетки.
С другой стороны, в документах WO96/07432 и WO00/54802 рассматриваются способы, которые используют фотодинамический эффект в качестве механизма введения не проникающих через мембрану молекул внутрь цитозоля клетки таким способом, который не приводит в обязательном порядке к обширной деструкции клеток или к гибели клеток. В рамках такого способа, молекулу, которую необходимо ввести внутрь, и фотосенсибилизирующее соединение вводят в клетки одновременно или последовательно, при этом фотосенсибилизирующее соединение и указанная молекула подвергаются эндоцитозу, либо, в ином варианте, помещаются в эндосомы, лизосомы или другие внутриклеточные компартменты, ограниченные мембраной.
Молекула, которую нужно поместить во внутриклеточные компартменты, и фотосенсибилизирующее соединение вводят в клетку вместе или последовательно, и оба они поглощаются клеткой в одни и те же внутриклеточные компартменты (то есть перемещаются совместно). Молекула, предназначенная для интернализации, затем высвобождается посредством воздействия на клетку светом с подходящей длиной волны с целью активации фотосенсибилизирующего соединения, которое, в свою очередь, ведет к разрушению мембран соответствующих компартментов и последующему высвобождению молекулы, которая располагается в том же компартменте, что и фотосенсибилизирующее средство, в цитозоль. Такой способ получил название "фотохимическая интернализация" или ФХИ (PCI). Таким образом, на конечной стадии воздействия света на клетки в рамках указанного способа происходит высвобождение рассматриваемой молекулы из того же внутриклеточного компартмента, где находится фотосенсибилизирующее средство, и она появляется в цитозоле.
Считалось, что для того, чтобы данный способ был эффективным, необходимо, чтобы и фотосенсибилизирующее средство, и молекула, которая должна быть высвобождена в цитозоль, находились в одних и тех же компартментах при проведении облучения.
Сейчас неожиданно было обнаружено, что молекулы могут быть введены в цитозоль клеток способами, аналогичными ФХИ, но в которых экспозиция клеток на свету необязательно является окончательной стадией, при этом указанные способы не зависят от того, находятся ли молекула и фотосенсибилизирующее средство в одних и тех же внутриклеточных компартментах во время воздействия света. В таких способах фотосенсибилизирующее соединение может вступать в контакт с клетками и активироваться посредством облучения до того, как рассматриваемая молекула, подлежащая интернализации и таким образом попадающая в цитозоль, будет приведена в контакт с указанными клетками. Таким образом, несмотря на то что подвергаемая интернализации молекула и фотосенсибилизирующее средство необязательно локализованы в одних и тех же внутриклеточных компартментах во время воздействия света, молекула, тем не менее, входит в клетку и доставляется в цитозоль. Указанные результаты представляются чрезвычайно неожиданными, а такие способы дают значительные преимущества по сравнению со способами, в которых световое облучение представляет собой окончательную стадию.
Таким образом, в своем наиболее общем виде настоящее изобретение относится к способу введения молекулы внутрь цитозоля клетки, при этом указанный способ включает контакт данной клетки с фотосенсибилизирующим средством, контакт данной клетки с вводимой молекулой и облучение данной клетки светом с длиной волны, эффективной для активации фотосенсибилизирующего средства, причем указанное облучение проводится перед поглощением указанной молекулы во внутриклеточный компартмент, содержащий указанное фотосенсибилизирующее средство, предпочтительно перед поглощением клеткой указанной молекулы в любой внутриклеточный компартмент.
Так, в одном альтернативном варианте, указанное облучение может быть проведено после поглощения молекулы во внутриклеточный компартмент, что позволяет, чтобы подлежащая интернализации указанная молекула и фотосенсибилизирующее средство находились во время облучающего воздействия света не в одних и тех же внутриклеточных компартментах. Однако в предпочтительном варианте реализации настоящего изобретения облучение проводят перед поглощением клеткой молекулы, подлежащей интернализации.
Термин "интернализация" в контексте настоящего изобретения относится к доставке молекул в цитозоль. Так, в данном случае "интернализация" включает стадию высвобождения молекул из внутриклеточных/связанных с мембраной компартментов в цитозоль клеток.
В контексте настоящего описания термин "поглощение клеткой" или "перемещение" относится к одной из стадий интернализации, на которой молекулы, внешние для клеточной мембраны, захватываются внутрь клетки, так что они оказываются внутри внешней клеточной мембраны, например, посредством эндоцитоза или других соответствующих механизмов поглощения, например, внутрь или ассоциированно с ограниченными мембраной внутриклеточными компартментами, такими, например, как эндоплазматический ретикулум, тельца Гольджи, лизосомы, эндосомы и т.п.
В частности, в предпочтительном аспекте настоящего изобретения рассматривается способ введения молекулы в цитозоль клетки, причем указанный способ включает контакт данной клетки с фотосенсибилизирующим средством, облучение указанной клетки светом с длиной волны, эффективной для активации фотосенсибилизирующего средства, и, по существу, в то же самое время или несколько позже облучения, контакт данной клетки с молекулой, подлежащей введению.
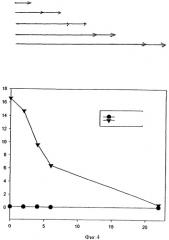
Предпочтительно, клетки приводят в контакт с молекулами, подлежащими введению или интернализации (обозначаемые здесь и далее как "переносимые молекулы"), в момент времени после того, как было проведено облучение или, иными словами, фотохимическая обработка клеток посредством контакта их с фотосенсибилизирующим средством и последующим облучением, производится перед тем, как указанные молекулы добавляют к клеткам. В данном варианте молекулы, подлежащие введению в цитозоль, могут быть приведены в контакт с клетками, которые были подвергнуты фотохимической обработке, в любой момент времени после такой обработки, при условии, что переносимые молекулы еще могут быть захвачены клетками. Временной интервал, в течение которого указанные молекулы могут быть приведены в контакт с клетками и все еще могут быть поглощены ими, зависит от множества факторов, таких, например, как тип клеток, конкретная природа данной молекулы, конкретная природа используемого фотосенсибилизирующего средства и длительность световой обработки. Указанный временной интервал может быть, при необходимости, определен для определенного набора состояний. Однако предпочтительно, чтобы молекулы, подлежащие переносу в цитозоль, добавлялись к клеткам относительно скоро после фотохимической обработки, например, в течение 24 часов после такой фотохимической обработки, и более предпочтительно в течение первых 10 часов после фотохимической обработки, например, в течение первых 5 часов или, более предпочтительно, в течение первого часа. Так, например, in vitro или ex vivo переносимая молекула может быть введена в течение определенного периода времени, например в течение времени от 30 минут до 24 часов, предпочтительно в течение времени от 1 до 2 часов, при этом введение начинается сразу же или вскоре после облучения, например, если конец облучения рассматривать как исходную точку, то переносимая молекула должна быть внесена в момент времени от 0 минут до 24 часов, например, в момент времени от 0 до 4 часов. Было показано, что даже в том случае, если переносимая молекула контактирует с клеткой через достаточно длительное время после облучения, интернализация в клетку все еще возможна. Так, например, переносимая молекула может быть внесена более чем через час после облучения, например, более чем 2, 4, 8, 10 или даже 12 часов после облучения.
Таким образом, в предпочтительном варианте реализации указанная клетка вступает в контакт с указанной переносимой молекулой в период времени от 0 до 4 часов после облучения, длящегося от 1 до 2 или 3 часов или дольше, например, в период времени по меньшей мере от 0,5 до 3 часов. Время, в которое вводится переносимая молекула, варьируется в зависимости от используемых для введения in vitro или in vivo способов. Для способов введения in vitro переносимые молекулы могут быть, в основном, приведены в контакт со всеми целевыми клетками одновременно, например, если клетки растут в культуре in vitro, и, таким образом, относительно легко привести искомые молекулы в контакт с клетками в соответствующей временной точке. In vivo, однако, стадия контакта целевых клеток с переносимыми молекулами очевидно более усложнена и будет зависеть от способа введения и от локализации целевых клеток. Так, например, в том случае, когда переносимая молекула может быть введена непосредственно в целевые клетки, например, посредством местной инъекции, переносимая молекула вступит в контакт с целевыми клетками (или по меньшей мере с частью их) относительно быстро, например, в течение порядка минут или часов после введения. С другой стороны, если переносимые молекулы вводят посредством внутривенной инъекции в отдаленную мишень, то указанным молекулам может потребоваться гораздо больше времени для того, чтобы вступить в контакт с целевыми клетками. Так, например, им может потребоваться от 24 до 96 часов после введения для достижения целевых клеток. Такое "время путешествия" должно быть принято во внимание при решении вопроса о соответствующем времени введения переносимых молекул относительно времени введения фотосенсибилизирующего средства и времени облучения.
В альтернативном варианте осуществления настоящего изобретения переносимая молекула может быть приведена в контакт с клетками по существу в то же самое время, что и время облучения, а не после облучения. Выражение "по существу в то же самое время" в настоящем описании означает точно в то же самое время, то есть одновременно, но также включает добавление молекул к клеткам незадолго перед облучением, например, за один или два часа перед облучением, при условии, что клеточное поглощение переносимой молекулы не происходило во время облучения, хотя и может все еще иметь место после облучения, или при условии, что если клеточное поглощение переносимой молекулы происходило, то при этом переносимая молекула и фотосенсибилизирующий агент не локализованы в одних и тех же внутриклеточных компартментах во время экспозиции на свету.
Как отмечалось выше, для определения точного времени добавления переносимой молекулы и фотосенсибилизирующего средства, а также времени облучения, необходимого для достижения указанных выше эффектов, следует учесть различные факторы, включая клетки, подлежащие обработке, используемые средства и молекулы и окружение клеток, особенно в отношении того, в какой системе - in vivo или in vitro - происходит процесс. С учетом указанных соображений, соответствующие временные параметры легко могут быть определены.
В качестве основного принципа для определения соответствующих условий можно указать, что стадия облучения должна проходить либо перед поглощением клеткой переносимой молекулы (при условии, что само фотосенсибилизирующее средство уже было перенесено во внутриклеточные компартменты), либо после поглощения клеткой переносимой молекулы при условии, что переносимая молекула и фотосенсибилизирующее средство не локализованы в одних и тех же внутриклеточных компартментах в момент воздействия света. В отношении последнего варианта очевидно, что переносимая молекула вступает в контакт с клетками в момент времени, предшествующий началу воздействия облучения. Такие условия составляют один из предпочтительных вариантов осуществления настоящего изобретения.
Описанные ранее способы фотохимической интернализации, при которых переносимая молекула и фотосенсибилизирующее средство добавлялись к клеткам перед облучением, зависели от природы рассматриваемых молекул в плане возможности локализации в одних и тех же внутриклеточных компартментах перед воздействием света, так что лизис указанных внутриклеточных компартментов в результате активации светом фотосенсибилизирующего средства приводил к высвобождению в цитозоль и рассматриваемой молекулы, и указанного фотосенсибилизирующего средства.
Указанный процесс схематически изображен на фиг.7. Что касается настоящего изобретения, то очевидно, что фотосенсибилизирующее средство и переносимая молекула, предназначенная для введения в цитозоль, не находятся в одних и тех же внутриклеточных компартментах в момент воздействия света, поскольку переносимую молекулу добавляют к клеткам только незадолго до или уже после экспозиции на свету.
Механизм действия указанных способов до сих пор не известен, и в действительности уже сам факт, что данный способ работает, является удивительным. Не ограничивая себя рамками какой-либо теории, можно указать, что причиной таких удивительных открытий может быть слияние фотохимически поврежденных везикул со вновь сформированными внутриклеточными везикулами, что затем приводит к высвобождению заново захваченных посредством эндоцитоза молекул в цитозоль. Указанный процесс изображен схематически на диаграмме, представленной на фиг.7.
Альтернативно, фотохимическое повреждение лизосомных ферментов или везикул, содержащих лизосомные ферменты, таких как указанные эндосомы, может снижать скорость внутриклеточной деградации молекул, подлежащих интернализации. Такой процесс может быть связан либо со сниженным транспортом к везикулам, содержащим лизосомные ферменты, либо с транспортом к внутриклеточным везикулам, характеризующимся меньшей гидролитической активностью. В этом случае, указанные молекулы будут иметь больше времени для того, чтобы избегнуть эндоцитозного включения в компартменты, чем в том случае, когда активен процесс лизосомной деградации. Еще одним альтернативным объяснением может быть тот факт, что фотохимическая обработка клеток приводит к небольшому повреждению плазматических мембран клеток, что ведет к повышению проникновения макромолекул через клеточную мембрану. Однако проведенные эксперименты (см. пример 7) свидетельствуют о том, что это, скорее всего, не может служить искомой причиной.
Настоящее изобретение относится, таким образом, к способам транспортировки или трансфекции любых молекул в цитозоль живых клеток как in vitro (то есть в культуре клеток), так и in vivo, после чего указанные молекулы становятся доступными в цитозоле.
Такие способы могут использоваться не только для переноса молекул (или их частей или фрагментов) во внутреннюю область клетки, но также, в некоторых случаях, могут доставлять или экспрессировать их на поверхность клетки. Таким образом, после перемещения и высвобождения молекулы в клеточный цитозоль согласно способу настоящего изобретения, в том случае, если указанные(ая) клетки(а) представляют(ет) собой специализированные клетки, такие как, например, антиген-презентирующая клетка, молекула или ее фрагмент могут переноситься на поверхность клетки, где они могут быть представлены на внешней стороне клетки, то есть на клеточной поверхности. Такие способы могут иметь особую практическую ценность в области вакцинации, когда компоненты вакцин, то есть антигены или иммуногены, могут быть введены в клетку для представления на поверхности такой клетки, с тем чтобы индуцировать, облегчить или повысить иммунный ответ. Дополнительные детали, связанные с использованием способа, делающего возможным экспрессирование молекул на клеточную поверхность, описаны в документе WO00/54802.
Переносимые молекулы, которые могут быть введены в цитозоль клеток с использованием способов настоящего изобретения, включают молекулы, которые не способны легко проникать через клеточные мембраны. Кроме того, настоящее изобретение может способствовать увеличению доставки в цитозоль и активности молекул, которые способны лишь частично проникать через мембрану клетки или мембраны внутриклеточных везикул. Переносимые молекулы могут представлять собой органические соединения, белки или фрагменты белков, такие, например, как пептиды, антитела, или антигены, или их фрагменты. Другой класс переносимых молекул, пригодных для использования согласно настоящему изобретению, включает цитотоксические средства, такие как белковые токсины или цитотоксические органические соединения, например блеомицин. Еще один класс подходящих переносимых молекул включает нуклеиновые кислоты.
Нуклеиновые кислоты могут использоваться в виде генов, кодирующих, например, терапевтические белки, антисмысловые молекулы РНК, рибозимы, аптамеры или триплексы РНК, образующие олигонуклеотиды. Альтернативно, нуклеиновые кислоты могут использоваться в виде некодирующих молекул, таких как, например, синтетическая ДНК или антисмысловые молекулы РНК, рибозимы, аптамеры, триплексы, образующие олигонуклеотиды, пептидные нуклеиновые кислоты (ПНК), фактор транскрипции "ложной" ДНК или химерные олигонуклеотиды, используемые для репарации специфических мутаций у пациента. Там, где это приемлемо, молекулы нуклеиновой кислоты могут иметь вид полных генов или фрагментов нуклеиновой кислоты, необязательно включенных в векторную молекулу или структуру, например, в плазмидный вектор или в вирусную частицу или бактериофаг. Последняя форма имеет особую применимость в том случае, когда переносимая молекула предназначена для использования в генной терапии.
Фотосенсибилизирующее средство, которое может использоваться согласно настоящему изобретению, представляет собой любой такой агент, который локализуется во внутриклеточных компартментах, в особенности в эндосомах или лизосомах. Набор таких фотосенсибилизирующих средств известен в технике и описан в литературе, включая документ WO96/07432. В этом аспекте могут быть отмечены ди- и тетрасульфонированный фталоцианин алюминия (например, AlPcS2a), сульфонированные тетрафенилфосфины (TPPSn) (ТФФС), нильский голубой, производные хлорина е6, уропорфирин I, филлоэритрин, гематопорфирин и метиленовый синий, которые, как было показано, локализуются в эндосомах и лизосомах клеток в культурах клеток. Это в большинстве случаев обусловлено эндоцитозным характером поглощения фотосенсибилизаторов. Таким образом, фотосенсибилизирующее средство предпочтительно представляет собой вещество, которое поглощается во внутренние компартменты лизосом или эндосом. Однако могут быть использованы также и другие фотосенсибилизирующие средства, которые локализуются в других внутриклеточных компартментах, например в эндоплазматическом ретикулуме или аппарате Гольджи. Понятно также, что такие механизмы могут работать и в тех случаях, когда результаты фотохимической обработки воздействуют на другие клеточные компоненты (то есть на компоненты, отличные от компартментов, изолированных мембранами). Так, например, одна из возможностей может заключаться в том, что фотохимическая обработка разрушает молекулы, важные для внутриклеточного транспорта или слияния везикул. Такие молекулы могут необязательно быть локализованы в компартментах, ограниченных мембраной, но фотохимическое повреждение таких молекул может, тем не менее, вести к фотохимической интернализации переносимых молекул, например, посредством механизма, при котором фотохимические воздействия на такие молекулы ведут к уменьшению транспорта молекулы, подлежащей интернализации (то есть переносимой молекулы), к деградируемым везикулам, таким как лизосомы, так что данная молекула, подлежащая интернализации, может выйти в цитозоль до ее деградации. Примеры таких молекул, которые необязательно локализованы в компартментах с ограничивающей мембраной, включают несколько молекул микротрубчатой транспортной системы, таких как динеин и компоненты динактина, и, например, rab5, rab7, фактор чувствительности к N-этилмалеимиду (NSF), растворимый белок связывания фактора NSF (SNAP) и им подобные.
Классы подходящих фотосенсибилизирующих средств, которые могут быть отмечены применительно к данному случаю, включают порфирины, фталоцианины, пурпурины, хлорины, бензопорфирины, нафталоцианины, катионные красители, тетрациклины и лизомотропные слабые основания или их производные (Berg et al., J. Photochemistry and Photobiology, 1997, 65, 403-409). Другие подходящие фотосенсибилизирующие средства включают тексафирины, феофорбиды, порфицены, бактериохлорины, кетохлорины, производные гематопорфирина и их производные, эндогенные фотосенсибилизаторы, индуцируемые 5-аминолевулиновой кислотой и их производные, димеры или другие конъюгаты фотосенсибилизаторов.
Предпочтительно, фотосенсибилизатор находится в свободной форме, то есть он не конъюгирован с какой-либо другой макромолекулой. Однако альтернативно фотосенсибилизатор может быть ассоциирован, присоединен или конъюгирован с носителем или другой молекулой, приведенной в настоящем описании, например, присоединен к нацеливающему антителу или связан с носителем, таким как полилизин.
Предпочтительные фотосенсибилизирующие средства включают TPPS4, TPPS2a, AlPcS2a и другие амфифильные фотосенсибилизаторы. В предпочтительном аспекте настоящее изобретение предлагает способы, в которых пригодные для использования фотосенсибилизирующие средства относятся к соединениям, представленным 5-аминолевулиновой кислотой или сложными эфирами 5-аминолевулиновой кислоты или их фармацевтически приемлемыми солями.
В таких сложных эфирах 5-аминогруппа может быть замещенной или незамещенной, в последнем случае они представляют собой сложные эфиры АЛК (ALA).
Более конкретно, сложные эфиры АЛК, используемые согласно настоящему изобретению, представляют собой сложные эфиры 5-аминолевулиновых кислот с необязательно замещенными алканолами, то есть алкильные сложные эфиры или замещенные алкильные сложные эфиры.
Соответственно, сложные эфиры АЛК, которые могут использоваться согласно настоящему изобретению, представляют собой соединения формулы I,
R2 2N-CH2COCH2-CH2CO-OR1 (I)
(где R1 может представлять собой алкил, необязательно замещенный гидрокси-, алкокси-, ацилокси-, алкоксикарбонилокси-, амино-, арил-, оксо- или фтор-группами с необязательным включением атомов кислорода, азота, серы или фосфора; и R2, каждый из которых может быть одинаковым или различным, представляет собой атом водорода или группу R1) или их соли.
Замещенные алкильные группы R1 могут быть моно- или полизамещенными. Так, замещенные R1 группы включают, например, незамещенный алкил, алкоксиалкил, гидроксиалкоксиалкил, полигидроксиалкил, гидроксиполиалкиленоксиалкил и т.п. Термин "ацил" в контексте настоящего описания включает и карбоксилатные, и карбонатные группы; так, ацилокси-замещенные алкильные группы включают, например, алкилкарбонилоксиалкил. В таких группах любой алкиленовый фрагмент предпочтительно содержит атомы углерода в количестве, определенном для алкильных групп ниже. Предпочтительные арильные группы включают фенил и моноциклические 5-7-членные гетероароматические соединения, особенно фенил, причем сами такие группы могут быть необязательно замещены.
Репрезентативные замещенные группы R1 включают алкоксиметильную, алкоксиэтильную и алкоксипропильную группы или ацилоксиметильную, ацилоксиэтильную и ацилоксипропильную группы, например, пивалоилоксиметил.
Сложные эфиры АЛК, предпочтительные для использования в качестве фотосенсибилизирующих средств согласно настоящему изобретению, включают те из них, в которых R1 обозначает незамещенную алкильную группу и/или каждый R2 обозначает атом водорода.
В контексте настоящего описания термин "алкил" включает любую длинноцепочечную или короткоцепочечную, линейную или разветвленную алифатическую насыщенную или ненасыщенную углеводородную группу. Ненасыщенные алкильные группы могут быть моно- или полиненасыщенными и включают и алкенильные, и алкинильные группы. Такие группы могут содержать вплоть до 40 атомов углерода. Однако предпочтительными являются алкильные группы, содержащие вплоть до 10, например 8, более предпочтительно вплоть до 6, и особенно предпочтительно вплоть до 4 атомов углерода.
Следует особо отметить сложный АЛК-метиловый эфир, сложный АЛК-этиловый эфир, сложный АЛК-пропиловый эфир, сложный АЛК-гексиловый эфир, сложный АЛК-гептиловый эфир и сложный АЛК-октиловый эфир и их соли, которые представляют собой предпочтительные фотосенсибилизирующие средства для использования согласно настоящему изобретению.
Необходимо, чтобы фотосенсибилизирующее средство контактировало с клеткой до облучения. Однако, в отличие от переносимой молекулы, указанное средство должно вводиться до облучения, так чтобы к моменту облучения указанное средство уже было включено во внутриклеточный компартмент. В этой связи, данный агент вводится за 1-72 часа до облучения, например за 4-48 часов, например, за 4-24 часа до облучения. И снова, как обсуждалось выше в отношении стадии приведения переносимой молекулы в контакт с клетками, время введения фотосенсибилизирующего средства для достижения контакта с целевой клеткой относительно времени облучения зависит от того времени, которое потребуется фотосенсибилизирующему средству для достижения целевых клеток и поглощения ими. Указанное время может варьировать в зависимости от используемых способов, т.е. от того, проводится оно in vivo или in vitro, и от того, проводится ли введение непосредственно в целевую ткань или в отдаленный участок. Во всех случаях важно, чтобы фотосенсибилизирующее средство поглощалось целевыми клетками перед процессом облучения. Указанное средство может быть приведено в контакт с целевыми клетками непосредственно до облучения, например, за 1 или 4-72 часа, предпочтительно за 4-24 часа, например, за 12-20 часов, или оно может быть удалено для прекращения контакта непосредственно перед облучением, например, более чем за 5 минут, например за 10 минут - 8 часов, например, за 1-4 часа с использованием свободной от агента среды.
Необязательно, один или другой или оба компонента - фотосенсибилизирующее средство и переносимая молекула, подлежащая введению в клетки, могут быть присоединены, или ассоциированы, или конъюгированы с одной или более молекулами носителя, нацеливающими молекулами или векторами, которые могут действовать в направлении облегчения или увеличения поглощения фотосенсибилизирующего средства или переносимой молекулы, или могут способствовать достижению мишени или доставке указанных структур в конкретный тип клеток, ткани или внутриклеточного компартмента. Примеры систем носителей включают полилизин или другие поликатионы, сульфат декстрана, различные катионные липиды, липосомы, восстановленные ЛНП-частицы, пространственно стабилизированные липосомы или аденовирусные частицы. Такие системы переносчиков в основном улучшают фармакокинетические свойства и увеличивают поглощение клетками переносимой молекулы и/или фотосенсибилизирующего средства и могут также направлять переносимую молекулу и/или фотосенсибилизирующее средство во внутриклеточные компартменты, для которых достижение фотохимической интернализации было бы особенно благоприятным, хотя сами данные системы в основном не обладают способностью направлять переносимую молекулу и/или фотосенсибилизирующее средство в специфические клетки (например, раковые клетки) или ткани. Однако для достижения такого специфического или селективного нацеливания молекулы указанного носителя, переносимая молекула и/или фотосенсибилизатор могут быть ассоциированы или конъюгированы со специфическими нацеливающими молекулами, которые облегчают специфическое поглощение клетками переносимой молекулы в желательные типы клеток или тканей. Такие нацеливающие молекулы могут также направлять переносимую молекулу во внутриклеточные компартменты, для которых особенно благоприятно достижение фотохимической интернализации.
Могут быть использованы различные нацеливающие молекулы, такие, например, как описанные в литературе (Curiel, D.T. (1999), Ann. New York Acad. Sci., 886, 158-171; Bilbao, G., et al. (1998), in Gene Therapy of Cancer (Walden et al., eds., Plenum Press, New York); Peng K.W. and Russell S.J. (1999), Curr. Opin. Biotechnol. 10, 454-457; Wickham T.J. (2000), Gene Ther. 7, 110-114).
Молекула носителя и/или нацеливающая молекула могут быть ассоциированы, связаны или конъюгированы с переносимой молекулой, фотосенсибилизирующим средством или с ними обоими и при этом может использоваться один и тот же или разные носители или нацеливающие молекулы. Если в качестве носителя используют, например, аденовирусные частицы, то переносимая молекула может быть включена в состав аденовирусных частиц. Так, например, если рассматриваемая переносимая молекула представляет собой молекулу ДНК, кодирующую белок, или молекулу РНК, то такая ДНК включается в вирусный вектор и после фотохимической интернализации указанная молекула ДНК будет присутствовать в правильном внутриклеточном сайте, так что будет происходить экспрессия кодируемой молекулы.
Экспрессия таких молекул может контролироваться с помощью вектора, разработанного с помощью хорошо известных в технике и задокументированных способов. Так например, могут использоваться регуляторные элементы, такие как, например, тканеспецифичные или регуляторные промоторы, для достижения регулируемой экспрессии специфичной для определе