Способ лечения тромбоцитарных нарушений у новорожденных телят с диспепсией
Иллюстрации
Показать всеИзобретение относится к области ветеринарии. Способ включает взятие крови, ее стабилизацию, выделение из крови тромбоцитов, оценку активности в них каталазы и супероксиддисмутазы и содержания малонового диальдегида с расчетом величины фактора антиоксидантного состояния тромбоцитов. При нахождении фактора антиоксидантного состояния тромбоцитов у новорожденных телят в границах 6,4×106-5,5×106 МЕ2/нмоль×109 тр. телятам в течение 10 дней дают «Экос» 150 мг/кг живой массы. При нахождении фактора антиоксидантного состояния в границах 5,4×106-4,7×106 МЕ2/нмоль×109 тр. телятам назначают 0,01% раствор «Фосфопага» в дозе 100,0 мл утром и «Экос» в дозе 150 мг/кг живой массы вечером в течение 10 дней. При нахождении фактора антиоксидантного состояния тромбоцитов у новорожденных телят с диспепсией 4,6×106 МЕ2/нмоль×109 тр. и ниже телятам назначают 0,01% раствор «Фосфопага» в дозе 100,0 мл утром, глюконата кальция 10% в дозе 10,0 мл днем и «Экос» 150 мг/кг живой массы вечером. Способ позволяет проводить своевременную и эффективную коррекцию тромбоцитопатии у новорожденных телят в каждом конкретном случае, оздоровить молодняк крупного рогатого скота. 2 ил., 3 табл.
Реферат
Изобретение относится к ветеринарии в области гематологии, а именно к гемостазу, и может быть использовано для выбора корректирующего подхода для лечения тромбоцитарных нарушений у новорожденных телят с диспепсией.
Аналогов способа выбора корректирующего подхода для лечения тромбоцитарных нарушений у новорожденных телят с диспепсией не существует.
В литературе имеются рекомендации по применению гидроалюмосиликатного сорбента «Экос» телятам-молочникам для снижения в пище тяжелых металлов, нитритов и других соединений, профилактируя растройства желудочно-кишечного тракта и стимулируя прирост массы тела (Шапошников А.А., Посохов А.В. Использование гидроалюмосиликатного сорбента «Экос» в рационах стельных коров и телят-молочников. // Материалы Всероссийской научной конференции с международным участием «Сорбенты как фактор качества жизни и здоровья». Москва-Белгород, 2004. - С.180-184).
В литературе имеются рекомендации по назначению «Фосфопага» для дезинфекции помещений, больниц, коровников, птицеферм, обработки зерновых культур, картофеля перед посевом и перед хранением для лучшей сохранности урожая (К.Ефимов Борьба за хлеб насущный: ПАГИ на службе сельского хозяйства. // Журнал. Барьер безопасности, 2005. - №1, - с.77-81).
Для повышения уровня секреции в желудочно-кишечном тракте телят применяется глюконат кальция. Однако подхода к рациональному назначению лечебных подходов теленку в каждом конкретном случае не разработано.
Целью изобретения является повышение эффективности выбора лечебного подхода для коррекции тромбоцитопатии у новорожденных телят с диспепсией.
Сущность заявляемого способа заключается в том, что для выбора корректирующего подхода для лечения тромбоцитарных нарушений у новорожденных телят с диспепсией из вены берется кровь в пробирку с последующим выделением из нее тромбоцитов, определением в них активности каталазы, супероксиддисмутазы (СОД), содержания малонового диальдегида (МДА) и расчета фактора антиоксидантного состояния тромбоцитов (ФАСТ).
По полученным значениям ФАСТ у каждого конкретного теленка возможно определять степень повреждающего действия продуктов перекисного окисления липидов (ПОЛ) на тромбоцитарные функции. По состоянию ФАСТ регистрируется способность тромбоцитов противостоять вредным воздействиям элементов патогенеза диспепсии. По величине ФАСТ также можно определить какое лечение необходимо назначить в данном случае, чтобы стабилизировать ПОЛ кровяных пластинок при ослаблении в них активности каталазы и СОД и тем самым нивелировать причинные факторы развития тромбоцитопатии.
Способ отличается тем, что с применением нескольких технически простых и не требующих дорогостоящих реактивов, оборудования, затрат сил и времени методов возможно производить выбор корректирующего подхода для лечения тромбоцитарных нарушений у новорожденных телят с диспепсией, способного привести к полной нормализации состояния тромбоцитарных функций и эффективной профилактикой возникновения тромбозов различных сосудов.
По завершению лечебных мероприятий возможно повторное обследование с определением ФАСТ с целью контроля адекватности проводимых мер.
Заявляемый способ осуществляется следующим образом.
Взятие крови производят в утренние часы. Кровь берут из вены в количестве 20 мл через толстую иглу самотеком в пробирку. В качестве консерванта используют 5% раствор трилона-Б из расчета 1,5 мл консерванта на 20 мл цельной крови. Затем кровь с консервантом осторожно и тщательно перемешивают и для осаждения эритроцитов и лейкоцитов центрифугируют при 1000 об/мин в течение 10 мин. Надосадочный слой, который содержит основную массу тромбоцитов, отсасывают в отдельную пробирку и центригируют при 1000 об/мин в течение 10 мин. При этом оставшиеся в надосадочном слое эритроциты и лейкоциты оказываются в осадке. Осадок удаляют, а супернатант помещают в отдельную пробирку и центифугируют при 2200 об/мин в течение 15 мин. В результате получают осадок, состоящий из одних тромбоцитов. Выход тромбоцитов составляет 1,5×109-2,5×109 клеток из 20 мл цельной крови. Полученные тромбоциты отмывают следующим образом. Недосадочную жидкость после третьего центрифугирования удаляют, а к осадку тромбоцитов добавляют 6 мл 0,85% раствора натрия хлорида, приготовленного на 2,7% растворе трилона Б. Осадок кровяных пластинок осторожно перемешивают и центрифугируют при 2200 об/мин в течение 10 мин. Затем супернатант удаляют, а к осадку вновь добавляют физиологический раствор на трилоне Б в тех же количествах. Эту процедуру повторяют трижды. Следует отметить, что выделение и отмывание тромбоцитов проводят при комнатной температуре. Часть клеток в процессе отмывания теряется и количество тромбоцитов, выделенных из 20 мл цельной крови, в итоге составляет в среднем 1,8×109 клеток. В каждом конкретном случае количество тромбоцитов подсчитывается в камере Горяева.
Последующая оценка активности каталазы и СОД осуществляется следующим способом.
Определение каталазы в крови.
Принцип метода состоит в том, что каталаза разрушает субстрат Н2О2, а оставшуюся неразрушенной часть перекиси водорода измеряют с помощью молибдата натрия. Как известно для молибдена характерно образование при взаимодействии с перекисью водорода перекисных соединений состава Na2МоО6, которые имеют желтую окраску. Интенсивность окраски образующихся перекисных соединений молибдена зависит от количества перекиси водорода в растворе, т.е. от активности каталазы в пробе.
Реагенты.
(1) 0,3% водный раствор перекиси водорода (1 мл концентрированного раствора перекиси водорода доводят дистиллированной водой до 100 мл).
(2) 4% водный раствор молибдата натрия.
| Таблица 1 | ||
| Схема определения каталазы в крови | ||
| Вводимые реагенты | Холостая проба | Исследуемая проба |
| Раствор H2O2, мл | 2,000 | 2,000 |
| Суспензия тромбоцитов, мл | - | 0,010 |
| Раствор молибдата, мл | 1,000 | 1,000 |
В табл.1 приведено описание методики.
Раствор молибдата добавляют к каждой пробе по отдельности и сразу же после перемешивания реакционной смеси измеряют экстинкцию при 410 нм против дистиллированной воды. Экстинкция холостой пробы около 0,350. Чем больше в пробе каталазы, тем меньше перекиси водорода остается неразрушенной и тем меньше образуется перекисей молибдата. Результат оценивают по степени разрушения перекиси водорода каталазой или степени блокирования образования конечных продуктов перекисей молибдата и выражают в процентах. Расчет проводят по формуле
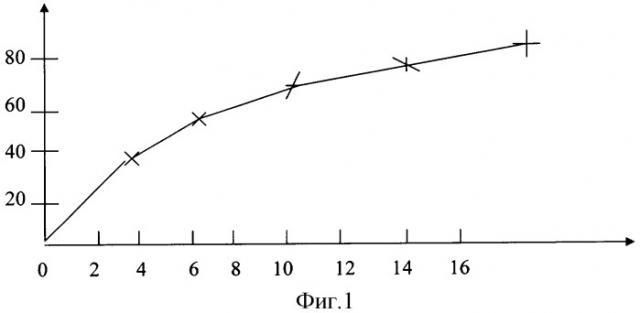
где Ех.пр и Еиссл.пр - экстинкция соответственно холостой и исследуемой проб. С помощью калибровочной кривой, построенной для стандартных растворов каталазы (схема 1 на фиг.1), оценивают активность каталазы в пробе на основании рассчитанного процента разрушения перекиси водорода. Активность каталазы относят к концентрации тромбоцитов (в МЕ/109 тр.) в исследуемой взвеси тромбоцитов.
По оси абсцисс схемы отложена активность каталазы в ME/10 тр., по оси ординат - блокирование реакции в %.
Определение СОД.
Принцип определения основан на восстановлении нитротетразолия супероксидными радикалами, которые образуются при реакции между феназинметасульфатом и восстановленной формой никотинамиддинуклеотида (NAD·H). Образование нитроформазана, продукта восстановления нитротетразолия, блокируется наличием в пробе СОД. Так, на основании количества нитроформазана можно оценить активность СОД.
Реагенты.
(1) 0,15 М фосфатный буфер (рН 7,8) (4,48 г Na2HPO4, 0,25 г КН2PO4 растворяют в 500 мл дистиллированной воды).
(2) Инкубационная смесь 37 мг ЭДТА-Na2, 330 мг нитротетразолия голубого, 55 мг феназинметасульфата смешивают с 300 мл фосфатного буфера, оставляют стоять на ночь. Утром фильтруют.
(3) Раствор NAD·H (152 мг NAD·H растворяют в 10 мл трис-ЭДТА-буфера).
(4) Трис-ЭДТА-буфер, рН 8,0 (37 мг ЭДТА-Na, 24 мг трис растворяют в 100 мл дистиллированной воды).
В суспензии тромбоцитов определяют СОД (табл.2).
| Таблица 2. | ||
| Схема определения СОД. | ||
| Добавляемые реагенты | Холостая проба | Исследуемая проба |
| Инкубационная смесь, мл | 1,500 | 1,500 |
| Дистиллированная вода, мл | 0,100 | - |
| Суспензия тромбоцитов, мл | - | 0,100 |
| Раствор NAD·H, мл | 0,050 | 0,050 |
Смешивают при комнатной температуре и измеряют экстинкцию холостой и исследуемой проб при 540 нм на спектрофотометре. Экстинкция холостой пробы составляет около 0,680. Расчет производят по формуле
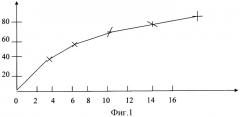
Активность СОД определяют с помощью калибровочной кривой (схема 2 на фиг.2). Активность СОД в крови выражают в ME/109 тр. По оси абсцисс схемы отложены активность СОД в МЕ/109 тр, по оси ординат - блокирование восстановления нитротетразолия в %.
Определение МДА.
Уровень МДА определяется тиобарбитуровым методом в отмытых и ресуспендированных тромбоцитах, принцип метода Smith I.B., Jngerman С.М., Silver M.I. Malondialdehyde formation as an indicator of prostaglandin production by human platelet. // J. Lab. Clin. Med. - 1976. - Vol.88. - №1. - P.167-172 в модификации Кубатиев А.А., Андреев С.В. Перекиси липидов и тромбоз. // Бюллетень экспериментальной биологии. - 1979. - №5. - с.414-417.
В пробу 0,5 мл суспензии тромбоцитов добавляют 0,5 мл 50% трихлоруксусной кислоты на 1 N HCl и 0,5 мл 0,9% тиобарбитуровой кислоты. Сразу после смешивания реактивов проба помещается на кипящую водяную баню на 15-30 мин. После этого ее охлаждают при комнатной температуре и центрифугируют при 3000 об/мин.
Супернатант фотометрируют при λ=532 нм. Контролем служит проба, в которую вносили 0,5 мл физиологического раствора. Расчет ведется по формуле
где ε - экстинкция пробы;
1,5·105 - коэффициент молярной экстинкции;
3 - коэффициент учитываемого разведения;
109 - коэффициент перехода в нМ.
Концентрация МДА в пересчете на 109 тромбоцитов определяется следующим образом:
С (нМ·109 тромбоцитов)=ε·2·102/N;
N - число тромбоцитов в мкл, деленное на 100000.
Оценка полученных результатов.
Для характеристики антиоксидантного состояния тромбоцитов применяется расчетно определяемый фактор, по величине которого комплексно оценивают активность важных антиоксидантных энзимов и уровень сдерживаемого ими перекисного окисления липидов кровяных пластинок (С.Чевари, Т.Андял, Я.Штрегер. Определение антиоксидантных параметров крови и их диагностическое значение в пожилом возрасте. // Лабор. дело. 1991. - №10. - с.9-13). Этот фактор антиоксидантного состояния выражается формулой
По полученным значениям ФАСТ у каждого конкретного новорожденного теленка с диспепсией возможно подбирать необходимое лечение, достаточное для коррекции тромбоцитарного гемостаза, в данном случае, способное оптимизировать ФАСТ и устранить ведущую причину возникновения тромбоцитопатии, сняв повреждающее влияние на тромбоциты высокого количества в них продуктов перекисного окисления липидов тромбоцитов и повысив активность каталазы и СОД.
Выбор корректирующего подхода для лечения тромбоцитарных нарушений у новорожденных телят с диспепсией осуществляется следующим образом. После взятия крови, ее стабилизации, выделения из крови тромбоцитов, оценки активности в них каталазы и суперсиддисмутазы и содержания малонового диальдегида производится расчет величины ФАСТ, по которой осуществляется выбор корректирующего подхода для лечения тромбоцитарных нарушений у обследуемых новорожденных телят с диспепсией.
При нахождении фактора антиоксидантного состояния тромбоцитов у новорожденных телят с диспепсией в границах 6,4×106-5,5×106 МЕ2/нмоль×109 тр. полную коррекцию тромбоцитарных нарушений можно проводить с помощью «Экоса» 150 мг/кг в течение 10 дней. При нахождении значения фактора антиоксидантного состояния тромбоцитов у новорожденных телят с диспепсией в границах 5,4×106-4,7×106 МЕ2/нмоль×109 тр. полную нормализацию тромбоцитарных нарушений возможно провести с помощью сочетания «Фосфопага» 0,01% 100,0 мл утром и «Экоса» 150 мг/кг вечером в течение 10 дней. В случае величины фактора антиоксидантного состояния тромбоцитов у новорожденных телят с диспепсией 4,6×106 ME2/нмоль×109 тр. и ниже, коррекцию тромбоцитарных нарушений можно проводить с помощью сочетания «Фосфопага» 0,01% 100,0 мл утром, глюконата кальция 10% 10,0 мл днем и «Экоса» 150 мг/кг вечером.
При проведении соответствующих лечебных мероприятий возможно повторное обследование с определением ФАСТ с целью контроля адекватности проводимых мер.
| Таблица 3 | |||||
| Антиоксидантные параметры крови у обследованных новорожденных телят | |||||
| Категория обследованных | Число наблюдений | Каталаза МЕ/109 тр. | СОД МЕ/109 тр. | МДА нмоль/109тр. | ФАСТ МЕ2/нмоль×109 тр. |
| Здоровые новорожденные телята | 40 | 11600,0-9050,0 | 2500,0-1750,0 | 0,35-0,98 | 82,8×106-16,1×106 |
| Новорожденные телята с диспепсией и риском тромбоцитарных нарушений | 52 | 9049,0-6500,0 | 1749,0-1500,0 | 0,99-1,49 | 16,0×106-6,5×106 |
| Новорожденные телята с диспепсией и тромбоцитарными нарушениями | 49 | 6499,0-4800,0 | 1499,0-1200,0 | 1,50-2,20 | 6,4×106 и ниже |
Таким образом, с применением нескольких технически простых и не требующих дорогостоящих реактивов, оборудования, затрат сил и времени методов возможно осуществить выбор корректирующего лечебного подхода для нивелирования тромбоцитопатии у конкретного новорожденного теленка с диспепсией с полным исключением риска возникновения тромбозов различных сосудов.
Внедрение данного способа выбора корректирующего подхода для лечения тромбоцитарных нарушений у новорожденных телят с диспепсией в ветеринарных учреждениях позволит проводить своевременную и эффективную коррекцию тромбоцитопатии у новорожденных телят в каждом конкретном случае, оздоровить молодняк крупного рогатого скота.
Пример 1. Новорожденный теленок №21, 6 сутки жизни, с диспепсией 2-й день обследован в условиях телятника. У теленка была взята и исследована кровь. Выявлено повышение адгезивно-агрегационной способности тромбоцитов (54%), агрегационной активности тромбоцитов с рядом индукторов (АДФ 30,0 с., коллаген 28,0 с., тромбин 40,0 с., Н2О2 38,0 с., адреналин 89,0 с., АДФ + адреналин 26,0 с., АДФ + коллаген 25,0 с., адреналин + коллаген 24,0 с.) и усиление внутрисосудистой активности (ВАТ) (дискоциты 70%, диско-эхиноциты 15%, сфероциты 9%, сферо-эхиноциты 4%, биополярные формы 2%). Обследование установило ослабление активности каталазы 6200,0 МЕ/109 тр., СОД 1400,0 МЕ/109 тр., повышение МДА тромбоцитов 1,5 нмоль/109 тр. ФАСТ составил 5,7×106 МЕ2/нмоль×109 тр. Это указывало на необходимость назначения теленку для коррекции тромбоцитарных нарушений «Экоса» внутрь 1 раз в сутки по 150 мг/кг на 10 дней вечером. Через 3 суток диспепсия полностью купировалась, а к 10 дню нормализовался ФАСТ 32,4×106 МЕ2/нмоль×109 тр., (каталаза 10500,0 МЕ/109 тр., СОД 1850,0 МЕ/109 тр., МДА тромбоцитов 0,6 нмоль/109 тр.). Полностью нивелировались тромбоцитарные нарушения: адгезивно-агрегационная способность тромбоцитов составила 36%, оптимизировалась агрегационная активность тромбоцитов с рядом индукторов (АДФ 36,0 с., коллаген 33,0 с., тромбин 48,0 с., Н2О2 42,0 с., адреналин 101,0 с., АДФ + адреналин 30,0 с., АДФ + коллаген 29,0 с., адреналин + коллаген 28,0 с.) и нормализовались ВАТ (дискоциты 81%, диско-эхиноциты 9%, сфероциты 5% сферо-эхиноциты 2%, биполярные формы 2%).
В дальнейшем содержать данного теленка было рекомендовано на рациональном режиме кормления в течение 1 мес для профилактики рецидива диспепсии и риска возникновения тромбоцитарных нарушений.
Пример 2. Новорожденный теленок №64, 8 суток, с диспепсией 3 суток обследован в условиях телятника. У больного теленка была взята и исследована кровь с оценкой адгезивно-агрегационной способности тромбоцитов (64%), агрегационной активности тромбоцитов с рядом индукторов (АДФ 28,0 с., коллаген 22,0 с., тромбин 32,0 с., Н2О2 27,0 с., адреналин 68,0 с., АДФ + адреналин 20,0 с АДФ + коллаген 17,0 с., адреналин + коллаген 18,0 с.). Установлено усиление ВАТ (дискоциты 58%, диско-эхиноциты 20%, сфероциты 13%, сферо-эхиноциты 7%, биполярные формы 2%), что позволило у него диагносцировать тромбоцитопатию с наклонностью к гиперагрегации. В тромбоцитах зарегистрирована следующая активность каталазы: 6000,0 МЕ/109 тр., СОД 1300,0 ME/109 тр., содержание МДА 1,6 нмоль/109 тр. Рассчитан ФАСТ 4,8×106 МЕ2/нмоль×109 тр. По величине ФАСТ было принято решение назначить теленку на 10 дней сочетание «Фосфопага» 0,01% 100,0 мл и «Экоса» 150 мг/кг вечером.
Это позволило купировать у него диспепсию в течение 2 суток. Нормализовались ФАСТ - 27,6×106 МЕ2/нмоль×109 тр. (каталаза 9600,0 МЕ/109 тр., СОД 2300,0 ME/109 тр., МДА тромбоцитов 0,8 нмоль/109 тр.). На 10-й день лечения нормализовались исследованные параметры тромбоцитарного гемостаза: адгезивно-агрегационная способность тромбоцитов (35%), агрегационная активность тромбоцитов с рядом индукторов (АДФ 36,0 с., коллаген 33,0 с., тромбин 48,0 с., Н2O2 42,0 с., адреналин 91,0 с., АДФ + адреналин 30,0 с., АДФ + коллаген 27,0 с., адреналин + коллаген 27,0 с.) и ВАТ (дискоциты 80%, диско-эхиноциты 8%, сфероциты 6%, сферо-эхиноциты 4%, биполярные формы 2%).
Дальнейшее кормление теленка в рациональном режиме в течение 2 недель закрепило полученный эффект, исключая рецедивирование тромбоцитопатии.
Пример 3. Новорожденный теленок №75, 9 суток, с диспепсией 4 суток обследован в условиях телятника. У больного теленка была взята и исследована кровь с оценкой адгезивно-агрегационной способности тромбоцитов (60%), агрегационной активности тромбоцитов с рядом индукторов (АДФ 26,0 с., коллаген 33,0 с., тромбин 29,0 с., Н2О2 20,0 с., адреналин 57,0 с., АДФ + адреналин 17,0 с., АДФ + коллаген 14,0 с., адреналин + коллаген 12,0 с.) и ВАТ (дискоциты 52%, диско-эхиноциты 25%, сфероциты 13%, сферо-эхиноциты 7%, биполярные формы 3%), что позволило у него диагносцировать тромбоцитопатию с наклонностью к гиперагрегации. В тромбоцитах зарегистрирована следующая активность каталазы 5800,0 МЕ/109 тр., СОД 1200,0 МЕ/109 тр., содержание МДА 2,0 нмоль/109 тр. Рассчитано ФАСТ 3,5×106 МЕ2/нмоль×109 тр. По величине ФАСТ было принято решение назначить теленку на 10 дней «Фосфопаг» 0,01% 100,0 мл утром, глюконат кальция 10% 10,0 мл днем и «Экос» 150 мг/кг вечером.
Это позволило купировать у него диспепсию в течение 2 суток, нормализуя к 10 дню ФАСТ - 36,4×106 МЕ2/нмоль×109 тр. (каталаза 9800,0 МЕ/109 тр., СОД 2600,0 МЕ/109 тр., МДА тромбоцитов 0,7 нмоль/109 тр.) и перевести на уровень контроля исследованные параметры тромбоцитарного гемостаза: адгезивно-агрегационная способность тромбоцитов (33%), агрегационная активность тромбоцитов с рядом индукторов (АДФ 37,0 с., коллаген 35,0 с., тромбин 49,0 с., Н2О2 45,0 с., адреналин 105,0 с., АДФ + адреналин 32,0 с., АДФ + коллаген 29,0 с., адреналин + коллаген 32,0 с.) и ВАТ (дискоциты 83%, диско-эхиноциты 9%, сфероциты 5%, сферо-эхиноциты 2%, биполярные формы 1%).
Дальнейшее кормление теленка в рациональном режиме в течение 2 недель закрепило полученный эффект, исключая рецедивирование тромбоцитопатии.
Способ лечения тромбоцитарных нарушений у новорожденных телят с диспепсией, отличающийся тем, что у телят берут пробу крови, осуществляют ее стабилизацию, выделение из крови тромбоцитов, оценку активности в них каталазы и супероксиддисмутазы и содержания малонового диальдегида с расчетом величины фактора антиоксидантного состояния тромбоцитов, и при нахождении фактора антиоксидантного состояния тромбоцитов у новорожденных телят в границах 6,4·106-5,5·106 МЕ2/нмоль·109 тр., телятам в течение 10 дней дают «Экос» 150 мг/кг живой массы; при нахождении фактора антиоксидантного состояния в границах 5,4·106-4,7·106 МЕ2/нмоль·109 тр., телятам назначают 0,01% раствор «Фосфопага» в дозе 100,0 мл утром и «Экос» в дозе 150 мг/кг живой массы вечером в течение 10 дней; при нахождении фактора антиоксидантного состояния тромбоцитов у новорожденных телят с диспепсией 4,6·106 МЕ2/нмоль·109 тр. и ниже, телятам назначают 0,01% раствор «Фосфопага» в дозе 100,0 мл утром, глюконата кальция 10% в дозе 10,0 мл днем и «Экос» 150 мг/кг живой массы вечером.