Олигосахариды, модифицированные флюорофорным маркером, для определения гликаназных активностей и ферментативный способ их получения
Иллюстрации
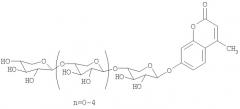
Показать всеДанное изобретение относится к новым олигосахаридам, модифицированным флюорофорным маркером, а именно: 4-O-метилумбеллиферил β-D-ксилопиранозил-(1,4)-бис-[O-β-D-ксилопиранозил-(1,4)]-β-D-ксилопиранозид, 4-O-метилумбеллиферил β-D-ксилопиранозил-(1,4)-трис-[O-β-D-ксилопиранозил-(1,4)]-β-D-ксилопиранозид, 4-O-метилумбеллиферил β-D-ксилопиранозил-(1,4)-тетракис-[О-β-D-ксилопиранозил-(1,4)-β-D-ксилопиранозид. Назначение - измерение активностей как чистых, так и грубых препаратов β-ксиланаз. Изобретение относится также к ферментативному синтезу олигосахаридов формулы:
заключающемуся в инкубировании β-ксилозидазы из Aspergillus sp. при 37°С в нейтральной реакционной среде в присутствии арил-β-D-ксилопиранозида и 4-O-метилумбеллиферил-β-D-ксилопиранозида. 4 н.п. ф-лы, 1 ил., 2 табл.
Реферат
Предлагаемое изобретение относится к области биотехнологии, биоорганического синтеза и служит для измерения ферментативных активностей.
Существуют близкие по своей структуре соединения, а именно модифицированные хромофорным маркером олигосахариды глюкозы, соединенные альфа-1,4-связью, которые были получены методом органического синтеза или сочетанием методов органического синтеза и с использованием другого типа ферментов, а именно циклодекстринтрансфераз [1, 2].
Олигосахариды, модифицированные флуоресцентными и хромофорными маркерами, могут быть получены с использованием подходов органического синтеза и без использования ферментов [3, 4]. При этом используется предварительное получение олигосахаридов из природных полисахаридов методами кислотного гидролиза, а затем соединения этих олигосахаридов в более длинные полимерные цепи после избирательной защиты свободных гидроксильных групп моносахаридных звеньев. При таком подходе используется не менее чем 8-стадийный органический синтез, что делает существенно более дорогой процедуру их получения и понижает выходы итоговых соединений. Кроме того, метод органического синтеза не позволяет получать меченные флуоресцентные и хромогенные олигосахариды со степенью полимеризации более 6, т.к. выходы таких соединений являются исчезающе малыми. Отсутствие методов органического синтеза для получения олигосахаридов с высокой регио- и стереоспецифичностью требует применения хроматографических методов разделения продуктов на каждой стадии синтеза, что также увеличивает стоимость всего процесса в целом. Ферментов, способных осуществлять синтез ксилоолигосахаридов, содержащих хромофорные и флуорофорные маркеры, со степенью полимеризации более 2, ранее не было обнаружено.
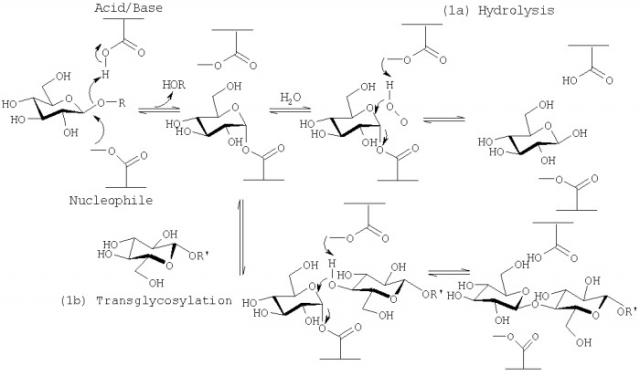
Так называемые «сохраняющие» гликозидгидролазы (К.Ф.3.2.1...) действуют по механизму двойного нуклеофильного замещения SN2, проходящего через образование ковалентно-связанного гликозилферментного комплекса. В целом, реакция гидролиза проходит через две стадии (гликозилирование и дегликозилирование), на каждой из которых образуется карбоксоний-ион-подобное переходное состояние и обращается конфигурация аномерного С1-атома. В результате конечный продукт реакции гидролиза, катализируемый «сохраняющими» гликозидгидролазами, имеет ту же конфигурацию аномерного центра, что и исходный субстрат. Характерным свойством многих сохраняющих гликозидгидролаз является наличие у них трансгликозилирующей активности (см. схему 1 из [5]). Если роль акцептора гликозида играет вода, это приводит к осуществлению гидролиза. Если в качестве акцептора выступают другие соединения, имеющие гидроксильную группу, например сахариды, спирты, сам субстрат, происходит реакция трансгликозилирования.
Схема 1 (Jakeman, D.L. & Withers S.G. Trends in Glicosci. And Glycotechnol. 2002, 14:13-25).
Сущностью изобретения является ферментативный синтез с использованием β-ксилозидазы из Aspergillus sp. олигосахаридов, модифицированных флюорфорным маркером (Таблица 1), необходимых для определения гликаназных активностей, который позволяет исключить стадии органического синтеза.
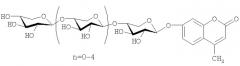
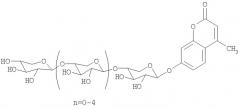
ОБЩАЯ СТРУКТУРНАЯ ФОРМУЛА 4-O-МЕТИЛУМБЕЛЛИФЕРИЛ-БЕТА-D-КСИЛООЛИГОЗИДОВ СО СТЕПЕНЬЮ ПОЛИМЕРИЗАЦИИ 2-6:
| Таблица 1. | |||
| Соединения, полученные с помощью аминокислотной последовательности | |||
| № | Название | Формула | Молекулярный вес |
| 1 | 4-O-метилумбеллиферил β-D-ксилопиранозил-1,4-β-D-ксилопиранозид | С20Н24O11 | 440.4 |
| 2 | 4-O-метилумбеллиферилβ-D-ксилопиранозил-1,4-β-D-ксилопиранозил-1,4-β-D-ксилопиранозид | C25H32O15 | 572.5 |
| 3 | 4-O-метилумбеллиферил β-D-ксилопиранозил-1,4-бис-[O-β-D-ксилопиранозил-1,4]-β-D-ксилопиранозид | С30Н40O19 | 704.6 |
| 4 | 4-O-метилумбеллиферил β-D-ксилопиранозил-1,4-трис-[O-β-D-ксилопиранозил-1,4]-β-D-ксилопиранозид | С35Н48O23 | 836.7 |
| 5 | 4-O-метилумбеллиферил β-D-ксилопиранозил-1,4-тетракис-[O-β-D-ксилопиранозил-1,4]-β-D-ксилопиранозид | С40Н56O27 | 968.9 |
Способ поясняется чертежом.
Метод выделения β-ксилозидзы
β-Ксилозидаза выделена из культуральной жидкости мицелиального гриба Aspergillus sp., выращенного в 20-л ферментере в течение 3 суток, в аэробных условиях, при температуре 30°С. Среда для роста содержала (г/л): КН2PO4 - 1; NaNO3 - 1.5; (NH4)2SO4 - 1.5; MgSO4×Н2О - 0.5; пшеничные отруби - 40. После роста клетки были отделены центрифугированием (3000×g, 20 мин). Супернатант был переведен в 25 mM Na ацетатный буфер, рН 4.5 (буфер А), на колонке Sephadex G-50 (50×1500 мм) (Pharmacia, Sweden), уравновешенной тем же буфером. Грубый суммарный препарат белка наносили на колонку SP-Sephadex С-50 (50×100 мм), уравновешенную буфером А, и смывали раствором 1 М NaCl в этом же буфере. Полученные фракции концентрировали, диализовали против буфера Б (КФБ 0.01 М, рН 7.0). Полученные фракции наносили на колонку DEAE TSK-5PW (Pharmacia LKB, Sweden), уравновешенную буфером Б. β-Ксилозидазу элюировали линейным градиентом (0.01 М-0.5 М КФБ). Фракции, содержащие фермент, объединяли и диализовали против буфера А. Полученный раствор белка наносили на колонку SP TSK-5PW (21.5×150) (Pharmacia LKB, Sweden), уравновешенную буфером А, и элюировали линейным градиентом (0-0.5 М) NaCl в буфере А. Фракции, содержащие β-ксилозидазу, объединяли и диализовали против буфера В (Tris-HCl 0.02 M, рН 7.5). Полученный раствор белка очищали на колонке MonoQ HR (5/5) (Pharmacia LKB, Sweden), смывая линейным градиентом (0-0.5 М) NaCl в буфере В. Очищенный белок диализовали против дистиллированной воды и подвергали лиофилизации.
Фермент β-ксилозидаза (аминокислотная последовательность приведена ниже) производит полимеризацию ксилозы, модифицированной различными флюорофорными или хромофорными маркерами, а именно 4-метилумбеллиферил, орто-нитрофенил, 5-(2-аминоэтиламино)-1-нафталенсульфоновая кислота, 2,4-динитрофенил. В результате воздействия фермента получаются олигосахариды ксилозы со степенью полимеризации от 2 до 10, содержащие хромофорный или флюорофорный маркер. Эти соединения являются субстратами для ксиланаз (К.Ф. 3.2.1.36), глюканаз (К.Ф. 3.2.1.20), целлюлаз (К.Ф. 3.2.1.4) и позволяют определять их активность по высвобождению хромофорного/флюорофорного маркера. Аминокислотная последовательность β-ксилозидазы:
| 1 | mahsmsrpva | ataaallala | lpqalaqant | syvdyniean | pdlyplciet | iplsfpdcqn |
| 61 | gplrshlicd | etatpydraa | slislftlde | liantgntgl | gvsrlglpay | qvwsealhgl |
| 121 | dranfsdaga | ynwatsfpqp | ilttaalnrt | lihqiasiis | tqgrafnnag | rygldvyapn |
| 181 | intfrhpvwg | rgqetpgedv | slaavyayey | itgiqgpdpe | sniklaatak | hyagydienw |
| 241 | hnhsrlgndm | nitqqdisey | ytpqfhvaar | dakvqsvmca | ynavngvpac | adsyflqtil |
| 301 | rdtfgfvdhg | yvssdcdaay | niynphgyas | sqaaaaaeai | lagtdidcgt | tyqwhinesi |
| 361 | aagdisrddi | eqgvirlytt | lvqagyfdsn | ttkannpyrd | lswsdvletd | awnisyqaat |
| 421 | qgivllknsn | nvlpltekay | ppsnttvali | gpwanattql | lgnyygnapy | mispraafee |
| 481 | agykvnfaeg | tgisststsg | faaaisaaqs | adviiyaggi | dntleaeald | resiawpgnq |
| 541 | ldliqklasa | agkkplivlq | mgggqvdsss | lknntnvsal | lwggypgqsg | gfalrdiitg |
| 601 | kknpagrlvt | tqypasyaee | fpatdmnirp | egdnpgqtyk | wytgeavyef | ghglfyttfa |
| 661 | esssntttke |
Методы получения 4-O-метилумбеллиферил β-1,4-D-ксилоолигосахаридов с помощью β-ксилозидазы
Синтез 4-O-метилумбеллиферил-β-D-ксилопиранозил-(1,4)-β-D-ксилопиранозида
Условия реакции: Водный раствор пара-нитрофенил-β-D-ксилопиранозида (20 мМ) и раствор 4-O-метилумбеллиферил β-D-ксилопиранозида в 50% диметилсульфоксиде (40 мМ) смешивали с 10 ед. β-ксилозидазы, инкубировали в 6 мл 30 мМ натрий-фосфатного буфера (рН 6.5) в течение 4 часов при температуре 37°С. Реакцию останавливали замораживанием и сушкой путем лиофилизации. Получившуюся смесь продуктов гидролиза и трансгликозилирования сначала разделяли хроматографически на колонке INERTSIL PREP-ODS (20.0×250 мм), затем на колонке TSK-NH2-60 (4.6×250 мм, Pharmacia) с использованием изократической элюции в 80% ацетонитриле. Заключительной стадией очистки являлась гель-фильтрация на колонке Bio-Gel P2 (Bio Rad) в растворе дистиллированной воды. Полученные фракции высушивали лиофильно.
4-O-метилумбеллиферил β-D-ксилопиранозил-(1,4)-β-D-ксилопиранозид, 1Н ЯМР (D2O) δH 5.12 (1 Н, J1,2 7.52, Н-1), 4.51 (1 H, J1,2 7.84, Н-1'), 4.19 (1 H, dd, J5a,5b 11.72, J4,5а 5.27, Н-5а), 4.01 (1 H, dd, J5a,5b 11.60, J4,5а 5.40, Н-5а'), 3.88 (1Н, ddd, J4,6b 10.1, J3,4 8.8, H-4), 3.74 (1 H, t, J2,3 9.4, Н-3), 3.66 (1 Н, ddd, J4,6b 10.3, J3,4 9.2, H-4'), 3.64 (1 Н, dd, H-2), 3.62 (1 H, dd, H-5b), 3.48 (1 H, t, J2,3 9.2, Н-3'), 3.35 (1 H, dd, H-5b'), 3.32 (1 H, dd, H-2');
13С ЯМР (D2O) δC: 103.98 (С-1'), 102.15 (С-1), 78.25 (С-4'), 77.68 (С-3'), 75.55 (С-3), 74.82 (С-2'), 74.57 (С-2), 71.23 (С-4), 67.30 (С-5'), 65.12 (C-5); ESI+ MS [M+Na]+ m/z 463.1216 рассч. C20H24NaO11, эксперим. 463.1209.
Синтез 4-O-метилумбеллиферил β-D-(1,4)-ксилоолигосахаридов со степенью полимеризации от 3 до 6.
Условия реакции: Водный раствор 4-O-метилумбеллиферил β-D-ксилопиранозил-β-D-(1,4)-ксилопиранозида (80 мМ) смешивали с 10 ед. β-ксилозидазы, инкубировали в 6 мл 30 мМ натий-фосфатного буфера (рН 6.5) в течение 3 часов при температуре 37°С. Реакцию останавливали замораживанием и сушкой путем лиофилизации. Получившуюся смесь продуктов гидролиза и трансгликозилирования сначала разделяли хроматографически на колонке INERTSIL PREP-ODS (20.0×250 мм), затем на колонке TSK-NH2-60 (4.6×250 мм, Pharmacia) с использованием изократической элюции в 80% ацетонитриле. Заключительной стадией очистки являлась гель-фильтрация на колонке Bio-Gel P2 (Bio Rad) в растворе дистиллированной воды. Полученные фракции высушивали лиофильно.
4-O-метилумбеллиферил β-D-ксилопиранозил-(1,4)-β-D-ксилопиранозил-(1,4)-β-D-ксилопиранозид; 1Н ЯМР (D2O) δH: 5.21 (1 H, d, J1,2 7.52, Н-1), 4.52 (1 H, d, J1,2 7.63, Н-1'), 4.48 (1 H, d, J1,2 7.84, Н-1''), 4.19 (1 H, dd, Ja5a,6b 11.82, J4,5а 5.16, Н-5а), 4.14 (1 H, dd, J5a,6b 11.76, J4,5а 5.32, Н-5'а), 3.98 (1 H, dd, J5a,6b 11.60, J4,5а 5.48, Н-5а''), 3.88 (1 H, ddd, J3,4 8.65, J4,5b 10.0, Н-4), 3.80 (1 H, ddd, J3,4 8.86, J4,5b 10.20, Н-4'), 3.73 (1 H, t, J2,3 9.24, Н-3), 3.65 (1 H, dd, H-2), 3.64 (1 H, dd, H-5b), 3.63 (1 H, ddd, J3,4 9.2, J4,5b 10.39, Н-4''), 3.58 (1 H, t, J2,3 9.13, Н-3'), 3.44 (1 H, t, J2,3 9.28, Н-3''), 3.41 (1 H, dd, H-5b'), 3.34 (1 H, dd, H-2'), 3.32 (1 H, dd, H-5b''), 3.27 (1 H, dd, H-2'').
13С ЯМР (D2O) δC: 165.93 (C-2 MU), 161.60 (C-7 MU), 158.01 (C-4 MU), 155.99 (C-8a MU), 128.76 (C-4a MU), 117.21 (C-5 MU), 116.10 (C-6 MU), 113.41 (С-3 MU), 105.63 (C-8 MU), 103.94 (С-1''), 103.79 (С-1'), 102.17 (С-1), 78.47 (C-4'), 78.21 (C-4), 77.68 (С-3''), 75.74 (С-3'), 75.56 (С-3), 74.82 (C-2''), 74.71 (С-2'), 74.59 (C-2), 71.24 (C-4''), 67.28 (C-5''), 65.11 (C-5), 65.05 (C-5'), 19.93 (4-Ме-MU); ESI+ MS [M+Na]+ m/z 595.1639 рассч. for C25H32NaO15, эксперим. 595.1627.
4-O-метилумбеллиферил β-D-ксилопиранозил-(1,4)-бис-[O-β-D-ксилопиранозил-(1,4)]-β-D-ксилопиранозид; 13С ЯМР (D2O) δC: 161.02 (С-7), 157.41(С-4 MU), 155.40 (С-8а MU), 128.16 (C-5 MU), 116.62 (C-4a MU), 115.40 (С-6 MU), 112.72 (С-3 MU), 104.96 (C-8 MU), 19.24 (4-Me-MU), 103.19 (С-1'''), 103.05 (С-1''), 102.99 (С-1'), 101.42 (С-1), 77.72 (C-4'), 77.66 (C-4''), 77.44 (C-4), 76.94 (С-3'''), 74.98 (C-3' and С-3''), 74.79 (С-3), 74.08 (C-2'''), 73.97 (С-2' and C-2''), 73.85 (C-2), 70.49 (C-4'''), 66.53 (C-5'''), 64.38 (C-5), 64.28 (С-5' and C-5''); ESI+ MS [M+Na]+ m/z 727.2062 рассч. C30Н40О19, эксперим. 727.2075.
4-O-метилумбеллиферил β-D-ксилопиранозил-(1,4)-трис-[O-β-D-ксилопиранозил-(1,4)]-β-D-ксилопиранозид; ESI+ MS [M+Na]+ m/z рассч. 859.2484 C35H48NaO23, эксперим. 859.2401.
4-O-метилумбеллиферил β-D-ксилопиранозил-(1,4)-тетракис-[O-β-D-ксилопиранозил-(1,4)]-β-D-ксилопиранозид; ESI+ MS [M+Na]+ m/z рассч. 991.8956 C40H56NaO27, эксперим. 991.9012.
Аналитические методы
При ферментативном синтезе МУФКn и МУФГКn аликвоты реакционной смеси отбирали через определенные промежутки времени и продукты реакции анализировали методом ТСХ в системе бутанол/ уксусная кислота/ вода (3:1:1) и методом ВЭЖХ на колонке Waters Spherisorb C8 (Supeico inc.) с использованием линейного градиента вода - ацетонитрил (0-40%).
Все 1Н и 13С ЯМР спектры регистрировали с использованием спектрометра АМХ-500 Bruker (1H при 500.13 МГц, 13С при 125.13 МГц) при комнатной температуре для растворов в различных растворителях. В качестве внешнего стандарта использовали тетраметилсилан, калибровали с использованием сигналов остаточных протонов растворителей. Химические сдвиги (δ в ppm) даны относительно сдвигов для CDCl3 (δH 7.25), 30% раствор CD3CN в D2O (δH 2.21), 30% раствор (CD3)2СО в D2O (δH 2.19); значения J даны в Гц. Одномерные 1H одномерные спектры эффекта Оверхаузера, 13С и фазово-чувствительные двумерные спектры (COSY-DQF, NOESY и протон-углеродные корреляционные спектры) регистрировали с использованием стандартных импульсных программ при 20°С и 50°С. Результаты анализировали с использованием пакета программ XWINNMR (Bruker). Соотнесение сигналов индивидуальных сахарных остатков основывалось на двумерной фазово-чувствительной спектроскопии COSY. Определение последовательности остатков основывалось на крос-пиках эффекта Оверхаузера в двумерном NOESY эксперименте (время смешения 180 мс) и наблюдении эффекта Оверхаузера между аномерными протонами и протоном при замещенном положении.
Масс-спектры продуктов трансгликозилирования были сняты в режиме регистрации положительных ионов на Micromass Q-TOF2 (ортогонально ускоряющий квадруполь/время-пролетный масс-спектрометр), соединенном с нанофлоу источником ионов (Micromass, Manchester, UK), (Королевский институт биотехнологии, Швеция). Типичное разрешение однозарядных ионов в режиме работы времяпролетного анализатора составляло 9500 FWHM. ширины на половине высоты. Калибровка масс-времяпролетного анализатора проводилась в диапазоне m/z 130-1980, используя растворы NaJ (2 г/л) и CsJ (0,05 г/л) в системе изопропанол-вода 1:1 в качестве стандартов.
Растворы МУФ-ксилооигосахаридов в концентрации 10-50 мкМ в системе метанол-вода 1:1, содержащей 0,5 мМ NaCl, вводились в масс-спектрометр через насос со скоростью 500 нл/мин. Для оптимизации интенсивности (М+Na) ионного сигнала напряжение на капилляре электроспрея поддерживалось 3 кВ, и напряжение на конусе варьировалось (40-80 В). Давление аргона в столкновительной камере составляло 3,6-3,7 мБар (ANALYSER Penning gauge) в MS и MS/MS экспериментах. Для достижения оптимального баланса между интенсивностями родительских и фрагментированных ионов в MS/MS экпериментах энергия столкновения изменялась в диапазоне 26-50 В в зависимости от стойкости (М+Na) ионов. Время сканирования 2,5 сек с задержкой между сканами 0,1 сек использовалось во всех экспериментах. Данные регистрировались до приемлемого отношения сигнал-шум. Для создания центроидного спектра использовали 60-80 индивидуальных MS/MS спектров. Для калибровки MS/MS спектров была использована масса моноизотопного фрагментарного иона В-2 (287.0743 массовой единицы).
Использование полученных соединений
Ксилан - главный гемицеллюлитический полисахарид растительных клеточных стенок, составляющий до 35% от общей клеточной массы. Полная деградация структурно-неоднородных природных ксиланов требует синергетического действия нескольких гемицеллюлитических ферментов. Среди них - эндо-бета-1,4-ксиланазы (К.Ф. 3.2.1.8), гидролизующие внутренние связи в ксилане, и бета-ксилозидазы (К.Ф. 3.2.1.37), расщепляющие получающиеся ксилоолигосахариды до свободной ксилозы. Гемицеллюлазы крайне важны для поддержания общего баланса углерода в природе, поскольку они ответственны за полную деградацию растительной биомассы до растворимых сахаридов. Последние, в свою очередь, используются в качестве источников углерода и энергии микроорганизмами и высшими животными. В последнее десятилетие ферменты ксилан-деградирующего комплекса привлекли к себе огромное внимание вследствие их широкого применения во многих биотехнологических процессах, прежде всего, в целлюлозно-бумажной промышленности, при производстве пищевых и кормовых добавок, при производстве этанола, поверхностно-активных веществ, вина, соков и хлебо-булочных изделий. Поэтому детализированные исследования субстратной специфичности ксиланаз из различных источников и изучение механизма их действия может привести к пониманию процесса гидролиза (деструкции) и образования связей между углеводсодержащих материалов и разработать новые инструменты для их обработки.
Важное биотехнологическое значение гликозидгидролаз состоит в способности синтезировать ряд биологически активных соединений, содержащих углеводную компоненту. Эти возможности основаны на наличии у многих гликозидгидролаз, наряду с гидролазной, трансгликозилирующей активности, позволяющей ферменту при определенных условиях не только гидролизовать, но образовывать гликозидные связи в процессе катализируемой им реакции.
Применение ксилоолигосахаридов, содержащих хромофорный или флюорофорный маркер на редуцирующем конце, в качестве соединений для определения β-ксиланазной активности основано на спектрофотометрической или флюорометрической регистрации высвобождения хромофорной или флюорофорной групп.
Все полученные соединения могут быть использованы для измерения активностей как чистых, так и грубых препаратов β-ксиланаз [6, 7]. Пример использования двух из синтезированных субстратов, а именно 4-O-метилумбеллиферил-β-D-ксилопиранозил-1,4-β-D-ксилопиранозида и 4-O-метилумбеллиферил-β-D-ксилопиранозил-1,4-β-D-ксилопиранозил-1,4-β-D-ксилопиранозида, для измерения кинетических параметров реакции гидролиза, катализируемой двумя различными ксиланазами, приведен в Таблице 2.
| Таблица 2. | ||||
| Кинетические параметры гидролиза 4-O-мутилумбелиферил ксилоолигосахаридов грибными ксиланазами | ||||
| Субстрат | β-Ксиланаза из A. orizae | β-Ксиланаза из Т. reesei | ||
| Кm, мM | kcat, s-1 | Km, мM | kcat, s-1 | |
| МУФК2 | 0.10±0.005 | 48.0±2.4 | 0.15±0.008 | 45.1±2.25 |
| МУФК3 | 0.16±0.01 | 74.1±3.7 | 0.19±0.01 | 71.2±3.5 |
Литература:
1. Oligosaccharide derivatives and their use as substrate for measuring alpha-amylase activity. United States Patent 4762917.
2. Satomura S, Omichi K, Ikenaka T. Anal Biochem. 1986 May 1; 154(2):449-53. Measurement of cyclomaltodextrin glucanotransferase activity by high-performance liquid chromatography using a fluorogenic substrate.
3. Tokutake S, Kotani K, Saito K, Yamaji N. Chem Pharm Bull (Tokyo). 1992 Sep; 40(9):2531-6. Syntheses of 2-chloro-4-nitrophenyl beta-D-maltopentaosides with bulky modification and their application to the differential assay of human alpha-amylases.
4. Teshima S, Hayashi Y, Emi S, Ishimaru K. Clin Chim Acta. 1991 May 31; 199(1):23-31. Determination of alpha-amylase using a new blocked substrate (3-ketobutylidene beta-2-chloro-4-nitrophenyl-maltopentaoside).
5. Jakeman, D.L. & Withers S.G. Glycosynthases: new tools for oligosaccharides synthesis. Trends in Glicosci. And Glycotechnol. 2002, 14:13-25.
6. Kalogeris E, Christakopoulos P, Kekos D, Maoris BJ. Mode of action of a minor xylanase from Thermoascus aurantiacus on polysaccharides and model substrates. J Biosci Bioeng. 1999, 87:819-821.
7. Katapodis P, Vrsanska M, Kekos D, Nerinckx W, Biely P, Claeyssens M, Maoris BJ, Christakopoulos P. Biochemical and catalytic properties of an endoxylanase purified from the culture filtrate of Sporotrichum thermophile. CarbohydrRes. 2003, 338:1881-1890.
1. 4-O-метилумбеллиферил β-D-ксилопиранозил-(1,4)-бис-[O-β-D-ксилопиранозил-(1,4)]-β-D-ксилопиранозид.
2. 4-O-метилумбеллиферил β-D-ксилопиранозил-(1,4)-трис-[O-β-D-ксилопиранозил-(1,4)]-β-D-ксилопиранозид.
3. 4-O-метилумбеллиферил β-D-ксилопиранозил-(1,4)-тетракис-[O-β-D-ксилопиранозил-(1,4)]-β-D-ксилопиранозид.
4. Способ получения олигосахаридов, модифицированных флюорофорным маркером, общей формулы
заключающийся в инкубировании β-ксилозидазы при 37°С в нейтральной реакционной среде в присутствии арил-β-D-ксилопиранозида и 4-O-метилумбеллиферил-β-D-ксилопиранозида.