Способ прогнозирования разрыва сердечной стенки в остром периоде инфаркта миокарда
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к кардиологии, и может быть использовано для прогнозирования разрыва сердечной стенки в остром периоде инфаркта миокарда. Проводят электрокардиографическую (ЭКГ) диагностику и исследование крови. При этом у больного в стационаре определяют признаки-предикторы осложненного течения заболевания, включающие как кардиальные, так и отягощающие факторы риска, а именно: ЭКГ-признаки поражения миокарда в виде появления зубцов QS и/или исчезновения зубца R и/или стойкой элевации сегмента ST более 6 мм в трех и более грудных отведениях, специфические маркеры некроза в виде более чем 10-кратного повышения в сыворотке крови уровня тропонина Т и/или MB- фракции креатинфосфокиназы; и при сочетании всех выявленных кардиальных факторов с острой или хронической энтеровирусной инфекцией, а также с отягощающими факторами в виде: герпесвирусных инфекций, сахарного диабета, эмфиземы легких и возраста старше 50 лет, больного относят в группу высокого риска разрыва сердечной стенки. Способ позволяет повысить достоверность прогнозирования разрыва сердечной стенки у больных в остром периоде инфаркта миокарда. 2 з.п. ф-лы, 2 ил.,3табл.
Реферат
Изобретение относится к области медицины, а именно к кардиологии, и может быть использовано для прогнозирования разрыва сердца в остром периоде инфаркта миокарда.
Разрыв сердца (PC) является тяжелым осложнением острого инфаркта миокарда (ОИМ), которое обусловливает летальный исход 12-22% больных [1]. Прогресс в клинической фармакологии, достигнутый в современной медицине, не способствовал снижению частоты PC, наоборот, отмечено даже ее увеличение. Поэтому остаются актуальными вопрос прижизненной диагностики предразрывного состояния и поиск наиболее важных факторов риска возникновения PC и его патогенеза [2].
Известно, что разрыв сердца чаще возникает у больных с трансмуральным инфарктом миокарда в пожилом возрасте. Установлена прямая корреляционная зависимость между локализацией инфаркта миокарда по передней стенке левого желудочка и частотой разрывов сердца. В остром периоде инфаркта миокарда, осложнившегося разрывом сердца, наблюдают высокую скорость некротизации, выраженную дискинезию зоны инфаркта на фоне гипердинамического синдрома, более высокую частоту сердечных сокращений, в большем числе отведений электрокардиограммы (ЭКГ) регистрируют комплексы типа QS, отмечают замедленное возвращение сегмента ST к изолинии. В дальнейшем у больных наблюдают быстро прогрессирующие признаки тампонады перикарда, шок и электромеханическую диссоциацию сердца [3]. Редко возможна прижизненная диагностика этого осложнения с помощью ЭхоКГ.
Известно также, что смертность от острого инфаркта миокарда среди больных с сахарным диабетом значительно выше, чем среди больных, им не страдающих. Это обусловлено снижением компенсаторной способности миокарда, не пораженного инфарктом, и связано с сочетанием следующих патофизиологических механизмов: исходной застойной сердечной недостаточности, вызванной диабетической кардиомиопатией, уменьшением вазодилатационного резерва эпикардиальных и резистивных артерий, нарушениями метаболизма миокарда.
Известен способ прогнозирования разрыва сердца в остром периоде инфаркта миокарда (принятый за аналог), основанный на учете факторов риска, к которым относят: а) первый ИМ у пациентов в возрасте старше 60 лет, б) женский пол, в) сопутствующую гипертоническую болезнь, г) сердечную недостаточность в первые дни острого периода инфаркта [4]. Однако специфичность такого прогноза недостаточна, так как авторы не учитывают экзогенные и эндогенные факторы, препятствующие образованию рубца и вызывающие деструкцию внеклеточного матрикса (ВКМ).
В качестве прототипа рассмотрен способ того же назначения, который включает ЭКГ диагностику и исследование крови [5]. Однако достоверность указанного способа по тем же причинам также недостаточно высока.
Техническим результатом заявленного способа является повышение достоверности прогноза, что достигается путем учета комплекса показателей, таких как ЭКГ-признаки поражения миокарда левого желудочка, наличие специфических маркеров некроза и отягощающих факторов, деструктивно влияющих на ВКМ.
Для реализации технического результата на предварительном этапе исследований была поставлена задача - проанализировать патогенетические механизмы, способствующие неблагоприятному течению острого инфаркта миокарда (разрыву сердечной стенки) у больных с коморбидной патологией.
Прогнозирование разрыва сердца связано с оценкой динамики биохимических процессов, участвующих в синтезе ВКМ миокарда. Кардиальный ВКМ - это коллагены (ламинин, фибронектин, хондроитинсульфат), которые поддерживают и выравнивают миоциты для сохранения механических связей, посредством которых укорочение саркомера переводится в силовое мышечное сокращение. Кроме участия в мышечном сокращении ВКМ запасает факторы роста, цитокины, гормоны и сообщается с клетками при помощи рецепторов к интегринам. Наиболее многочисленны в миокарде фибробласты, которые активируются факторами роста (тромбоцитарными, проинсулиновыми, эпителиальными и др.). В свою очередь, уровень ВКМ фибробласты регулируют тремя путями:
1) синтезом и резервированием молекул матрикса,
2) поддержанием механического напряжения коллагеновой сети,
3) деградацией и обновлением матрикса путем продукции и высвобождения матриксных металлопротеиназ (ММП).
Известно, что кардиофибробласты могут синтезировать коллагеназы, желатиназы, стромелизины, матрилизин и мембранные ММП, а также их ингибиторы. Они вовлечены в развитие ряда сердечно-сосудистых заболеваний, включая ремоделирование коронарных артерий, образование и разрыв бляшек и аневризм.
Матриксные металлопротеиназы принадлежат к семейству цинксодержащих эндопептидаз, ответственных за расщепление белков ВКМ. Более 20 видов ММП подразделяются на 2 типа - секреторные и мембраносвязанные. ММП синтезируются в латентной форме (зимогены или про-ММП) и активируются либо расщеплением сериновыми протеиназами в области терминальной аминогруппы, либо в результате конформационных изменений, индуцируемых окислительным стрессом. Недавно многие из них были идентифицированы, клонированы и охарактеризованы. Коллагеназы (ММП-1, ММП-8, ММП-13) расщепляют тройные спирально закрученные волокна коллагена на желатиновые фрагменты, а эти фрагменты образуют субстрат для другого класса ММП, желатиназ (ММП-2 и ММП-9). Стромелизины (такие как ММП-3) способны расщеплять широкий спектр компонентов ВКМ, а также активировать ряд других ММП.
Все типы металлопротеиназ обнаруживаются в миокарде в обычных условиях (миоциты, фибробласты, эндотелий). В ответ на провоспалительные стимулы (нейтрофилы, макрофаги) синтез их увеличивается.
ММП традиционно классифицируют по соответствующим субстратам ВКМ, но список их субстратов включает и такие нематриксные белки как цитокины, рецепторы и молекулы адгезии. Невозможно приписать некую абсолютную функцию для конкретной ММП, поскольку функциональная активность протеиназы в большей степени определяется ее специфическим субстратом, чем самим типом ММП, а итоговый эффект протеолиза определяется фактором времени и доступностью как ММП, так и субстрата. Так, например, ММП может вызывать или подавлять рост, сигнализировать о выживании или гибели клеток, стимулировать или ингибировать ангиогенез в зависимости от доступности субстрата. Активность ММП необходима для процесса неоваскуляризации, однако ряд ММП [2, 3, 7, 9 и 12] могут превращать плазмин в ангиостатин, который является мощным ингибитором ангиогенеза.
Баланс между про- и антифибротическими факторами ВКМ определяет образование рубца. Изменения в сторону антифибротических факторов замедляют синтез коллагена, что впоследствии может приводить к разрыву миокарда [6].
К факторам, провоцирующим такие изменения, относятся вирусные инфекции, генетические дефекты и заболевания, связанные с нарушением синтеза соединительной ткани. Так, при синдроме Элерса-Данлоса лишь в 11,5% случаев заболевание обусловлено генетическими дефектами, а в остальных связано с воздействием внешних факторов, прежде всего вирусов, которые вызывают мезенхимальные дисплазии, нарушая процессинг предшественников коллагена или вызывая дефекты в их ферментной системе. Наиболее активны в этом отношении энтеровирусы и вирусы герпеса.
У больных с миокардитами, кардиомиопатиями и пороками сердца установлена высокая инфицированность энтеровирусами Коксаки А9, А13, А18, В3, В4, В5. При миокардите Абрамова-Фидлера, по современным воззрениям представляющую собой дилятационную кардиомиопатию, инфицированность энтеровирусами составляет 73,1% [7].
Вирусные протеиназы 2Арrо, 3Срrо и 3CD, расщепляющие полипротеин вируса, в дальнейшем участвуют в разрезании коллагена совместно с клеточными протеиназами, которые в свою очередь также активируются вирусом. Так, Matthias Paushinger и соавт. (2004) показал на мышах линии BALB/c, инфицированных вирусом Коксаки ВЗ, что вирусный миокардит сопровождался существенным повышением ММР-3 и ММР-9 и снижением TIMP-1 и TIMP-4, при этом повышалась растворимая фракция коллагена 1 в миокарде [8].
Используя гепарансульфат в качестве рецептора, энтеровирус снижает уровень гепарансульфатных протеогликанов, которые, будучи универсальными компонентами базальной мембраны, индуцируют рост хряща, а в нервной системе стимулируют пролиферацию нейроглии [9]. Это приводит к нарушению синтеза хряща и димиелинизации нервных волокон, в том числе в диэнцефальной области, что ведет к развитию диэнцефального синдрома, симпатикотонии и, как следствие, к повышению тонуса сосудов, уровня глюкозы в крови и дислипидемии. Эти факторы в дальнейшем формируют так называемый кардиологический континуум, что усугубляет в конечном итоге ишемические процессы в миокарде.
Вирусы герпеса также вызывают мезенхимальные дисплазии за счет снижения активности фибробластов, факторов роста и активации металлопротеиназ, но они в отличие от энтеровирусов реплицируются только в живых клетках. Поэтому на первом этапе герпес- и энтеровирусы взаимодействуют как синергисты, вызывая серию деструктивных изменений в клеточных и внеклеточных компонентах, приводящих к патологическим изменениям сердечной стенки, геометрии камеры, насосной функции, которые обусловлены изменениями внеклеточного матрикса [10].
Для выявления причин нарушения синтеза ВКМ и факторов, приводящих к разрыву сердца в острый период инфаркта миокарда, были проведены комплексные клинико-патанатомические исследования на отделении кардиореанимации больницы Святого Георгия.
За период 2005-2006 гг. на отделение кардиореанимации поступило 1980 человек с предварительным диагнозом "острый инфаркт миокарда", который уточняли в соответствии с рекоментациями ВОЗ с использованием клинических, лабораторных и инструментальных методов исследования. По данным ЭКГ определяли локализацию ИМ (передний, нижний, нижнебазальный, циркулярный), рассчитывали максимальные значения элевации сегмента ST в день госпитализации и далее в динамике, число отведений с комплексом QS и подъемом сегмента ST. Учитывали топику, наличие и градацию нарушений ритма. Причину смерти и локализацию некроза определяли по данным паталогоанатомического исследования.
Аутопсийный материал, который включал 34 умерших в возрасте от 50 до 80 лет, из них: 27 от разрыва миокарда, 7 от кардиогенного шока, был исследован на:
- энтеровирусные инфекции по 64 фенотипам,
- вирусы герпеса - HSV1, HSV2, HHV6, НЕВ, CMV.
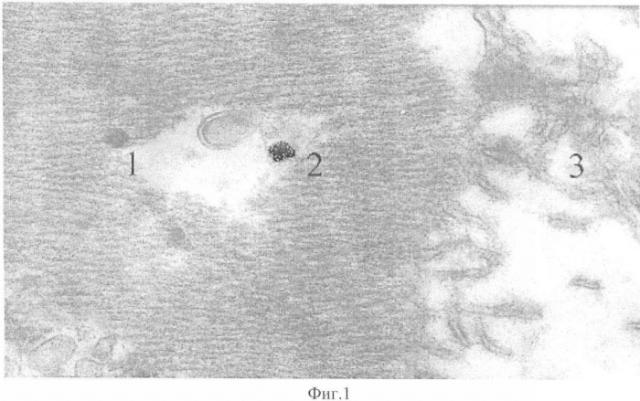
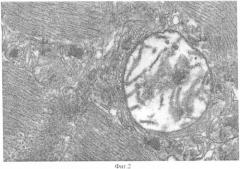
Энтеровирусы определяли количественно в зоне разрыва миокарда и вне зоны инфаркта методом модифицированной реакции связывания комплемента (м-РСК). Вирусы герпеса выявляли методом ПЦР. Вирусологический контроль исследований проводили при помощи электронной микроскопии (Фиг.1, 2). Титры энтеровирусов по исследованным зонам представлены в таблице 1.
| Таблица 1 | |||
| Средний титр энтеровирусов в миокарде по зонам. | |||
| № | Фенотип вируса | Средний титр вирусов по зонам | |
| Зона инфаркта (разрыва) | Зона вне инфаркта | ||
| 1. | Коксаки А | 0,655 | 0,345 |
| 2. | Коксаки В5 | 0,674 | 0,380 |
| 3. | ECHO | 0,540 | 0,343 |
Из полученных данных следует, что титр вируса в зоне инфаркта превышает титр вируса вне этой зоны в среднем на 75%. Это подтверждает факт быстрого роста титра вируса в безъядерных клетках, что способствует разрыву миокарда.
Однако следует отметить, что вирусоносительство как монофактор не приводит к разрыву сердечной стенки в острый период инфаркта. Детальный анализ историй болезни умерших от разрыва миокарда показал наличие сопутствующих хронических заболеваний, изменяющих активность протеиназ в сторону антифибротических параметров. Эти данные приведены в таблице 2.
| Таблица 2 | ||||||
| Прогностические факторы формирования разрыва миокарда | ||||||
| № | Прогностические факторы | % б-х | ||||
| Энтеровирусы | Герпесвирусы | Гипергликемия | Эмфизема | Возраст | ||
| 1 | + | + | >70 | 51,9 | ||
| 2 | + | + | >70 | 14,8 | ||
| 3 | + | + | >70 | 7,4 | ||
| 4 | + | + | + | 50-70 | 22,2 | |
| 5 | + | + | + | + | 50-70 | 3,7 |
| Итого | 100 |
Из таблицы следует, что обязательным, но не достаточным условием формирования разрыва миокарда является наличие энтеровирусной инфекции. Достаточность условий обеспечивают сопутствующие факторы. Так, для умерших от разрыва миокарда старше 70 лет такой сопутствующий фактор, как правило, один, а для умерших от 50 до 70 лет, таких факторов уже несколько. В группе больных, умерших от инфаркта миокарда без его разрыва, необходимого сочетания вышеназванных факторов выявлено не было.
Факторы риска разрыва миокарда и некоторые патофизиологические механизмы их реализации представлены в таблице 3.
| Таблица 3 | ||
| Прогностические факторы риска разрыва сердечной мышцы | ||
| № | Факторы риска | Патофизиологические механизмы |
| 1 | Энтеровирусы | Высокая активность ММП, низкий уровень ТИМП |
| 2 | Герпесвирусы | Низкая активность фибробластов и высокая ММП |
| 3 | Гипергликемия | Низкий уровень проинсулинового ФР |
| 4 | Эмфизема легких | Высокая активность ММП |
| 5 | Возраст старше 70 лет | Низкая активность фибробластов |
На основании анализа результатов проведенных исследований был разработан способ прогнозирования разрыва сердечной стенки у больных в остром периоде инфаркта миокарда, основанный на учете факторов риска, связанных с нарушением коронарного кровообращения (кардиальные факторы), коморбидной патологией и возрастом (отягощающие факторы).
Сущность предлагаемого изобретения заключается в том, что при поступлении больного в стационар у него определяют признаки - предикторы осложненного течения заболевания, к которым относят как кардиальные, так и отягощающие факторы риска, а именно: ЭКГ-признаки трансмурального крупноочагового поражения миокарда левого желудочка в виде появления зубца Q(QS) и/или исчезновения зубца R и/или стойкой элевации сегмента ST>6 мм в трех и более грудных отведениях; специфические маркеры некроза в виде более чем 10-кратного повышения в сыворотке крови уровня тропонина Т и/или MB-фракции креатинфосфокиназы; и при сочетании всех выявленных кардиальных факторов с острой или хронической энтеровирусной инфекцией (Коксаки и/или ECHO), a также с отягощающими факторами в виде герпесвирусных инфекций, сахарного диабета, пожилого возраста и эмфиземы легких, больного относят в группу высокого риска разрыва сердечной стенки.
В соответствии с изобретением в группу высокого риска разрыва сердечной стенки в остром периоде инфаркта миокарда относят больных от 50 до 70 лет, у которых ЭКГ признаки поражения миокарда и специфические маркеры некроза сочетаются с острой или хронической энтеровирусной инфекцией, а также с двумя и более отягощающими факторами. Кроме того, для отнесения в группу высокого риска больных в возрасте старше 70 лет достаточным является сочетание вышеуказанных признаков с одним из отягощающих факторов.
Способ осуществляют следующим образом.
При поступлении больного в реанимационное отделение и установлении диагноза инфаркт миокарда у него проводят количественный анализ ЭКГ в 12 стандартных отведениях. По данным ЭКГ уточняют локализацию ИМ (передний, нижний, нижнебазальный, циркулярный), рассчитывают максимальные значения элевации сегмента ST, число отведений с комплексом QS и подъемом сегмента ST. Регистрируют появление зубца Q(QS) и/или исчезновения зубца R и/или стойкую элевацию сегмента ST>6 мм в трех и более отведениях. Оценивают результаты измерения в сыворотке крови уровней белков/ферментов: тропонина Т и/или МВ-фракции креатинфосфокиназы, выявляют наличие более чем 10-кратного повышения указанных специфических маркеров некроза, свидетельствующих о повреждении миокарда.
В случае выявления коронарных факторов риска проводят исследования на присутствие отягощающих факторов, а именно: инфицированности энтеро- и герпесвирусными инфекциями, что осуществляют путем выявления специфических вирусных антигенов и/или антител в крови больного к вирусам Коксаки и/или ECHO и вирусам герпеса. Кроме того, дополнительно уточняют возраст больного, наличие сопутствующих заболеваний в виде сахарного диабета и эмфиземы легких.
В соответствии с изобретением больного в возрасте от 50 до 70 лет относят в группу высокого риска при выявлении у него сочетания ЭКГ-признаков трансмурального поражения миокарда левого желудочка, специфических маркеров некроза и энтеровирусной инфекции Коксаки и/или ECHO с двумя и более отягощающими факторами.
Больного в возрасте старше 70 лет относят в группу высокого риска при выявлении у него сочетания ЭКГ-признаков трансмурального поражения миокарда левого желудочка, специфических маркеров некроза и энтеровирусной инфекции Коксаки и/или ECHO с хотя бы еще одним отягощающим фактором.
С помощью предложенного способа на отделении кардиореанимации был обследован 41 больной в остром периоде инфаркта миокарда в возрасте старше 50 лет. У 34 больных прогноз был подтвержден на аутопсии, т.е. достоверность способа составила 83%.
Пример 1. Больная Ф. 56 лет. Диагноз при поступлении: - трансмуральный переднебоковой ОИМ. На ЭКГ: патологический зубец QS V1-V4, элевация сегмента ST V2-V5 до 7 мм. При инструментально-клиническом обследовании были выявлены: более чем 10-кратное повышение в сыворотке крови уровня тропонина Т и МВ-фракции креатинфосфокиназы, энтеровирусы Коксаки В5; герпесвирусы - HSV1, гипергликемия, сахарный диабет 2-го типа.
В связи с тем, что у больной выявлено сочетание ЭКГ-признаков поражения миокарда, специфических маркеров некроза и энтеровирусной инфекции с еще 2-я отягощающими факторами, для возраста старше 50 лет, она в соответствии с изобретением должна быть отнесена в группу высокого риска разрыва сердечной стенки.
Летальный исход наступил на третьи сутки после инфаркта. Патанатомическое заключение: гемотампонада перикарда, разрыв инфарцированного миокарда, острое венозное полнокровие, Коксаки В5 с титром в зоне инфаркта 0,79 (метод мРСК), сахарный диабет 2-го типа, герпесвирусная инфекция (электронная микроскопия).
Пример 2. Больная П. 59 лет. Диагноз при поступлении: - трансмуральный переднебоковой ОИМ. На ЭКГ: патологический зубец QS VI-V4, элевация сегмента ST V1-V4 до 6 мм. При инструментально-клиническом обследовании были выявлены: более чем 10-кратное повышение в сыворотке крови уровня тропонина Т и МВ-фракции креатинфосфокиназы, герпесвирусы - HSV1, гипергликемия, сахарный диабет 2-го типа, энтеровирусы не выявлены.
В связи с тем, что у больной ЭКГ-признаки поражения миокарда и специфические маркеры некроза не сочетаются с энтеровирусной инфекции, ее в соответствии с изобретением не относят в группу высокого риска разрыва сердечной стенки.
После курса интенсивной терапии больная была выписана для амбулаторного лечения в удовлетворительном состоянии.
Таким образом, выделение среди больных ОИМ группы высокого риска разрыва сердечной стенки позволяет обоснованно назначать им комплекс лечебных мероприятий, направленных на профилактику этого осложнения. К таким мероприятиям можно отнести: более строгий и длительный режим ограничения физической и психической активности, стабилизацию артериального давления, строгие ограничения в применении адреномиметических средств, назначение инфузионных нитропрепаратов, ингибиторов АПФ, проведение противовирусной терапии и др.
Литература
1. Сыркин А.Л. Инфаркт миокарда. - М.: Медицина, 1991. - 304 с.
2. Голиков А.П. - Некоторые итоги и перспективы развития неотложной кардиологии // Кардиология. - 1998. - №12. - с.51-52.
3. Кузнецов В.А., Криночкин Д.В. Разрыв сердца при инфаркте миокарда. // Кардиология - 1996 - №10 - с.10-13.
4. Трофимов Г.А., Андрашев В.Н. Разрыв сердца в остром периоде инфаркта миокарда, прогнозирование и пути профилактики // Клин. медицина. - 1994. - №6. - с.22-25.
5. Дажибаев А.Н. Способ прогнозирования летального исхода крупноочагового инфаркта миокарда RU 2246114 от 10.02.2005.
6. Tsuruda Т., Costello-Boerrigter L.C., Bumett J.C.-Matrix metalloproteinases: pathways of induction by bioactive molecules.// Heart Failure Reviews. 2004, v.9, p.53-61.
7. Бочаров Е.Ф., Ерман Б.Ф., Фомин В.В. - Энтеровирусная инфекция: новые аспекты. Новосибирск: Наука, 1990, - 224 с.
8. Lindsey М. - ММР induction and inhibition in Myocardial infarction.// Heart Failure Reviews. 2004, v.9, p.7-19.
9. Гилберт М. Биология развития. - М.: Мир, 1995.
10. Birkedal-Hansen H, Cobb CM, Taylor RE, Fullmer HM. Synthesis and release of procollagenase by cultured fibroblasts.//J.Biological Chemistry, 1976, v.251, p.3162-3168.
1. Способ прогнозирования разрыва сердечной стенки у больных в остром периоде инфаркта миокарда, включающий электрокардиографическую (ЭКГ) диагностику и исследование крови, отличающийся тем, что при поступлении больного в стационар у него определяют признаки-предикторы осложненного течения заболевания, включающие как кардиальные, так и отягощающие факторы риска, а именно: ЭКГ-признаки поражения миокарда в виде появления зубцов QS и/или исчезновения зубца R, и/или стойкой элевации сегмента ST более 6 мм в трех и более грудных отведениях, специфические маркеры некроза в виде более чем 10-кратного повышения в сыворотке крови уровня тропонина Т и/или MB- фракции креатинфосфокиназы; при сочетании всех выявленных кардиальных факторов с острой или хронической энтеровирусной инфекцией, а также с отягощающими факторами в виде герпесвирусных инфекций, сахарного диабета, эмфиземы легких и возраста старше 50 лет, больного относят в группу высокого риска разрыва сердечной стенки.
2. Способ по п.1, отличающийся тем, что больного в возрасте от 50 до 70 лет относят в группу высокого риска при выявлении сочетания ЭКГ-признаков поражения миокарда, специфических маркеров некроза и энтеровирусной инфекции Коксаки и/или ECHO с еще двумя и более отягощающими факторами.
3. Способ по п.1, отличающийся тем, что больного в возрасте старше 70 лет относят в группу высокого риска при выявлении сочетания ЭКГ-признаков поражения миокарда, специфических маркеров некроза и энтеровирусной инфекции Коксаки и/или ECHO с хотя бы одним отягощающим фактором.