Белок nmb0928 и его применение в фармацевтических композициях
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описан белок из N.meningitidis, названный NMB0928, представляющий собой антиген, способный вызывать в организме реципиента защитный ответ против инфекций, вызываемых бактериями из рода Neisseria, и имеющий установленную аминокислотную последовательность. Представлен ген, кодирующий описанный белок. Настоящее изобретение может использоваться для получения композиций, обладающих расширенным иммунным диапазоном и, тем самым, расширить диапазон их действия против различных патогенов. 4 н. и 8 з.п. ф-лы, 13 ил., 3 табл.
Реферат
Предшествующий уровень техники
Данное изобретение относится к области медицины, в частности к развитию новых вакцинных композиций превентивного или терапевтического применения, которые позволяют улучшать качество иммунной реакции против вакцинных антигенов заболеваний из различных источников.
Neisseria meningitidis, грамотрицательный диплококк, единственным известным хозяином которого является человек, является возбудителем менингококкового менингита. Обычно эта бактерия обнаруживается у бессимптомных носителей среди здоровой популяции и эта ниша является наиболее обычным источником для ее микробиологического выделения.
В мировом масштабе маленькие дети в возрасте менее двух лет являются наиболее чувствительной популяцией для заражения менингококковым менингитом, однако молодая взрослая и обычная взрослая популяция может быть также поражена.
В отсутствие лечения менингококковое заболевание имеет летальный исход для большинства пораженных индивидуумов, и вакцинация могла бы предотвращать эту ситуацию путем остановки развития событий на ранней фазе бактериальной колонизации.
Несколько стратегий было разработано с целью получения вакцины, удовлетворяющей необходимым требованиям для индукции защиты против указанного заболевания во всей популяции. Для этой цели внимание было обращено на капсульные антигены, так как их иммунологическая специфичность дала возможность произвести классификацию этого микроорганизма на серологические группы. Было определено, что пять из этих серологических групп ответственны за большинство клинических случаев менингококкового заболевания по всему миру. Серогруппа А является главной причиной эпидемий в зонах Африки ниже Сахары. Серогруппы В и С ассоциированы в большинстве случаев со случаями в развитых странах. Серогруппы Y и W135 являются обычными в большинстве рецидивирующих случаев этого заболевания, и они преобладают в некоторых областях США, с явным увеличением в последние несколько лет. Из этой информации является очевидной необходимость применения, исследования и оценки капсульных полисахаридов в качестве вакцинных кандидатов. Тетравалентная вакцина на основе капсульных полисахаридов, сообщающая защиту против серогрупп А, С, Y и W-135, была лицензирована в Соединенных Штатах. Индуцируемые антитела после вакцинации являются специфическими в отношении серогруппы (Rosenstein N. et al., 2001. Menningococcal disease. N. Engl. J. Med. 344, 1378-1388).
Серогруппа В, которая отличается от остальных, продолжает быть важной причиной эндемического и эпидемического менингококкового заболевания и это обусловлено в основном полным отсутствием эффективных вакцин против нее. Отмечалось, что капсульный полисахарид является слабоиммуногенным, а кроме того, теоретически существует риск, заключающийся в том, что вакцина на основе этого соединения будет индуцировать иммунотолерантность и аутоиммунную реакцию вследствие его структурного сходства с олигосахаридными цепями, которые присутствуют в нервных структурах плода человека (Finne J. et al., 1987. An IgG monoclonal antibody to group B meningococci cross-reacts with developmentally regulated polysialic acid units of glycoproteins in neural and extraneural tissues. J. Immunol., 138: 4402-4407). Таким образом, развитие вакцин против серогруппы В сосредоточивается на использовании субкапсулярных антигенов.
Белки наружной мембраны и везикулярные вакцины
Начальные попытки получения вакцин в 70-х годах на основе белков наружной мембраны были основаны на истощении LPS препаратов белков наружной мембраны детергентом (Frasch CE and Robbins JD. 1978. Protection against group B meningococcal disease. III. Immunogenicity of serotype 2 vaccines and specificity of protection in guinea pig model. J. Exp. Med. 147(3):629-44). Затем белки наружной мембраны, ОМР, осаждали для получения агрегатов, суспендированных в хлориде натрия. Несмотря на обещающие успех результаты в исследованиях на животных, эти вакцины не могли индуцировать бактерицидное антитело ни у взрослых, ни у детей (Zollinger WD, et al., 1978. Safety and immunogenicity of a Neisseria meningitidis type 2 protein vaccine in animals and humans. J. Infect. Dis. 137(6):728-39). Слабое действие этих вакцин в значительной степени приписывали потере третичной структуры, которая сопутствовала осаждению. Таким образом, следующей логической стадией было получение вакцины с применением белков, проявляющих их нативную конформацию в форме пузырьков (везикул) наружной мембраны (Zollinger WD, et al., 1979. Complex of meningococcal group B polysaccharide and type 2 outer membrane protein immunogenic in man. J. Clin. Invest. 63(5):836-48, Wang LY and Frasch CE. 1984. Development of a Neisseria meningitidis group B serotype 2b protein vaccine and evaluation in a mouse model. Infect Immun, 46(2):408-14136).
Эти вакцины из везикул наружной мембраны были значимо более иммуногенными, чем агрегаты ОМР, и было показано, что иммуногенность дополнительно усиливалась в результате адсорбции на адъюванте гидроксиде алюминия (Wang LY and Frasch CE. 1984. Neisseria meningitidis group B serotype 2b protein vaccine and evaluation in a mouse model. Infect Immunol. 46(2):408-14136).
Ряд испытаний эффективности проводили с применением растворимых вакцин везикул наружной мембраны различных составов. Две наиболее интенсивно исследованные вакцины были разработаны в 1980-х годах в ответ на вспышки эпидемии на Кубе (Sierra GV et al. 1991. Vaccine against group B Neisseria meningitidis: protection trial and mass vaccination results in Cuba. NIPH Ann Dis. 14(2):195-210) и Норвегии (Bjune G. et al. 1991. Effect of outer membrane vesicle vaccine against group B meningococcal disease in Norway. Lancet. 338(8775):1093-6) соответственно. OMV-вакцина, полученная в Институте Finlay на Кубе (коммерчески продаваемая как VA-MENGOC-BC), получена из штамма B:4:P1.19,15 с полисахаридом серогруппы С и препаратом высокомолекулярных ОМР и адсорбирована на гидроксиде алюминия (Sierra GV et al. 1991. Vaccine against group B Neisseria meningitidis: protection trial and mass vaccination results in Cuba. NIPH Ann Dis. 14(2):195-210). Эта вакцина способствовала быстрому спаду эпидемии на Кубе (Rodrigues AP, et al. The epidemiological impact of antimeningococcal B vaccination in Cuba. 1999. Mem Inst Oswaldo Cruz. 94(4):433-40).
Вакцина, полученная Norwegian National Institute for Public Health (NIPH) подобным образом, была сначала предназначена для применения во время периода гиперэндемического заболевания, вызываемого другим организмом из клона ЕТ-5 (B:15:P1.7,16). Она была также моновалентной вакциной, полученной из очищенных везикул наружной мембраны, адсорбированной на гидроксид алюминия (Bjune G, et al. 1991. Effect of outer membrane vesicle vaccine against group B meningococcal disease in Norway. Lancet. 338(8775):1093-6).
Вакцины везикул наружной мембраны, по-видимому, эффективно презентируют белки наружной мембраны в достаточно природной конформации, чтобы сделать возможным генерирование функциональных бактерицидных антител по меньшей мере у подростков и взрослых. Было также показано, что генерируемые реакции в виде антител увеличивали опсонофагоцитоз менингококков. Точный состав вакцин (т.е. содержание ОМР, содержание LPS и присутствие или отсутствие адъюванта) имел важное значение для иммуногенности (Lehmann AK, et al. 1991. Immunization against serogroup B meningococci. Opconin response in vaccines as measured by chemiluminescence. APMIS. 99(8):769-72, Gomez JA, et al. 1998. Effect of adjuvants in the idotypes and bactericidal activity of antibodies against the transferrib-binding proteins of Neisseria meningitidis. Vaccine. 16(17); 1633-8, Steeghs L, et al. 1999. Immunogenicity of Outer Membrane Proteins in a Lipopolysaccharide-Deficient Mutant of Neisseria meningitidis: Influence of Adjuvants on the Immune Response. Infect Immunol. 67(10):4988-93).
Профиль антигенов изолятов заболевания также быстро изменяется, и вакцина с охватом только ограниченного числа выбранных штаммов становится, по-видимому, неэффективной в пределах немногих лет, пока состав вакцины не будет изменен для отображения локальной эпидемиологии.
В настоящее время вакцины OMV используются более широко, чем любая другая вакцина серогруппы В, и они потенциально применимы в контексте вспышек заболевания, вызываемого единственным типом PorA.
Иммуногены, которые генерируют перекрестную реактивность между штаммами, пока еще не определены полностью. Исследования сывороток после вакцинации как из испытаний вакцины в Институте Finlay, так и из испытаний вакцины NIPH позволили предположить, что антитела против PorA (P1, белок серотипа класса 1) и OpcA (другой основной ОМР, ранее известный как Opc) (Wedege E, et al. 1998. Immune Responses against Major Outer Membrane Antigens of Neisseria meningitidis in Vaccines and Controls Who Contracted Meningococcal Disease during the Norwegian Serogroup B Protection Trial. Infect Immun. 66(7): 3223-31), оба, были важными в опосредовании сывороточной бактерицидной активности (причем PorA был наиболее иммуногенным), и оба эти антигена обнаруживают явную вариабельность от штамма к штамму.
Выдающееся положение белка PorA и значительный уровень вариабельности в этом белке, который, по-видимому, подвергается непрерывному изменению как между эпидемиями, так и во время эпидемий (Jelfa J, et al. 2000. Sequence Variation in the porA Gene of a Clone of Neisseria meningitidis during Epidemic Spread. Clin Diagn Lab Immunol. 7(3):390-5) в эпитопах, на которые направлена большая часть бактерицидной активности после вакцинации (и после заболевания), усиливали беспокойство в отношении того, что защита, предоставляемая вакцинами на основе единственного штамма OMV (моновалентные), может быть серо-подтип-рестриктированной (т.е. зависимой от типа PorA).
В попытке преодоления этой потенциальной проблемы в Нидерландах в RIVM была разработана вакцина OMV, которая содержала белки PorA из шести различных преобладающих патогенных изолятов (Van Der Ley P and Poolman JT. 1992. Construction of a multivalent meningococcal vaccine strain based on the class 1 outer membrane protein. Infect Immun. 60(8):3156-61, Claassen I, et al. 1996. Production, characterization and control of a Neisseria meningitidis hexavalent class 1 outer membhane protein containing vesicle vaccine. Vaccine. 14(10):1001-8). В этом случае вакцинные пузырьки (везикулы) экстрагировали из двух вариантов хорошо охарактеризованного штамма Н44/76, который был получен генной инженерией для экспрессии трех раздельных белков PorA.
Поиск универсального антигена
Ясно, что белки наружной мембраны (ОМР) могу индуцировать функциональную иммунную реакцию против заболевания серогруппы В, но что ни одна из разработанных до сих пор вакцин не является универсально защитной вследствие большой гетерогенности экспонированных на поверхности районов белков наружной мембраны. Умеренный перекрестно-реактивный иммунитет, индуцированный вакцинами везикул наружной мембраны, способствовал поиску антигена (или группы антигенов наружной мембраны), который индуцирует функциональные антитела и который присутствует на всех менингококковых штаммах. Такие антигены, если они присутствуют на всех штаммах, независимо от серологической группы, могут образовать основу истинно универсальной менингококковой вакцины, которая могла бы устранить потенциальную проблему капсульного запуска патогенных штаммов после вакцинации полисахаридами.
Как только стало очевидным, что вариабельность иммунодоминантного белка PorA могла бы ограничивать его применение в качестве универсальной вакцины, ряд других основных белков наружной мембраны были рассмотрены в отношении их вакцинного потенциала, и несколько из них исследуются дополнительно. Белки, которые были рассмотрены, включают в себя белки класса 5 (OpcA), NspA и регулируемые железом белки (TbpA и В, FbpA, FetA). TbpA образует часть трансферринсвязывающего комплекса с TbpA. Недавнее исследование предполагает, что TbpA играет важную функциональную роль в связывании железа (Pintor M, et al. 1998. Analysis of TbpA and TbpA functionality in defective mutants of Neisseria meningitidis. J Med Microbiol 47(9): 757-60) и является более эффективным иммуногеном, чем TbpB.
Высококонсервативный минорный белок наружной мембраны был обнаружен при помощи нового способа, использующего комбинации препаратов белков наружной мембраны из различных менингококковых штаммов для иммунизации мышей (Martin D, et al. 1997. Highly Conserved Neisseria meningitidis Surface Protein Confers Protection against Experimental Infection. J Exp Med 185 (7): 1173-83). В-клетки этих мышей использовали для получения гибридом, которые затем подвергали скринингу на перекрестную реактивность против множественных штаммов менингококков. Было обнаружено, что одно моноклональное антитело с высокой перекрестной реактивностью связывается с белком наружной мембраны в 22 кДа, и оно было названо NspA. Было показано, что иммунизация рекомбинантным белком NspA индуцирует перекрестную бактерицидную реакцию у мышей против штаммов серогрупп А-С. Вакцинация также защищает мышей от летальной менингококковой инфекции (Martin D, et al. 1997. Highly Conserved Neisseria meningitidis Surface Protein Confers Protection against Experimental Infection. J. Exp. Med 185 (7): 1173-83). Сравнение последовательностей NspA среди генетически дивергентных менингококковых штаммов демонстрирует, что этот белок является высококонсервативным (97% гомология) (Cadieux N, et al. 1999. Bactericidal and Cross-Protective Activities of a Monoclonal Antibody Directed against Neisseria meningitidis NspA Outer Membrane Protein. Infect Immun 67 (9): 4955-9).
Присутствие NspA было детектировано при помощи ELISA на 99,2% испытанных штаммов из серогрупп А-С с применением моноклональных анти-NspA-антител (Martin D, et al. 1997. Highly Conserved Neisseria meningitidis Surface Protein Confers Protection against Experimental Infection. J Exp Med 185 (7): 1173-83). Было показано, что эти моноклональные антитела являются бактерицидными против многочисленных штаммов менингококков и способны уменьшать менингококковую бактериемию в мышиной модели (Cadieux N, et al. 1999. Bactericidal and Cross-Protective Activities of a Monoclonal Antibody Directed against Neisseria meningitidis NspA Outer Membrane Protein. Infect Immun 67 (9): 4955-9). Хотя эти данные, по-видимому, предполагают, что NspA является многообещающим вакцинным кандидатом, который способен защищать во всех эпитопных микроокружениях серологических групп, поликлональная сыворотка против рекомбинантного NspA из мышей не связывается с поверхностью приблизительно 35% менингококковых штаммов серогруппы В, несмотря на присутствие гена nspA в этих организмах (Moe GR et al. 1999. Differences in Surface Expression of NspA among Neisseria meningitidis Group B Strains. Infec Immun 67 (11): 5664-75).
Презентация антигенов и приготовление вакцин
Более ранние исследования предполагали, что форма, в которой презентируются антигены, является, вероятно, решающей. Эпитопы на мембраносвязанных белках часто зависят от сохранения точной третичной структуры, а оно, в свою очередь, зависит от гидрофобных мембраносвязанных доменов. Было показано, что препараты белков наружной мембраны индуцируют иммунитет у человека при презентации в форме везикул (Zollinger WD, et al., 1979. Complex of meningococcal group B polysaccharide and type 2 outer membrane protein immunogenic in man. J. Clin. Invest. 63(5):836-48, Zollinger WD, et al., 1978. Safety and immunogenicity of a Neisseria meningitidis type 2 protein vaccine in animals and humans. J. Infect. Dis. 137(6):728-39).
Вакцины единственного белка использовали в этой области десятилетиями и обычно обнаруживали хорошую стабильность. Если презентация в форме везикул необходима для того, чтобы антигены оставались мембраносвязанными, то стабильность и воспроизводимость, возможно, трудно гарантировать. Иммуногенность и реактогенность везикул наружной мембраны могут варьироваться с изменениями количества белка и LPS, удаленных в процессах очистки. Значительный опыт в получении вакцин был накоплен в приготовлении вакцины OMV, однако, и получаемые в настоящее время вакцины являются предметом тщательного контроля качества. Конструирование полностью синтетических липосомных везикул может сделать возможной дополнительную оптимизацию и стандартизацию таких вакцин (Christodoulides M, et al. 1998. Immunization with recombinant class 1 outer-membrane protein from Neisseria meningitidis: influence of liposoms and adjuvants on antibody avidity, recognition of native protein and the induction of a bactericidal immune response against meningococci. Microbiology 144(Pt 11):3027-37). Иными словами, белки наружной мембраны были представлены как в виде везикул, так и в виде чистых экспрессируемых белков, и развитие реакций в виде антител было умеренным. Основные усилия до сих пор сосредоточивались на внутримышечной инъекции менингококковой вакцины, приводящей к продуцированию системного IgG. Однако при менингококковом заболевании, где инвазия хозяина происходит через назальный эпителий, может быть также важным продуцирование секреторного IgA.
Геномная последовательность N. meningitidis
Геномные последовательности МС58 (серогруппы В менингококка) (Tettelin H, et al. 2000/ Complete Genome Sequence of Neisseria meningitidis Serogroup B Strain VC58. Science 287 (5459): 1809-15172) и Z2491 (штамм серогруппы А) (Parkhill J, et al. 2000. Complete DNA sequence of a serogroup A strain of Neisseria meningitidis Z2491. Nature 404 (5777):502-6173) были выяснены и опубликованы в течение 2000 года. Доступность опубликованных генных последовательностей должны оказать разительное влияние на исследование менингококковых вакцин. В то время как секвенирование генома МС58 находилось в процессе развития, Pizza et al. начали идентифицировать открытые рамки считывания, которые, как было предсказано, кодируют либо мембраносвязанные, экспонированные на поверхности, либо экспортируемые белки. Они идентифицировали 570 таких рамок считывания (ORF), амплифицировали их с применением полимеразной цепной реакции и клонировали их в Escherichia coli для экспрессии кодируемых белков в виде либо His-меченых, либо слитых с глутатион-S-трансферазой белков (Pizza M, et al., 2000. Identification of Vaccine Candidates Against Serogroup B Meningococcus by Whole-Genome Sequencing. Science 287 (5459): 1816-20). 61% (350) выбранных ORF были успешно экспрессированы, ORF, которые не могли экспрессироваться, часто были ORF, содержащими более, чем один, гидрофобный трансмембранный домен (возможно, исключающий ряд белков, связанных с наружной мембраной). Эти рекомбинантные белки очищали и использовали для вакцинации мышей. Затем иммунные сыворотки оценивали на поверхностное связывание с множественными менингококковыми штаммами при помощи твердофазного иммуноферментного анализа (ELISA) и проточной цитометрии и на бактерицидную активность против двух штаммов с применением сывороточного бактерицидного анализа. Наконец, семь белков отбирали для дополнительного исследования на основании положительной реакции во всех трех анализах. Было показано, что вакцинные композиции испытания с применением ряда из этих белков в комбинации с адъювантами индуцировали значительные бактерицидные титры против гомологичного менингококкового штамма (МС58) в мышах, но ни один из этих белков не индуцировал титры SBA такие высокие, как везикулярная вакцина наружной мембраны МС58 (Giuliani MM, et al. 2000. Proceedings 12th IPNC. p.22). С другой стороны, есть определенные основания полагать, что комбинации этих белков могут проявлять более высокую иммуногенность в мышах, чем отдельные белки (Santini L. et al. 2000. Proceedings 12th IPNC. p.25). Многочисленные открытые рамки считывания, которые были исключены во время этого исследования, возможно, из-за неуспешности экспрессии белка или модификации их иммунологических свойств, могут также иметь вакцинный потенциал и требуют дополнительного исследования.
Вакцинные компоненты могут быть выбраны более эффективно после достижения понимания вклада индивидуальных антигенов в патогенез N. meningitidis. Эти антигены могут сами быть эффективными вакцинными кандидатами или, альтернативно, аттенуированные мутанты могли бы рассматриваться в качестве вакцинных компонентов. В этом направлении применение вакцинных кандидатов с высокой степенью консервативности последовательности среди нескольких видов патогенных микроорганизмов могло бы обеспечить решение в отношении множественных заболеваний, которые они могут вызывать в случае, если эти кандидаты индуцируют подходящую реакцию через действие иммунной системы.
Технической целью, которую преследует данное изобретение, является развитие вакцинных композиций, способных увеличивать и/или расширять индуцированную иммунную реакцию против различных патогенов или против широкого диапазона индивидуальных вариантов патогенов, которыми являются патогены ракового, бактериального, вирусного или любого другого происхождения.
Описание изобретения
В реализуемом предмете данного изобретения сообщается, впервые, применение белка NMB0928 в качестве компонента вакцинной композиции с терапевтическим или превентивным характером против менингококкового заболевания или любой инфекции, вызываемой членом рода Neisseria.
Новый признак данного изобретения состоит в применении, ранее не сообщаемом, белка NMB0928 в препаратах с новыми свойствами, способных индуцировать системную и мукозную иммунную реакцию защиты широкого спектра, обусловленную консервативным характером этого белка в различных изолятах Neisseria meningitidis и Neisseria gonorrhoeae.
Краткое описание чертежей
Фигура 1. Клонирующий вектор рМ100, используемый в клонировании и экспрессии белка NMB0928. pTrip, промотор триптофана; N-term P64k, N-концевой фрагмент Р-64k; Т4 termibator, терминатор транскрипции фага Т4.
Фигура 2. Конечная конструкция нуклеотидной последовательности гена NMB0928 в векторе рМ100.
Фигура 3. Анализ электрофореза в ДСН-ПААГ фракций, полученных из разрушения клеток; Дорожка 1, супернатант; Дорожка 2, осадок клеток.
Фигура 4. Анализ с применением электрофореза в ДСН-ПААГ процесса солюбилизации белка NMB0928, начинающийся с осадка разрушения клеток: (А) дорожка 1, осадок разрушения клеток; дорожка 2, осадок после промывания 1Х ТЭ-буфером, содержащим 3 М мочевину; дорожка 3, растворимая фракция, полученная из этого промывного раствора; (В) дорожка 1, супернатант солюбилизации 1Х ТЭ-буфером, содержащим 6 М мочевину; дорожка 2, осадок солюбилизации.
Фигура 5. Уровни антител (IgG) против рекомбинантного белка NMB0928, полученные после иммунизации мышей одним и тем же антигеном интраназальным или внутрибрюшинным путем. Представлены результаты ELISA, которые были выражены в виде обратной величины наивысшего разведения, которое удваивает величину неиммунной сыворотки.
Фигура 6. Узнавание посредством Вестерн-блоттинга белка NMB0928, присутствующего в OMV N. meningitidis, с применением сывороток из мышей, иммунизированных рекомбинантным белком: стрелка указывает полосу, соответствующую иммуно-идентифицированному белку NMB0928.
Фигура 7. Реакция в виде антитела IgA против рекомбинантного белка NMB0928, на уровне слизистой оболочки, в мышах, иммунизированных этим антигеном интраназальным путем. Результаты выражены в виде обратной величины наивысшего разведения, которое удваивает величину неиммунной сыворотки. (А) реакция в виде антитела IgA в слюне. (В) реакция антитела IgA в промывках легкого.
Фигура 8. Результаты поисков гомологии между белком NMB0928 ("guery", запрашиваемый белок) и опубликованными последовательностями в геномах из различных серологических групп Neisseria meningitidis ("Sbjct") с применением программы BLAST.
Фигура 9. Узнавание белка NMB0928 в различных штаммах N. meningitidis, с применением сывороток, индуцированных против рекомбинантного антигена. В виде диаграмм показаны только результаты, полученные при использовании полуочищенного белка внутрибрюшинным путем, но подобное поведение наблюдали и в остальных из этих случаев. Результаты выражены в виде обратной величины наивысшего разведения, которое удваивает величину неиммунных сывороток.
Фигура 10. Сравнение среди сывороток, индуцированных иммунизацией белком, полученным двумя способами, введенным внутрибрюшинным путем, в экспериментах с пассивным иммунитетом против менингококковой инфекции, на модели детенышей крыс.
Фигура 11. Узнавание белка NMB0928 и панели неродственных антигенов генерируемыми mAb (mAb Е45-8-15, 2G23-12). Р1, белок класса 1 штамма Neisseria meningitidis В:4:Р1.15; Р64k, субъединица Е3 пируватдегидрогеназы из Neisseria meningitidis; Т.Т., столбнячный токсоид; HBsAg, поверхностный антиген гепатита В.
Фигура 12. Узнавание белка 92 сывороткой реконвалесцентов человека из выживших пациентов с менингококковым заболеванием. В качестве отрицательного контроля использовали сыворотки здоровых доноров. Результаты показаны в виде оптической плотности в анализе типа ELISA.
Фигура 13. Титры антител против пептида JY1 из сывороток животных, иммунизированных либо свободным пептидом (JY1), либо рекомбинантным белком (NMB0928), либо конъюгатом JY1-NMB0928.
Примеры
Пример 1
Детектирование белка NMB0928 в препаратах везикул наружной мембраны Neisseria meningitidis серогруппы В
С целью исследования белков, которые присутствуют в везикулах наружной мембраны Neisseria meningitidis серогруппы В (штамма В:4:Р1.19.15) проводили двумерный электрофорез в соответствии со способом, описанным в другом месте (Gorg A, et al. 1985. Electrophoresis 6:599-604). Затем выполняли ферментативное расщепление на экстрагированных из геля белках с применением трипсина (Promega, Madison, WI, U.S.). Генерируемые после расщепления пептиды экстрагировали в раствор с применением микроколонок (ZipTips, Millipore, MA, U.S.). Для масс-спектрометрического анализа пептиды элюировали из микроколонок 60% ацетонитрилом, 1% муравьиной кислотой с последующим немедленным нанесением в нанонаконечники (Protana, Denmark).
Измерения проводили в масс-спектрометре смешанного типа на основе квадруполя и времени полета (Q Tof-2™, Manchester, United Kingdom), снабженном источником ионизации (nanoESI). Данные масс-спектрометрии получали в диапазоне w/z 400-2000 в 0,98 сек и с применением 0,02 сек между сканами. Получение данных и обработку данных проводили с применением программы MassLynx (Version 3.5, Micromass).
Идентификацию белков на основе данных масс-спектра проводили с применением программы ProFound (Zhang W and Cgait BT. 2000. ProFound: an expert system for protein identification using mass spectrometric peptide mapping information. Anal Chem 72:2482-2489. http://prowl.rockefeller.edu/cgi-bin/ProFound). Поиск был адресован генам и полученным последовательностям белков, содержащимся в базе данных (http://www.ebi.ac.uk/swissprot/) и NCBI (http://www.ncbi.nim.nih.gov/), c учетом окисления метионинов, дезамидирования и карбоксиамидометилирования цистеинов в качестве возможных модификаций, которые могут встречаться.
Идентификацию белков на основе масс-спектров проводили с применением программы MASCOT (Perkins DN, et al. 1999. Probability-based protein identification by serching sequence databases using mass spectrometry data. Electrophoresis 20:3551-3567. Параметры поиска включали в себя модификации цистеина, а также окисления и дезамидирования.
Начиная от анализа результатов, полученных из индентификации белков, присутствующих в препаратах везикул наружных мембран, белок NMB0928 отбирали для оценки в качестве возможного вакцинного кандидата, из которого один пептид идентифицировали при помощи масс-спектрометрии.
Пример 2
Идентификация продукта гена NMB0928 как липопротеина-34 Neisseria meningitidis
Для идентификации белка NMB0928 выполняли поиск гомологии последовательности в базе данных NCBI с применением программы BLAST (Altschul SF et al. 1990. Basic local alignment search tool.J Mol Biol 215:403-410, http:/www.ncbi.nlm,nih.gov/BLAST/). Результаты этой процедуры показали гомологию, наряду с соответствующим белком в других серотипах Neisseria, с одним белком в нескольких микроорганизмах, в том числе липопротеином-34, кодируемым геном nipB из Escherichia coli, идентифицированным в 1991 году. Это показывает, что этот белок фракционируется в протеолипосомах наружной мембраны (Bouvier J, Pugsley A.P. and Stragier P. 1991. A gene for new lipoprotein in the dapA-purC interval of E.coli chromosome. J Bacteriol 173(17):5523-31).
Сохранение (консервация) этих белков в геноме нескольких микробных родов привело к их включению в виде группы ортологичных белков в консервативном домене, сообщенном NCBI [gni|CDD|12651, COG3317, NipB, Неохарактеризованный липопротеин (биогенез оболочки клетки, наружная мембрана), которое указывает на существование общего филогенетического предка.
Анализ окружения этих генов, использующий базу данных MBGD (Uchiyama, I. 2003. MBGD: microbial genome database for comparative analysis. Nucleic Acids Res. 31, 58-62), выявил существенное сходство в организации этого гена, приведшее к идентификации белка NMB0928 как липопротеина-34 (NipB) Neisseria meningitidis.
Пример 3
Клонирование и экспрессия гена NMB0928, кодирующего белок NMB0928 из N. meningitidis, в Escherichia coli
Для клонирования и экспрессии гена NMB0928 использовали клонирующий вектор рМ-100. Этот вектор позволяет проведение клонирования с применением различных рестрикционных ферментов (рестриктаз) и генерирование высоких уровней экспрессии гетерологичных белков в форме телец включения в E.coli.
Вектор рМ-100 (фигура 1) имеет следующие элементы: промотор тритофана, сегмент гена, кодирующий стабилизирующую последовательность из 47 аминокислот из Nt-фрагмента белка Р64 кДа из штамма N. meningitidis В:4:Р1.19, 15, последовательность терминатора транскрипции бактериофага Т4 и последовательность гена, придающего устойчивость к ампициллину в качестве маркера отбора.
Из нуклеотидной последовательности, кодирующей белок NMB0928 (пример 1), конструировали два праймера (7740 и 7741) для амплификации этого сегмента данного гена без последовательности, которая кодирует предсказанный сигнальный пептид, из геномной ДНК штамма В:4:Р1.19, 15.
BglII
(SEQ ID NO: 1)
EcoRV
(SEQ ID NO: 2)
Для предсказания сигнального пептида использовали сервер World Wide Web SignalP (http://www.matrixscience.com/)http://www.cbs,dtu.dk/services/SignalP-2.0).
После амплификации гена NMB0928 при помощи ПЦР (Randall K, et al. 1988. Science 42394:487-491) с применением праймеров 7740 и 7741 продукт ПЦР расщепляли рестриктазами BglI и EcoRI и клонировали в предварительно расщепленный клонирующий вектор рМ-100. Конечная конструкция показана на фигуре 2, и белок NMB0928 экспрессируется в виде белка, слитого с Nt-сегментом белка Р64 кДа. Секвенирование клонированного гена NMB0928 проводили с применением автоматического секвенатора ALFexpress (Termo SequenaseТМCyТМ(5 Terminator Kit, Amersham Biosciences) и олигонуклеотидов 1573 (SEQ ID NO:8) и 6795 (SEQ ID NO:9), которые связывают последовательность стабилизатора Р64 и терминатор транскрипции Т4 соответственно. Генерируемая здесь плазмида была названа рМ-242 для ее последующего применения.
Для экспрессии гена NMB0928 штамм E.coli GC366 трансформировали химическим способом плазмидой рМ-242 (фигура 2). Эксперимент по экспрессии проводили в минимальной среде (М9) (Miller JH. 1972. Experiments in Molecular Genetics, Cold Spring Harbor Laboratory Press, New York, USA), дополненной 1% глицерином, 1% гидролизатом казеина, 0,1 мМ CaCl2, 1 мМ MgSO4 и 50 мкг/мл ампициллина. Бактериальные культуры инкубировали 12 часов при 37°С и 250 об/мин. Выращенные культуры центрифугировали и выполняли разрушение ультразвуком клеточного осадка (IKA LABORTECHNIK). Фракции из осадка и супернатанта анализировали электрофорезом в ДСН-ПААГ (Laemmli UK. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4, Nature 277:680) и окрашивали Кумасси бриллиантовым синим R-250. Процент экспрессии определяли проведением денситометрии геля (LKB Bromma 2202 Ultrascan laser densitometer; Amersham Pharmacia Biotech, United Kingdom). Белок NMB0928 получали из фракции осадка, и он составлял приблизительно 60% общего содержания белка этой фракции (фигура 3). Осадок промывали 1xТЭ-буфером (10 мМ Трис-гидроксиметиламинометан, 1 мМ этилдиаминотетрауксусная кислота, рН 8), содержащим 2 М мочевину, и некоторые примеси переходили в супернатант, а белок NMB0928 оставался в осадке (фигура 4А). Затем этот осадок солюбилизировали 1xТЭ-буфером, содержащим 6 М мочевину, и этот рассматриваемый белок переходил в растворимую фракцию, которую диализовали против 1х ТЭ-буфера с получением конечного препарата с чистотой 70%, как это можно видеть на фигуре 4В.
Пример 4
Оценка иммунной реакции, индуцируемой после иммунизации белком NMB0928 внутрибрюшинным и интраназальным путями
Для оценки иммуногенности белка NMB0928 проектировали и проводили эксперимент по иммунизации на мышах, где один и тот же белок вводили двумя различными способами. Первый состоял в экстракции полосы из полиакриламидного геля (Castellanos L, et al. 1996. A procedure for protein elution from reverse-stained polyacrylamide gels applicable at the low picomole level: An alternative route to preparation of low abundance proteins for microanalysis. Electroforesis 17: 1564-1572), а второй был описан в примере 3, и этот продукт был назван полуочищенным белком.
Этими препаратами иммунизировали самок мышей Balb/c (8-10-недельных) после разделения на 4 группы из 8 мышей каждая. Три иммунизации выполняли интраназальным или внутрибрюшинным путем с 15-дневным интервалом между ними. Белок, вводимый внутрибрюшинным путем, был эмульгирован адъювантом Фрейнда. В таблице 1 описана композиция для этих групп.
| Таблица 1 | |||
| Группы мышей Balb/с, используемых для иммунизации | |||
| Группы | Белок, экстрагированный из геля | Полуочищенный белок | Путь |
| 1 | 50 мкг | -- | в/н |
| 2 | -- | 50 мкг | в/н |
| 3 | 10 мкг | -- | в/б |
| 4 | -- | 10 мкг | в/б |
Титры антител (IgG) против рекомбинантного белка и гомологичного белка, присутствующего в бактерии, определяли при помощи ELISA в пробах сыворотки, взятых после третьей инокуляции. На фигуре 5 показаны титры антител против рекомбинантного белка отдельных животных. Уровни антител определяли после второй инокуляции, хотя они были более высокими после третьей инокуляции. Кроме того, выполняли иммуноидентификацию при помощи Вестерн-блоттинга, где узнавали полосу соответствующего белка. Группы, иммунизированные внутрибрюшинным путем, имели титры, значимо более высокие, чем титры, индуцируемые интраназальным путем.
Для статистического анализа этих результатов использовали непараметрический дисперсионный анализ Крускала-Уоллиса вследствие негомогенности дисперсии в этих группах в соответствии с критерием Бартлетта. Критерий множественного сравнения Дунна использовали для сравнения средних значений каждой обработки.
Сыворотки, полученные после иммунизации рекомбинантным белком, узнавали природный белок, присутствующий в препарате белка наружной мембраны (ОМР) штамма CU385. Эти результаты представлены на фигуре 6.
Для анализа реакции слизистой оболочки оценивали пробы слюны и промывки легких. Фигура 7 показывает только группы, иммунизированные интраназальным путем. Наблюдали увеличение титра IgA в группе, получавшей полуочищенный белок.
Пример 5
Характеристика последовательности гена, кодирующего белок NMB0928, в различных штаммах N. meningitidis
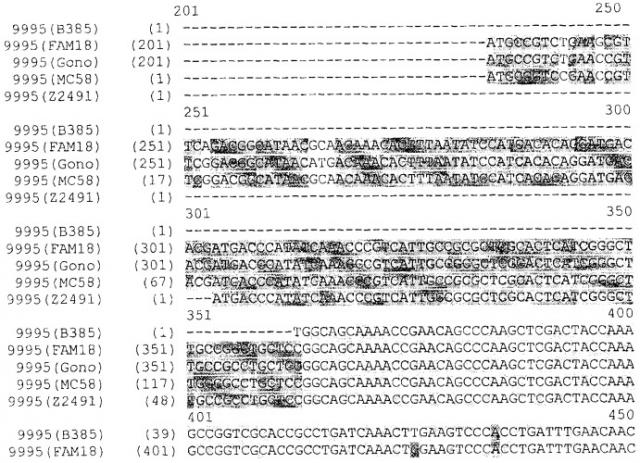
Для анализа сохранения последовательности гена, кодирующего белок NMB0928, в патогенных видах рода Neisseria выполняли поиск сходства с геномами Neisseria meningitidis (сергруппами А, В и С) и Neisseria gonorrhoeae, опубликованными в базе данных NCBI (NC 003116.1, NC 003112.1, NC 003221, NC 002946 SANGER 135720|Contig1), с применением программы BLAST (Altschul SF et al. 1990. Basic local alignment search tool. J Mol Biol 215:403-410, http:/www.ncbi.nlm.nih.gov/BLAST/). Фигура 8 показывает результаты сравнения последовательности для этих последовательностей, которые дают значимое сопоставление в каждом из анализируемых генов. Эти последовательности имеют 98% идентичность в серогруппах А и С, 99% идентичность в серогруппе В и 96% идентичность с Neisseria gonorrhoeae с последовательностью, полученной для гена, которая кодирует белок NMB0928 (SEQ ID NO:3). Кроме того, последовательность указанного гена определяли для 3 Кубинских изолятов (SEQ ID NO:5-7), которые принадлежат к серогруппе В (В:4:Р1. 19,15), и сопоставление последовательностей выполняли с применением программы ClustalX (http://www.ebi.ac.uk/clustalw/). Результаты этого сопоставления показывают, что имеется высокое сохранение (консервативность) в нуклеотидной последовательности гена NMB0928 среди анализируемых штаммов.
Применение белка NMB0928 в качестве вакцинного кандидата, с учетом высокой степени сходства, существующей среди вышеупомянутых последовательностей, позволило бы вызывать эффективную иммунную реакцию с защитой широкого спектра (вследствие перекрестной реактивности) против менингококкового заболевания.
Пример 6
Характеристика иммунной реакции с широким спектром действия, индуцируемой иммунизацией мышей Balb/с белком NMB0928
Для оценки, индуцирует ли иммунизация белком NMB0928 реакцию, широко перекрестно-реактивную с другими штаммами Neisseria, выполняли анализ ELISA. Полистироловые планшеты покрывали целыми клетками 7 штаммов Neisseria, которые принадлежат к различным серологическим типам и серологическим подтипам. Эти планшеты инкубировали с объединенными сыворотками, полученными против белка NMB0928, двумя способами иммунизации, как описано в примере 4.
Фигура 9 показывает результаты, полученные с сыворотками, индуцированными против полуочищенного белка, вводимого внутрибрюшинным путем. Как видно, эти иммунные сыворотки узнавали белок, присутствующий в различных штаммах, причем уровни были сходными с уровнем, обнаруженным в штамме CU385. Остальные сыворотки имели сопоставимую реакцию в этом анализе.
Пример 7
Защита, индуцированная мышиными сыворотками, специфическими в отношении белка NMB0928, против гомологичного и гетерологичного штаммов, на модели детенышей крыс
Для определения функциональной активности полученных антисывороток анализ защиты проводили на модели менингококковой инфекции детенышей крыс. Двадцать четыре крысы (5-6-дневные) делили на группы по 6 крыс каждая.
Определяли, защищали ли сыворотки, вводимые внутрибрюшинным путем, крыс от инфекции, вызываемой бактериями (штамма CU385), инокулированными тем же самым путем спустя один час. Сыворотки каждой группы объединяли и разводили 1/10 (в стерильном ЗФР) перед инокуляцией их крысам-детенышам. Спустя четыре часа у животных брали пробы и подсчитывали жизнеспособные бактерии в их крови.
Для интерпретации этих результатов выполняли дисперсионный анализ (Anova) с последующим критерием множественного сравнения Дюннета, в котором эти тест-группы сравнивали с отрицательным контролем. Как видно на фигуре 10, группы, которые получали антисыворотки против белка NMB0928, демонстрируют статистически значимые различия с негативным контролем и поэтому они считаются в этой модели защитными.
Подобный анализ выполняли с инфицированием детенышей крыс штаммами М982 и 120/90, выделенными из организма кубинских пациентов, серологическая клас