Измененные рекомбинантные клетки (arc), предназначенные для продуцирования и доставки антивирусных агентов, адъювантов и акселераторов вакцин
Иллюстрации
Показать всеНастоящее изобретение относится к композициям активного цитокина-интерферона-гамма, а также к недорогим способам получения указанных композиций и к способам лечения и ускорения иммунной реакции, которые включают введение измененной рекомбинантной клетки (ARC) представляющей собой Р. Fluorescens, содержащей гетерологичный ген интерферона-гамма. Преимущество изобретения заключается в повышении удельной активности интерферона. 5 н. и 17 з.п. ф-лы, 13 табл., 13 ил.
Реферат
Перекрестная ссылка на родственную заявку
Данная заявка притязает на приоритет предварительной заявки на патент США № 60/417124, поданной 8 октября 2002 г., которая полностью включена в данную заявку в качестве ссылки, в том числе все фигуры, таблицы, последовательности и формулы.
Уровень техники
Цитокины и хемокины являются важными элементами функциональных иммунных систем. Например, интерферон является одним из первых рекомбинантных лекарственных средств, полученных с помощью биотехнологии, который применяется в качестве антивирусного агента и иммуноадъюванта для создания вакцин для животных [2;24]. Гамма-интерферон (IFN-γ) является цитокином, который вызывает сильную антивирусную и иммунную реакции у животных [1-3; 6; 8; 13; 17; 18; 20; 22; 23; 25]. Вакцины, усиленные IFN-γ [13;18], применимы для лечения таких болезней как, например, транспортная лихорадка и мастит у крупного рогатого скота. Однако при современной технологии получения IFN-γ является неустойчивым и чрезвычайно дорогостоящим препаратом. При стоимости в несколько сот долларов за миллиграмм и требуемой для лечения дозировке в несколько миллиграммов на одну дозу применение IFN-γ в качестве антивирусного агента или вакцинного адъюванта для животных является практически невозможным. Поэтому возможности интерферонов и других цитокинов (см. таблицу I) в качестве волшебного средства для лечения болезней до сих пор не реализованы в полной мере [1].
IFN-γ оказывает прямое или косвенное воздействие почти на все элементы систем врожденного и приобретенного иммунитета [1] у крупного рогатого скота и других животных, таких как млекопитающие, птицы, рыба и рептилии. Кроме того, IFN-γ является одним из самым сильных, может быть, самым сильным плейотропом цитокинов, оказывающим глубокое влияние на процессинг и презентацию антигенов, ингибирование миграции лимфоцитов, активацию макрофагов, продуцирование антител против В-лимфоцитов [21], активность естественных клеток-киллеров (NK) и увеличение молекул на поверхности лейкоцитов для направленной миграции и иммунного распознавания. Сильные рецепторы для IFN-γ расположены на Т- и В-лимфоцитах, NK-клетках, моноцитах, макрофагах, фибробластах, нейтрофилах, эндотелиальных клетах и клетках гладких мышц. Кроме того, благодаря антивирусному действию IFN-γ является главной мишенью для губительного воздействия вирусов. Например, вирусы кодируют белки, которые могут инактивировать IFN-γ, блокировать IFN-индуцируемые пути активации антивирусных антител и прерывать межклеточную передачу сигналов IFN-γ.
Биологически активный бычий IFN-γ был впервые клонирован и синтезирован в Escherichia coli в 1986 г. [5]. Нуклеотидная последовательность конского IFN-γ, описанная в 1994 г., была на 67% идентична человеческому IFN-γ и на 78% идентична бычьему IFN-γ. Структура рекомбинантного куриного IFN-γ была описана в 1999 г., при этом активная усеченная форма (усеченная в положении остатка lys 133) была экспрессирована в E. coli. Установлено, что данная трехмерная структура подобна бычьему и человеческому IFN-γ несмотря на то, что общая идентичность аминокислот составляет только 32% [14].
Сущность изобретения
Настоящее изобретение относится к композициям активного цитокина и/или хемокина, а также к недорогим способам получения указанных композиций, упаковке композиций активного цитокина и/или хемокина в измененные клетки, к процессингу и доставке композиций активного цитокина и/или хемокина. Данное изобретение относится также к способам лечения и способам ускорения иммунной реакции, которые предусматривают введение активного гамма-интерферона и других композиций цитокина и/или хемокина животным или человеку.
В соответствии с одним аспектом данного изобретения IFN-γ и другие цитокины могут быть экспрессированы в целом ряде бактериальных клеток, включая бактерии Pseudomonas fluorescens, при помощи методов рекомбинантных ДНК, хорошо известных в данной области. В результате соответствующей реконструкции гена цитокина и введения его в плазмидный вектор хозяина точно между сильным регулируемым промотором и терминаторами транскрипции/трансляции можно экспрессировать IFN-γ в определенном чужеродном хозяине. Пригодность любого такого хозяина можно легко проверить обычными методами, известными специалисту в данной области, без излишнего экспериментирования. После экспрессии IFN-γ или других цитокинов в трансформированных бактериальных клетках на высоком уровне указанные клетки можно изменить соответствующими агентами, включая тепловые и химические агенты, которые убивают (стерилизуют) клетки, стабилизируют экспрессированный активный цитокин и модифицируют оболочку клетки для оптимального высвобождения упакованного в клетку цитокина. Например, используемый в данной заявке способ стерилизации/изменения клеток Pseudomonas fluorescens, экспрессирующих IFN-γ, представляет собой модификацию процесса, ранее применявшегося для продуцирования коммерческого биопестицида MVP [4; 9; 19]. В соответствии с указанным способом клетки P. fluorescens обрабатывают йодом, таким как люголь, при рН около 4,3. Йод при указанном показателе рН полностью стерилизует культуру in situ, изменяет оболочку клетки, придавая ей физическую долговечность, и делает оболочку бактериальной клетки подверженной протеолитическому распаду [9]. Кроме того, указанный способ устраняет флокуляцию клеток и, по-видимому, уменьшает эндотоксические свойства оболочки клетки Pseudomonas.
IFN-γ-содержащие измененные рекомбинантный клетки (IFN-γ/ARC) можно доставлять пероральным, назальным, глазным или парентеральным способом при помощи инъекций. Такие методы вакцинации IFN-γ/ARC можно использовать для лечения человека и животных, например, крупного рогатого скота; клетки ARC, содержащие бычий IFN-γ, можно использовать в качестве профилактического средства для предотвращения транспортной лихорадки или для защиты новорожденных телят от вирусных болезней и/или бактериального гастроэнтерита. Кроме того, указанным способом можно лечить человека и животных, отличных от крупного рогатого скота, таких как лошади, свиньи, куры и комнатные животные. Данный способ применим также для ослабления вызываемых стрессом заболеваний у животных и человека, а также для усиления иммунной реакции при использовании вышеуказанной композиции в качестве адъюванта и акселератора, для вакцинации человека путем введения IFN-γ-содержащих клеток ARC в количествах, достаточных для достижения требуемого биологического действия.
Краткое описание чертежей
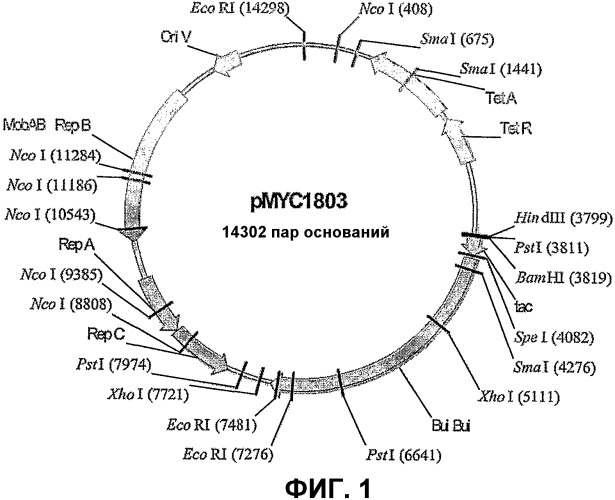
На фиг.1 показана плазмидная карта pMYC1803.
На фиг.2 показана кодирующая последовательность, комплементарная последовательность и аминокислотная последовательность для синтетического бычьего гамма-интерферона без сигнального пептида.
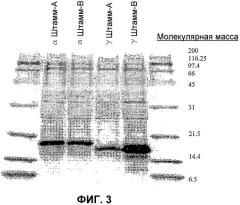
На фиг.3 показана фотография результатов анализа методом SDS-PAGE, на которой изображены главные полосы бычьего α- и γ-интерферона длиной соответственно около 18 и 17 кДа. Образцы культуры разводили в отношении 1:5 до погружения в гель. В каждую лунку добавляли 10 мкл.
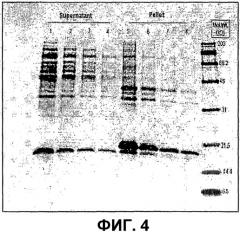
На фиг.4 показана фотография результатов эксперимента методом электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) с использованием разрушенной при помощи французского пресса культуры P. fluorescens, содержащей BAI и BGI, на которой основная масса BAI изображена в виде осажденной фракции.
На фиг.5 в виде таблицы показаны результаты анализа устойчивости BGI/ARC.
На фиг.6А графически изображен белок МНС II, продуцированный клетками бычьей почки in vitro под действием гомогенного бычьего IFN-γ (BGI), очищенного от рекомбинантной культуры Eschericia coli. На фиг.6В в виде графика сравнивается продуцирование белка МНС II клетками бычьей почки in vitro под действием 1) нетрансформированных клеток МВ324 P. fluorescens (ARC без вектора, без BGI); 2) трансформированных клеток MR1241 P. fluorescens (ARC с вектором, без BGI); 3) трансформированных клеток MR1605 P. fluorescens (BGI/ARC, ARC с вектором, с BGI); и 5) BGI, очищенного от рекомбинантных клеток P. fluorescens.
На фиг.7А показано воздействие рекомбинантного BGI (RecBoIFNγ), очищенного от E. coli, на продуцирование белка МНС II дендритными клетками. На фиг.7В сравнивается продуцирование MHC II дендритными клетками под действием 1) нетрансформированных контрольных клеток-хозяев P. fluorescens (МВ324); 2) контрольных клеток ARC (MR1241), трансформированных только вектором pMYC1803; 3) клеток BGI/ARC (MR1605) (трансформированных геном BGI); и 4) BGI, очищенного от P. fluorescens (DOWIFN).
На фиг.8 показано влияние BGI/ARC на температуру тела экспериментальных телят.
На фиг.9 показано влияние BGI/ARC на массу тела экспериментальных телят.
На фиг.10 показано влияние BGI/ARC на клинические симптомы заболевания у крупного рогатого скота.
На фиг.11 показана активность иммуноадъюванта BGI/ARC и способность клеток BGI-ARC ускорять иммунную реакцию у телят на антиген (например, альбумин свиной сыворотки).
На фиг.12 показано воздействие BGI/ARC на пролиферацию лимфоцитов (при измерении методом введения 3Н тимидина).
На фиг.13 показана активность птичьего IFN-γ/ARC (CGI/ARC) на продуцирование оксида азота макрофагом цыплят.
Подробное описание изобретения
Настоящее изобретение относится к композициям активного цитокина и/или хемокина, экспрессированным в процессированных (измененных) бактериальных системах, именуемых в данном описании изобретения "измененные рекомбинантные клетки" или "ARC". ARC представляют собой рекомбинантные бактериальные клетки, содержащие экспрессированные гетерологичные белки, причем указанные клетки убивают специальными методами химической стерилизации, в результате применения которых изменяется оболочка бактериальных клеток. Вышеуказанный процесс изменяет свойства оболочки клетки бактерий одновременно в двух разных направлениях: А) происходит физическое упрочнение оболочки клетки, благодаря чему бактериальные клетки становятся более устойчивыми к разрушению под действием i) сдвигающего усилия; ii) ультразвуковых колебаний или iii) давления; и В) происходит денатурация белка в оболочке клетки, что делает клетки более подверженными разрушению в результате протеолитического гидролиза.
Разные варианты осуществления настоящего изобретения относятся к бактериальным клеткам ARC, трансформированным векторами, содержащими по крайней мере один гетерологичный ген, кодирующий IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-15, IL-16, IL-18, IL-23, IL-24, эритропоэтин, G-CSF, M-CSF, тромбоцитарный фактор роста (PDGF), MSF, лиганд FLT-3, EGF, фактор роста фибробластов (FGF, например, aFGF (FGF-1), bFGF (FGF-2), FGF-3, FGF-4, FGF-5, FGF-6 или FGF-7), инсулиноподобные факторы роста (например, IGF-1, IGF-2), эндотелиальный фактор роста сосудов (VEGF); интерфероны (например, IFN-γ, IFN-α, IFN-β); фактор ингибирования лейкоза (LIF); мерцательный нейротрофический фактор (CNTF); онкостатин М; фактор самоподдержания стволовых клеток (SCF); трансформирующие факторы роста (например, TGF-α, TGF-β1, TGF-β2, TGF-β3) или хемокины (которые включают, не ограничиваясь ими, BCA-1/BLC-1, BRAK/Kec, CXCL16, CXCR3, ENA-78/LIX, эотаксин-1, эотаксин-2/MPIF-2, эксодус-2/SLC, фракталкин/нейротактин, GROальфа/MGSA, НСС-1, I-TAC, лимфотактин/АТАС/SCM, MCP-1/MCAF, МСР-3, МСР-4, MDC/STCP-1, ABCD-1, MIP-1α, MIP-1β, MIP-2α/GROβ, MIP-3α/эксодус/LARC, MIP-3β/эксодус-3/ELC, MIP-4/PARC/DC-CK1, PF-4, RANTES, SDF1α, TARC или ТЕСК) или цитокины и/или хемокины, приведенные в таблицах 1, 8 и 9. В предпочтительном варианте осуществления изобретения клетки ARC содержат IFN-γ (например, бычий, птичий (в частности, куриный), рыбий или человеческий IFN-γ). В другом предпочтительном варианте осуществления изобретения клетки ARC содержат IFN-γ и IFN-α (например, бычий, птичий (в частности, куриный), рыбий или человеческий IFN-γ и IFN-α). В используемом здесь значении термин "ARC" означает измененные рекомбинантные клетки, содержащие один или несколько гетерологичных генов. Измененные рекомбинантные клетки, не содержащие гетерологичных генов интерферона или белкаинтерферона, определяются как "контрольные клетки ARC".
В некоторых вариантах осуществления изобретения бактериальные клетки коэкспрессируют один или несколько других гетерологичных генов, кодирующих антигены и/или антигенные белки. Неограничивающие примеры антигенов или антигенных белков включают, не ограничиваясь ими, аутоантигены, опухолевые антигены, тривакцины против кори, эпидемического паротита и краснухи (MMR), полиомиелитные вакцины, противостолбнячные вакцины, патогены, обычно присутствующие в окружающей среде (например, пищевые патогены, такие как виды Klebsiella, Salmonella, Escherichia, вирусы гепатита, вирусы гриппа и т.д.), и патогенные вещества, намеренно вводимые в среду, окружающую субъекта, такие как биотоксин (например, микотоксины, такие как трихотеценовый микотоксин (Т-2), стафилококковый энтеротоксин В, рицин или нейротоксин Clostridium botulinum, "вооруженные" бактериальные клетки (например, вирусы, содержащие ДНК- или РНК-вставки токсина, бактериальные или грибные клетки, трансформированные токсинами [например, микотоксины, такие как трихотеценовый микотоксин (Т-2), стафилококковый энтеротоксин В, рицин или нейротоксин Clostridium botulinum], вирусные патогены, грибные патогены, бактериальные патогены (например, вирус оспы, вирус сибирской язвы, вирус Эбола, Yersinia pestis), иммуномодуляторные белки, такие как суперантигены, сывороточные альбумины или белковые стабилизаторы. Разные варианты осуществления изобретения относятся к отдельным композициям ARC, экспрессирующим один гетерологичный ген (например, один цитокин, хемокин или белок). В некоторых вариантах осуществления изобретения коэкспрессированный белок или антиген, такой как сывороточный альбумин, кодирован ДНК, выделенной из организма животного требуемого вида. В соответствии с некоторыми вариантами осуществления изобретения все белки, экспрессированные в бактериальной системе, находятся в одном векторе. Другие варианты осуществления изобретения относятся к трансформации бактериальных клеток несколькими векторами, кодирующими требуемые белки. В других вариантах осуществления изобретения один или несколько гетерологичных генов могут быть введены в клетку-хозяина любым известным способом, обеспечивающим нахождение гена вне хромосомы или встраивание в геном хозяина. (Термин "гетерологичный" означает, что данный ген отсутствует в клетке-хозяине, в которую он был введен, и что обычно данный ген не встречается в таком хозяине. То есть, даже если микроорганизм-хозяин и источник гетерологичного гена обмениваются информацией, такой гетерологичный ген обычно не встречается в естественных клетках-хозяевах дикого типа. Термин "тегерологичный" обычно относится к разным видам животных, используемых в качестве хозяина и источника гена).
Можно использовать разные конструкции, которые включают системы репликации, полученные из плазмид, вирусов или центромеров, в комбинации с автономным реплицирующим сегментом (ars) для устойчивого сохранения. В тех случаях, когда необходима интеграция, можно использовать конструкции, которые способны обеспечить репликацию и являются транспозонами или обладают транспозоноподобной активностью введения либо характеризуются гомологией с геномом хозяина. Часто используют последовательности ДНК, содержащие гетерологичный ген между последовательностями, гомологичными последовательностям в геноме хозяина, находящимся в хромосоме или плазмиде. Желательно, чтобы гетерологичный ген присутствовал в нескольких копиях. См., например, патент США № 4399216. Таким образом, для введения гетерологичного гена можно использовать конъюгацию, трансдукцию, трансфекцию и трансформацию.
В вариантах осуществления изобретения, в которых использован внехромосомный элемент, конструкция ДНК предпочтительно включает маркер, позволяющий отбирать клетки-хозяева, содержащие данную конструкцию. Таким маркером обычно является маркер, устойчивый к биоцидам, например, устойчивый к антибиотикам или тяжелым металлам, обладающий комплементацией, характерной для прототрофии к ауксотрофному хозяину, или подобными свойствами. Системы репликации могут обладать особыми свойствами, такими так самопроизвольная репликация, могут включать клетки cos или характеризоваться другими специальными признаками.
Вместе с вышеуказанным гетерологичным геном можно использовать один или несколько гетерологичных генов, формирующих сигналы, регулирующие инициацию и терминацию транскрипции и трансляции, которые распознает клетка-хозяин. Однако в тех случаях, когда гетерологичный ген модифицирован, например, в результате удаления лидерной последовательности или введения последовательности, кодирующей зрелую форму цитокина и/или хемокина, где весь ген кодирует предшественник, часто необходимо изменить последовательностью ДНК так, чтобы получить регуляторную последовательность инициации транскрипции, отличную от естественной последовательности.
Для разных хозяев существует целый ряд последовательностей инициации транскрипции. Такая последовательность может обеспечивать конститутивную экспрессию цитокина и/или хемокина или регулируемую экспрессию, которая может быть индуцирована химическим веществом, например, метаболитом, температурой или регулируемым репрессором. См., например, патент США № 4374927, который полностью включен в данное описание изобретения в качестве ссылки. Выбор промотора зависит от ряда факторов, таких как сила промотора, интерференция промотора в жизнедеятельность клеток, влияние на промотор регуляторных механизмов, являющихся эндогенными для данной клетки, и тому подобных. Можно получить большое число промоторов из разных источников, включая коммерческие источники.
Векторы, пригодные для экспрессии цитокинов, приведенных в таблицах 1, 8 и 9, хорошо известны специалистам в данной области. Аналогичным образом гетерологичные гены, кодирующие цитокины и хемокины, приведенные в таблицах 1, 8 и 9, хорошо известны специалистам в данной области, при этом кодирующие последовательности можно получить из разных источников, включающих разные базы данных, представленные в патентах, общедоступные базы данных (в частности, базы данных нуклеиновых кислот и белков, представленные в Национальной медицинской библиотеке или в Европейской лаборатории молекулярной биологии), которые содержат нуклеотидные или полипептидные последовательности, кодирующие вышеуказанные цитокины, хемокины или другие белки, научную литературу или научные публикации, приведенные в каталогах, публикуемых компаниями, такими как Genzyme, Inc., R&D Systems, Inc., или InvivoGen, Inc [см., например, каталоги Cytokine Research Products, 1995, Genzyme Diagnostics, Genzyme Corporation, Cambridge MA; 2002 or 1995 Catalog R&D Systems, Inc. (Minneapolis, MN); или 2002 Catalog of InvivoGen, Inc (San Diego, CA), которые полностью включены в данное описание изобретения в качестве ссылки, в том числе все приведенные в них ссылки]. Альтернативно, нуклеиновые кислоты, кодирующие цитокины и/или хемокины, и векторы, содержащие нуклеиновые кислоты, кодирующие цитокины и/или хемокины, можно приобрести у коммерческих поставщиков, таких как R&D Systems, Inc. (Minneapolis, MN 55413) или InvivoGen, Inc. (San Diego, CA 92121). В соответствии с некоторыми объектами данного изобретения бактериальные клетки модифицируют для экспрессии разных комбинаций цитокинов и/или хемокинов.
Бактериальные клетки, пригодные для использования в настоящем изобретении, включают прокариоты (грамположительные и грамотрицательные микроорганизмы) и низшие эукариоты, такие как грибы. Бактериальные клетки, пригодные для использования в настоящем изобретении, относятся к нижеследующим родам: 1) Enterobacteriaceae, включая виды родов Escherichia, Erwinia, Shigella, Salmonella и Proteus; 2) Bacillaceae; 3) Rhizobiaceae, такой как Rhizobium; 4) Spirillaceae, такой как фотобактерии, Zymomonas, Serratia, Aeromonas, Vibrio, Desulfovibrio, Spirillum; 6) Lactobacillaceae; 7) Pseudomonadaceae, такой как Pseudomonas и Acetobacter; 8) Azotobacteraceae и Nitrobacteraceae. К низшим эукариотам относятся также грибы, такие как Phycomycetes и Ascomycetes, которые включают дрожжи, такие как Saccharomyces и Schizosaccharomyces; и дрожжи Basidiomycetes, такие как Rhodotorula, Aureobasidium, Sporobolomyces и тому подобные. После высокой экспрессии белков цитокина в трансформированных бактериальных клетках указанные клетки можно собрать известными способами и обработать фиксирующими реагентами для лизиса клеток и стабилизации активного цитокина. В некоторых вариантах осуществления изобретения цитокины и/или хемокины экспрессируют в клетках Pseudomonas fluorescens; после чего клетки фиксируют, собирают, промывают или необязательно промывают и затем фиксируют.
Клетку-хозяина, содержащую один или несколько гетерологичных генов, можно выращивать в любой известной питательной среде, в которой конструкция ДНК характеризуется селективным преимуществом (например, в избирательной среде, содержащей антибиотики), при условии, что в данной избирательной среде по существу все клетки сохраняют гетерологичные гены. Указанные клетки затем можно собрать известными способами и модифицировать вышеописанными методами. Альтернативно клетки можно сначала фиксировать и затем собирать.
Клетки ARC определяют в данном изобретении при помощи нижеследующих испытаний: А) Клетки ARC являются мертвыми. Указанные клетки не могут образовывать колонии на питательных средах, пригодных для роста их живых форм. В) Клетки ARC характеризуются повышенной физической долговечностью. Указанные клетки устойчивы к разрушению ультразвуком или обладают более высокой устойчивостью при прохождении через французский пресс по сравнению с неизмененными живыми формами. С) Клетки ARC подвержены распаду в результате протеолиза. То, что данные клетки в большей степени подвержены протеолитическому распаду под действием трипсина (или целого ряда других протеаз) по сравнению с их неизмененными живыми формами, можно определить при помощи микроскопии или других методов. D) Клетки ARC содержат рекомбинантные гетерологичные гены и экспрессируют гетерологичные белки, при этом требуемые функциональные свойства гетерологичных белков частично или полностью сохранены.
Разные методы инактивации и изменения клеток-хозяев предусматривают подкисление кислотами, такими как уксусная кислота, с добавлением или без добавления галогенирующего агента, такого как йод; ультрафиолетовое облучение; лиофилизацию; токсины, например, антибиотики; фенолы; анилиды, например, карбанилид и салициланилид; гидроксимочевину; четвертичные спирты; антибактериальные красители; EDTA и амидины; неспецифические органические и неорганические химические вещества, такие как вышеуказанные галогенирующие агенты, например, хлорирующие, бромирующие или йодирующие агенты; альдегиды, например, глутаральдегид или формальдегид; токсичные газы, такие как озон и пероксид этиленоксида; псоралены; дессиканты; или тому подобные, которые могут быть использованы отдельно или в комбинации. Выбор агента зависит от определенного цитокина или хемокина, характера клетки-хозяина и принципов модификации клеточной структуры, необходимой для достижения требуемых эффектов лизиса клеток, сохранения активности цитокинов, физического упрочнения клеточной оболочки и химической денатурации белков клеточной оболочки, в результате чего клетки становятся более чувствительными к протеолизу.
Приемлемые агенты, предназначенные для инактивации и изменения клеток с образованием ARC, включают галогенирующие агенты, в частности, галогены с атомными числами 17-80. В частности, можно использовать йод в мягких условиях и производить обработку в течение периода времени, достаточного для достижения требуемых результатов. Другие приемлемые методы предусматривают обработку альдегидами, такими как формальдегид и глутаральдегид, антибактериальными средствами, такими как хлорид зефирана и хлорид цетилпиридиния, спиртами, такими как изопропиловый спирт и этанол, разными гистологическими фиксаторами, такими как фиксатор Боуина и фиксатор Гелли (см. Humason, Gretchen L., Animal Tissue Techniques, W.H. Freeman and Company, 1967); или комбинацией физических (тепловых) и химических агентов, которые увеличивают активность цитокина и/или хемокина.
При галогенировании йодом температура обычно находится в интервале от около 0°С до 50°С, но данную реакцию можно выполнять при комнатной температуре. Специалист в данной области может легко определить оптимальный диапазон переменных параметров с учетом активности или отсутствия активности цитокина, экспрессированного соответствующими клетками ARC. Другие подобные переменные специалист в данной области может протестировать без ненужного экспериментирования. Например, йодирование можно испытать при помощи трийодида или йода, вводимого в количестве 0,5-5% в кислую водную среду, в частности, в водный раствор карбоновой кислоты, который может изменяться в пределах около 0,5-5М. Можно также использовать уксусную кислоту или другие карбоновые кислоты, содержащие от около 1 до 4 атомов углерода. Время реакции обычно составляет от менее минуты до около 24 часов, в частности, от около 1 до 6 часов; показатель рН растворов для галогенирования (например, йодирования) находится в пределах от около 4,0 до около 7,0. В некоторых вариантах осуществления изобретения показатель рН находится в пределах от около 4,0 до около 6,0, от около 4,0 до около 5,0, от около 4,1 до 4,7, от около 4,2 до 4,6, от около 4,3 до 4,4 или около 4,3. В других вариантах осуществления изобретения показатель рН находится в пределах от около 3,0 до около 6,0, от около 3,5 до около 5,0, от около 3,7 до 4,7, от около 3,8 до 4,6, от около 3,9 до 4,4 или около 4,3. Любой остаточный йод при необходимости можно удалить, осуществляя взаимодействие с восстановителем, таким как дитионит, тиосульфат натрия или другие восстановители. Кроме того, модифицированные клетки могут быть подвергнуты дальнейшей обработке, такой как тщательная промывка, для удаления реакционной среды, выделения в сухом виде и смешивания с обычными связующими веществами, пластификаторами и адъювантами, обычно используемыми специалистами в данной области. В некоторых вариантах осуществления изобретения клетки ARC могут быть получены путем обработки перекрестносшивающими агентами, известными в данной области.
Один из способов изменения клеток, в частности, фиксация люголем, описан в ссылке [9] и патенте США № 4695455 (которые полностью включены в данное описание изобретения в качестве ссылки). Измененные клетки промывают водой и вводят в соответствующий препарат для использования в терапевтических целях. В соответствии с данным аспектом изобретения получают композиции, содержащие измененные микроорганизмы, которые можно вводить нуждающемуся субъекту в количествах, достаточных для достижения требуемого биологического эффекта. Указанные композиции можно получить с использованием любых носителей, включая, например, носители, описанные в публикации E.W. Martin's Remington's Pharmaceutical Science, Mack Publishing Company, Easton, PA.
Настоящее изобретение относится к способам индукции и/или ускорения иммунной реакции у субъекта, которые предусматривают стадии введения субъекту (такому как птица, амфибия, рептилия, водное панцирное животное, рыба или млекопитающее) композиции, содержащей измененные рекомбинантные клетки (ARC), экспрессирующие цитокин/хемокин, один или несколько представляющих интерес антигенов и, необязательно, дополнительные молекулы адъювантов, такие как липополисахарид (LPS) или динуклеотид CpG в количестве, достаточном для возбуждения иммунной реакции. В некоторых предпочтительных вариантах осуществления изобретения клетки ARC коэкспрессируют: а) один или несколько представляющих интерес антигенов и b) один или несколько цитокинов/хемокинов, таких как IFN-γ или другие цитокины/хемокины, приведенные в таблицах 1, 8 и 9. В других вариантах осуществления изобретения нуждающемуся субъекту вводят композицию, содержащую смесь одного или нескольких антигенов и клеток ARC, экспрессирующих один или несколько цитокинов/хемокинов. В смешанной композиции используют нижеследующие антигены: 1) в очищенном виде, 2) в виде неочищенного экстракта и/или 3) в отдельной композиции ARC, в которой клетки трансформированы ДНК, кодирующей представляющий интерес антиген. В любом варианте осуществления изобретения композиция может необязательно содержать адъюванты, известные специалистам в данной области. В некоторых предпочтительных вариантах осуществления изобретения клетки ARC коэкспрессируют по крайней мере IFN-γ и IFN-α.
Другим аспектом настоящего изобретения являются способы ускорения иммунной реакции у субъекта, которые предусматривают введение нуждающемуся субъекту измененных рекомбинантных клеток (ARC), содержащих один или несколько цитокинов и/или хемокинов или их композиции, в количествах, достаточных для ускорение иммунной реакции у указанного субъекта. В соответствии с одним аспектом изобретения возникновение максимальной гуморальной иммунной реакции (например, появление максимального числа антител IgM- и/или IgG-классов после антигенной стимуляции) у субъекта можно ускорить на 1-14 дней или больше. В соответствии с данным аспектом изобретения субъект может быть предварительно подвергнут воздействию антигена, либо указанный антиген может быть введен субъекту одновременно с вышеуказанной композицией.
Таким образом, настоящее изобретение относится к способам ускорения образования у субъекта изотипов антитела (например, IgG1 и IgG2) или разных классов антител (например, IGM, IgG, IgA, IgE и/или IgY), которые включают введение композиций, включающих клетки ARC, содержащие один или несколько цитокинов и/или хемокинов. Указанный способ может далее включать введение антигена или иммуногена до, одновременно или после введения композиции ARC. В некоторых вариантах осуществления изобретения композиция ARC представляет собой IFN-γ/ARC. Другие варианты осуществления изобретения относятся к клеткам ARC, содержащим IFN-α и IFN-γ. В разных вариантах осуществления изобретения гены интерферона принадлежат человеку, птицам (например, цыплятам), крупному рогатому скоту, млекопитающим или рыбе.
В некоторых вариантах осуществления изобретения клетки ARC, экспрессирующие один или несколько цитокинов и/или хемокинов, вводят нуждающемуся субъекту в период времени от двух до ста часов и через шестьдесят восемь часов после стимуляции представляющим интерес антигеном. Термин "представляющий интерес антиген" означает, не ограничиваясь ими, аутоантигены, опухолевые антигены, тривакцины против кори, эпидемического паротита и краснухи, полиомиелитные вакцины, противостолбнячные вакцины, патогены, обычно присутствующие в окружающей среде (например, пищевые патогены, такие как виды Klebsiella, Salmonella, Escherichia, вирусы гепатита, вирусы гриппа и т.д.) и патогенные вещества, намеренно вводимые в среду, окружающую субъекта, такие как биотоксин (например, микотоксины, такие как трихотеценовый микотоксин (Т-2), стафилококковый энтеротоксин В, рицин или нейротоксин Clostridium botulinum, "вооруженные" бактериальные клетки (например, вирусы, содержащие ДНК- или РНК-вставки токсина, либо бактериальные или грибные клетки, трансформированные токсинами [например, микотоксины, такие как трихотеценовый микотоксин (Т-2), стафилококковый энтеротоксин В, рицин или нейротоксин Clostridium botulinum], вирусные патогены, грибные патогены, бактериальные патогены (например, вирус оспы, вирус сибирской язвы, вирус Эбола, Yersinia pestis), иммуномодуляторные белки, такие как суперантигены, сывороточные альбумины или белковые стабилизаторы. Таким образом, настоящее изобретение относится а) к лечению субъекта, подвергшегося воздействию биологического агента, используемого при совершении террористического акта с применением биологического оружия, и b) к лечению субъекта, подвергшегося воздействию патогена, обычно присутствующего в окружающей среде. В предпочтительных вариантах осуществления изобретения, относящихся к данному аспекту, клетки ARC коэкспрессируют IFN-γ и/или IFN-α и, необязательно, LPS. Клетки ARC, необязательно, коэкспрессируют другие белки, цитокины и/или хемокины помимо IFN-γ и IFN-α.
Настоящее изобретение относится также к способам лечения опухолей, рака или злокачественных новообразований, которые предусматривают введение субъекту измененных рекомбинантных клеток (ARC), содержащих один или несколько цитокинов и/или хемокинов или их композиции в количествах, достаточных для оказания терапевтического эффекта. В некоторых вариантах осуществления изобретения термин "лечение" и/или "терапевтический эффект" означает любой процесс, действие, применение, терапию или тому подобные, при выполнении которых субъекту оказывают медицинскую помощь с использованием объекта, улучшающего состояние здоровья, качество жизни или прогноз болезни у данного субъекта. В других вариантах осуществления изобретения термин "лечение" или "терапевтический эффект" означает также предоставление субъекту лечения, в результате которого уменьшается масса опухоли, сокращается число раковых клеток или происходит ремиссия подвергнутой лечению опухоли, рака или злокачественного новообразования.
Настоящее изобретение относится к способам стимуляции, супрессии или модуляции иммунной системы субъекта, которые включают введение композиций, включающих измененные бактериальные клетки (ARC), содержащие цитокины и/или хемокины (например, приведенные в таблицах 1, 8 и 9), экспрессированные способами по данному изобретению. Один конкретный вариант осуществления изобретения относится к способу активации или стимуляции макрофага у субъекта, который предусматривает введение клеток ARC, содержащих один или несколько гетерологичных генов в количествах, достаточных для активации или стимуляции макрофага. В конкретном варианте осуществления изобретения клетки ARC содержат гетерологичные гены, кодирующие IFN-γ и, необязательно, IFN-α.
Настоящее изобретение относится также к способам усиления сопротивляемости организма субъекта вирусной инфекции, которые предусматривают введение композиций, включающих измененные рекомбинантные бактериальные клетки (ARC), содержащие цитокины и/или хемокины, экспрессированные способами по данному изобретению. В некоторых вариантах осуществления изобретения измененные бактериальные клетки содержат такие цитокины как IFN-γ. В других вариантах осуществления изобретения композиции содержат цитокины и/или хемокины, модулирующие требуемое биологическое действие. Такие композиции вводят в количествах, достаточных для стимуляции, супрессии или модуляции требуемого биологического действия (например, антивирусной активности или другой активности, представленной в таблицах 1, 8 или 9). Таким образом, настоящее изобретение относится также к способам индукции требуемых биологических действий, указанных в таблицах 1, 8 и 9, которые предусматривают введение композиций ARC (например, клеток ARC, содержащих гетерологичные гены, кодирующие цитокины и/или хемокины, вызывающие требуемое биологическое действие) в количествах, достаточных для индукции требуемого биологического действия.
Настоящее изобретение относится также к способам индукции по крайней мере одного требуемого биологического действия у млекопитающего, которые включают введение клеток ARC, содержащих один или несколько гетерологичных генов, или композиций ARC в количествах, достаточных для индукции требуемого биологического действия. Биологические действия приведенных в качестве примеров цитокинов и/или хемокинов известны специалистам в данной области, и неограничивающие примеры биологических действий, опосредуемых разными цитокинами и/или хемокинами, приведены в таблицах 8-9.
Настоящее изобретение относится также к способам, пригодным для применения в медицины и ветеринарии. Термин "субъект" означает рыбу, птиц, млекопитающих и/или рептилий. Млекопитающие, в отношении которых вышеописанные способы могут оказать благоприятный эффект, включают, не ограничиваясь ими, такие виды как человекообразные обезьяны, шимпанзе, орангутаны, человек, мартышки; домашние животные, такие как собаки, кошки, морские свинки, хомячки, вьетнамские свинки, кролики и хорьки; сельскохозяйственные животные, такие как коровы, буйволы, зубры, лошади, ослы, свиньи, овцы и козы; экзотические животные, обычно содержащиеся в зоопарках, такие как медведи, львы, тигры, пантеры, слоны, гиппопотамы, носороги, жирафы, антилопы, ленивцы, газели, зебры, гну, луговые собачки, коалы, кенгуру, опоссумы, еноты, панды, большие п