Способ мультисубстратного тестирования микробных сообществ и его применение
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и экологии. Предложен способ мультисубстратного тестирования природных микробных сообществ для определения типа местообитания, степени и типа негативного воздействия неблагоприятных факторов на почвенные местообитания и оценки качества почв. Способ предусматривает отбор проб, получение суспензии почвенного микробного комплекса внесение суспензии в ячейки тест-планшета, содержащего набор тест-субстратов, минеральную среду и индикатор потребления субстратов. Последующую инкубацию тест планшетов в термостатируемой камере до появления окраски индикатора, фотометрическую регистрацию интенсивности окраски субстратов с помощью плашечного фотометра. Далее проводят математический анализ полученных спектров потребления субстратов. Использование метода недорого и экспрессно позволяет получить информацию об экологическом статусе исследуемого местообитания в течение 48-72 часов. Изобретение может быть использовано в экологии. 2 н. и 8 з.п. ф-лы, 3 ил., 1 табл.
Реферат
Использование. Для объективного, экспрессного, качественного и количественного определения состояния природных местообитаний, таких как почва и почвоподобные тела.
Сущность изобретения. Способ осуществляют путем определения интенсивности потребления тестового набора органических моносубстратов исследуемым микробным сообществом при инкубации в специальных тест-планшетах. Определение производят фотометрически с использованием индикатора дегидрогеназной активности (соли тетразолия).
Полученный многомерный массив данных является уникальным функциональным портретом исследуемого микробного объекта, на основании которого можно производить классификацию сообществ и вычислять параметры их функционального биоразнообразия.
Изобретение относится к экологии, а именно к способам оценки состояния природных объектов и окружающей среды. Оно может быть использовано для простого и относительно быстрого получения объективной информации об уровне и типе нарушений природной среды естественными и техногенными физическими, химическими и биологическими факторами, и общем благополучии таких природных местообитаний как почвы и почвоподобные тела.
Более полувека известен прямой метод изучения биоразнообразия микробных сообществ С.Н.Виноградского (Виноградский С.Н. Микробиология почвы. М., Изд-во АН СССР, 1952, 792 с.), являющийся идеологическим предшественником системы, а прототипом является система таксономической дифференциальной диагностики болезнетворных микроорганизмов BIOLOG (США). В основу алгоритмов анализа и интерпретации данных положена теория биоразнообразия и методы ранговых распределений и энтропийного анализа, используемые в общей теории информации.
Современное состояние проблемы оценки качества окружающей природной среды.
Основными подходами к биологическому мониторингу качества окружающей природной среды являются использование тест-организмов, либо показателей состояния природных экосистем.
1. Использование тест-организмов.
В задачах биомониторинга в качестве тест-объектов служат биологические системы разных уровней экосистемной иерархии: организмы, популяции, сообщества. Традиционным и наиболее удобным с позиций методической стандартизации, но малоинформативным, а иногда и просто не адекватным поставленным задачам и преследуемым целям, служит использование совокупностей относительно одинаковых тест-организмов в условиях лабораторных экспериментов (Терехова В.А. Биотестирование как метод определения класса опасности отходов // Экология и промышленность России, 2003, №12. С.27-29.) по тестированию проб из окружающей среды (сценедесмус, дафния), либо в природных экосистемах (так называемые индикаторные виды). Недостатки этого подхода заключаются в том, что получаемая информация о качестве среды оценивается с позиций только одной популяции, со всеми ее особенностями. В связи с этим возникают артефакты, когда тест-организмы используются для оценки качества среды, изначально непригодной для их существования (особенно в лабораторных опытах). В то же время, очевидно, что допустимые уровни и эффекты как простых, так и комплексных техногенных факторов следует оценивать с позиций другого уровня организации живых систем: индигенных сообществ. Это подразумевает необходимость использования сообществ в качестве индикаторов (биосенсоров) допустимых уровней того или иного воздействия.
2. Использование показателей состояния сообществ.
Этот подход предполагает измерение структурных или функциональных параметров экосистемы с целью оценки качества среды и, одновременно, степени деградации сообщества под влиянием тех или иных факторов. Изначально в основе подхода лежала концепция, постулирующая прямую связь между качеством среды и структурным разнообразием экологических сообществ. Впоследствии она была модифицирована в теорию оптимального биоразнообразия. Для оценки и содержательной интерпретации данных, отражающих состояние сообществ, в мировой практике используются методы многомерной статистики, теории информации, в особенности, анализ ранговых распределений. Таким образом, сообщество выступает в роли многомерного биосенсора, используемого как для самодиагностики, так и для оценки качества среды для человека. При этом микробные сообщества, в силу их масштабов, высокого метаболического разнообразия, быстроты реакций на изменение условий среды и ключевой роли в поддержании динамической стабильности экосистем являются оптимальными для решения этих задач. Качество любого сенсора определяется его чувствительностью и селективностью. По этим позициям сообщество превосходит любую популяцию, однако обстоятельством, определяющим эффективность применения сообщества как биосенсора, является тип получаемой информации и методы ее анализа. В современной экологии единственным оптимальным подходом выступает использование многомерных показателей тест-объекта, подвергаемых сравнительному анализу относительно эталонов нормы и тест-объектов, испытывающих модельное воздействие в разной степени в модельных острых и хронических опытах (В.К.Шитиков, Г.С.Розенберг, Т.Д.Зинченко. Количественная гидроэкология: методы системной идентификации // Тольятти 2003: Иэвб Ран, 2003. - 463 с.). Традиционным направлением в использовании структурных характеристик сообществ в задачах мониторинга является изучение видового биоразнообразия. Положительным аспектом данного подхода является, на первый взгляд, относительная простота содержательной интерпретации первичных данных, особенно если биология видов сообщества хорошо изучена. Однако получение информации о структуре сообщества обычно представляет собой весьма трудоемкую задачу. Кроме того, в силу феномена дублирования ключевых экосистемных функций видами с существенно разной биологией, структурную информацию иногда невозможно интерпретировать с точки зрения оптимальности (нормальности) функционирования сообщества в составе экосистемы более высокого уровня. В связи с этим получил развитие подход к оценке состояния экосистем и качества окружающей среды на основе базовых функций сообщества.
До создания эффективных методов анализа многомерных данных в качестве таких функций рассматривали эмиссию биогенных газов, отражающих интегральные биологические функции экосистемы: дыхание, денитрификацию, фиксацию азота из атмосферы. Другой подход был основан на измерении скорости разложения тех или иных биополимеров, чаще всего целлюлозы и крахмала. Однако эти методы, в силу аддитивного характера отслеживаемых параметров и функционального дублирования определяющих их процессов, не обладали ни достаточной чувствительностью и информативностью, ни селективностью, а также не позволяли связать ригидность или лабильность отслеживаемых характеристик системы со степенью ее структурно-функциональной трансформации и качеством среды с точки зрения ненарушенных сообществ и человека.
Преодоление этих проблем достижимо путем использования достаточно широкого спектра характеристик (специфично метаболизируемых субстратов), что позволяет, с использованием адекватных методов обработки первичной информации обеспечить и селективность, и чувствительность. Практическое осуществление этого подхода относительно просто: необходимо обеспечить стандартное измерение интенсивности потребления различных субстратов сообществом либо его репрезентативной частью. Этот подход практически реализован в системе «BIOLOG» (США) (BIOLOG reference manual, BIOLOG Ink., Hayward, California, 1992; www.biolog.com), изначально созданной для дифференциальной диагностики патогенных микроорганизмов и впоследствии успешно использованной для содержательной дифференциации микробных сообществ природных экосистем, испытывающих различные виды техногенного воздействия разной интенсивности.
Недостатки применения этого подхода связаны с конструктивно-методическими особенностями системы «BIOLOG» и концептуальными недостатками ее применения: использованием в качестве элементарных тестов слишком сложных субстратов, применение избыточно широкой батареи тестов, тривиальность методов анализа данных, отсутствие глубокой теоретической проработки методологического подхода и содержательной интерпретации данных. Эти недостатки в большей или меньшей степени преодолены в предлагаемой системе мультисубстратного тестирования «Эко-Лог».
Цели изобретения.
1. Разработка экспрессного и информативного метода количественного и качественного описания функционального биоразнообразия микробных сообществ на основе методики фотометрического определения интенсивности потребления тест-субстратов испытуемым микробным объектом.
2. Скрининг и мониторинг состояния и качества почв и почвоподобных тел и установление объективного контроля за общим уровнем техногенного загрязнения в любой точке местности на обширных территориях на основании мультисубстратного тестрования почвенных естественных микробных сообществ. Выявление неблагополучных участков с последующим определением в них традиционными физико-химическими методами токсичных фракций и отдельных токсикантов.
3. Разработка системы параметров, позволяющих количественно оценить благополучие местообитания на основании данных о потреблении субстратов естественным микробным сообществом.
4. Определение «красной черты» - пороговой интенсивности того или иного воздействия, приводящего к необратимому нарушению системы для конкретного местообитания, и связанный с этим пересмотр существующей концепции экологических стандартов и системы ПДК. Переход от общих универсальных - к локальным ПДК, получаемых экспериментальным путем непосредственно для каждого местообитания и загрязнителя).
Поставленные цели достигаются использованием многомерных параметров функционирования микробных сообществ исследуемых местообитаний - спектров потребления этими сообществами органических субстратов. Используемые параметры складываются из специфичных элементарных признаков, что определяет высокую разрешающую способность и, вместе с тем, помехоустойчивость данного способа. Анализ данных при помощи адекватных методов снижения их размерности и классификации позволяет решать задачи дифференциальной диагностики и оценки качества природных и искусственных экосистем по результатам сравнения с эталоном нормы, либо по абсолютным информационно-энтропийным показателям ранговых распределений спектра потребления субстратов микробного сообщества, что более удобно в практике. Для получения необходимой информации (спектров потребления субстратов, СПС) создан программно-аппаратный комплекс, включающий планшеты с набором тест-субстратов, компьютеризованную систему считывания и анализа получаемой информации «Эко-Лог», а также соответствующие методические алгоритмы отбора и анализа проб из объектов окружающей среды.
Оптимальный количественный мониторинг «здоровья» природных местообитаний достигаются использованием технологии «Эко-Лог» с обработкой полученных спектров потребления субстратов на основе концепции биоразнообразия, с анализом данных в рамках специальных моделей ранговых распределений.
Способ мультисубстратного тестирования
Способ мультисубстратного тестирования микробных сообществ осуществляли следующим образом (методика проведения анализа почв соответствует свидетельству об аттестации МВИ №13-06 «Методика выполнения измерений интенсивности потребления тест-субстратов микробным сообществом почв и почвоподобных объектов фотометрическим методом»).
Пробы почвы отбираются почвенным микробуром, из расчета 10 субпроб с 1 м2. Образец для МСТ должен быть представлен репрезентативной смешанной почвенной пробой. Для этого с помощью карманного почвенного бура отбирают случайным образом 10 проб объемом 1 см3 с 1 м2 и получают рандомизированную пробу, из которой для анализа берется 1 г почвы. Образцы до анализа могут храниться 3 мес в холодильнике, в состоянии естественной влажности или в воздушно-сухом состоянии. Однако при этом образцы контрольной и сравниваемой с ней групп должны перед анализом храниться в одинаковых условиях и одно и то же время. Оптимальным является анализ свежеотобранных образцов
В стаканчик с навеской почвы помещают 100 мл фосфатного буфера (рН 6,5). После этого содержимое стаканчика обрабатывается ультразвуком (УЗДН-1, 22 кГц, 0,04 А, 30 секунд). Столь же эффективной является, по нашим данным, предварительная подготовка на лабораторном встряхивателе типа «ВОРТЭКС» (3400 об/мин, 1.5 мин). Затем следует отобрать из полученной суспензии около 40 мл в центрифужные пробирки и отцентрифугировать (ЦУМ-8, 2000 об/мин, 2 минуты).
Отобрать 20 мл супернатанта в кювету дозатора (или крышку чашки Петри) и добавить 2 мл раствора ТТБ. Тщательно перемешать полученную суспензию покачиванием кюветы и 2-3 циклами «набор-выливание» многоканальным дозатором типа ППМ-8.
Раскапать в чашку «Эко-Лог», содержащую набор тест-субстратов (см. таблицу), содержимое кюветы дозатором ППМ-8 с одноразовыми сменными наконечниками, установленным на розлив 200 мкл. После раскапывания образца заполненную чашку накрыть крышкой и инкубировать в термостате при t=+28°С.
Планшеты с суспензиями инкубируют до появления визуально регистрируемой окраски ячеек от 12 до 72 часов, в зависимости от особенностей образца и целей исследования. В течение инкубационного периода происходит развитие микроорганизмов в ячейках с восстановлением трифенилтетразолия в формазан, придающий среде в ячейке красное окрашивание. Концентрация формазана и обусловленная им оптическая плотность ячейки определяются обилием и активностью микроорганизмов. Массив данных фотометрического измерения значений оптической плотности по всем ячейкам (всем субстратам) представляет собой спектр потребления субстратов (СПС) для данного почвенного микробного комплекса.
После окончания инкубации осуществляется регистрация данных МСТ программно-аппаратным комплексом «Эко-Лог» (фиг.1).
Считывание происходит автоматически и не требует квалифицированного персонала. Оптическая плотность ячеек чашки измеряется с использованием чашечного спектрофотометра (анализатора иммуноферментных реакций «Униплан») или слайдсканера (в зависимости от модификации ПО) диапазоне 510 нм, считывается и сохраняется программой «Эко-Лог» в виде файла базы данных формата mdb. При этом интенсивность потребления субстратов (окраска каждой ячейки) представлена значением в диапазоне от 0 до 3000. Сохраняется также название образца, его порядковый номер и время измерения. При анализе СПС программное обеспечение «Эко-Лог» автоматически вычисляет параметры биоразнообразия и коэффициенты ранговых распределений спектров потребления субстратов.
Суть этого, достаточно широко используемого в экологии и других науках, подхода заключается в том, что параметры системы, ранжированные по интенсивности проявления тех или иных свойств от большего к меньшему, аппроксимируются кривыми модельных уравнений, коэффициенты которых являются информационными (биоразнообразие) или энергетическими (своеобразный термометр системы) характеристиками системы (Пузаченко Ю.Г. Методологические основы географического прогноза и охраны среды. М.: изд-во УРАО, 1998. - 212 с.). Сравнение этих индексов позволяет ранжировать системы по степени их стабильности и сложности вне зависимости от их типа и генезиса.
Коэффициенты ранговых распределений абсолютны, т.е. позволяют сравнивать разные, семантически непохожие друг на друга системы. Использование в МСТ классического (лингвистика) распределения Ципфа f(n)=kBn не всегда приводило к удовлетворительному описанию микробных сообществ. Поэтому нами была составлена оригинальная трехпараметрическая модель рангового распределения потребления субстратов почвенным микробным сообществом почв (фиг.2):
, где n=ln(N), N - номер ранга; F(n)=ln(yN);
yN - интенсивность потребления субстрата ранга N; е - основание натурального логарифма; Е0, b, d - параметры. В интересующей нас области значений (положительные значения n и F(n)) параметры модели могут трактоваться следующим образом. Е0 описывает запас энергии системы (среднее потребление субстратов), d - крутизна хвоста распределения (адаптационный индекс-критерий гибкости и устойчивости системы), b - в интересующем нас месте координатной плоскости - ширина плато, описывающая информационное разнообразие распределения: отношение стационарной (старшие ранги-доминанты) и динамической частей системы (младшие ранги, редкие классы) или же с позиций кинетики - отношение быстрых/медленных функциональных компонентов.
В изученных нами микробных системах наиболее информативным оказался коэффициент d, отражающий стабильность сообщества. Варьируя в изученных нами природных и модельных системах от 0.01 до 1.7, он позволяет оценить благополучие и стабильность микробных сообществ. На основании экспериментов можно ввести следующую шкалу: в благополучных избыточных системах, имеющих максимальный запас прочности, d принимает значения от 0.01 до 0.1; в устойчивых стабильных системах от 0.1 до 0.4; системам с истощенными ресурсами или находящимся под обратимым воздействием какого-либо нарушающего фактора характерны значения d от 0.4 до 0.8; кризисным дестабилизированным системам соответствуют значения 0.8-1; значения >1 характерны для необратимо нарушенных систем, потерявших исходную функциональную целостность. Ранее в экологии трехпараметрические модели ранговых распределений не применялись. Находится и мера отклонения реального распределения от модельного (энтропия Кульбака),
HK=-Σpi(logpi/hi),
где pi - вероятность i-го класса для реального распределения, hi - для равновесного, которая является также мерой неравновесности системы. Вычисляется так же массив параметров функционального биоразнообразия, наиболее употребительными из которых являются число потребленных субстратов, общая Н=-Σpi(logpi) и удельная (R=Н/logК) энтропии (Индекс Шеннона и выравненнность в экологии), количество потребленных субстратов, средняя интенсивность потребления субстратов, трактуемая как удельная метаболическая работа сообщества.
Для качественной идентификации типа системы проводится кластерный анализ (квадрат Эвклидова расстояния - кластеризация по Варду) для поиска наиболее близкого эталона. При необходимости вычисления интенсивности известного воздействия используют нейросетевые модели связи интенсивности потребления субстратов и силы воздействия, построенные в процессе предварительных модельных экспериментов.
ПРИМЕР 1. Оценка функционального биоразнообразия для микробиологического мониторинга загрязнения почвы синтетическими моющими средствами (CMC).
В работе использовались образцы дерново-подзолистой почвы (Московская область), отобранные из гумусового горизонта. Почва была освобождена от крупных растительных остатков и просеяна через сито диаметром 5 мм, высушена до воздушно-сухого состояния. В качестве загрязняющего вещества использовалось порошкообразное CMC - «Порошок обычный». Почвенные навески массой 120 г увлажнялись до 30% растворами CMC в следующих концентрациях: 0,0008, 0,004, 0,01, 0,02, 0,05 и 0,1 г/г почвы и инкубировались в полиэтиленовых контейнерах при постоянной влажности и комнатной температуре в течение 8 суток. Контролем служила почва без внесения CMC. Было проведено МСТ согласно вышеописанной процедуре.
Обработка результатов МСТ проводилась в несколько этапов - от простого к сложному.
На начальной стадии оценивалось количество потребленных субстратов и интенсивность их потребления. Резкое снижение анализируемых показателей наблюдается для концентраций 0,05 и 0,1 г/г почвы, которые наиболее негативно повлияли на сообщество. Токсичность здесь настолько велика, что выживают лишь микроорганизмы, наиболее резистентные к данному уровню воздействия. Компенсационные процессы практически отсутствуют. Контрольный образец также характеризуется довольно низкими значениями исследуемых показателей; это объясняется малым количеством активных микроорганизмов, вследствие недостаточного количества источников углерода и энергии в исследуемой почве (инкубация происходила без добавления глюкозы или других питательных субстратов). Концентрация 0,0008 г/г вызвала некоторую стимуляцию развития сообщества. Резкий рост биоразнообразия мы видим при концентрациях 0,004-0,02 г/г почвы; это свидетельствует о том, что содержащиеся в почве ПАВ выступают в роли субстрата, запускают сукцессию и вызывают бурное развитие популяций, способных использовать их в качестве источников углерода. Концентрация 0,02 г/г, по всей видимости, не оказывают сильного токсичного действия на естественное микробное сообщество и позволяют развиваться популяциям-деструкторам. Происходит функциональная перестройка сообщества с целью разложения ПАВ, входящих в состав CMC.
К аналогичным выводам мы приходим и на основании результатов кластерного анализа. С его помощью мы классифицировали состояния микробного сообщества при различных уровнях нагрузки. Образцы оказались сгруппированы в три крупных кластера: группа образцов в диапазоне концентраций 0,01-0,02 г/г почвы, представляющих сообщество с активным потреблением ПАВ, группа, включающая контрольный образец и концентрации 0,0008 и 0.04, группа экстремальных концентраций 0,05-0,1 г/г почвы, что соответствует существованию трех функционально-различных систем. Взаимное сходство между группой образцов с экстремальной концентрацией загрязняющего вещества и контрольными вариантами объясняется ингибирующим действием этих концентраций, «прореживающих» контрольный спектр, но не добавляющих новых компонентов, как в вариантах с низкими концентрациями. Объединяя все результаты анализа данных, выделяем два уровня воздействия поллютанта, вызывающих качественную перестройку микробной системы: 0,004 и 0,05 г/г почвы. Вторая критическая концентрация, однако, вызывает более сильные изменения, так как практически полностью подавляет протекание компенсационных процессов. Снятие данной нагрузки вряд ли уже позволит системе вернуться в исходное состояние.
Отметим, что подходы, использованные на начальных этапах обработки полученных данных (общая характеристика спектров, кластерный анализ), не являются достаточными при проведении мониторинга, так как на их основе невозможно определить универсальный критерий для оценки предельно допустимого уровня внешнего воздействия.
Метод ранговых распределений позволил нам с помощью МСТ количественно оценить изменения, произошедшие в микробной системе под воздействием поллютанта, и определить абсолютную величину предельного уровня воздействия CMC. Метод ранговых распределений для МСТ не применялся, однако вполне успешно применяется в общей экологии (Левич А.П. Структура экологических сообществ. М., МГУ, 1980, 181 с.). В основе метода - следствия гипотезы равновесия, связанной с теорией термостатики и неравновесной термодинамики. Допустим, имеется множество элементов N некоторой природной системы и пространство свойств m (g1, g2, ..., gm). Множество N в пространстве свойств m отображается в классы К (1, 2, ..., i...k) с числом элементов в классе Ni и вероятностью попадания элемента в соответствующий класс рi=Ni/N, Σpi=1. Разбиение по рангам может быть осуществлено различными способами. Если подразумевается, что члены нашего множества взаимодействуют друг с другом, (в частности возникают их устойчивые комбинации), то это равноценно тому, что они осуществляют самоклассификацию, пробегая все i возможных классов разбиения. Под разнообразием же понимается множество различимых состояний или классов природного объекта (системы), отображающее возможные взаимодействия между его элементами. Оценкой разнообразия является энтропия H=-Σpi(logpi). Описывается ранговое распределение модельными кривыми, обычно это нелинейные функции, которые используют два параметра. Из них один - это крутизна распределения (LP=-Σlogp(i)) показывает информативность системы (минимальная информативность системы будет в том случае, когда все классы содержат одинаковое количество элементов, т.е. когда потеряны редкие классы). Второй параметр - энергия системы (E=Σp(i)i). На основании определенных теоретических представлений выводится модель равновесного рангового распределения. Для равновесного состояния принимается, что производные по любой переменной равны нулю, как и производные, отражающие переход элементов из одного класса в другой. Разнообразие (энтропия) равновесной системы, крутизна и энергия равновесного распределения должны быть максимальны. Для того же, чтобы оценить степень неравновесности реальной исследуемой системы, нужно сравнить реальное распределение с равновесным и измерить степень отклонения. Мерой сравнения может служить энтропия Кульбака:
HK=-Σpi(logpi/hi),
где pi - вероятность i-го класса для реального распределения, hi - для равновесного, либо χ2=NΣ((hi-pi)/pi). Кроме этих параметров можно рассмотреть выравненность системы (R=H/logK) - при равном числе элементов равна 1, резкое снижение данного показателя свидетельствует о выраженном доминировании некоторых классов. Все эти показатели позволяют охарактеризовать состояние системы, включая определение универсальной оценки предельного уровня воздействия. При значении параметра, отражающего крутизну распределения, равном единице, распределение трансформируется в прямую линию, а прежняя система фактически прекращает свое существование.
Существует несколько канонических форм ранговых распределений. В нашей работе было использовано оригинальное ранговое распределение, адаптированное для анализа данных МСТ: проводя МСТ, мы получаем ранговое распределение элементов исследуемого микробного сообщества по интенсивностям потребления 47-ми различных субстратов. Уравнение, описывающее распределение у=у0+(-В)·еx·D(-x), где у0 - константа. В и D - параметры распределения отражающие энергию системы и крутизну распределения, соответственно. Значение D=1, будем считать критическим (см. вышеописанное). Исследуя динамику значений этого и других параметров функционального разнообразия при различных уровнях воздействия, мы смогли определить предельно допустимую для функционирования микробного сообщества концентрацию CMC.
Наибольшие значения коэфициэнта D, позволяющие оценить нестабильность системы, а следовательно, и наибольшее отклонение от равновесности системы, вызвали концентрации 0,05 и 0,1 г/г почвы. Микробное сообщество контрольного образца, вследствие специфичного времени отбора проб, тоже достаточно далеко от равновесного. Наибольшее стабилизирующее действие наблюдается для концентрации 0,0008 г/г.
Образцы с концентрациями 0,004-0,02 г/г почвы занимают некоторое промежуточное состояние.
ПРИМЕР 2. Микробиологическое картирование почв
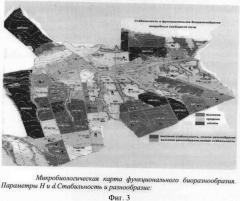
Эффективность метода МСТ показана на примере получения микробиологической карты для сельскохозяйственной практики. Нами была составлена для ЗАО "Красненское" (Белгородская обл.) микробиологическая карта почв этого хозяйства. По всей видимости, такой подход реализован впервые. С изучаемых полей были отобраны смешанные пробы и проведено МСТ и рассчитаны параметры биоразнообразия согласно вышеописанной процедуре.
На карте-схеме в пределах почвы одного типа представлены показатели «здоровья» микробных сообществ, их биоразнообразие Н (Индекс Шеннона) и показатель стабильности (коэффициент d рангового распределения). Вся область значения этих параметров для исследованных территорий разбивалась на 3 части - область высоких, низких и средних значений. Для каждого сочетания указанных значений вводился на карте свой цветовой код: например высокая стабильность и высокое разнообразие - зеленый, низкая стабильность и низкое разнообразие - красный, высокая стабильность и низкое разнообразие - синий, и т.д. (фиг.3). Представленные данные позволили провести бонитировку земель хозяйства, обозначить неблагополучные территории, нуждающиеся в агромелиоративных мероприятиях, подтвердить изменения в функциональных спектрах почвенных микробных сообществ после применения комплексных микробных удобрений. Кроме того, эта информация является базовой для планируемого долгосрочного мониторинга почв хозяйства, ориентированного на получение экологически чистой продукции.
ПРИМЕР 3. Функциональный мониторинг микробных сообществ почв, загрязненных керосином.
Нами была проведена оценка возможностей применения метода мультисубстратного тестирования для характеристики изменений почвенных микробных сообществ, нарушенных керосином. Для исследования загрязнения почвы керосином использовались образцы окультуренной дерново-подзолистой почвы (Московская обл.), отобранные из гумусного горизонта. Почва была высушена до воздушно-сухого состояния, освобождена от крупных растительных остатков и просеяна через сито диаметром 5 мм. В качестве поллютанта использовали керосин осветительный КО - 25 (ГОСТ ТУ 38.401-58-10-90; плотность - 0,805 г/см3).
Мониторинг загрязнений керосином проводили в модельных экспериментах. Навески массой 300 г увлажняли до 30% от массы воздушно-сухой почвы водными эмульсиями керосина и инкубировали в полиэтиленовых контейнерах при постоянной влажности и комнатной температуре в течение 25 суток. Исследуемые концентрации керосина - 1, 2, 5 и 10 мл/100 г почвы (каждый вариант в двух повторностях). Контролем служила почва без внесения поллютанта. На 7-е, 14-е, и 25-е сутки отбирали средние пробы и проводили МСТ согласно вышеописанной процедуре.
На основании СПС микробных сообществ почвы при разных уровнях нагрузки и на разных этапах инициированной сукцессии были рассчитаны показатели и индексы функционального разнообразия, проведен кластерный анализ. Анализ расположения исследуемых образцов в пространстве параметров ранговых распределений позволяет сделать заключение о том, что внесение керосина приводит к увеличению числа редких классов и повышает метаболическую работу сообщества. Это, без сомнения, свидетельствует о расширении адаптационных возможностей микробного сообщества и свидетельствует об интенсификации биоремедиационных процессов, направленных на компенсацию внешнего воздействия (известно, что наличие именно «редких» классов обеспечивает высокие адаптационные способности почвенного сообщества микроорганизмов). Максимальные значения параметров на 7, 14 и 25 сутки инкубирования приходятся на варианты с концентрациями 2, 5, 5 мл/100 г почвы соответственно. При этом на 25 сутки разница между контролем и вариантами 1 и 2 мл/100 г почвы практически нивелируется. Подобные выводы можно сделать и при анализе параметров биоразнообразия.
Проведенный кластерный анализ позволил дополнительно классифицировать микробные сообщества почвы с различными уровнями нагрузки. На полученных дендрограммах выделяется два функционально различных кластера: увеличение концентрации керосина до 5 мл/100 г почвы не вызывает серьезных качественных изменений в сообществе загрязненной почвы по сравнению с контролем и соответствует некоторому оптимальному интервалу существования сообщества, адаптированного к деструкции углеводородов.
Дальнейшее увеличение нагрузки вызывает более серьезные изменения и приводит к формированию качественно иного по функциональным характеристикам сообщества, не исключая, тем не менее, протекания деструкционных процессов. Суммируя анализ исследованных показателей, можно прогнозировать снижение концентрации керосина в почве и восстановление исходной структуры микробного сообщества вероятно на всем исследуемом диапазоне концентраций. При этом максимальный темп восстановления ожидается в диапазоне концентраций 1-5 мл/100 г почвы; дальнейшее увеличение нагрузки снижает темпы ремедиации. Это согласуется с имеющимися в литературе сведениями о способности самоочищения почв от керосина даже в случае достаточно высоких концентраций (до 60% и более).
ПРИМЕР 4. Оценка эффективности деструкции нефтесодержащих отходов цианобактериальным комплексом.
Для постановки эксперимента в лабораторных условиях использовали образцы почв, отобранные в местах складирования нефтесодержащих отходов Астраханского газоперерабатывающего завода (АГПЗ). Исходное содержание суммарных нефтепродуктов в отобранных для постановки эксперимента почвенных образцах, содержащих нефтешлам, составило 17,4%. Стандартная процедура биотестирования с использованием сценедесмус позволила отнести данные образцы к 4-5-му классу опасности.
Экспериментальные системы представлены четырьмя стеклянными цилиндрами с нефтезагрязненной почвой (мощность почвенного профиля 15 см). Три варианта инокулированы сухой биомассой циано-бактериального сообщества (10 г на 1 кг почвы). Сухая биомасса была получена путем естественного высушивания и измельчена до величины частиц не более 0,5 мм. Модельные экосистемы нефтезагрязненной почвы с целью определения оптимального варианта использования циано-бактериального сообщества выдерживали в следующих условиях: 1 - переизбыточное увлажнение (затопление); 2 - рыхление (культивация); 3 - внесение азотно-фосфорно-калийных удобрений (биогены). Нефтезагрязненная почва без внесения циано-бактериального сообщества и применения дополнительных агротехнических мероприятий выступала в качестве контрольного варианта деструкции нефтепродуктов (загрязнение). В качестве эталона сравнения по окончании экспериментальных работ использовали почву, отобранную на территории АГПЗ и не подверженную прямому загрязнению нефтесодержащими отходами (контроль). Наблюдение за модельными экосистемами продолжалось 18 месяцев.
Степень репарации микробных сообществ почвы под воздействием циано-бактериального сообщества и комплекса дополнительных агротехнических приемов оценивали методом мультисубстратного тестирования (МСТ) с помощью автоматизированной системы микробиологического мониторинга «Эко-Лог» и биотестирования с использованием в качестве тест-организмов дафний и сценедесмус. Полученный массив данных исследовался методами многомерной статистики. Массив данных был разделен на группы путем кластерного анализа (квадрат эвклидова расстояния, кластеризация по Варду). Проведена оценка индексов функционального биоразнообразия и индексов стабильности микробных системы на основе анализа ранговых распределений.
Анализ функциональной структуры микробных сообществ изученных модельных экосистем по окончании экспозиции методом кластерного анализа позволяет выделить две группы. Одна группа объединяет в себя образцы контрольной почвы и вариант с добавлением биогенов. Другая группа включает вариант загрязненной нефтепродуктами модельной системы и остальные варианты ремедиации. Таким образом, мы сталкиваемся с двумя качественно непохожими друг на друга классами систем - нормальной почвенной системой и загрязненной.
Анализ параметров стабильности системы и запаса энергии системы, вытекающих из оценки ранговых распределений, позволяет соотнести образцы исследуемых почв. Очевидно, что образцы с максимальным запасом энергии и максимальной стабильностью будут наиболее благополучными. Таким параметрам удовлетворяет вариант контроля. Он характеризуется также максимальной выравненностью и высоким биоразнообразием. Концентрация остаточных углеводородов в нем составляет 6,0%. Осуществление процедуры биотестирования позволило отнести данную пробу к 5-му классу опасности. Высокой стабильностью, хотя и меньшим запасом энергии системы обладает также и вариант нефтезагрязненной почвы по окончании экспозиции. Концентрация остаточных углеводородов в нем составляет 6,9%, 5-й класс опасности. Отмечается некоторое повышение биоразнообразия сообщества и снижение его выровненности. Это кажущееся противоречие легко объяснимо, если принять во внимание тот факт, что загрязнение