Способ определения количественного содержания фосфатидилхолина в фосфолипидных комплексах
Иллюстрации
Показать всеИзобретение относится к области анализа материалов и может быть использовано для определения количественного содержания фосфатидилхолина в фосфолипидных комплексах при проведении аналитических и научно-исследовательских работ. Способ заключается в том, что фосфолипидный комплекс, полученный из исследуемых объектов, сушат под вакуумом, затем растворяют в хлороформе, наносят пробы хлороформного раствора фосфолипидов на пропитанную цитратным буферным раствором хроматографическую бумагу, проводят зональный высоковольтный электрофорез при 600 В в течение 60 мин, после завершения электрофореза бумагу высушивают, высушенные полоски обрабатывают 5%-ным раствором фосфорномолибденовой кислоты в этаноле, сушат при комнатной температуре, измеряют длину электрофоретического пробега фосфатидилхолина и определяют количественное содержание фосфатидилхолина с помощью градуировочного графика, полученного для стандартного раствора фосфатидилхолина в координатах содержание фосфатидилхолина (мг/см3) - значение длины его электрофоретического пробега (мм). Изобретение позволяет упростить способ, повысить точность определения и снизить материальные затраты при определении количественного содержания фосфатидилхолина в фосфолипидных комплексах. 2 ил.
Реферат
Изобретение относится к области анализа материалов с помощью электрических средств, а именно путем электрофореза, и может быть использовано для определения количественного содержания фосфатидилхолина в фосфолипидных комплексах, полученных из животных, пищевых или растительных объектов, при проведении аналитических и научно-исследовательских работ.
Известны способы определения фосфолипидного состава липидной смеси с помощью хроматографических методов. Эти способы включают в себя экстракцию липидной смеси из пищевых, растительных или животных объектов, хроматографическое разделение липидной смеси на отдельные фракции и детектирование хроматографических зон специфическими реагентами. Виды используемого хроматографического разделения различны, чаще всего используется метод тонкослойной хроматографии и хроматографии на колонках. Также варьируют используемые реагенты.
Эти способы направлены на получение сведений преимущественно о качественном составе фосфолипидной компоненты в анализируемой липидной смеси. Для интерпретации количественных результатов хроматографического разделения требуется проведение дополнительных методов анализа, например, фотоколориметрии, денситометрии, ферментативных методов, проведения специфических качественных реакций, взвешивания элюатов, что обуславливает наличие целого ряда операций предварительной подготовки пробы для дальнейшего количественного обнаружения, и, как следствие этого, увеличивается ошибка количественного определения. Кроме того, это значительно увеличивает время количественного анализа, количество используемого оборудования и реагентов, стоимость проведения анализа.
Известен способ определения содержания фосфолипидов в сливочном масле, предусматривающий извлечение фосфолипидов, тонкослойную хроматографию выделенных фосфолипидов, проявление хроматограмм, а для определения содержания суммы и отдельных фракций фосфолипидов проводят фотоденситометрирование (а.с. СССР №567133, МПК G01N 33/04, 1977). Известен способ определения содержания фосфолипидов в растительном масле, включающий подготовку образца, построение калибровочной кривой в координатах содержание фосфолипидов (%) - значение электропроводности, определение значения электропроводности образца и осуществление расчета по формуле, исходя из данных калибровочной кривой (патент РФ №2170428, МПК 7 G01N 33/03, 2001).
Всем этим способам присущи вышеуказанные недостатки.
Наиболее распространенным биологически активным фосфолипидом является фосфатидилхолин (ФХ). Уникальные поверхностно-активные свойства ФХ позволяют при приеме содержащих его препаратов восстановить разрушенные участки мембран и, таким образом, предотвратить развитие структурных патологий клеток. Поскольку данный фосфолипид обладает гепатопротекторным действием, клетки печени быстро восстанавливают утраченные функции. В настоящее время существует много препаратов, содержащих фосфатидилхолин («Lezithin» фирмы Multipower, «ЛИВОЛИН-ФОРТЕ» компании «Медикап», «Эссенциале» фирмы Рон-Пуленк Рорер, «Фосфоглиф», Россия).
Задачей изобретения является создание экспрессного способа определения количественного содержания индивидуального фосфолипида - фосфатидилхолина - в фосфолипидных комплексах, полученных из растительных, пищевых и животных объектов.
Технический результат заключается в упрощении способа, повышении точности определения и снижении материальных затрат при определении количественного содержания фосфатидилхолина.
Технический результат достигается тем, что способ определения количественного содержания фосфатидилхолина в фосфолипидных комплексах заключается в том, что фосфолипидный комплекс, полученный из исследуемых объектов, сушат при 30-35°С под вакуумом, затем растворяют в хлороформе до 1% концентрации, наносят пробы хлороформного раствора фосфолипидов на пропитанную цитратным буферным раствором хроматографическую бумагу в объеме 1-2 мкл, проводят зональный высоковольтный электрофорез при 600 В в течение 60 мин, после завершения электрофореза бумагу высушивают при 110°С в течение 20-30 минут, высушенные полоски обрабатывают 5%-ным раствором фосфорномолибденовой кислоты в этаноле, сушат при комнатной температуре, измеряют длину электрофоретического пробега фосфатидилхолина и определяют количественное содержание фосфатидилхолина с помощью градуировочного графика, полученного для стандартного раствора фосфатидилхолина в координатах содержание фосфатидилхолина (мг/см3) - значение длины его электрофоретического пробега (мм).
Зональный высоковольтный электрофорез проводится в цитратном буферном растворе, приготовленном согласно стандартной прописи: 1 л дистиллированной воды + 17,5 г лимонной кислоты + 8,2 г NaOH.
Предлагаемый способ определения количественного содержания ФХ в фосфолипидных комплексах позволяет значительно упростить процесс анализа, сократить время его проведения.
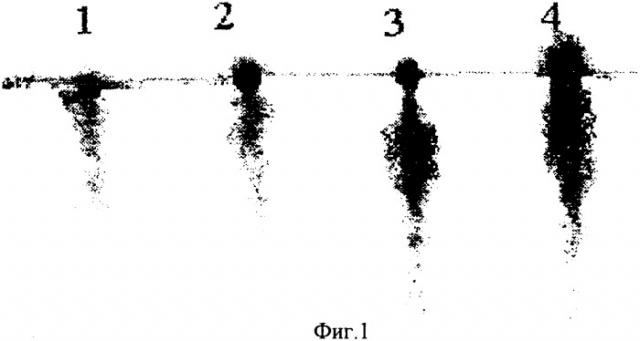
На фиг.1 представлена электрофореграмма стандартных растворов ФХ (в цитратном буферном растворе, реагент-обнаружитель - 5%-ный раствор фосфорномолибденовой кислоты в этаноле) с концентрациями:
1) 39,38 мг/см3;
2) 58,08 мг/см3;
3) 78,76 мг/см3;
4) 98,72 мг/см3.
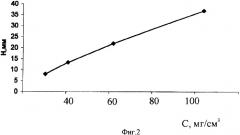
На фиг.2 представлен градуировочный график для определения ФХ в нитратном буферном растворе, построенный на основе экспериментальных данных при использовании стандартных растворов ФХ, а в качестве реагента-обнаружителя - 5%-ного раствора фосфорномолибденовой кислоты в этаноле (Н - высота электрофоретической зоны).
Отработку предлагаемого способа проводили на стандартных растворах фосфолипидов фирм «Sigma», «ICN Biomedical» в хлороформе. При этом использовались различные буферные растворы, агенты-обнаружители, объемы наносимых проб стандартных растворов фосфолипидов, время экспонирования и напряжение. Было установлено, что:
1. Объем наносимой пробы стандартных хлороформных растворов фосфолипидов существенно влияет на процесс разделения и качество электрофоретических зон. Большое количество наносимой пробы значительно ухудшает картину разделения, и основная масса фосфолипидов остается на старте. Поэтому нами экспериментально были установлены оптимальные объемы наносимых проб хлороформного раствора ФХ, так как его количество в любом фосфолипидном комплексе доминирует, которые составили 1-2 мкл.
2. При использовании в качестве проводящей жидкости цитратного буферного раствора (приготовленного согласно стандартной прописи) достигалось наилучшее разделение и качество электрофоретических зон.
3. Наиболее предпочтительной явилась хроматографическая бумага ГОСТ 10395-63 и плотностью 85. При выборе марки хроматографической бумаги руководствовались тем обстоятельством, что разные марки бумаги обладают неодинаковой впитывающей способностью, что определяет ее электропроводимость во влажном состоянии. В нашем случае наиболее предпочтительной являлась хроматографическая бумага с наибольшей впитывающей способностью, а значит и электропроводимостью во влажном состоянии. Исходя из этих соображений, была выбрана хроматографическая бумага вышеуказанного ГОСТа и плотности.
4. Время экспонирования и оптимальное напряжение устанавливались экспериментально - они составили в случае использования цитратного буферного раствора соответственно 60 мин и 600 В.
5. В нитратном буферном растворе электрофореграмма ФХ имеет вид «свечей», а высота таких свечей линейно зависит от концентрации ФХ в области 30-100 мг/см3. Этот факт был использован для построения градуировочного графика в координатах содержание фосфатидилхолина (мг/см3) - значение длины его электрофоретического пробега (мм).
Предложенный способ реализуется следующим образом.
На хроматографическую бумагу размером 25×10 см в центре наносили стартовую линию и смачивали цитратным буферным раствором всю поверхность бумаги, за исключением полоски размером 1,5 см с обеих сторон от стартовой линии (для предотвращения размывания анализируемой пробы).
Фосфолипидный комплекс, полученный из пищевых, животных или растительных объектов, и предполагаемый для определения, сушили в чашке Петри под вакуумом при температуре 30-35°С, затем растворяли в хлороформе до 1%-ной концентрации.
Подготовленный таким образом хлороформный раствор фосфолипидов наносили микрошприцем МШ-10 (Россия) на стартовую линию на расстояние не менее 1 см от края бумаги. Объем наносимых проб составлял 1 и 2 мкл, расстояние между ними - не менее 2,5 см друг от друга. Бумагу подсушивали и помещали на электрофоретический столик таким образом, чтобы концы бумаги были погружены на 1 см в кюветы с цитратным буферным раствором. Для предотвращения чрезмерного испарения цитратного буферного раствора, которое может привести к снижению его концентрации и изменению величины рН, всю систему помещали в закрытую камеру и проводили электрофорез. Электродные кюветы заполняли цитратным буферным раствором и соединяли кюветы полосками хроматографической бумаги.
Электрофорез проводили при напряжении 600 В в течение 60 мин.
После завершения электрофоретического процесса бумагу переносили в термостат и высушивали при температуре 110°С в течение 20-30 мин.
Детектирование электрофоретических зон после разделения проводили следующим образом. Высушенные полоски бумаги помещали в сухие кюветы и обрабатывали 5%-ным раствором ФМК. Затем полоски бумаги вывешивали на раму и сушили при комнатной температуре. На электрофореграмме измеряли длину электрофоретического пробега ФХ - «свечи» - и, используя предварительно построенный градуировочный график, определяли количественное содержание ФХ в исследуемом фосфолипидном комплексе.
Пример.
0,05-0,07 г фосфолипидного комплекса, полученного из масла семян амаранта, переносили количественно в мерную колбу вместимостью 25 мл и доводили объем раствора до метки хлороформом. Получали хлороформный раствор исследуемых фосфолипидов с концентрацией 2-3 мг/см3.
Точную навеску стандартного ФХ фирмы «Сигма» массой 2 г помещали в химический стакан вместимостью 50 мл, добавляли 10 мл хлороформа и перемешивали до полного растворения ФХ. Затем содержимое стакана количественно переносили в мерную колбу вместимостью 25 мл и доводили до метки хлороформом. В результате получали стандартный раствор ФХ с концентрацией 80 мг/см3. Затем путем последовательного разведения готовили серию стандартных растворов ФХ с концентрациями 60, 40 и 20 мг/см3.
На стартовую линию хроматографической бумаги размером 25×10 см наносили при помощи микрошприца по 2 мкл исследуемого хлороформного раствора ФХ и по 2 мкл стандартных растворов ФХ с концентрацией 20, 40, 60 и 80 мг/см3. Проводили электрофоретическое разделение при 600 В в цитратном буферном растворе. Детектирование электрофоретических зон проводили 5%-ным раствором фосфорномолибденовой кислоты в этаноле. Затем строили градуировочный график на основе полученных экспериментальных данных при использовании стандартных растворов ФХ и рассчитывали с его помощью искомое содержание ФХ в исследуемом фосфолипидном комплексе.
Способ определения количественного содержания фосфатидилхолина в фосфолипидных комплексах, заключающийся в том, что фосфолипидный комплекс, полученный из исследуемых объектов, сушат при 30-35°С под вакуумом, затем растворяют в хлороформе до 1% концентрации, наносят пробы хлороформного раствора фосфолипидов на пропитанную цитратным буферным раствором хроматографическую бумагу в объеме 1-2 мкл, проводят зональный высоковольтный электрофорез при 600 В в течение 60 мин, после завершения электрофореза бумагу высушивают при 110°С в течение 20-30 мин, высушенные полоски обрабатывают 5%-ным раствором фосфорномолибденовой кислоты в этаноле, сушат при комнатной температуре, измеряют длину электрофоретического пробега фосфатидилхолина и определяют количественное содержание фосфатидилхолина с помощью градуировочного графика, полученного для стандартного раствора фосфатидилхолина в координатах содержание фосфатидилхолина (мг/см3) - значение длины его электрофоретического побега (мм).