Альфа-аминоамидные производные, применимые в качестве антимигренозных средств
Иллюстрации
Показать всеИзобретение относится к области медицины и фармакологии, касается применения альфа-аминоамидов формулы (1) для изготовления лекарственного средства для лечения состояний головной боли, включающих механизм расширения сосудов мозга, и способа лечения указанных состояний, характеризующегося высокой эффективностью и отсутствием побочных эффектов. 2 н. и 11 з.п. ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к α-аминоамидным производным, применимым в качестве антимигренозных средств; в частности, настоящее изобретение относится к применению α-аминоамидных производных при изготовлении лекарственного средства для лечения головной боли, в частности таких ее видов, как мигрень, кластерная головная боль или другие сильные головные боли.
Международная классификация головной боли подразделяет состояния головной боли на две основные категории: первичные и вторичные головные боли.
Первичные головные боли включают, например, мигрень, головную боль, головную боль напряжения и кластерную головную боль.
Вторичные головные боли являются в основном следствием органических нарушений, таких как инфекция, нарушения обмена веществ или другое системное заболевание.
Мигренозные головные боли (их называют также просто мигренями) и кластерные головные боли являются хорошо известными медицинскими состояниями. Известная обширная информация о них содержится в таких ссылках, как "Headache in Clinical Practice" (edited by Silberstein S. et al., Oxford Univ. Press, 1998); и "Headache Disorders: A Management Guide for Practitioners", by Rapoport A. and Sheftell F. (Saunders W.B., Philadelphia, 1996). Различные определения, категории и диагностические нормативы, которые относятся к мигренозным головным болям (и к кластерным головным болям, приведенным ниже, а также к другим типам боли), определяются в соответствии со стандартизованными критериями, которые одобрены и выпущены Международным обществом по изучению головной боли (IHS) и были опубликованы в качестве дополнения к журналу Cephalalgia в 1988.
Несмотря на появление "триптановых" лекарств, которые, как известно, оказывают непосредственное воздействие на сужение кровеносных сосудов, в том числе суматриптана (применяется также для лечения кластерных головных болей), наратриптана, золмитриптана и ризатриптана, не существует достаточно безопасных, быстрых, надежных и удовлетворительных методов лечения как первичных головных болей, таких как рецидивирующие мигрени и кластерные головные боли, и вторичных головных болей, таких как головные боли, возникающие вследствие инфекции, расстройств обмена веществ и других системных заболеваний.
Проблемы и ограничения, которые сопутствуют курсам лечения, предусматривающим применение триптанов (а также другим известным методам, таким как, например, курсы лечения, включающие введение аналогов эрготамина и т.д.), могут быть следствием ряда причин; как правило, основные недостатки включают следующие: (i) пациенты с различными типами сердечных или сосудистых проблем не могут безопасно принимать триптан; (ii) значительное количество пациентов, которые повторно проходят однократный курс лечения, подвергаются значительному риску развития формы толерантности, которая может привести к повышенным хроническим и даже продолжительным головным болям; (iii) для того, чтобы облегчение достигло заметного уровня, часто требуется намного больше времени, чем полчаса; и (iv) сразу же после проведения курса лечения пациенту часто требуется полный отдых в течение нескольких часов, что делает невозможным или же затрудняет для него или для нее возможность вернуться к работе или сделать что-либо конструктивное в этот день.
В WO 98/25594 раскрывается применение 3,5-диамино-6-(2,3-дихлорфенил)-1,2,4-триазина, противосудорожного средства, известного также как ламотригин, или его фармацевтически приемлемой соли для изготовления лекарственного средства для использования в лечении и/или предупреждении мигрени.
В WO 99/26614 раскрываются замещенные 2-аминоацетамидные соединения, преимущественно α,α-дизамещенные, для лечения или ослабления боли; поскольку указанные соединения активны в качестве блокаторов натриевых каналов, то в указанном документе раскрывается также их применение для лечения ряда болезней и состояний, опосредованных притоком ионов натрия, среди которых приводится и мигрень.
Тем не менее известно, что головная боль, возникающая по нейроваскулярному механизму, не удовлетворительно отзывается на лечение с помощью аналгетиков и, наоборот, соединения, обладающие антимигренозными свойствами, такие как триптаны, не обладают общими болеутоляющими свойствами (Steiner T.J., Findley L.J., Yuen A.W.: "Lamotrigine versus placebo in the prophylaxis of migraine with and without aura", Cephalgia 1997, 17: 109-12; Saxena P.R., Den Boer M.O.: "Pharmacology of antimigraine drugs", J. Neurology 1991, 238 Suppl. 1: S28-35); таким образом, антимигренозные свойства нельзя предсказать на основании болевых моделей.
Далее, авторы изобретения обнаружили, что большинство замещенных 2-аминоацетамидных соединений, раскрытых в WO 99/26614, не являются эффективными антимигренозными средствами, а потому их пригодность для лечения мигрени и, в общем случае, болезней и состояний, опосредованных притоком ионов натрия, невозможно рационально предсказать лишь на основании того, что они являются признанными блокаторами натриевых каналов.
Если учесть, что антимигренозные свойства невозможно предсказать ни на основании болевых моделей, ни на основании блокирующей активности соединений по отношению к натриевым каналам, то сохраняется большая потребность в улучшении методов медикаментозного лечения, которые обеспечивают быстрое облегчение при первичных и вторичных головных болях, в особенности при интенсивной боли, вызываемой острой мигренью, или кластерных головных болях, и которые не сопряжены с проблемами, вызываемыми рецидивами мигрени, затяжным седативным действием, нежелательными побочными эффектами или повышенным риском для здоровья пациентов, страдающих от сердечных или сосудистых проблем.
Основным объектом настоящего изобретения является быстрый и высокоэффективный способ лечения первичных головных болей, включая мигрень, таких как головная боль напряжения, трансформированная мигрень или развивающаяся мигрень и кластерная головная боль, а также вторичных головных болей, таких как головные боли, вызываемые инфекцией, расстройством обмена веществ или другими системными заболеваниями, и других острых головных болей, при этом способы лечения обеспечивают высокоэффективное лечение практически без побочных эффектов или затяжных последствий (таких как сонливость, мышечная слабость, потеря ориентации, тошнота и т.п.), а потому позволяют пациенту быть готовым и способным сесть за руль автомобиля, работать или вести обычный активный образ жизни по прошествии не более одного часа после проведения курса лечения.
Другим объектом настоящего изобретения является способ лечения состояний хронической и/или неустранимой боли, таких как, например, невралгия тройничного лицевого нерва, хроническая пароксизмальная гемикрания и т.п., которые возникают в результате нарастания указанных выше первичных и вторичных головных болей.
Все типы рассмотренных выше головных болей, которые можно лечить в соответствии с настоящим изобретением, далее называют общим термином "состояние головной боли".
Термин "лечение" или выражение "лечение состояния", где бы в настоящем описании они ни использовались, означают подавление указанного состояния, т.е. либо его задержку, либо его облегчение, или регресс состояния, а также предупреждение его развития сразу же после того, как возникают симптомы, характерные для указанного состояния.
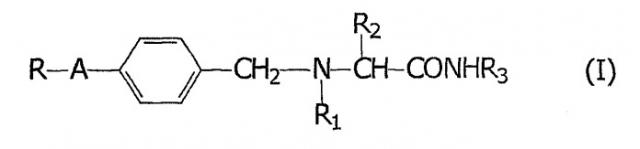
Было обнаружено, что указанные и другие объекты настоящего изобретения, которые станут очевидны после полного прочтения и понимания приведенного ниже описания, могут быть достигнуты путем применения α-аминоамидов общей формулы (I)
где
А обозначает -(CH2)m- или -(CH2)n-Х-, где m равно 1 или 2; n равно нулю, 1 или 2; а Х обозначает -О-, -S- или -NH-;
R обозначает фурильное, тиенильное или пиридильное кольцо, или фенильное кольцо, незамещенное или замещенное одним или двумя заместителями, независимо выбранными из галогена, гидроксильной, С1-С4 алкильной, С1-С3 алкоксильной и трифторметильной группы;
R1 обозначает водород или С1-С3 алкильную группу;
R2 обозначает водород или С1-С2 алкильную группу, незамещенную или замещенную гидроксильной или фенильной группой; фенильную группу, незамещенную или замещенную одним или двумя заместителями, независимо выбранными из С1-С3 алкильной группы, галогена, гидроксильной, С1-С2 алкоксильной и трифторметильной группы;
R3 обозначает водород или С1-С3 алкильную группу;
если изомеры существуют, то либо в виде индивидуального изомера, либо в виде смеси изомеров, или их фармацевтически приемлемого производного;
при изготовлении лекарственного средства для лечения состояний головной боли.
Алкильные или алкоксильные группы могут быть разветвленными группами или группами с прямой цепью. Атомом галогена преимущественно является фтор, хлор или бром, в частности фтор или хлор.
С1-С4 алкильная группа является линейной или разветвленной алкильной группой; предпочтительно метильной, этильной, пропильной, изопропильной, бутильной или трет-бутильной группой; наиболее предпочтительно она является метильной или этильной группой.
С1-С3 алкоксильная группа является линейной или разветвленной алкоксильной группой; предпочтительно метокси-группой, этокси-группой, пропокси-группой, изопропокси-группой; наиболее предпочтительно она является метокси-группой или этокси-группой.
Тиенильное кольцо представляет собой, например, 2- или 3-тиенильное кольцо.
Пиридильное кольцо представляет собой, например, 2-, или 3-, или 4-пиридильное кольцо, в частности 3-пиридильное кольцо.
Фурильное кольцо представляет собой, например, 2- или 3-фурильное кольцо.
Замещенное фенильное кольцо предпочтительно замещено одним или двумя заместителями, независимо выбранными из галогена, С1-С3 алкильной и трифторметильной группы.
С1-С2 алкильная группа, замещенная гидроксильной группой, преимущественно представляет собой гидроксиметильную или 1-гидроксиэтильную группу.
С1-С2 алкильная группа, замещенная фенильным кольцом, преимущественно представляет собой бензильную или фенэтильную группу.
Предпочтительно в приведенной выше формуле (I):
А обозначает группу, выбранную из -CH2-CH2-, -CH2-O-, -CH2-S-, -CH2-CH2-O-;
R обозначает фенильное кольцо, незамещенное или замещенное одним или двумя заместителями, независимо выбранными из галогена, С1-С3 алкильной или метоксильной группы; или тиенильную группу;
R1 обозначает водород или С1-С2 алкильную группу;
R2 обозначает водород или метильную группу, не замещенную или замещенную гидроксильной группой, или фенильную группу, не замещенную или замещенную С1-С2 алкильной группой, галогеном, гидроксильной, метоксильной и трифторметильной группой; и
R3 обозначает водород или С1-С2 алкильную группу.
Другая предпочтительная группа α-аминоамидов включает приведенные выше соединения формулы (I), где:
А обозначает -CH2-O-, -CH2-S- или -CH2-CH2-;
R обозначает фенильное кольцо, незамещенное или замещенное одним или двумя атомами галогена;
R1 обозначает водород;
R2 обозначает водород или метильную группу, незамещенную или замещенную гидроксильной группой, или фенильную группу, незамещенную или замещенную атомом галогена;
R3 обозначает водород или метильную группу.
Предпочтительными α-аминоамидами по настоящему изобретению являются:
2-(4-бензилоксибензиламино)пропанамид;
2-[4-(2-фторбензилокси)бензиламино]пропанамид;
2-[4-(2-хлорбензилокси)бензиламино]пропанамид;
2-[4-(3-фторбензилокси)бензиламино]пропанамид;
2-[4-(3-хлорбензилокси)бензиламино]пропанамид;
2-[4-(4-фторбензилокси)бензиламино]пропанамид;
2-[4-(2-фторбензилокси)бензиламино]-N-метилпропанамид;
2-[4-(3-фторбензилокси)бензиламино]-N-метилпропанамид;
2-[4-(2-фторбензилокси)бензиламино]-3-гидроксипропанамид;
2-[4-(3-фторбензилокси)бензиламино]-3-гидроксипропанамид;
2-(4-бензилоксибензиламино)-3-гидрокси-N-метилпропанамид;
2-[4-(2-фторбензилокси)бензиламино]-3-гидрокси-N-метилпропанамид;
2-[4-(2-хлорбензилокси)бензиламино]-3-гидрокси-N-метилпропанамид;
2-[4-(3-фторбензилокси)бензиламино]-3-гидрокси-N-метилпропанамид;
2-[4-(3-хлорбензилокси)бензиламино]-3-гидрокси-N-метилпропанамид;
2-(4-(2-тиенилметиленокси)бензиламино)пропанамид;
2-[4-(2-(3-фторфенил)этил)бензиламино]пропанамид;
2-[4-бензилтиобензиламино]пропанамид;
2-[4-бензилоксибензиламино]-3-фенил-N-метилпропанамид;
2-[4-бензилоксибензиламино]-N-метилбутанамид;
2-[4-бензилоксибензиламино]-2-фенилацетамид;
2-[4-(2-фторбензилокси)бензиламино]-2-фенилацетамид;
2-[4-(3-фторбензилокси)бензиламино]-2-фенилацетамид;
2-[4-(3-хлорбензилокси)бензиламино]-2-фенилацетамид;
2-[4-(3-фторбензилокси)бензиламино]-2-(2-фторфенил)ацетамид;
2-[4-(3-фторбензилокси)бензиламино]-2-(3-фторфенил)ацетамид;
2-[4-(3-хлорбензилокси)бензиламино]-2-(3-фторфенил)ацетамид;
если изомеры существуют, то либо в виде индивидуального изомера, либо в виде смеси изомеров, или их фармацевтически приемлемое производное.
В соответствии с настоящим изобретением наиболее предпочтительными являются следующие α-аминоамиды: (S)-(+)-2-[4-(3-фторбензилокси)бензиламино]пропанамид (далее для его обозначения в тексте настоящего описания используют кодовое название NW-1015), (S)-(+)-2-[4-(2-фторбензилокси)бензиламино]пропанамид (далее для его обозначения в тексте настоящего описания используют кодовое название NW-1029) и (S)-(+)-2-[4-(3-хлорбензилокси)бензиламино]пропанамид (далее для его обозначения в тексте настоящего описания используют кодовое название NW-1039).
α-Аминоамиды формулы (I) и их болеутоляющая активность, в частности, против хронической или невропатической боли у млекопитающих, включая людей, раскрывается в WO 90/14334, WO 94/22808, WO 97/05102, WO 99/26614, WO 99/35123 и WO 99/35125; любые из α-аминоамидов приведенной выше формулы (I) могут быть получены в соответствии с методиками, раскрытыми в указанных документах, которые включены в настоящее описание посредством ссылки в той части, которая касается получения указанных α-аминоамидов.
В WO 90/14334, WO 94/22808, WO 97/05102, WO 97/05111 раскрываются замещенные бензиламиноамидные соединения, активные по отношению к центральной нервной системе и пригодные в качестве антиэпилептических средств, препаратов против болезни Паркинсона, нейрозащитных средств, антидепрессантов, противосудорожных снотворных средств (Pevarello P., Bonsignori A., Doster P., Heidempergher F., Pinciroli V., Colombo M., McArthur R.A., Salvati P., Post C., Fariello R.G. and Varasi M.: "Synthesis and anticonvulsant activity of a new class of 2-[(aryl-alkyl)amino]alkanamide derivatives", J. Med. Chemistry 1998, 41: 579-590).
В WO 99/35123 и WO 99/35125 раскрываются замещенные бензиламинопропанамидные соединения, обладающие активностью по отношению к центральной нервной системе и пригодные в качестве болеутоляющих средств. Было показано, что α-аминоамиды, раскрытые в WO 99/35123 и WO 99/35125, являются блокаторами Na+-каналов, обладающими болеутоляющим воздействием против некоторых болевых моделей у животных (Faravelli L., Maj R., Veneroni O., Fariello R.G., Benatti L., Salvati P., Society for Neuroscience 2000; 26 (1): 1218).
Другой аспект настоящего изобретения касается способа лечения состояний головной боли у нуждающихся в лечении млекопитающих, в том числе людей, который включает введение указанному млекопитающему терапевтически эффективной дозы, по меньшей мере, одного α-аминоамида указанной выше формулы (I) или его фармацевтически приемлемой соли.
В частности, млекопитающему, нуждающемуся в вышеуказанном лечении, вводят дозу α-аминоамида приведенной выше формулы (I), которая находится в интервале от приблизительно 0,05 до 20 мг/кг веса тела в день; предпочтительно находится в интервале от приблизительно 0,5 до 10 мг/кг в день; наиболее предпочтительно в интервале от приблизительно 0,5 до 5 мг/кг в день.
Указанным образом можно купировать, облегчить и предупредить состояния головной боли у млекопитающих, включая людей. Примеры состояний головной боли у млекопитающих, которые можно лечить вышеуказанными α-аминоамидами формулы (I), являются головными болями, которые связаны с механизмом расширения внутричерепных сосудов и включают как первичные, так и вторичные головные боли; в частности, такие первичные головные боли, которые возникают вследствие острой боли при приступах мигрени или кластерной головной боли, или головные боли, которые возникают посредством сосудистых механизмов, и такие вторичные головные боли, которые вызываются инфекцией, расстройством обмена веществ или системными заболеваниями.
Примеры состояний, связанных с головными болями, которые можно лечить с помощью α-аминоамида приведенной выше формулы (I), включают, в частности, мигрень, такую как, например, острая, трансформированная или сосудистая мигрень; головную боль, такую как, например, головная боль острого, кластерного или развивающегося типа или головная боль напряжения; невралгию, такую как, например, невралгия тройничного нерва; гемикранию, такую как, например, хроническая пароксизмальная гемикрания; лицевую боль и арахноидит.
Далее, термин "фармацевтически приемлемое производное" α-аминоамида приведенной выше формулы (I) по тексту настоящего описания включает любой фармацевтически приемлемый метаболит, биопредшественник и/или пролекарство, т.е. соединение, структурная формула которого отлична от структурной формулы α-аминоамида приведенной выше формулы (I), но которое, тем не менее, при введении млекопитающему, в частности человеку, прямо или косвенно превращается in vivo в соединение, имеющее структурную формулу указанного α-аминоамида.
Примеры фармацевтически приемлемых производных α-аминоамидов указанной выше формулы (I) включают кислотно-аддитивные соли с неорганическими кислотами, в частности азотной, хлористоводородной, бромистоводородной, серной и фосфорной кислотами и т.п., или органическими кислотами, в частности уксусной, пропионовой, гликолевой, молочной, малоновой, яблочной, винной, лимонной, янтарной, бензойной, коричной, миндальной, метансульфоновой, п-толуолсульфоновой и салициловой кислотой и т.п.
Вышеуказанные α-аминоамиды формулы (I) могут вводиться в качестве "активного ингредиента" фармацевтически приемлемой композиции, которую можно получить по обычным методикам, известным из области техники, например, смешиванием активного ингредиента с фармацевтически приемлемыми, терапевтически инертными органическими и/или неорганическими носителями.
Композиции, содержащие вышеуказанный α-аминоамид, могут вводиться в виде различных лекарственных форм, в частности перорально в форме таблеток, пастилок, капсул, таблеток, покрытых сахаром или пленкой, жидких растворов, эмульсий или суспензий; ректально в форме суппозиториев; парентерально, в частности в виде внутримышечной или внутривенной инъекции или вливания; и чрескожно.
Подходящие фармацевтически приемлемые, терапевтически инертные органические и/или неорганические носители, пригодные для приготовления указанных композиций, включают, например, воду, желатин, гуммиарабик, лактозу, крахмал, целлюлозу, стеарат магния, тальк, растительные масла, полиалкиленгликоли и т.п. Композиции, включающие α-аминоамид вышеуказанной формулы (I), могут подвергаться стерилизации, а также могут содержать дополнительные компоненты, хорошо известные специалистам в данной области техники, такие как, например, консерванты, стабилизаторы, увлажняющие средства и эмульгаторы, в частности парафиновое масло, моноолеат маннита, соли для регулирования осмотического давления, буферные добавки и т.п.
Например, твердые оральные формы могут вместе с активным ингредиентом содержать разбавители, в частности лактозу, декстрозу, сахарозу, целлюлозу, кукурузный крахмал или картофельный крахмал; лубриканты, в частности оксид кремния, стеариновую кислоту, стеарат магния или кальция и/или полиэтиленгликоли; связующие, в частности крахмалы, гуммиарабики, метилцеллюлозу, карбоксиметилцеллюлозу или поливинилпирролидон; разрыхлители, в частности крахмал, альгиновую кислоту, альгинаты или натриевое производное гликолята крахмала; шипучие смеси; красители; подсластители; смачиватели, такие как лецитин, полисорбаты, лаурилсульфонаты; и, в общем случае, нетоксичные и фармакологически неактивные вещества, применяемые в фармацевтических составах. Указанные фармацевтические приемлемые препараты могут быть приготовлены известным способом, например, путем смешивания, гранулирования, таблетирования, формирования покрытия из сахара или формирования пленочного покрытия.
Оральные композиции включают составы пролонгированного действия, которые могут быть получены обычными способами, например с помощью нанесения энтеросолюбильного покрытия на таблетки или гранулы.
Жидкие дисперсии для перорального введения могут представлять собой, в частности, сиропы, эмульсии и суспензии.
Сиропы в качестве носителей могут включать, например, сахарозу или сахарозу вместе с глицерином, и/или маннитом, и/или сорбитом.
Суспензии или эмульсии в качестве носителя могут содержать, например, природную смолу, агар, альгинат натрия, пектин, метилцеллюлозу, карбоксиметилцеллюлозу или поливиниловый спирт. Суспензии или растворы для внутримышечных инъекций могут вместе с активным соединением содержать фармацевтически приемлемый носитель, в частности стерильную воду, оливковое масло, этилолеат, гликоли, например пропиленгликоль, и, если необходимо, подходящее количество гидрохлорида лидокаина. Растворы для внутривенных инъекций или вливаний в качестве носителя могут, например, содержать стерильную воду или же предпочтительно они могут быть в форме стерильных водных изотонических физиологических растворов.
Суппозитории вместе с активным ингредиентом могут содержать фармацевтически приемлемый носитель, в частности масло какао, полиэтиленгликоль, поверхностно-активное вещество на основе сложного эфира жирной кислоты и полиоксиэтилированного сорбита или лецитин.
Композицию, включающую α-аминоамид вышеуказанной формулы (I), обычно готовят в виде стандартной дозы, содержащей, например, от 35 до 350 мг активного ингредиента на одну стандартную дозировочную форму.
Подходящее лечение назначают 1, 2 или 3 раза в день в зависимости от скорости выведения лекарственного средства из организма. Таким образом, необходимая доза может представлять собой однократную дозу или частичные дозы, которые вводят через определенные промежутки времени, например от двух до четырех или более частичных доз в день. Лечение преимущественно начинают до возникновения мигрени и продолжают без ограничений.
Фармацевтические композиции, включающие α-аминоамид вышеуказанной формулы (I), содержат в одной стандартной дозе, в частности в капсуле, таблетке, порошке для инъекции, чайной ложке, суппозитории и т.п. от приблизительно 35 до приблизительно 350 мг активного ингредиента.
Необходимые для введения оптимальные терапевтически эффективные дозы могут быть легко определены специалистами и в основном меняются в зависимости от силы препарата, от способа введения препарата и от прогрессирования состояния или болезни, лечение которых проводят. Кроме того, факторы, связанные с конкретным субъектом, лечение которого проводят, включают возраст субъекта, вес, диету и время введения и вызывают необходимость согласовать дозу в соответствии с терапевтически эффективным уровнем.
Как указано выше, применение и способ по настоящему изобретению обеспечивает многочисленные преимущества, которые дают возможность быстро и весьма эффективно предупредить и вылечить практически все типы мигрени, кластерной головной боли или другие типы сильной головной боли и снизить или полностью купировать боль, вызываемую головными болями; в частности, предупредить и вылечить как первичные, так и вторичные головные боли или другие системные заболевания и другие острые головные боли.
Кроме того, применение и способ по настоящему изобретению не приводит практически ни к каким вредным побочным эффектам или затяжным последствиям (таким как сонливость, мышечная слабость, потеря ориентации, тошнота и другие подобные проблемы) и тем самым позволяет пациенту быть готовым и способным сесть за руль автомобиля, работать или вести обычный активный образ жизни по прошествии не более часа после проведения указанного курса лечения.
Следующие примеры поясняют настоящее изобретение, но его не ограничивают.
ПРИМЕР 1
Следующая фармацевтическая композиция, а также композиции по Примерам 2 и 3, содержащие α-аминоамид вышеуказанной формулы (I), получают смешиванием перечисленных ниже ингредиентов с помощью методов, обычно используемых в фармацевтике и известных специалистам в данной области техники.
Одна 35 мг капсула содержит:
| NW-1015 | 35,00 мг |
| Кросповидон | 4,37 мг |
| Микрокристаллическая целлюлоза | 5,95 мг |
| Стеарат магния | 0,17 мг |
| Коллоидный диоксид кремния | 0,18 мг |
ПРИМЕР 2
Одна 100 мг капсула содержит:
| NW-1015 | 100,00 мг |
| Кросповидон | 7,50 мг |
| Микрокристаллическая целлюлоза | 8,95 мг |
| Стеарат магния | 1,50 мг |
| Коллоидный диоксид кремния | 0,30 мг |
ПРИМЕР 3
Одна 175 мг капсула содержит:
| NW-1015 | 175,00 мг |
| Кросповидон | 13,05 мг |
| Микрокристаллическая целлюлоза | 15,57 мг |
| Стеарат магния | 2,61 мг |
| Коллоидный диоксид кремния | 0,49 мг |
ФАРМАКОЛОГИЯ
Антимигренозная активность вышеуказанных α-аминоамидов формулы (I) подтверждена приведенными ниже исследованиями сосудистых мигреней и связанными с ними заболеваний на животных моделях.
Исследования [Reuter U., Sanchez del Rio M., Moskowitz M.A., "Experimental models of migraine", Functional neurology (15) Suppl. 3 9-18, 2000; Magnus L., "Nonepileptic uses of gabapentin. Experience", Epilepsia, 1999; 40 (Suppl. 6) S66-72; discussion S73-S74; Peitl B., Pethô G., Pórszász R., Németh J. and Szolcsányi J., "Capsaicin-insensitive sensory-efferent meningeal vasodilatation evoked by electrical stimulation of trigeminal nerve fibres in the rat"] регионального кортикального кровотока (CBF) показывают, что во время фазы мигрени, сопровождаемой головной болью, наблюдается расширение как больших внечерепных, так и внутричерепных артерий. Это явление связывают с антидромным возбуждением с последующим высвобождением вазоактивных нейропептидов и с ортодромным возбуждением тройничных волокон, связанных с повышенной нейронной активностью.
Было показано, что вышеуказанные α-аминоамиды активно подавляют расширение церебральных сосудов, вызываемое электрическим стимулированием глазного ответвления ганглия тройничного нерва, а потому, как полагают, пригодны в качестве антимигренозных средств.
ОБЩИЕ МЕТОДЫ
Животные и хирургические операции
Самцов крыс линии Wistar (250-350 г) анестезируют пентобарбиталом натрия (50 мг/кг внутрибрюшинно), растворенным в физиологическом растворе.
В трахею и левую бедренную артерию вводят канюлю для проведения соответственно искусственного дыхания (55 качаний в минуту) и измерения средней величины кровяного давления (МВР). В бедренную вену вводят канюлю для внутривенного введения тестируемых средств. Температуру тела поддерживают на уровне 37-38°С за счет автоматического регулирования температуры подогреваемой подстилки.
Животных помещают в стереотаксическую рамку и делают продольный надрез в скальпе. В черепе проделывают трепанационное отверстие и в глазное ответвление ганглия тройничного нерва (3,8 мм дорсально к брегме, 2,5 мм латерально от срединной линии и 9,5 мм ниже поверхности твердой оболочки) вводят биполярный электрод из нержавеющей стали (Plastic One MS 306).
Правильное размещение электрода подтверждают коротким электрическим стимулированием, которое вызывает движение лапы вследствие активации тройничного волокна. После удаления мозга правильное положение электрода в волокне визуально проверяют по окончании каждого эксперимента.
Второе отверстие проделывают ипсилатерально от электрода (1,5 мм рострально от брегмы и 1,5 мм латерально от сагиттального шва) и закрепляют иглу зонда (диаметр кончика 0,8 мм) лазерного доплеровского флоуметра таким образом, чтобы его кончик был направлен в ветвь средней церебральной артерии (МСА), и изменение церебрального кровотока (CBF) регистрируют в режиме on-line с помощью лазерной доплеровской системы PeriFlux 4001.
Артефакты при проведении лазерных доплеровских измерений в процессе электрической стимуляции тройничного ганглия, вызванные движением мышц, предотвращают с помощью болюса внутривенной инъекции нейромышечного блокатора бромида панкурония (0,6 мг/кг внутривенно). Анестезию и нейромышечную блокаду поддерживают в течение всего эксперимента за счет вливания пентобарбитала натрия и панкурония (12,5 мг/кг/час + 2,4 мг/кг/час соответственно).
МЕТОДИКА ЭКСПЕРИМЕНТА
По окончании хирургической операции делают паузу в тридцать минут с тем, чтобы измеряемые параметры стабилизовались.
Величину CBF в состоянии покоя повышают электрическим стимулированием в течение 30 сек прямоугольными импульсами длительностью 0,5 мсек, 1-10 Гц, 0,5-1 мА. После двух усредненных стимуляций без добавления лекарства вводят носитель или лекарства.
α-Аминоамидные соединения NW-1015, NW-1029, NW-1039 по настоящему изобретению и соединения сравнения 2-(4-(2-фторбензилокси)бензиламино)-2-метилпропанамид (для его обозначения в тексте настоящего описания используют кодовое название NW-1050), 2-(4-(4-фторбензилокси)бензиламино)-2-метилпропанамид (для его обозначения в тексте настоящего описания используют кодовое название NW-1055) представляют собой также одно из соединений, испытания которых раскрыты в WO 99/26614, семикарбазон 4-(4-фторфенокси)бензальдегида (далее обозначают как Со102862, испытания которого раскрыты в WO 00/61188), а также носитель вводят внутривенно после второго базального стимулирования, которое регистрирует ответную реакцию на поток, вызванный электрическим стимулированием, через 5, 15, 30 и 60 мин после проведения лечения.
NW-1015 вводят в дозах 1, 2 и 5 мг/кг; NW-1029 вводят в дозах 5 и 10 мг/кг и NW-1039 вводят в дозах 2 и 5 мг/кг, в то время как NW-1050, NW-1055 и Со102862 все вводят в дозе 20 мг/кг.
Ответные реакции, которые наблюдаются после введения лекарства, сравнивают с группой, получавшей носитель, и представляют в виде процента ингибирования индуцированного CBF. Данные сравнивают, применяя ковариантный анализ (ANCOVA), а затем проводят сравнение по тесту Даннета.
РЕЗУЛЬТАТЫ
Антимигренозный эффект тестируемых соединений после внутривенного введения вышеуказанных выбранных соединений наблюдают и измеряют в виде процента ингибирования CBF, индуцированного в контрольных условиях. Данные, представленные ниже в таблице, демонстрируют ингибирующую активность тестируемых соединений на ответную реакцию CBF, индуцированного электрической стимуляцией левого глазного ответвления ганглия тройничного нерва.
| Таблица | |||||
| Соединение | Доза (мг/кг) | Время (мин) после введения | |||
| 5 | 15 | 30 | 60 | ||
| % Ингибирования ответной реакции CBF | |||||
| NW-1015 | 1 | 25,6±2,9 | 25,8±2,7 | 36,6±4,7** | 15,7±9,8 |
| NW-1015 | 2 | 15,0±1,8* | 22,0±3,8** | 20,6±6,2* | 4,0±6,3 |
| NW-1015 | 5 | 25,2±2,6 | 35,5±6,5** | 34,7±1,9** | 27,1±3,6 |
| NW-1029 | 5 | 15,5±3,7 | 20,8±3,5 | 27,8±3,9** | 30,6±2,8 |
| NW-1029 | 10 | 23,9±3,9 | 34,9±8,2** | 35,3±2,6** | 35,7±3,9** |
| NW-1039 | 2 | 24,2±6,2 | 31,3±6,2* | 32,1±8,1** | 36,2±9,1** |
| NW-1039 | 5 | 45,0±6,3** | 41,7±1,8** | 38,1±2,6** | 20,9±9,4 |
| NW-1050 | 20 | 1,2±0,3 | 1,8±0,6 | 1,7±0,8 | 0,9±0,1 |
| NW-1055 | 20 | 6,9±4,2 | 3,4±3,2 | 11,3±2,0 | 14,0±4,0 |
| Co102862 | 20 | 0,9±0,1 | 1,1±0,3 | 1,2±0,2 | 0,7±0,1 |
| *p<0,05, **p<0,01 по тесту Даннета |
Результаты (среднее значение ± стандартное отклонение среднего значения 4/6 крыс в группе) выражают в виде процента ингибирования индуцированной ответной реакции CBF по отношению к носителю.
NW-1015 после внутривенного введения показывает длительную активность вплоть до 60 мин при снижении индуцированного CBF. NW-1029 также снижает индуцированный CBF вплоть до 60 мин после введения. NW-1039 для испытанных доз показывает снижение индуцированной ответной реакции CBF по сравнению с группой, получавшей носитель.
NW-1055 с дозой 20 мг/кг вызывает легкое ингибирование индуцированного CBF, которое тем не менее не достигает статистически значимого различия по сравнению с группой, получавшей носитель. NW-1050 и Со102862 при дозе 20 мг/кг полностью неактивны.
Приведенные выше данные подтверждают, что отдельные замещенные 2-аминоацетамидные соединения, раскрытые в WO 99/26614, неэффективны в качестве антимигренозных средств, а потому подобную активность невозможно рационально предсказать на основании того, что указанные соединения известны как блокаторы натриевых каналов. В частности, предпочтительные α,α-дизамещенные ацетамиды (2-метилпропанамидные производные) значительно менее действенны, чем вышеуказанные амиды формулы (I).
Приведенные выше данные по биологической активности подтверждают, что α-аминоамиды вышеуказанной формулы (I) могут применяться в качестве антимигренозных средств, в частности, для лечения состояний головной боли, которые включают механизм расширения церебральных сосудов.
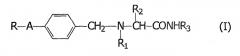
1. Применение α-аминоамида общей формулы (I):
где
А обозначает -(СН2)m- или -(CH2)n-Х-, где m равно 1 или 2; n равно нулю, 1 или 2; а Х обозначает -О-, -S- или -NH-;
R обозначает фурильное, тиенильное или пиридильное кольцо, или фенильное кольцо, незамещенное или замещенное одним или двумя заместителями, независимо выбранными из галогена, гидроксильной, C1-C4 алкильной, C1-С3 алкоксильной и трифторметильной группы;
R1 обозначает водород или C1-С3 алкильную группу;
R2 обозначает водород или C1-C2 алкильную группу, незамещенную или замещенную гидроксильной или фенильной группой; фенильную группу, незамещенную или замещенную одним или двумя заместителями, независимо выбранными из С1-С3 алкильной группы, галогена, гидроксильной, C1-С2 алкоксильной и трифторметильной группы;
R3 обозначает водород или C1-С3 алкильную группу;
если изомеры существуют, то либо в виде индивидуального изомера, либо в виде смеси изомеров, или их фармацевтически приемлемого производного; при изготовлении лекарственного средства для лечения состояний головной боли, включающих механизм расширения сосудов мозга.
2. Применение α-аминоамида по п.1, где в формуле (I)
А обозначает группу, выбранную из -СН2-СН2-, -СН2-O-, -CH2-S-, -СН2-СН2-O-;
R обозначает фенильное кольцо, незамещенное или замещенное одним или двумя заместителями, независимо выбранными из галогена, С1-С3 алкильной или метоксильной группы; или тиенильную группу;
R1 обозначает водород или C1-C2 алкильную группу;
R2 обозначает водород или метильную группу, незамещенную или замещенную гидроксильной группой, или фенильную группу, незамещенную или замещенную C1-C2 алкильной группой, галогеном, гидроксильной, метоксильной и трифторметильной группой;
R3 обозначает водород или C1-C2 алкильную группу.
3. Применение α-аминоамида по п.1, где в формуле (I)
А обозначает -СН2-О-, -CH2-S- или -СН2-CH2-;
R обозначает фенильное кольцо, незамещенное или замещенное одним или двумя атомами галогена;
R1 обозначает водород;
R2 обозначает водород или метильную группу, незамещенную или замещенную гидроксильной группой, или фенильную группу, незамещенную или замещенную атомом галогена;
R3 обозначает водород или метильную группу.
4. Применение α-аминоамида по п.1, где α-аминоамид выбирают из
2-(4-бензилоксибензиламино)пропанамида;
2-[4-(2-фторбензилокси)бензиламино]пропанамида;
2-[4-(2-хлорбензилокси)бензилами