Множественные варианты менингококкового белка nmb 1870
Иллюстрации
Показать всеИзобретение касается композиции для лечения заболевания, вызываемого Neisseria meningitides. Согласно изобретению белок NMB 1870 представляет собой эффективный антиген для получения иммунного ответа против менингококка, и он экспрессируется среди всех менингококковых серогрупп. Идентифицированы сорок две различные последовательности NMB 1870, и они образуют группы трех вариантов. Сыворотка, полученная против данного варианта, бактерицидна внутри той же самой группы варианта, но неактивна против штаммов, которые экспрессируют один из двух других вариантов, т.е. существует внутривариантная, но не межвариантная перекрестная защита. Поэтому в данном изобретении для максимальной перекрестной штаммовой эффективности используют смеси, содержащие различные варианты NMB 1870. В изобретении раскрывается способ индуцирования иммунного ответа млекопитающего, предусматривающий использование композиций на основе различных вариантов NMB 1870, а также представлены нуклеиновые кислоты, кодирующие указанные варианты белка NMB 1870 (соответствующие последовательности представлены в перечне последовательностей). Композиции на основе белка NMB 1870 обладают иммуногенными двойствами во время инфекции, способны вызывать образование бактерицидных антител, вызывают иммунитет против менингококков, причем не только против менингококков серогруппы В. 5 н. и 27 з.п. ф-лы, 14 ил., 19 табл.
Реферат
Все цитируемые здесь документы включены сюда в качестве ссылок во всем своем объеме.
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к области вакцинации и, в особенности, вакцинации против заболевания, вызываемого патогенными бактериями рода Neisseria, такими как N. meningitidis (менингококк).
УРОВЕНЬ ТЕХНИКИ
Neisseria meningitidis является грамотрицательной инкапсулированной бактерией, которая образует колонии в верхних дыхательных путях приблизительно у 10% популяции человека. Приблизительно в одном случае на каждые 10000 колонизированных человек (или в одном случае на 100000 населения) бактерия выходит в кровоток, где она размножается и вызывает сепсис. Из кровотока бактерия может проникать через гематоэнцефалический барьер и вызывать менингит. Оба заболевания являются очень опасными и могут приводить к смерти 5-15% зараженных детей и молодых взрослых людей в течение нескольких часов, несмотря на наличие эффективных антибиотиков. Вплоть до 25% у тех, кто выживает, остаются долговременные осложнения.
Предупреждение заболевания частично достигается вакцинацией. Иммунизация стала возможной с 1969, когда было обнаружено, что защита от заболевания коррелирует с наличием сывороточных антител, способных вызвать комплементзависимую гибель бактерий, и что очищенный капсульный полисахарид способен вызывать образование данных антител. Несмотря на то, что существуют полисахаридные или конъюгированные вакцины против серогрупп A, C, W135 и Y, данный подход не может применяться против серогруппы B, поскольку капсульный полисахарид представляет собой полимер полисиаловой кислоты, которая является аутоантигеном у людей. Для разработки вакцины против серогруппы B были использованы экспонированные на поверхностность белки, содержащиеся в везикулах наружной мембраны (OMV). Данные вакцины вызывают сывороточные бактерицидные ответы антител и защищают от заболевания, но они не индуцируют перекрестную штаммовую защиту [1].
Полная геномная последовательность N. meningitidis серогруппы B была опубликована [2] и подвергалась анализу для идентификации антигенов для вакцин [3]. Также известна полная геномная последовательность N. meningitidis серогруппы А [4] и доступна полная геномная последовательность штамма FA1090 Neisseria gonorrhoeae [5]. В ссылках с 6 по 9 описаны белки Neisseria meningitidis и Neisseria gonorrhoeae и способы экспрессии данных белков описаны в ссылках с 10 по 12.
Цель данного изобретения заключается в предоставлении дополнительных и улучшенных композиций для получения иммунитета против менингококкового заболевания и/или инфекции, в особенности, против серогруппы B.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Один из ˜ 2200 белков, описанных в ссылке 2, является «NMB1870». Первоначально белок был описан как белок «741» из штамма MC58 [SEQ ID 2535 и 2536 в ссылке 8; здесь - SEQ ID 1], и также он обозначался как «GNA1870» [следующая ссылка 3] или как «ORF2086» [13].
В наши дни было обнаружено, что NMB1870 является чрезвычайно эффективным антигеном, вызывающим противоменингококковые ответы антител, и что он экспрессируется во всех менингококковых серогруппах. NMB1870 был обнаружен во всех менингококковых штаммах, исследованных до настоящего времени. Были определены сорок две различные менингококковые последовательности NMB1870 и было обнаружено, что данные последовательности группируются в три варианта. Кроме того, было обнаружено, что сыворотка, полученная против конкретного варианта, является бактерицидной в пределах той же самой группы варианта, но не является активной против штаммов, которые экспрессируют один из двух других вариантов, то есть существует внутривариантная перекрестная защита, но не межвариантная перекрестная защита.
Поэтому для максимальной перекрестной межштаммовой эффективности следует использовать более одного варианта для иммунизации пациента.
Следовательно, изобретение относится к композиции, содержащей, по крайней мере, два из следующих антигенов:
(а) первый белок, содержащий аминокислотную последовательность, имеющую, по крайней мере, a% идентичности последовательности с SEQ ID 24 и/или содержащую аминокислотную последовательность, состоящую из фрагмента, по крайней мере, x следующих одна за другой аминокислот из SEQ ID 24;
(b) второй белок, содержащий аминокислотную последовательность, имеющую, по крайней мере, b% идентичности последовательности с SEQ ID 33 и/или содержащей аминокислотную последовательность, состоящую из фрагмента, по крайней мере, y следующих одна за другой аминокислот из SEQ ID 33; и
(c) третий белок, содержащий аминокислотную последовательность, имеющую, по крайней мере, c% идентичности последовательности с SEQ ID 41 и/или содержащей аминокислотную последовательность, состоящую из фрагмента, по крайней мере, z следующих одна за другой аминокислот из SEQ ID 41.
Изобретение также относится к использованию NMB1870 для получения иммунитета против множества (например, 2, 3, 4, 5 или более) штаммов и/или серогрупп N. meningitidis.
Вариабельность внутри и между (a), (b) и (c)
Величина а составляет, по крайней мере, 85, например 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 99,5 или более. Величина b составляет, по крайней мере, 85, например 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 99,5 или более. Величина с составляет, по крайней мере, 85, например 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 99,5 или более. Величины a, b и c по сути своей не связаны друг с другом.
Величина x составляет, по крайней мере, 7, например 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 225, 250. Величина y составляет, по крайней мере, 7, например 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 225, 250. Величина z составляет, по крайней мере, 7, например 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 225, 250. Величины x, y и z по сути своей не связаны друг с другом.
Предпочтительно, чтобы любая данная аминокислотная последовательность не попадала в более чем одну из категорий (a), (b) и (c). Любая данная последовательность NMB1870, таким образом, попадет только в одну из категорий (a), (b) и (c). Таким образом, предпочтительно, чтобы: у белка (a) было менее чем i% идентичности последовательности с белком (b); у белка (a) было менее чем j% идентичности последовательности с белком (c); и у белка (b) было менее чем k% идентичности последовательности с белком (c). Величина i составляет 60 или более (например, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90 и т.д.) и представляет собой по большей части a. Величина j составляет 60 или более (например, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90 и т.д.) и представляет собой по большей части b. Величина k составляет 60 или более (например, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90 и т.д.) и представляет собой по большей части c. Величины i, j и k по сути своей не связаны друг с другом.
Следовательно, как пример осуществления изобретения с двумя белками, белок (a) может иметь >85% идентичности последовательности с SEQ ID 24, белок (b) может иметь >85% идентичности последовательности с SEQ ID 33, но белок (a) и (b) имеет менее чем 75% идентичности последовательности относительно друг друга. Следовательно, каждый белок (a) и (b) близко родственны их «прототипным» последовательностям, но они не являются настолько близко родственными друг другу.
Следовательно, как пример осуществления изобретения с тремя белками, белок (a) может иметь >85% идентичности последовательности с SEQ ID 24, белок (b) может иметь >85% идентичности последовательности с SEQ ID 33, белок (c) может иметь >85% идентичности последовательности с SEQ ID 41, но белок (a) и (b) имеют менее чем 75% идентичности последовательности относительно друг друга, белок (a) и (c) имеют менее чем 75% идентичности последовательности относительно друг друга, белок (b) и (c) имеют менее чем 75% идентичности последовательности относительно друг друга.
Смесь двух или более из (a), (b) и (c) может предпочтительно вызывать иммунный ответ, который является бактерицидным против, по крайней мере, одного штамма N. meningitidis для каждого из, по крайней мере, двух из нижеследующих трех групп штаммов:
(a) MC58, gb185 (=M01-240185), m4030, m2197, m2937, iss1001, NZ394/98, 67/00, 93/114, bz198, ml390, nge28, lnp17592, 00-241341, f6124, 205900, m198/172, bz133, gb149 (=M01-240149), nm008, nm092, 30/00, 39/99, 72/00, 95330, bz169, bz83, cu385, h44/76, m1590, m2934, m2969, m3370, m4215, m4318, n44/89, 14847.
(b) 961-5945, 2996, 96217, 312294, 11327, a22, gb013(=M01-240013), e32, m1090, m4287, 860800, 599, 95N477, 90-18311, c11, m986, m2671, 1000, m1096, m3279, bz232, dk353, m3697, ngh38, L93/4286.
(c) M1239, 16889, gb355 (=M01-240355), m3369, m3813, ngp165.
Например, смесь может вызывать бактерицидный ответ, эффективный против каждого из штаммов MC58, 961-5945 и M1239 N. meningitidis серогруппы B.
Смесь двух или более из (a), (b) и (c) может предпочтительно вызывать иммунный ответ, который является бактерицидным, по крайней мере, для 50% клинически значимых менингококковых штаммов серогруппы В (например, по крайней мере, 60%, 70%, 80%, 90%, 95% или более).
Смесь двух или более из (a), (b) и (c) может предпочтительно вызывать иммунный ответ, который является бактерицидным против штаммов N.meningitidis серогруппы B и штаммов из, по крайней мере, одной (например, 1, 2, 3, 4) из серогрупп A, C, W135 и Y.
Смесь двух или более из (a), (b) и (c) может предпочтительно вызывать иммунный ответ, который является бактерицидным против штаммов N.gonococcus и/или N.cinerea.
Смесь двух или более из (a), (b) и (c) может предпочтительно вызывать иммунный ответ, который является бактерицидным против штаммов, по крайней мере, в двух из трех основных ветвей древовидной схемы, показанной на фигуре 9 (то есть древовидной схемы, полученной при анализе SEQ ID с 1 по 23 при помощи алгоритма Кимуры и Джукса-Кантора).
Смесь двух или более из (a), (b) и (c) может предпочтительно вызывать иммунный ответ, который является бактерицидным против штаммов N.meningitidis, по крайней мере, у 2 (например, 2, 3, 4, 5, 6, 7) гипервирулентных линий ET-37, ET-5, кластера A4, линии 3, подгруппы I, подгруппы III и подгруппы IV-1 [14, 15].
Композиции по изобретению могут дополнительно вызывать бактерицидные иммунные ответы против одной или более гиперинвазивных линий.
Смесь двух или более из (a), (b) и (c) может предпочтительно вызывать иммунный ответ, который является бактерицидным против штаммов N.meningitidis, по крайней мере, в 2 (например, 2, 3, 4, 5, 6, 7) из следующих типов мультилокусных последовательностей: ST1, ST4, ST5, ST8, ST11, ST32 и ST41 [16]. Смесь может также вызывать иммунный ответ, который является бактерицидным против штаммов ST44.
Бактерицидные иммунные ответы без труда измеряют у мышей, и они являются стандартными показателями эффективности вакцины [например, смотри заключительное примечание 14 в ссылке 3]. Композиция не обязательно вызывает образование бактерицидных антител против каждого штамма MenB внутри определенных линий или MLST; скорее для любой конкретной группы из четырех или более штаммов менингококка серогруппы В внутри определенной гипервирулентной линии или MLST; антитела, индуцируемые за счет композиции, являются противобактерицидными против по крайней мере 50% (например 60%, 70%, 80%, 90% или более) группы. Предпочтительные группы штаммов будут включать в себя штаммы, выделенные, по крайней мере, в четырех из нижеследующих стран: GB, AU, CA, NO, IT, US, NZ, NL, BR и CU. Предпочтительно сыворотка имеет бактерицидный титр, равный, по крайней мере, 1024 (например, 210, 211, 212, 213, 214, 215, 216, 217, 218 или выше, предпочтительно, по крайней мере, 214), то есть сыворотка способна уничтожить, по крайней мере, 50% тестовых бактерий определенного штамма, если она разведена в соотношении 1/1024, например, как описано в заключительном примечании 14 ссылки 3.
Липопротеины
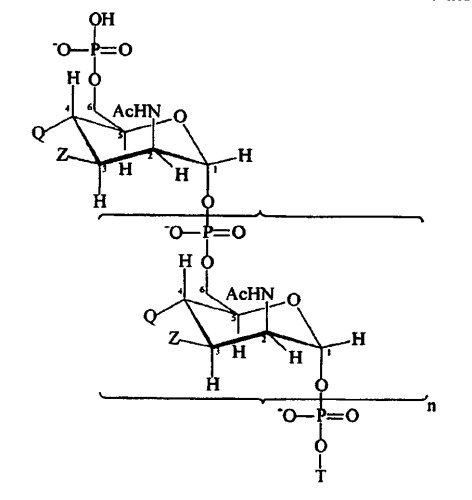
NMB1870 в N.meningitidis по своей природе представляет липопротеин. Также было обнаружено, что он липидизирован при экспрессии в E.coli.
Предпочтительно, чтобы один или более (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10) белков NMB1870, входящих в композиции по изобретению, являлись липопротеинами.
Изобретение относится к белку, содержащему аминокислотную последовательность, имеющую, по крайней мере, 50% (например, 60%, 70%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) идентичности последовательности с одной или более из SEQ ID с 24 по 45 и/или содержащей аминокислотную последовательность, состоящую, по крайней мере, из 7 (например, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 225, 250) следующих одна за другой аминокислот из одной или более SEQ ID с 24 по 45 (предпочтительно SEQ ID с 25 по 45), отличающихся тем, что белок является липопротеином.
Предпочтительно липопротеин имеет N-концевой остаток цистеина, к которому липид присоединен ковалентно. Для того чтобы получить липопротеин посредством бактериальной экспрессии, как правило, необходим подходящий N-концевой сигнальный пептид для непосредственной липидизации диацилглицирилтрансферазой, за которой следует расщепление специфичной для липопротеина SPазы (тип II). Наряду с тем, что липопротеин по изобретению может содержать N-концевой цистеин (например, SEQ ID с 24 по 45), он, следовательно, будет являться продуктом посттрансляционной модификации образующегося белка, который обычно содержит N-концевой метионин (например, SEQ ID с 1 по 22).
Липопротеин может быть связан с липидным бислоем и может быть солюбилизирован детергентом.
Последовательности
Белки NMB1870, применимые по изобретению, содержат аминокислотную последовательность, имеющую, по крайней мере, 50% (например, 60%, 70%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) идентичности последовательности с одной или более из SEQ ID NO с 1 по 23 и/или содержащую аминокислотную последовательность, состоящую из фрагмента, по крайней мере, 7 (например, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 225, 250) следующих одна за другой аминокислот из одной или более SEQ ID NO с 1 по 23.
Предпочтительные фрагменты включают в себя: (a) фрагменты, которые содержат эпитоп и предпочтительно бактерицидный эпитоп; (b) фрагменты, общие для двух или более SEQ ID с 1 по 23; (c) SEQ ID с 1 по 23 с 1 или более (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 110, 120 или более и т.д.) удаленными N-концевыми остатками; (d) SEQ ID с 1 по 23 с 1 или более (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 и т.д.) удаленными C-концевыми остатками; и (e) SEQ ID с 1 по 23 без их сигнальных пептидов (например, SEQ ID с 24 по 45). Данные фрагменты не являются взаимно исключающими, например, фрагмент может попадать в категорию (a) и (b) или категорию (c) и (d) и т.д.
Далее белки NMB1870, применимые по изобретению, содержат аминокислотную последовательность, имеющую, по крайней мере, 50% (например, 60%, 70%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) идентичности последовательности с одной или более из SEQ ID NO с 123 по 141, и/или содержащую аминокислотную последовательность, состоящую из фрагмента, по крайней мере, 7 (например, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 225, 250) следующих одна за другой аминокислот из одной или более SEQ ID NO с 123 по 141.
Далее белки NMB1870, применимые по изобретению, содержат аминокислотную последовательность, имеющую, по крайней мере, 50% (например, 60%, 70%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) идентичности последовательности с одной или более из SEQ ID NO с 1 по 252 по ссылке 13 и/или содержащую аминокислотную последовательность, состоящую из фрагмента, по крайней мере, 7 (например, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 225, 250) следующих одна за другой аминокислот из одной или более SEQ ID NO с 1 по 252 по ссылке 13. SEQ ID NO 300-302 по ссылке 13 относятся к консенсусным последовательностям, и SEQ ID NO 254-299 являются фрагментами. Предпочтительные фрагменты включают в себя: (a) фрагменты, которые содержат эпитоп и предпочтительно бактерицидный эпитоп; (b) фрагменты, общие для двух или более SEQ ID с 123 по 141; (c) SEQ ID с 123 по 141 с 1 или более (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 110, 120 или более и т.д.) удаленными N-концевыми остатками; (d) SEQ ID с 123 по 141 с 1 или более (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 и т.д.) удаленными C-концевыми остатками; и (e) SEQ ID с 123 по 141 без их сигнальных пептидов. Данные предпочтительные фрагменты не являются взаимно исключающими, например, фрагмент может попадать в категорию (a) и (b), или категорию (c) и (d) и т.д.
Предпочтительные аминокислотные последовательности с идентичностью <100% с SEQ ID NO с 1 по 23 и с 123 по 141 являются их аллельными вариантами, гомологами, ортологами, паралогами, мутантами и т.д. Предпочтительно, чтобы одно или более отличий в аллельных вариантах, гомологах, ортологах, паралогах или мутантах, по сравнению с SEQ ID NO с 1 по 23 и с 123 по 141, содержали консервативные аминокислотные замены, то есть замены одной аминокислоты на другую, которая имеет похожую боковую цепь. Генетически кодируемые аминокислоты обычно подразделяют на четыре семейства: (1) кислые, то есть аспартат, глутамат; (2) основные, то есть лизин, аргинин, гистидин; (3) неполярные, то есть аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан; и (4) незаряженные полярные, то есть глицин, аспарагин, глутамин, цистеин, серин, треонин, тирозин. Фенилаланин, триптофан и тирозин иногда классифицируют вместе в качестве ароматических аминокислот. В основном, замещение единичных аминокислот в пределах данных семейств не имеет большого влияния на биологическую активность.
Предпочтительная подгруппа белков не содержит аминокислотную последовательность TRSKP (SEQ ID NO: 70) или TRSKPV (SEQ ID NO: 71) среди 10 аминокислот N-конца белка. Другая предпочтительная подгруппа белков не содержит аминокислотную последовательность PSEPPFG (SEQ ID NO: 72) среди 10 аминокислот N-конца белка.
Другая предпочтительная подгруппа белков для применения по изобретению содержит аминокислотную последовательность (Gly)n, где n составляет 1, 2, 3, 4 или более, например SEQ ID NO: 73.
Особенность предпочтительных белков по изобретению заключается в их способности вызывать образование бактерицидных противоменингококковых антител после введения животному-хозяину.
Белки можно получить различными способами, например, при помощи химического синтеза (по крайней мере, частично), расщепляя более длинные полипептиды с использованием протеаз, транслируя с РНК, очищая из клеточной культуры (например, при рекомбинантной экспрессии или из культуры N.meningitidis) и т.д. Гетерологичная экспрессия в клетки хозяина E.coli является предпочтительным путем экспрессии (например, штаммы DH5α, BL21с(DE3), BLR и т.д.).
Белки по изобретению можно прикрепить или иммобилизировать на твердой подложке.
Белки по изобретению могут содержать обнаруживаемую метку, например, радиоактивную метку, флуоресцентную метку или биотиновую метку. Это особенно применимо в методиках иммунологического анализа.
Белки могут находиться в различных формах (например, нативной, слитой, гликозилированной, негликозилированной, липидизированной, с дисульфидными мостиками и т.д.). Белки предпочтительно являются менингококковыми белками.
Белки предпочтительно получают в значительной степени очищенными или в значительной степени в выделенном виде (то есть в значительной степени свободными от других белков клеток Neisseria или хозяина). В основном белки получают в неприродном окружении, например, они отделяются от их природного окружения. В некоторых осуществлениях исследуемые белки присутствуют в композициях, которые обогащены белками по сравнению с контролем. По существу, получают очищенные белки, в соответствии с чем, очищенные означает, что белки присутствуют в композиции, которая в значительной степени свободна от других экспрессированных белков, в соответствии с чем, в значительной степени свободные означает, что менее чем 90%, обычно менее чем 60% и наиболее обычно, менее чем 50% композиции дополняют другие экспрессированные белки.
Термин "белок" обозначает аминокислотные полимеры любой длины. Полимер может быть линейным или разветвленным, он может содержать модифицированные аминокислоты, и он может прерываться неаминокислотными элементами. Термины также охватывают аминокислотный полимер, который был модифицирован природно или посредством вмешательства; например, образование дисульфидных связей, гликозилирование, липидизация, ацетилирование, фосфорилирование или любая другая манипуляция или модификация, такая как конъюгация с компонентом мечения. Также попадающими под определение являются, например, белки, содержащие один или более аналогов аминокислот (включая, например, неприродные аминокислоты и т.д.), а также другие модификации, известные в данной области. Белки могут встречаться в качестве единичных цепей или связанных цепей.
Изобретение также относится к белкам, содержащим аминокислотную последовательность, имеющую, по крайней мере, 50% (например, 60%, 70%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) идентичности последовательности с одной или более из SEQ ID NO 77, 79, 82,83, 85, 87, 88, 89, 90, 91, 92, 93 и 94, и/или содержащую аминокислотную последовательность, состоящую из фрагмента, по крайней мере, 7 (например, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 225, 250) следующих одна за другой аминокислот из одной или более SEQ ID NO 77, 79, 82, 83, 85, 87, 88, 89, 90, 91, 92, 93 и 94.
В тех случаях, когда изобретение относится к одному белку NMB1870, изобретение не охватывает белок, содержащий аминокислотную последовательность, как описано в любой из SEQ ID NO: с 1 по 302 ссылки 13. Тем не менее, такие белки могут по выбору использоваться в тех случаях, когда изобретение относится к смесям NMB1870.
Гибридные и тандемные белки
Как упоминалось выше, NMB1870 можно использовать в виде слитого белка, хотя белки также могут экспрессироваться и иначе как слитые белки (например, без GST, MBP, гистидиновой метки или тому подобного).
У слитых белков может быть C-концевой и/или N-концевой партнер слияния. В тех случаях, когда N-концевой партнер слияния используется с SEQ ID с 1 по 23, специалисты поймут, что стартовый кодон (если он содержится) будет экспрессироваться как валин, поскольку GTG транслируется как валин, за исключением тех случаев, когда он используется в качестве стартового кодона, и в этом случае он транслируется как N-формил-метионин.
Подходящие N-концевые партнеры слияния включают в себя лидерные пептиды из других белков (особенно, других липопротеинов), которые можно заменить на природные лидерные пептиды NMB1870 (то есть, последовательность перед N-концевым цистеином можно заменить на другой интересующий лидерный пептид). Примерами являются последовательности, содержащие SEQ ID 46, и лидерная последовательность липопротеина Р4 H.influenzae [например, 17].
Предпочтительный тип слитого белка описан в ссылках 10, 11 и 12, в которых два или более (например, 3, 4, 5, 6 или более) белков Neisseria объединены таким образом, что они транслируются в качестве единой полипептидной цепи. В основном, такие гибридные белки можно представить формулой:
NH2-A-[-X-L-]n-B-COOH,
где X представляет собой аминокислотную последовательность, содержащую последовательность Neisseria, L представляет собой необязательную линкерную аминокислотную последовательность, A представляет собой необязательную N-концевую аминокислотную последовательность, B представляет собой необязательную C-концевую аминокислотную последовательность и n является целым числом, большим, чем 1. Значение n находится между 2 и x, и значение x типично представляет собой 3, 4, 5, 6, 7, 8, 9 или 10. Предпочтительно n равно 2, 3 или 4; более предпочтительно 2 или 3; наиболее предпочтительно n=2.
По настоящему изобретению, по крайней мере, одна из частей -X- представляет собой последовательность NMB1870, как описано выше. В некоторых гибридных белках, обозначаемых как «тандемные» белки, по крайней мере, одна из частей -X- имеет идентичность последовательности, по крайней мере, с одной из других X частей, например, X1 представляет собой SEQ ID NO: 24 и X2 представляет собой SEQ ID NO: 25. Белки, в которых объединены два или три из трех вариантов NMB1870, являются предпочтительными.
Для частей X, отличных от X1, предпочтительно, чтобы нативный лидерный пептид был бы удален, особенно когда X не является последовательностью NMB1870. В одном осуществлении удаляют лидерный пептид за исключением части -X-, расположенной в N-конце гибридного белка, то есть лидерный пептид X1 оставляют, но лидерные пептиды X2...Xn удаляют. Это равнозначно удалению всех лидерных пептидов и использованию лидерного пептида X1 в качестве части -A-.
Предпочтительные последовательности NMB1870 для использования в качестве частей -X- укорочены вплоть до полиглициновой последовательности и включают в себя эту последовательность полиглицинов, обнаруженную около зрелого N-конца, например, последовательность NMB1870 будет начинаться с VAA... (или IAA... для штамма m3813). Такие последовательности NMB1870 включают в себя SEQ ID NO: 80, 81 и 84.
Для каждых n случаев [-X-L-], может присутствовать или отсутствовать линкерная аминокислотная последовательность -L-. Например, если n=2, гибрид может быть NH2-X1-L1-X2-L2-COOH, NH2-X1- -X2-COOH, NH2-X1-L1-X2-COOH, NH2-X1-X2-L2-COOH и т.д. Линкерная аминокислотная последовательность (последовательности) -L- типично будут короткими (например, 20 или менее аминокислот, то есть 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают в себя короткие последовательности пептидов, которые облегчают клонирование, полиглициновые линкеры (то есть, Glyn, где n=2, 3, 4, 5, 6, 7, 8, 9, 10 или более) и гистидиновые метки (то есть Hisn, где n=3, 4, 5, 6, 7, 8, 9, 10 или более). Другие подходящие линкерные аминокислотные последовательности будут очевидны специалистам в данной области. Применимым линкером является GSGGGG (SEQ ID NO: 144) с дипептидом Gly-Ser, образованным из сайта рестрикции BamHI, таким образом, облегчающим клонирование и манипуляцию, и тетрапептид Gly4 (SEQ ID NO: 73) представляет собой другой типичный полиглициновый линкер. Другой применимый линкер представляет собой SEQ ID NO: 78.
-A- представляет собой необязательную N-концевую аминокислотную последовательность. Данная последовательность типично является короткой (например, 40 или менее аминокислот, то есть 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают в себя лидерные последовательности для непосредственной миграции белков или короткие последовательности пептидов, которые облегчают клонирование или очистку (например, гистидиновые метки, то есть Hisn, где n=3, 4, 5, 6, 7, 8, 9, 10 или более). Другие подходящие N-концевые аминокислотные последовательности будут очевидны специалистам в данной области. Если Xl теряет свой N-концевой метионин, то -A- может предоставить такой остаток метионина в транслируемом белке (например, -A- представляет собой один остаток Met). Применимая для экспрессии NMB1870 часть -A- представляет собой SEQ ID NO: 86. В сформировавшихся липопротеинах -A- предпочтительно относится к N-концевому цистеину (например, -A- представляет собой один остаток Cys).
-B- представляет собой необязательную С-концевую аминокислотную последовательность. Данная последовательность типично является короткой (например, 40 или менее аминокислот, то есть 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают в себя последовательности для непосредственной миграции белков, короткие последовательности пептидов, которые облегчают клонирование или очистку (например, содержащие гистидиновые метки, то есть Hisn, где n=3, 4, 5, 6, 7, 8, 9, 10 или более), или последовательности, которые увеличивают стабильность белка. Другие подходящие С-концевые аминокислотные последовательности будут очевидны специалистам в данной области.
У предпочтительного гибридного белка по изобретению одна из X частей представляет собой последовательность «белка 936». Например, где n=2, A=Met, X1 представляет собой последовательность 936 (например, SEQ ID NO: 76, которая является процессированным белком MC58), L1= полиглициновый линкер (например, SEQ ID NO: 144), X2= последовательность NMB1870, в которой N-конец удален вплоть до собственной полиглициновой последовательности и включающему ее в себя, и L2 и B могут отсутствовать. Примером такого гибридного белка является SEQ ID NO: 77, в которой укороченный NMB1870 из штамма m1239 расположен ниже процессированного 936 из штамма MC58. Дальнейшими примерами гибридных белков 936 (штамм 2996) и укороченного NMB1870 (штамм 2996 или M1239) являются SEQ ID NO: 91, 92, 93 и 94.
Предпочтительные тандемные белки, где n=3, могут иметь все три варианта NMB1870 в любом порядке:
| X1 | 1 | 1 | 2 | 2 | 3 | 3 |
| X2 | 2 | 3 | 1 | 3 | 1 | 2 |
| X3 | 3 | 2 | 3 | 1 | 2 | 1 |
Предпочтительные тандемные белки, где n=2, могут иметь два различных варианта NMB1870:
| X1 | 1 | 1 | 2 | 2 | 3 | 3 |
| X2 | 2 | 3 | 1 | 3 | 1 | 2 |
Примерами тандемных белков, где n=2 (два различных варианта NMB1870), являются SEQ ID NO: 79, 82, 83, 85, 87, 88, 89 и 90, которые используют штаммы MC58 (вариант 1), 2996 (вариант 2) и M1239 (вариант 3).
Пример тандемного белка, где n=3, приведен в качестве SEQ ID NO: 142.
NadA
Белок NadA описан в ссылках 191 и 192. В данных ссылках описаны три различные аллели NadA, хотя были обнаружены некоторые минорные варианты, например, штамм ISS1024 серогруппы C имеет вариант аллели 2 с одной делецией семивалентного повтора, оба штамма ISS759 и 973-1720 серогруппы C содержат вариант аллели 3 с одной мутацией аминокислоты в лидерном пептиде и штамм 95330 серогруппы B содержит рекомбинацию аллелей 1 и 2.
При секвинировании NadA из штаммов менингококка Haji была определена SEQ ID NO: 143. Данный белок является рекомбинантом известных аллелей 2 и 3.
Изобретение относится к белку, содержащему аминокислотную последовательность, имеющую, по крайней мере, 50% (например, 60%, 70%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99%, 99,5% или более, например, 100%) идентичности последовательности с SEQ ID NO: 143 и/или содержащую аминокислотную последовательность, состоящую из фрагмента, по крайней мере, 7 (например, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180, 200, 225, 250) следующих одна за другой аминокислот из SEQ ID NO: 143.
Предпочтительные фрагменты включают в себя: (a) фрагменты, которые содержат эпитоп и предпочтительно бактерицидный эпитоп; (b) фрагменты, общие для SEQ ID NO: 143 и, по крайней мере, одной из последовательностей NadA, описанных в ссылках 191 и 192; (c) SEQ ID NO: 143 с 1 или более (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 110, 120 или более и т.д.) удаленными N-концевыми остатками; (d) SEQ ID NO: 143 с 1 или более (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 и т.д.) удаленными С-концевыми остатками; и (e) SEQ ID NO: 143 без ее сигнального пептида. Данные фрагменты не являются взаимно исключающими, например, фрагмент может попадать в категорию (a) и (b) или категорию (c) и (d) и т.д.
Предпочтительные аминокислотные последовательности с идентичностью <100% с SEQ ID NO: 143 являются ее аллельными вариантами, гомологами, ортологами, паралогами, мутантами и т.д. Предпочтительно, чтобы одно или более различий в аллельных вариантах, гомологах, ортологах, паралогах или мутантах по сравнению с SEQ ID NO: 143, заключало в себе консервативную аминокислотную замену.
Нуклеиновые кислоты
Изобретение относится к нуклеиновой кислоте, кодирующей белок по изобретению, как описано выше. Изобретение также относится к нуклеиновой кислоте, содержащей: (a) фрагмент, по крайней мере, из n следующих один за другим нуклеотидов из указанной нуклеиновой кислоты, где n составляет 10 или более (например, 12, 14, 15, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 500 или более); и/или (b) последовательность, имеющая, по крайней мере, 50% (например, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или более) идентичности последовательности с указанной нуклеиновой кислотой.
Более того, изобретение относится к нуклеиновой кислоте, которую можно гибридизовать до нуклеиновой кислоты, кодирующей белок по изобретению, предпочтительно при "строгих" условиях (например, 65°C в 0,1×SSC, 0,5% раствор SDS).
Нуклеиновые кислоты по изобретению можно использовать в реакциях гибридизации (например, нозерн- или саузерн-блотах, или микроматрицах с нуклеиновыми кислотами или «генных чипах») и реакциях амплификации (например PCR, SDA, SSSR, LCR, TMA, NASBA и т.д.) и других методиках с нуклеиновыми кислотами.
Нуклеиновые кислоты по изобретению можно получить множеством способов, например, полностью или частично при помощи химического синтеза, расщепляя более длинные полинуклеотиды с использованием нуклеаз (например, рестрикционные ферменты), из геномных библиотек или библиотек кДНК, из самих бактерий и т.д.
Нуклеиновые кислоты по изобретению могут принимать различные формы, например, одноцепочечные, двуцепочечные, векторы, праймеры, зонды, меченные, не меченные и т.д.
Нуклеиновые кислоты по изобретению предпочтительно представляют собой выделенные или в значительной степени выделенные формы.
Изобретение охватывает нуклеиновую кислоту, содержащую последовательности, комплементарные последовательностям, описанным выше, например, для антисмысловых последовательностей или зондов или для использования в качестве праймеров.
Термин «нуклеиновая кислота» охватывает ДНК и РНК, и также их аналоги, такие как аналоги, содержащие модифицированные основные цепи и также пептидные нуклеиновые кислоты (PNA) и т.д.
Нуклеиновая кислота по изобретению может быть меченной, например, радиоактивной или флуоресцентной меткой. Это особенно применимо, когда нуклеиновая кислота должна использоваться в методиках определения нуклеиновых кислот, например, где нуклеиновая кислота представляет собой праймер или зонд при использовании в таких методах, как PCR, LCR, TMA, NASBA и т.д.
Изобретение также относится к векторам, содержащим нуклеотидные последовательности по изобретению (например, клонирующие или экспрессирующие вектора, такие как вектора, подходящие для иммунизации нуклеиновыми кислотами), и к клеткам хозяина, трансформированным такими векторами.
Дополнительные антигенные компоненты
Композиции по изобретению включают в себя небольшое количество (например, меньше чем t антигенов, где t составляет 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4 или 3) очищенных антигенов серогруппы B. Особенно предпочтительно, чтобы композиция не включала в себя сложные или неопределенные смеси антигенов, например, предпочтительно не включать в композицию везикулы наружной мембраны. Антигены предпочтительно экспрессируют в гетерологичном хозяине и затем очищают.
Композиция по изобретению включает в себя, по крайней мере, два различных белка NMB1870. Она может также включать в себя другой антиген Neisseria, так как вакцина, которая нацелена на более чем один антиген на бактерию уменьшает возможность селекции ускользающих мутантов. Антигены Neisseria для добавления в композиции включают в себя белки, содержащие:
(a) 446 четных SEQ ID (то есть 2, 4, 6,..., 890, 892), описанных в ссылке 6;
(b) 45 четных SEQ ID (то есть 2, 4, 6,..., 88, 90), описанных в ссылке 7;
(c) 1674 четных SEQ ID 2-3020, четных SEQ ID 3040-3114, и всех SEQ ID 3115-3241, описанных в ссылке 8;
(d) 2160 аминокислотных последовательностей с NMB0001 по NMB2160 из ссылки 2;
(e) аминокислотную последовательность, описанную в ссылке 10, 11 или 12;
(f) вариант, гомолог, ортолог, паралог, мутант и т.д. от (a) до (e), или
(g) везикулы наружной мембраны, полученные из N.meningitidis [например, смотри ссылку 139].
Дополнительно к антигенам из Neisseria композиция может включать в себя антигены для иммунизации против других заболеваний или инфекций. Например, композиция может включать в себя один или более из следующих далее антигенов:
- антигены из Helicobacter pylori, такие как CagA [с 18 по 21], VacA [22, 23], NAP [24, 25, 26], HopX [например 27], HopY [например 27] и/или уреаза.
- сахаридный антиген из N. meningitidis серогруппы А, C, W135 и/или Y, такой как олигосахарид, описанный в ссылке 28 из серогруппы C [смотри также ссылку 29] или олигосахарид ссылки 30
- сахаридный антиген из Streptococcus pneumoniae [например, 31, 32, 33].
- антиген из вируса гепатита A, такой как инактивированный вирус [например, 34, 35].
- антиген из вируса гепатита В, такой как поверхностный и/или центральный антигены [например, 35, 36].
- дифтерийный антиген, такой как дифтерийный анатоксин [например, глава 3 ссылки 37], например, му