Основные эфиры жирных кислот и их применение в качестве противовоспалительных или иммуномодулирующих средств
Иллюстрации
Показать всеНастоящее изобретение относится к основным эфирам жирных кислот общей формулы R1-О-CO-A или их фармацевтически приемлемым солям, где R1 представляет собой С10-С24алкенил, и А представляет собой остаток, содержащий, по крайней мере, одну ациклическую или циклическую аминогруппу и/или, по крайней мере, одно гетероароматическое кольцо, содержащее третичный или четвертичный атом азота, и к их применению в качестве противовоспалительных или иммуномодулирующих средств, в частности для лечения иммунологически опосредованного воспаления, а также в качестве адъювантов для антигенов, участвующих в клеточных и гуморальных ответах, 10 н. и 170 з.п. ф-лы, 4 табл., 10 ил.
Реферат
Область, к которой относится изобретение
Настоящее изобретение относится к основным эфирам жирных кислот и к их применению в качестве противовоспалительных или иммуномодулирующих средств, в частности, для лечения иммунологически опосредованных воспалений, а также в качестве адъювантов для антигенов, участвующих в клеточном и гуморальном ответах.
Сокращения: АА: адъювантный артрит; CFA: полный адъювант Фрейнда; DTH: гиперчувствительность замедленного типа; EAE: экспериментальный аутоиммунный энцефаломиелит; GA: ацетат глатирамера; IFA: неполный адъювант Фрейнда; i.v.: внутривенно; МВР: основный белок миелин; MS: рассеянный склероз; MSCH: гомогенат мышиного спинного мозга; OA: олеиловый спирт; PBS: забуференный фосфатом физиологический раствор; s.c.: подкожно.
Предшествующий уровень техники
1. Воспаление
Воспаление обычно делят на три фазы: острое воспаление, иммунный ответ и хроническое воспаление. Острое воспаление представляет собой начальный ответ на повреждение ткани и опосредуется высвобождением гистамина, серотонина, брадикинина, простагландинов и лейкотриенов. Иммунный ответ, который обычно следует за фазой острого воспаления, вырабатывается в том случае, если иммунокомпетентные клетки активируются в ответ на чужеродные организмы или антигенные вещества, высвобождаемые во время острого или хронического воспалительного ответа. Продуцирование иммунного ответа у хозяина может оказывать благоприятное действие, поскольку оно приводит к фагоцитозу или нейтрализации микроорганизмов. Однако это действие может оказаться неблагоприятным, если оно приводит к хроническому воспалению с непрекращающимся патологическим процессом, как это происходит при ревматоидном артрите.
Лечение пациентов, страдающих воспалениями, приводит к замедлению или прекращению процесса повреждения ткани, а также к ослаблению болей, которые являются ведущим симптомом и главной причиной жалоб пациентов.
Противоспалительные средства обычно подразделяются на стероидные или глюкокортикоидные средства и нестероидные противовоспалительные средства (NSAID). Глюкокортикоиды являются сильнодействующими противовоспалительными средствами, но высокая степень токсичности, ассоциированная с кортикостероидной терапией хронического заболевания, ограничивает их применение за исключением некоторых случаев острых воспалительных состояний. Поэтому предполагается, что главную роль в лечении хронических состояний, таких как ревматоидный артрит, должны играть нестероидные противовоспалительные средства.
Примерами нестероидных противовоспалительных средств являются производные аминоарилкарбоновых кислот, арилуксусных кислот, арилмасляных кислот, арилкарбоновых кислот, арилпропионовых кислот, пиразола, пиразолона, салициловой кислоты и некоторые другие производные различных химических соединений, включая специфические противоартритные/противоревматические средства.
Поэтому необходимость в получении новых нестероидных противовоспалительных средств, которые служили бы альтернативой имеющимся в настоящее время противовоспалительным лекарственным средствам, остается в высокой степени актуальной.
2. Вакцины и адъюванты
Лимфоциты представляют собой центральные клетки иммунной системы, ответственные за приобретенный иммунитет, и являются иммунологическими признаками разнообразия, специфичности, иммунологической памяти и способности распознавания "свое"/"чужое". Зрелые В-клетки отличаются от других лимфоцитов по механизму синтеза и по своей способности представлять мембраносвязанные молекулы иммуноглобулина (антитела), которые служат в качестве рецепторов для антигенов. Взаимодействие между антигеном и мембраносвязанным антителом на зрелых "необученных" В-клетках приводит к активации и дифференцировке В-клеточных клонов с соответствующей специфичностью и к последующему продуцированию В-клеточных клонов, на которых отсутствуют указанные мембраносвязанные антитела, но которые секретируют молекулы антитела с той же самой специфичностью связывания с антигеном.
Т-лимфоциты подобно В-лимфоцитам имеют мембранные рецепторы для антигенов. Однако в отличие от мембраносвязанного антитела на В-клетках Т-клеточный рецептор (TCR) не распознает свободного антигена. Вместо этого TCR распознает только антиген, связанный с аутоантигенной молекулой, кодируемой генами в главном комплексе гистосовместимости (МНС). Для распознавания большинством Т-клеток данный антиген должен быть представлен в ассоциации с МНС-молекулами на поверхности антигенпрезентирующих клеток (АРС) или на вирусинфицированных клетках, раковых клетках и трансплантатах.
Подобно В-клеткам Т-клетки экспрессируют специфические мембранные молекулы. Все субпопуляции Т-клеток экспрессируют TCR, комплекс полипептидов, включающих CD3, и в большинстве случаев, могут распознаваться по присутствию одной или другой из двух мембранных молекул CD4 и CD8. Т-клетки, экспрессирующие мембранную гликопротеиновую молекулу CD4, рестриктированы молекулами МНС класса II по распознаванию антигена, связанного с этими молекулами, тогда как Т-клетки, экспрессирующие CD8, димерный мембранный гликопротеин, рестриктированы МНС-молекулами класса I по распознаванию антигена, связанного с этими молекулами.
В общих чертах экспрессия CD4 и CD8 также определяют две главные субпопуляции Т-лимфоцитов. CD4+-Т-клетки обычно функционируют как Т-хелперные (TН) клетки и рестриктированы молекулами МНС класса II; тогда как CD8+-Т-клетки обычно функционируют как Т-хелперные (TС) клетки и рестриктированы молекулами МНС класса I.
TН-клетки активируются путем распознавания комплекса "антиген-МНС класса II" на антигенпрезентирующих клетках. После активации TН-клетка начинает делиться с образованием клона эффекторных клеток, каждая из которых является специфичной к тому же самому комплексу "антиген-МНС класса II". Эти TН-клетки секретируют различные цитокины, которые играют центральную роль в активации В-клеток, Т-клеток и других клеток, участвующих в иммунном ответе.
Изменения профиля цитокинов, продуцируемых TН-клетками, может приводить к изменению типа иммунного ответа, который вырабатывается другими лейкоцитами. Таким образом, исходя из специфических цитокинов, которые секретируются TН-клетками при их активации, эти TН1-клетки подразделяются на две группы: клетки, продуцирующие TН1-ответ с профилем цитокинов, которые поддерживают воспаление и активируют, главным образом, определенные Т-клетки и макрофаги; и клетки, продуцирующие TН2-ответ, который активирует, главным образом, В-клетки и иммунные антителозависимые ответы. Таким образом, TН1-клетки секретируют IL-2, который индуцирует пролиферацию Т-клеток, и цитокины, такие как IFN-γ, которые опосредуют воспаление ткани. В противоположность этому TН2-клетки секретируют IL-4, который активирует В-клетки, продуцирующие антитела определенных изотипов IgG, и ингибируют продуцирование воспалительных TН1-цитокинов, и IL-10, который ингибирует продуцирование воспалительных цитокинов макрофагами и, таким образом, способствует опосредованному снижению уровня продуцирования цитокинов TН1-клетками и влияет на антигенпрезентирующие клетки путем ингибирования экспрессии МНС класса II.
Аутоиммунный ответ является результатом нерелевантного ответа иммунной системы на аутокомпоненты, приводящего к активации аутореактивных клонов Т- или В-клеток, и генерирования гуморальных или клеточно-опосредованных ответов на эндогенные антигены с последующим повреждением клеток тканей и органов. Иногда такое повреждение вызывается антителами, как, например, в случае аутоиммунных расстройств, таких как болезнь Аддисона, аутоиммунная анемия, например, аутоиммунная гемолитическая анемия и пернициозная анемия, тиреоидит Хашимото и склеродермия.
Многие аутоиммунные расстройства, например инсулинзависимый сахарный диабет (IDDM или диабет типа I), рассеянный склероз, ревматоидный артрит и аутоиммунный тиреоидит, характеризуются деструкцией тканей, опосредованной Т-клетками, активированными эндогенным антигеном. Эти иммунные ответы на аутоантигены поддерживаются путем непрерывной активации аутореактивных Т-лимфоцитов.
Аутоиммунные заболевания могут быть подразделены на орган-специфические аутоиммунные заболевания, при которых иммунный ответ направлен на антиген-мишень, являющийся уникальным для конкретного органа или железы, то есть манифестации такого ответа в значительной степени ограничены этим органом; и системные аутоиммунные заболевания, при которых иммунный ответ направлен на антигены-мишени широкого ряда и которые поражают различные органы и ткани. Примерами орган-специфических иммунных заболеваний являются инсулинзависимый сахарный диабет, рассеянный склероз, ревматоидный артрит, тиреоидит и тяжелая миастения, и примерами системных аутоиммунных заболеваний являются системная красная волчанка и склеродермия.
В патогенезе орган-специфических аутоиммунных заболеваний участвуют TН1-клетки. Так, например, имеются убедительные данные, указывающие на то, что экспериментальный аутоиммунный энцефаломиелит у мышей (ЕАЕ) вызывается CD4+-TН1-клетками, специфичными для иммунизирующего антигена, например основного белка миелина (МВР) или протеолипидного белка (PLP). Это заболевание может передаваться от одного животного к другому посредством Т-клеток животных, иммунизованных либо МВР или PLP, либо посредством клонированных Т-клеточных линий таких животных. Очевидно, что TН1-тип ответов также приводят к развитию заболеваний или состояний, опосредованных другими Т-клеточными линиями, таких как контактный дерматит.
В большинстве случаев орган-специфические аутоиммунные заболевания развиваются вследствие аутореактивности CD4+-Т-клеток. Анализ этих Т-клеток выявил, что TН1/TН2-баланс может так или иначе влиять на развитие аутоиммунного заболевания. TН1-клетки участвуют в развитии аутоиммунного заболевания, тогда как TН2-клетки в некоторых случаях не только обеспечивают защиту от развития такого заболевания, но также и защиту от прогрессирования уже развивающегося заболевания и обеспечивают толерантность и поддержание этой толерантности к аллотрансплантату.
Было разработано несколько способов терапевтического лечения аутоиммунных заболеваний. Идентификация и секвенирование различных аутоантигенов послужили стимулом к разработке новых способов модуляции аутоиммунной Т-клеточной активности. Для лечения аутоиммунных заболеваний было предложено использовать все антигены, участвующие в патогенезе аутоиммунного заболевания, или пептиды, происходящие от последовательностей этих антигенов.
Синтетические пептиды, подходящие для иммуноспецифического лечения аутоиммунного заболевания, представляют собой пептиды, распознаваемые Т-клетками, участвующими в патогенезе аутоиммунного заболевания. Эти пептиды могут иметь последовательность, состоящую из патогенной последовательности, находящейся в последовательности антигена, ответственного за данное заболевание, либо аналог этой последовательности, в которой один или несколько нативных аминокислотных остатков заменены другими аминокислотными остатками, в частности так называемый "модифицированный пептид", который имеет одну аминокислотную замену в эпитопе патогенного нативного аналога (то есть области, контактирующей с TCR), но не имеет каких-либо альтераций в агретопе (то есть в области, контактирующей с МНС).
Каждое аутоиммунное заболевание может быть подвергнуто терапии с использованием идеального пептида, происходящего от последовательности антигена, ассоциированного с данным заболеванием, или модифицированного пептида или другого его аналога. Таким образом, для такого заболевания, как рассеянный склероз (MS), в развитии которого участвуют Т-клетки, реагирующие с аутоантигенами, такими как основный белок миелин (МВР), миелиновый гликопротеин олигодендроцита (MOG) и протеолипидный белок (PLP), требуется терапия с использованием пептида МВР, MOG или PLP или их аналога; для тяжелой миастении может потребоваться терапия с использованием пептида, происходящего от ацетилхолинового рецептора; для тиреоидита может потребоваться терапия с использованием пептида, происходящего от тироглобулина; для диабета типа 1 может оказаться подходящей терапия с использованием пептида, происходящего от фермента глутаминовая кислота-декарбоксилаза (GAD), или пептида, происходящего от последовательности инсулина; для системной красной волчанки может потребоваться терапия с использованием пептида, происходящего от белка Р53, и для синдрома Гийена-Барре может потребоваться терапия с использованием пептида, происходящего от миелинового антигена Р2.
В последние годы для лечения таких заболеваний было предложено использовать пептиды, происходящие от патогенного аутоантигена, ассоциирующегося с аутоиммунным заболеванием, или их аналоги. Так, например, для лечения рассеянного склероза было предложено использовать пептиды, происходящие от последовательности МВР человека (патенты США 5817629 и 6252040) и их аналоги (патенты США 5948764 и 6329499); для лечения диабета было предложено использовать пептидные аналоги 65 кДа-изоформы GAD человека или инсулина (патенты США 5945401 и 6197926 соответственно), и для лечения увеоретинита было предложено использовать аутоантиген или его фрагмент (патент США 5961977). Каждый из этих патентов и все патенты, цитируемые выше, во всей своей полноте введены в настоящее описание посредством ссылки.
Для лечения каждого из указанных различных аутоиммунных заболеваний может оказаться необходимым введение релевантного пептида в адъюванте, который мог бы активировать Т-клетки противовоспалительного TН2-фенотипа. Предполагается, что это может приводить к прекращению аутоиммунного процесса. Существуют также определенные ситуации, не связанные с лечением аутоиммунного заболевания, при которых может оказаться желательной активация специфических Т-клеток с TН2-фенотипом. Однако лечение с участием аутоантигенов должно быть проведено с использованием адъювантов, которые не индуцируют иммунный ответ TН1-типа, способный активировать опасный иммунный TН1-ответ у субъекта, подвергаемого лечению. Таким образом, необходимо идентифицировать адъюванты, способные образовывать комбинации со специфическими антигенами, которые будут индуцировать противовоспалительные Т-клетки TН2-типа.
По своей природе адъюванты представляют собой неспецифические иммуномодуляторы. Адъювант, который может быть использован для указанных выше целей, должен представлять собой неспецифический иммуномодулятор, который может быть использован в комбинации с антигеном или с другой молекулой для терапевтической вакцинации в целях индуцирования активации специфических Т-клеток с нужным противовоспалительным фенотипом.
Было показано, что некоторые пептиды, подходящие для их применения в терапии Т-клеточно-опосредованных заболеваний, расстройств или состояний, таких как аутоиммунные заболевания, являются эффективными при их подкожном (s.c.) введении мышам в масляном носителе, таком как эмульсия минерального масла, известная как неполный адъювант Фрейнда (IFA). Однако IFA, а также полный адъювант Фрейнда (CFA; препарат минерального масла, содержащий различные количества инактивированных микроорганизмов Mycobacterium), не могут быть использованы для введения человеку, поскольку минеральное масло не может разлагаться в организме.
Поэтому необходимость в получении эффективных носителей для пептидной терапии, которые могли бы разлагаться и действовать как адъювант, служащий в качестве носителя, депо-препарата или иммуностимулятора/энхансера, остается актуальной.
3. Материалы известного уровня техники
Некоторые жирные спирты и эфиры жирных кислот были описаны как растворители или эмульгаторы, используемые в фармацевтических композициях. Так, например, цетиловый спирт может быть использован в фармацевтических композициях как эмульгирующий и загущающий агент (The Merck Index, 2001, 13th edition, pp.347-8, #2037), олеиловый спирт может быть использован в лекарственных препаратах в качестве носителя (The Merck Index, 2001, 13th edition, p.1222, #6900) и алкиловые эфиры олеиновой кислоты могут быть использованы в лекарственных препаратах в качестве растворителей (The Merck Index, 2001, 13th edition, p.6899, #6898).
Была описана смесь высших алифатических первичных спиртов, выделенных, главным образом, из пчелиного воска, которая обладает умеренной противовоспалительной активностью. Состав такой смеси не указывается (Rodriguez et al., 1998).
Исследования масс-спектров никотинатов длинноцепочечных спиртов, например октадецил- и (Z)-9-октадецен-1-илникотинатов, выявили структуру длинноцепочечных спиртов (Vetter & Meister, 1981). Эти соединения не обладают какой-либо биологической активностью.
Сложные эфиры 4-аминометилбензойной кислоты (PAMBA) и С6-С16-насыщенных спиртов, например дециловых, ундециловых, тетрадециловых и гексадециловых спиртов, были проанализированы на их антифибринолитическую активность, и было установлено, что они не обладают такой активностью (Markwardt et al., 1966). Было обнаружено, что сложные эфиры РАМВА и короткоцепочечных спиртов способствуют снижению пролиферации in vitro культивированных эндотелиальных клеток, и более эффективным является сложный гексиловый эфир (Beyer & Pilgrim, 1991).
Алкил N,N-дизамещенные аминокислоты, например алкил-N,N-диметиламиноацетат, где алкил представляет собой октил, децил, додецил или тетрадецил, и децил(4-метил-1-пиперазигил)ацетат, были описаны как активаторы чрескожной пенетрации индометацина и, возможно, других лекарственных средств (Wong et al., 1989, патент США 4980378).
Комплексы, используемые в генотерапии и содержащие терапевтически активное вещество и катионный липид, такой как четвертичные соединения пиперазиния, замещенные как в положении 1, так и положении 4 метильным или олеилоксикарбонилметильным радикалами, описаны в патенте США 6291423.
Сложные эфиры N,N-диметиламиноуксусной кислоты и длинноцепочечных алканолов, например тетрадециловых, цетиловых и стеариловых спиртов и алкенолов, используемые в косметических средствах для волос, описаны в JP 2000-302650. Однако конкретного описания олеилового эфира не приводится.
Были получены сложные эфиры бетаина [внутренняя соль гидроксида (карбоксиметил)триметиламмония,] и длинноцепочечных спиртов, таких как дециловый, лауриловый, миристиловый, пальмитиловый, стеариловый и олеиловый спирт, и были исследованы их фармакодинамические свойства (Metayer & Jacob, 1952), либо была протестирована их активность в качестве биоцида при обработке охлаждающей водой (Rucka et al., 1983).
Четвертичные аммониевые соли лауриловых, миристиловых и цетиловых сложных эфиров N-карбоксиметилпиперидиновых, -пиперазиновых и -морфолиновых соединений были описаны как гермициды (Smith et al., 1951).
Сложные стеариловые эфиры аминокислот, например глицина, фенилглицина, аланина, валина, лейцина, лизина, пролина, фенилаланина и тирозина, и сложные стеариловые эфиры пептидов были предложены в качестве адъювантов для бактериальных и вирусных вакцин для введения человеку (Penney et al., 1985, 1993; Nixon-George et al., 1990).
Сложные эфиры DL-ω-фениламинокислот и С4-С10алканолов, такие как октиловый или дециловый эфир DL-2-фенилглицина или октиловый эфир DL-2-(4-диметиламинофенил)глицина, были описаны как антифлогистонные, антигистаминовые, спазмолитические, противоокислительные и противовоспалительные (Schulz et al., 1982; Schewe et al., 1991; Kontogiorgis et al., 2001).
Высшие сложные алкиловые эфиры аминокислот, например лауриловый, миристиловый, цетиловый и стеариловый эфиры глицина, фенилглицина, аланина, валина, норвалина, лейцина, изолейцина, лизина и фенилаланина, и их N-низшие алкильные производные описаны в патенте США 3821403 (Misato et al., 1974) как полезные для борьбы с болезнями растений.
Краткое описание изобретения
В соответствии с настоящим изобретением было обнаружено, что некоторые сложные эфиры длинноцепочечных жирных спиртов и карбоновых кислот, содержащих, по крайней мере, одну основную группу, действуют как противовоспалительные иммуномодуляторы, и поэтому они могут быть использованы для лечения воспаления, в частности, иммунологически опосредованного, а также они могут быть использованы в качестве адъювантов в комбинации со специфическими антигенами, участвующими как в клеточном, так и в гуморальном ответах, где указанный адъювант служит в качестве носителя, депо-препарата или иммунного стимулятора/активатора.
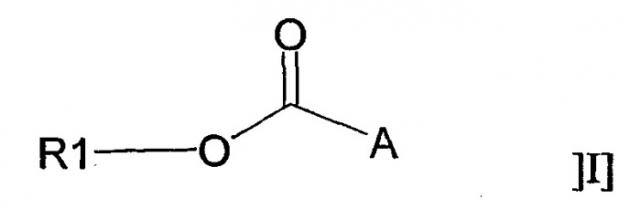
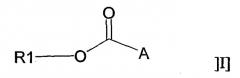
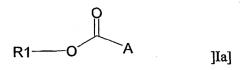
В одном аспекте настоящее изобретение относится к применению соединения общей формулы I:
или его фармацевтически приемлемой соли, где R1 представляет собой С12-С24алкил или С10-С24алкенил, и А представляет собой остаток, содержащий, по крайней мере, одну ациклическую или циклическую аминогруппу и/или, по крайней мере, одно гетероароматическое кольцо, содержащее третичный или четвертичный атом азота, для получения фармацевтической композиции для лечения воспаления.
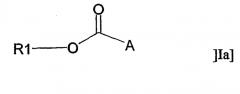
В другом аспекте настоящее изобретение относится к применению адъюванта общей формулы Ia:
или его фармацевтически приемлемой соли, где R1 представляет собой С10-С24алкил или С10-С24алкенил, и А представляет собой остаток, содержащий, по крайней мере, одну ациклическую или циклическую аминогруппу и/или, по крайней мере, одно гетероароматическое кольцо, содержащее третичный или четвертичный атом азота, за исключением соединений, где R1 представляет собой С18алкил и А представляет собой остаток, содержащий, по крайней мере, одну ациклическую аминогруппу, либо -СО-А представляет собой остаток пролина, для получения терапевтического препарата, дополнительно содержащего антиген.
Антигеном, используемым вместе с адъювантом общей формулы Ia, может быть антиген, участвующий в развитии аутоиммунных заболеваний, рака различных типов, таких как меланома, и инфекционных заболеваний, таких как бактериальные и вирусные инфекции. Терапевтический препарат, содержащий такой антиген и адъювант настоящего изобретения, может быть, в частности, полезен для активации Т-клеток для лечения аутоиммунных заболеваний и для достижения Т-клеточно-опосредованных иммунных эффектов, где предпочтительным является иммунный ответ TН2-типа.
Некоторые из этих соединений, представленных вышеуказанными формулами и определенных ниже, являются новыми и сами по себе представляют другой аспект настоящего изобретения.
Краткое описание чертежей
На Фиг.1 проиллюстрировано влияние октадец-(Z)-9-енилового эфира N,N-диметиламиноуксусной кислоты (соединения 1) на адъювантный артрит (AA). Соединение 1 внутривенно (i.v.) вводили крысам Lewis в день иммунизации (день 0, треугольники) или на 14-й день после начала развития AA (день +14, круги).
На Фиг.2 проиллюстрировано влияние соединения 1 на экспериментальный аутоиммунный энцефаломиелит (ЕАЕ). Соединение 1 вводили i.v. крысам DA в день иммунизации (день 0, круги).
На Фиг.3 проиллюстрировано влияние соединения 1 на жизнеспособность кожного аллотрансплантата. Соединение 1 вводили i.v. мышам в день трансплантации (день 0, круги).
На Фиг.4 проиллюстрировано ингибирование реакции гиперчувствительности замедленного типа (DTH) у мышей BALB/c после обработки различными концентрациями (1, 2 или 4 мг) тартрата октадец-(Z)-9-енилового эфира (4-метилпиперазин-1-ил)уксусной кислоты (соединения 3).
На Фиг.5 проиллюстрировано влияние различных концентраций (0,5, 1, 2 или 4 мг) соединений 5, 9 и 11 на DTH у мышей. В качестве позитивного контроля использовали дексаметазон (2 мг), и в качестве негативного контроля использовали гидрохлорид этилового эфира (4-метилпиперазин-1-ил)уксусной кислоты (0,5, 1, 2 или 4 мг).
На Фиг.6 проиллюстрировано влияние подкожного (s.c.) введения различных концентраций (10, 50, 100, 200 мг) соединения 3 на AA у крыс. Для сравнения использовали олеиловый спирт (ОА, 100 мг).
На Фиг.7 проиллюстрировано влияние подкожного (s.c.) введения различных концентраций (10, 50, 100, 200 мг) соединения 3 на ЕАЕ у крыс. Для сравнения использовали олеиловый спирт (ОА, 100 мг).
На Фиг.8 проиллюстрировано влияние введения per os различных концентраций (0,2, 1, 2, 10, 20 мг) соединения 3 на EAE у крыс. Для сравнения использовали олеиловый спирт (ОА, 10 мг).
На Фиг.9 проиллюстрировано влияние введения per os битартрат октадец-(Z)-9-енилового эфира пиперазин-1-илуксусной кислоты (соединения 9, 100 мг/кг) на ЕАЕ у крыс.
На Фиг.10 показано, что соединение 3 стимулирует иммунологические эффекты ацетата глатирамера (GA) у EAE-индуцированных мышей.
Подробное описание изобретения
В соответствии с одним аспектом настоящее изобретение относится к применению соединения общей формулы I:
или его фармацевтически приемлемой соли, где R1 представляет собой С12-С24алкил или С10-С24алкенил, и А представляет собой остаток, содержащий, по крайней мере, одну ациклическую или циклическую аминогруппу и/или, по крайней мере, одно гетероароматическое кольцо, содержащее третичный или четвертичный атом азота, для получения фармацевтической композиции для лечения воспаления.
В одном варианте данного аспекта изобретения в указанном противовоспалительном соединении формулы I остаток А выбран из группы, состоящей из:
(i)
где R2 представляет собой Н, С1-С6алкил, арил или аралкил, где любая арильная группа может быть незамещенной или замещена нитро, циано, галогеном, гидрокси, NR6R7 или СR8R8NR6R7; R3 представляет собой Н, электронную пару или С1-С6алкил; R4 и R5, каждый независимо представляет собой Н или С1-С6алкил, либо R4 и R5, взятые вместе с атомом азота, с которым они связаны, образуют 5-7-членное насыщенное кольцо, необязательно прерываемое атомом кислорода или атомом азота, необязательно замещенным С1-С6алкилом, и R6, R7 и R8, каждый независимо представляет собой Н или С1-С6алкил;
(ii) фенила, замещенного NR6R7 или CR8R8NR6R7, где R6, R7 и R8, каждый независимо представляет собой Н или С1-С6алкил; и
(iii)
где R9 представляет собой Н, низший алкил или индолил(С1-С4)алкил, и Х- представляет собой противоион, либо R9 представляет собой электронную пару, и Х отсутствует.
В другом аспекте настоящее изобретение относится к применению адъюванта общей формулы Ia:
или его фармацевтически приемлемой соли, где R1 представляет собой С10-С24алкил или С10-С24алкенил, и А представляет собой остаток, содержащий, по крайней мере, одну ациклическую или циклическую аминогруппу и/или, по крайней мере, одно гетероароматическое кольцо, содержащее третичный или четвертичный атом азота, за исключением соединений, где R1 представляет собой С18алкил, и А представляет собой остаток, содержащий, по крайней мере, одну ациклическую аминогруппу, либо -СО-А представляет собой остаток пролина, для получения терапевтического препарата, дополнительно содержащего антиген.
В одном варианте данного аспекта изобретения в указанном адъюванте формулы Ia остаток А выбран из группы, состоящей из:
(i)
где R2 представляет собой Н, С1-С6алкил, арил или аралкил, где любая арильная группа может быть незамещенной или замещена нитро, циано, галогеном, гидрокси, NR6R7 или СR8R8NR6R7; R3 представляет собой Н, электронную пару или С1-С6алкил; R4 и R5, каждый независимо представляет собой Н или С1-С6алкил, либо R4 и R5, взятые вместе с атомом азота, с которым они связаны, образуют 5-7-членное насыщенное кольцо, необязательно прерываемое атомом кислорода или атомом азота, необязательно замещенным С1-С6алкилом, при условии, что R4 и R5 не являются Н или С1-С6алкилом, если R1 представляет собой октадецил; и R6, R7 и R8, каждый независимо представляет собой Н или С1-С6алкил;
(ii) фенила, замещенного NR6R7 или CR8R8NR6R7, где R6, R7 и R8, каждый независимо представляет собой Н или С1-С6алкил; и
(iii)
где R9 представляет собой Н, С1-С6алкил или индолил(С1-С4)алкил, и Х- представляет собой противоион, либо R9 представляет собой электронную пару, и Х отсутствует.
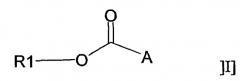
В другом аспекте настоящее изобретение относится к новым соединениям общей формулы:
R1-О-СО-А
где:
(i) R1 представляет собой С20-С24алкил или С10-С24алкенил, и А представляет собой остаток формулы:
где R2 представляет собой Н, С1-С6алкил, арил или аралкил, где любая арильная группа может быть незамещенной или замещена нитро, циано, галогеном, гидрокси, NR6R7 или СR8R8NR6R7; R3 представляет собой Н, электронную пару или С1-С6алкил; R4 и R5, каждый независимо представляет собой Н или С1-С6алкил, либо R4 и R5, взятые вместе с атомом азота, с которым они связаны, образуют 5-7-членное насыщенное кольцо, необязательно прерываемое атомом кислорода или атомом азота, необязательно замещенным С1-С6алкилом, и R6, R7 и R8, каждый независимо представляет собой Н или С1-С6алкил;
(ii) R1 представляет собой С18алкил, и А представляет собой остаток формулы:
где R2 представляет собой Н, R3 представляет собой электронную пару; и R4 и R5, взятые вместе с атомом азота, с которым они связаны, образуют 5-7-членное насыщенное кольцо, необязательно прерываемое атомом кислорода или атомом азота, необязательно замещенным С1-С6алкилом, или
(iii) R1 представляет собой С12-С16алкил, и А представляет собой остаток формулы:
где R2 представляет собой незамещенный арил, либо арил, либо аралкил, где арильная группа замещена нитро, циано, галогеном, гидрокси, NR6R7 или СR8R8NR6R7; R3 представляет собой Н, электронную пару или С1-С6алкил; R4 и R5, каждый независимо представляет собой Н или С1-С6алкил, либо R4 и R5, взятые вместе с атомом азота, с которым они связаны, образуют 5-7-членное насыщенное кольцо, необязательно прерываемое атомом кислорода или атомом азота, необязательно замещенным С1-С6алкилом, и R6, R7 и R8, каждый независимо представляет собой Н или С1-С6алкил;
(iv) R1 представляет собой С10алкил, и А представляет собой остаток формулы:
где R2 представляет собой С1-С6алкил, R3 представляет собой Н, электронную пару или С1-С6алкил; R4 и R5, каждый независимо представляет собой Н или С1-С6алкил, либо R4 и R5, взятые вместе с атомом азота, с которым они связаны, образуют 5-7-членное насыщенное кольцо, необязательно прерываемое атомом кислорода или атомом азота, необязательно замещенным С1-С6алкилом, и R6, R7 и R8, каждый независимо представляет собой Н или С1-С6алкил; или
(v) R1 представляет собой С10-С24алкил или С10-С24алкенил, и А представляет собой фенил, замещенный NR6R7 или СR8R8NR6R7, где R6, R7 и R8, каждый независимо представляет собой Н или С1-С6алкил, за исключением соединений, где R1 представляет собой С10-С16алкил, и А представляет собой фенил, замещенный -СН2-NH2, или
(vi) R1 представляет собой С10-С24алкил или С10-С24алкенил, и А представляет собой группу формулы:
где R9 представляет собой С1-С6алкил или индолил(С1-С4)алкил, и Х- представляет собой противоион;
и их фармацевтически приемлемых солей.
Для ясности, символ *, используемый во всех формулах, имеющихся в настоящем описании и в формуле изобретения, означает положение, в котором присоединена группа -СО- радикала R1-О-СО-.
В соответствии с настоящим изобретением R1 представляет собой С10-С24алкил или алкенил для адъювантов формулы Ia, либо R1 представляет собой С12-С24алкил или С10-С24алкенил для соединений формулы Ia, используемых для лечения воспаления. В обоих случаях R1 предпочтительно представляет собой С12-С20, более предпочтительно С16-С18 и, наиболее предпочтительно С18-алкил или алкенил. Алкильные группы могут быть прямыми или разветвленными, и предпочтительно выбраны из группы, состоящей из додецила, тетрадецила, гексадецила и октадецила, так, чтобы радикалы R1-О- происходили от насыщенных жирных спиртов, таких как лауриловый спирт, миристиловый спирт, цетиловый спирт (также известный как пальмитиловый спирт) и стеариловый спирт соответственно. Алкенильные группы могут иметь одну или несколько двойных связей и предпочтительно выбраны из группы, состоящей из гексадеценила, октадеценила, октадекадиенила и октадекатриенила, так чтобы радикалы R1-О- происходили от ненасыщенных жирных спиртов, таких как пальмитолеиловый спирт, или предпочтительно от ненасыщенных жирных С18-спиртов, имеющих одну или несколько двойных связей, находящихся в транс-форме либо предпочтительно в цис-форме, таких как, но не ограничивающихся ими, олеиловый спирт (цис-9-октадеценол), линолеиловый спирт (цис-9,12-октадекадиенол), γ-линолениловый спирт (цис-6,9,12-октадекатриенол) и линолениловый спирт (цис-9,12,15-октадекатриенол). В наиболее предпочтительном варианте осуществления изобретения R1 представляет собой цис-9-октадеценильный радикал, также называемый октадец-(Z)-9-енилом или олеилом.
Остаток А может включать первичную, вторичную или третичную аминогруппу или четвертичную аммониевую группу, которая может быть ациклической или циклической. Если указанная аминогруппа является ациклической, то полученные соединения представляют собой сложные эфиры аминокислот.
Таким образом, в одном варианте осуществления изобретения в соединениях, составляющих фармацевтические или терапевтические композиции настоящего изобретения, или в некоторых новых соединениях настоящего изобретения А представляет собой радикал формулы:
где R2 представляет собой Н, С1-С6алкил, арил или аралкил, где любая арильная группа может быть незамещенной или замещена нитро, циано, галогеном, гидрокси, NR6R7 или СR8NR6R7; R3 представляет собой Н, электронную пару или С1-С6алкил; R4 и R5, каждый независимо представляет собой С1-С6алкил, либо R4 и R5, взятые вместе с атомом азота, с которым они связаны, образуют 5-7-членное насыщенное кольцо, необязательно прерываемое атомом кислорода или атомом азота, необязательно замещенным С1-С6алкилом, и R6, R7 и R8, каждый независимо представляет собой Н или С1-С6алкил, где ограничения определены выше и в формуле изобретения. Так, например, для адъювантов формулы Ia и для новых соединений R4 и R5 не могут представлять собой Н или С1-С6алкил, если R1 представляет собой октадецил (стеарил); и для новых соединений, если R1 представляет собой С12-С16алкил, то R2 не может представлять собой Н, С1-С6алкил или незамещенный аралкил, либо если R1 представляет собой С10алкил, то R2 не может представлять собой Н, арил или аралкил.
В одном предпочтительном варианте изобретения R2 представляет собой Н. Используемый в данном описании термин "С1-С6алкил" означает прямой или разветвленный алкильный радикал, имеющий 1-6 атомов углерода, такой как, но не ограничивающийся ими, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, пентил и гексил. Используемый термин "арил", взятый отдельно или как часть "аралкильного" радикала, означает ароматический карбоциклический С6-С10радикал, такой как фенил и нафтил. В предпочтительном варианте изобр