Способ электрохимического анализа
Иллюстрации
Показать всеИзобретение относится к способам анализа многокомпонентных растворов в широком диапазоне концентраций и может использоваться в промышленности при анализе технологических растворов и сточных вод, при экологическом мониторинге водных сред, анализе пищевых продуктов и биологических материалов. Предложенный способ включает определение кулонометрической константы электрохимической ячейки для каждого из определяемых компонентов, которые концентрируют на рабочем электроде при постоянном значении потенциала электрода с последующим однократным растворением осадка в потенциодинамическом режиме, определение количества электричества Qti, затраченного на растворение каждого (i-того) осажденного компонента, интегрированием тока растворения по времени и определение количества электричества Q∞i, необходимого для полного выделения каждого из определяемых компонентов с использованием установленных величин кулонометрических констант, после чего по значениям Q∞i, используя закон Фарадея, определяют количество каждого вещества в ячейке и его концентрацию в пробе. Изобретение обеспечивает сокращение времени анализа, повышение точности и чувствительности определения концентрации элементов в растворе в автоматическом режиме. 1 табл., 4 ил.
Реферат
Заявляемое изобретение относится к измерительной технике, а именно к электрохимическому анализу, и может быть использовано в различных отраслях науки и техники, промышленности при создании электроаналитических приборов для анализа любых образцов после переведения их в растворенное состояние, а также для электрохимических исследований многокомпонентных растворов в широком диапазоне концентраций.
Известны различные способы электрохимического анализа, например вольтамперо-метрические, кулонометрические.
Известны способы электрохимического анализа, среди которых методы, включающие стадию электролиза, а именно - кулонометрия при контролируемом потенциале (ККП). ККП не требует градуировки прибора, т.е. построения градуировочных кривых или применения метода добавок.
ККП основана на проведении измерений в условиях изменения концентрации аналита во времени, т.к. при электролизе раствора происходит превращение определяемого вещества под действием электрического тока. Поэтому в кулонометрии используют электроды большой площади, а объем анализируемого вещества минимизируют.
Существует способ, относящийся к постоянной инверсионной потенциометрии, в котором реализован процесс кулонометрического измерения параметров электрохимической ячейки. Упомянутый способ защищен патентом США №5891322, G01N 27/26, приоритет 22.10.1996 г., публикация 06.04.1999 г.
Известный по патенту США №5891322 способ включает потенциометрическое концентрирование ионов металла на поверхности электрода при потенциале, превышающем потенциал поляризации металла, последующее электрохимическое растворение осадка с поверхности электрода в гальваностатическом режиме, повторение по крайней мере дважды цикла осаждения и электрохимического растворения. При этом производится измерение продолжительности каждого цикла электрохимического растворения и протекающего тока. Далее по измеренным токам и временным интервалам вычисляют фарадеевский заряд ионов и концентрацию металла в пробе.
Способ позволяет проводить безэталонные измерения за счет проведения циклов многократного электрохимического растворения и осаждения. Однако этот способ не обеспечивает точного определения "химического тока". При измерении необходимо проводить дифференцирование хронопотенциометрических кривых и далее поиск границ пиков, что существенно усложняет алгоритм измерения и затрудняет автоматизацию процесса измерения.
Наиболее близким по технической сущности к заявляемому способу является способ, защищенный патентом России №2199734, приоритет 04.12.2003, опубликован 27.02.2003. Известный способ электрохимического анализа включает потенциостатическое концентрирование (осаждение) определяемых компонентов на поверхности рабочего электрода, последующее растворение осадка в гальваностатическом режиме со значением потенциала на электроде (U1), соответствующим началу растворения определяемого компонента, до значения потенциала (U2), соответствующего окончанию растворения, второе осаждение до значения потенциала на электроде U1 и растворение в гальваностатическом режиме до значения U2, повторение циклов осаждение-растворение, контроль электрических и временных параметров в циклах и оценку по ним концентрации определяемого компонента в пробе, при этом второе и последующие осаждения проводят в гальваностатическом режиме и контролируют величину тока и временных интервалов осаждения и растворения, циклы осаждение-растворение повторяют до прекращения изменения временных интервалов осаждения или растворения, а оценку концентрации определяемого компонента в пробе осуществляют на основе данных о величине тока и временных интервалов осаждения и растворения в различных циклах, для других определяемых компонентов операции повторяют при соответствующих значениях U1 и U2. Далее рассчитывают количество электричества, количество вещества в растворе и его концентрацию.
Известный по патенту РФ №2199734 способ электрохимического анализа требует проведения по меньшей мере двух циклов измерений для каждого определяемого элемента, что увеличивает время анализа при работе с многокомпонентными растворами.
Заявляемое изобретение решает задачу сокращения времени анализа и повышения точности и чувствительности электрохимического анализа растворов сложного химического состава в широком диапазоне концентраций элементов в растворе в автоматическом режиме.
Поставленная задача решается за счет того, что в способе электрохимического анализа, включающем потенциостатическое концентрирование (осаждение) определяемых компонентов на поверхности рабочего электрода, последующее растворение осадка в гальваностатическом режиме со значением потенциала на электроде (U1), соответствующим началу растворения определяемого компонента, до значения потенциала (U2), соответствующего окончанию растворения, согласно изобретению устанавливают кулонометрическую константу электрохимической ячейки (пробы) для каждого из определяемых компонентов, которые концентрируют на рабочем электроде при постоянном значении потенциала электрода с последующим однократным растворением осадка в потенциодинамическом режиме, определяют количество электричества Qti, затраченное на растворение каждого (i-того) осажденного компонента интегрированием тока растворения по времени и определяют количество электричества Q∞i, необходимое для полного выделения каждого из определяемых компонентов с использованием установленных величин кулонометрических констант, после чего по значениям Q∞i, используя закон Фарадея, определяют количество каждого вещества в ячейке и его концентрацию в пробе.
Наличие отличительных от прототипа признаков позволяет сделать вывод о соответствии заявляемого способа критерию "новизна".
Предложенный способ электрохимического анализа позволяет за один цикл измерений определить количество и концентрацию нескольких веществ, содержащихся в ячейке (пробе), за счет того, что устанавливают кулонометрическую константу для каждого из содержащихся в ячейке (пробе) веществ.
Возможность очень точного определения кулонометрических констант появляется за счет осуществления большого количества измерений и тем самым достигается большая точность. Кроме того, установленные один раз значения констант могут использоваться при дальнейших измерениях все время жизни данной ячейки (пробы).
Использование инверсионно-вольтамперометрического принципа измерений в сочетании с кулонометриметрическим принципом обработки сигнала обеспечивает высокую точность и чувствительность способа. Кроме того, сохраняется возможность обходиться без концентрационной градуировки измерительных приборов и применения метода добавок.
Предлагаемый способ электрохимического анализа может быть реализован на любом вольтамперометрическом анализаторе, имеющем возможность работы в режиме инверсионной вольтамерометрии.
Реализация предлагаемого способа проиллюстрирована следующими чертежами.
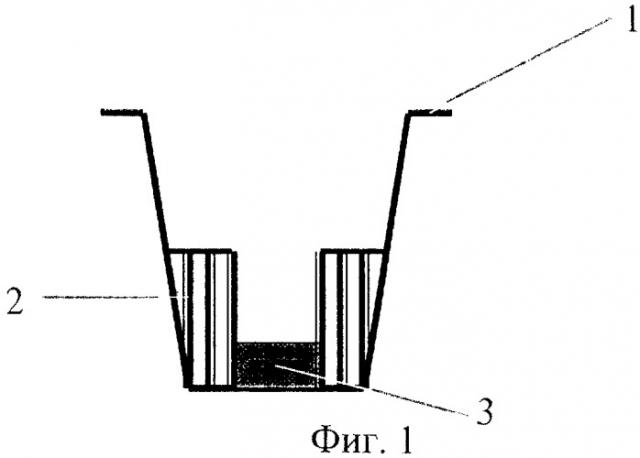
На фиг.1 - измерительная ячейка, где
1 - стеклоуглеродный тигель,
2 - цилиндр из полиэтилентерефталата,
3 - шайба из стеклоуглерода.
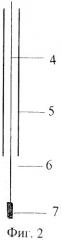
На фиг.2 - конструкция электрода, где
4 - хлорированная серебряная проволока,
5 - термоусадочная трубка,
6 - смесь хлоридов серебра и калия,
7 - фритта.
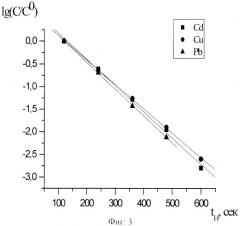
На фиг.3 - зависимость логарифма нормированной концентрации от времени электролиза.
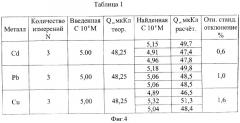
Фиг.4 - таблица, в которой проведены результаты определения ионов кадмия, свинца и меди при их совместном присутствии.
Отработка способа проводилась на полярографе ПУ-1 с датчиком АКВ-07. Измерительная ячейка (фиг.1) - стеклоуглеродистый тигель 1 - одновременно является вспомогательным электродом. Для уменьшения объема анализируемого раствора эта ячейка сконтруирована следующим образом. По центру тигля 1 расположен цилиндр 2 из полиэтилентерефталата, вклеенный с помощью герметика. Дальнейшее регулирование рабочего объема проводилось с помощью шайб 3 из стеклоуглерода или графита. Хлоридсеребряный электрод сравнения (фиг.2) изготовлен из хлорированной серебряной проволоки (4), хлорида калия и хлорида серебра (6), помещенных в термоусадочную трубку (5), нижний конец которой охватывает пористую керамическую фритту (7). В качестве рабочего электрода использован вращающийся дисковый электрод из стеклоуглерода с площадью 0,071 см2.
Кулонометрические константы ki находили следующим образом. В растворе фонового электролита состава, содержащего 5·10-8 М ионов меди, кадмия и свинца, проводили электролиз при потенциале более отрицательном, чем потенциал самого электроотрицательного иона (в данном конкретном случае - 0,9 В относительно хлоридсеребряного электрода сравнения). Затем осуществляли растворение полученного на электроде концентрата в фоновый раствор, не содержащий ионы этих металлов, при потенциале более положительном, чем потенциал растворения самого электроположительного иона (в данном конкретном случае - 0,9 В относительно хлоридсеребряного электрода сравнения). После этого проводили электролиз раствора, содержащего ионы исследуемых металлов, и растворение осадка в раствор фонового электролита, не содержащего ионов Cd, Pb и Cu, при тех же условиях. Последовательный электролиз приводил к изменению концентрации ионов металлов в растворе. По изменению высоты (или площади) пика растворения каждого металла находили изменение его концентрации в растворе.
Определение концентраций компонентов в пробе проводилось следующим образом. Выполняется электролитическое осаждение компонентов при времени электрода t в тех же условиях, что и при нахождении константы, потенциодинамическое растворение всех компонентов с поверхности электрода, нахождение количества электричества Qti, затраченного на растворение каждого компонента, интегрированием величины тока растворения по времени растворения и расчет Q∞i по формуле Q∞i=Qti/(1-e-kt). Далее по закону Фарадея:
где Q - количество электричества, необходимое для выделения на электроде q граммов вещества с молярной массой эквивалента, равной М/n (М - молярная масса вещества, n - число электронов, участвующих в реакции), F - число Фарадея - количество электричества, необходимое для выделения 1 моль любого вещества (F=96500 Кл), рассчитывается количество каждого компонента в растворе и его концентрация.
Для расчета величин кулонометрических констант каждого иона из полученных данных рассчитывалась остаточная концентрация вещества после каждого электролиза в растворе по формуле:
и далее строится график зависимости lgC/C°, t, который приводит к получению прямолинейной зависимости, отвечающей уравнению IgC/C°=-kt. На фиг.3 приведены эти зависимости для меди, кадмия и свинца. Из зависимостей, приведенных на фиг.3, были найдены величины кулонометрических величин для кадмия kCd=5,8*10-3 1/с, для меди kCu=5,4*10-3 1/с и для свинца kPb=5,5*10-3 1/с. Близкие значения констант, найденные для различных ионов, свидетельствуют о хорошей воспроизводимости измерений, так как при одинаковых условиях эксперимента (объеме раствора, площади электрода и условиях перемешивания) величины констант будут различаться соответственно коэффициентам диффузии.
Итак, мы видим, что используя предложенный способ электрохимического анализа, за один цикл измерений можно определить количество и концентрацию нескольких веществ, содержащихся в ячейке, и тем самым решить поставленную задачу - сокращение времени анализа и повышение точности и чувствительности электрохимического анализа растворов сложного химического состава в широком диапазоне концентраций элементов в растворе в автоматическом режиме.
Способ электрохимического анализа, включающий потенциостатическое концентрирование (осаждение) определяемых компонентов на поверхности рабочего электрода, последующее растворение осадка при значении потенциала на электроде (U1), соответствующем началу растворения определяемого компонента, до значения потенциала (U2), соответствующего окончанию растворения, контроль электрических и временных параметров для оценки концентрации определяемого компонента, которую рассчитывают по закону Фарадея, отличающийся тем, что устанавливают кулонометрическую константу электрохимической ячейки для каждого из определяемых компонентов, которые концентрируют на рабочем электроде при постоянном значении потенциала электрода с последующим однократным растворением осадка в потенциодинамическом режиме, определяют количество электричества Qti, затраченного на растворение каждого (i-го) осажденного компонента интегрированием тока растворения по времени и определяют количество электричества Q∞i, необходимое для полного выделения каждого из определяемых компонентов с использованием установленных величин кулонометрических констант, после чего по значениям Q∞i, используя закон Фарадея, определяют количество каждого вещества в ячейке и его концентрацию в пробе.