Способ спектрофотометрического определения концентрации липосомально инкапсулированных фармацевтических препаратов
Иллюстрации
Показать всеИзобретение относится к области исследования и анализа веществ и может быть использовано для определения концентрации исследуемого вещества при разработке новых сложных лекарственных форм фармацевтических препаратов с использованием спектрофотометрического метода. Способ определения концентрации липосомально инкапсулированных фармацевтических препаратов цитостатиков гидрофильной природы включает разрушение липосомальных везикул и последующее измерение концентрации вышедшего в раствор цитостатика, при этом липосомальные везикулы разрушают добавлением к липосомальной суспензии, разбавленной 2М раствором хлорида натрия в соотношении 1:1, 3-кратного объема хлороформа. После чего пробы нагревают до 50-60°С, центрифугируют при 5000 g в течение 5 мин, концентрацию вышедшего в водную фазу цитостатика определяют спектрофотометрически. Изобретение обеспечивает повышение точности определения. 2 табл., 4 ил.
Реферат
Изобретение относится к области исследования и анализа различных веществ, в частности фармацевтических препаратов, и может быть использовано для определения концентрации исследуемого вещества при разработке новых сложных лекарственных форм с использованием спектрофотометрического метода.
Известен способ спектрофотометрического определения концентраций различных индикаторов в воде, в соответствии с которым водный раствор очищают от механических примесей и осветляют центрифугированием, полученный раствор разделяют на равные порции по числу определяемых индикаторов и в каждую порцию добавляют дополнительные реагенты для анализа соответствующих индикаторов, а количественное содержание отдельных индикаторов в исходной пробе определяют по результатам оптических измерений каждой приготовленной порции раствора относительно величины естественного уровня фона при длинах волн, характерных для исследуемых индикаторов, при этом анализ проводят по результатам трех оптических измерений каждой смеси и измерение концентрации отдельных индикаторов при их совместном присутствии в пробе воды осуществляют интерполяционным методом по результатам трех анализов - исходной пробы без добавки и исходной пробы с двумя добавками, сначала фиксированного количества исследуемого индикатора, затем фиксированного количества воды [1].
Недостатком способа является относительно узкая область применения.
Известен также способ, который заключается в дезинтеграции липосомальных везикул нагреванием до температуры 90-100°С [3].
Недостатком этого способа является относительно низкая точность, поскольку возникает обратная интеграция везикул при остывании смеси. В результате липосомальные везикулы и мицеллы формируются заново и часть препарата попадает обратно в липосомы, поэтому в водном растворе можно измерить лишь оставшуюся часть реальной концентрации препарата.
Заслуживает внимания способ осаждения липосом, нагруженных препаратом с помощью протамин сульфата, с последующим спектрофотометрическим определением неинкапсулированного вещества в полученном супернатанте [5].
Однако метод имеет существенные ограничения, связанные с возможностью соосаждения определяемого вещества.
Наиболее близким по своей сущности к предлагаемому является способ, основанный на разрушении липидных везикул в водном растворе цитостатиков путем введения в него 0,05% раствора Тритон-100 и последующем флуориметрического измерения концентрации вышедшего в водный раствор препарата [4].
Недостатком метода является относительно низкая точность, вызванная образование различных мицеллярных форм определяемого препарата, что приводит к серьезным погрешностям в измерениях и вызывает трудности в интерпретации получаемых результатов. Кроме того, Тритон-100 обладает широким спектром поглощения и флуоресценции с несколькими максимумами. Способ имеет также относительно ограниченную область применения, поскольку фармпрепарат должен либо обладать собственным спектром флуоресценции в видимой области, либо быть окрашенным флуоресцентным красителем.
Требуемый технический результат заключается в расширении области применения и повышении точности.
Требуемый технический результат достигается тем, что в способе, основанном на разрушении липосомальных везикул и последующем измерении концентрации вышедшего в водный раствор препарата цитостатика, разрушение липидных везикул проводят путем введения трехкратного объема хлороформа с последующим нагревом и центрифугированием, а измерение концентрации вышедшего в водный раствор препарата производят фотометрическим методом.
Кроме того, требуемый технический результат достигается тем, что разрушение липидных везикул проводят в присутствии 2М раствора хлорида натрия в соотношении 1:1.
Кроме того, требуемый технический результат достигается тем, что нагрев перед центрифугированием проводят до 50-60°С.
Оптическую плотность вышедшего в водную фазу препарата определяют фотометрически по поглощению на спектрофотометре.
На графических изображениях представлены:
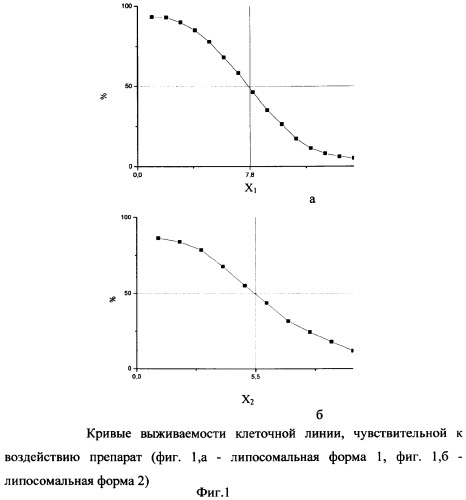
На фиг.1 - кривые выживаемости клеточной линии, чувствительной к воздействию препарат (фиг.1, а - липосомальная форма 1, фиг.1, б - липосомальная форма 2);
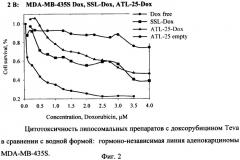
на фиг.2 - цитотоксичность липосомальных препаратов с доксорубицином Teva в сравнении с водной формой (гормононезависимая линия аденокарциномы MDA-MB-435S);
на фиг.3 - цитотоксичность липосомальных препаратов с гексопиранозидами ЛХС-1098аиЛХС-1110а.
Способ спектрофотометрического определения концентрации липосомально инкапсулированных фармацевтических препаратов осуществляется следующим образом.
При изготовлении липосомальных препаратов для загрузки водорастворимых фармпрепаратов применяется технология рН-градиента при инкубации на шейкерной платформе при +45°С в течение 30 мин с последующим охлаждением до +4°С. Для определения концентрации фармпрепарата, попавшего в липосомы и оставшегося внутри, липосомальные везикулы в присутствии 2М буферного раствора хлорида натрия в соотношении 1:1 разрушают (дезинтегрируют) добавлением в суспензию 3-кратного объема хлороформа, затем пробы нагревают до 50-60°С с последующим центрифугированием при 5000g в течение 5 мин.
Оптическую плотность вышедшего в водную фазу препарата определяют спектрофотометрически по поглощению на спектрофотометре, используя в качестве контроля водную фазу, полученную после проведения вышеописанных операций с липосомами без препарата.
Концентрация препарата рассчитывается по формуле Бугера-Ламберта-Бера [6]:
где А(λ) - оптическая плотность (поглощение), нм;
l - оптический путь, см;
См - молярная концентрация вещества, выраженная в моль/л;
'Е - молярный коэффициент экстинкции, М-1 см-1;
откуда СM=Аλ)/'El.
Способ дает возможность количественного определения веществ в двух- и мультикомпонентных системах, то есть, если липосомальный препарат включает не одно, а смесь действующих веществ. Тогда если компоненты препарата не вступают между собой в химические реакции, оптическая плотность раствора представляет собой сумму оптических плотностей компонентов и расчет концентраций компонентов А и В происходит при решении системы уравнений:
Откуда
Для некоторых веществ значения коэффициента экстинкции хорошо известны, и при измерениях нужно только точно воспроизвести условия, в которых они были получены. Для других веществ необходимо рассчитывать молярный коэффициент экстинкции. Это можно сделать, взяв точную навеску и приготовив раствор вещества с известной концентрацией Сcm. Рекомендуется снять спектр водного раствора с известной концентрацией вещества, а затем приступать к измерениям на длине волны, соответствующей одному из максимумов поглощения.
Молярный коэффициент экстинкции рассчитывается по формуле
'Е=A(λ)/Сcml
Или
где A(λ) - оптическая плотность (поглощение), нм;
Mr - молекулярная масса вещества, моль;
mв-ва - масса навески сухого вещества, г;
Vp-pa - объем раствора, л.
Закон Бугера-Ламберта-Бера [6] не выполняется в случаях, когда зависимость A(λ) от СM отклоняется от линейной. Для того чтобы расчет концентрации фармпрепаратов по результатам фотометрического измерения поглощения был правомерен, должны соблюдаться несколько условий:
а) измеряющий световой пучок является монохроматическим;
б) молекулы вещества распределены по всему объему равномерно (истинный раствор) и их количество в невозбужденном состоянии не меняется в ходе измерения;
в) молекулы вещества не изменяют характер взаимодействий между собой и с молекулами растворителя при определяемой концентрации;
г) ослабление выходящего светового пучка происходит только за счет поглощения фотонов, люминесценция, светорассеяние, отражение и т.д. не оказывают существенного влияния на регистрируемый выходящий поток;
д) измеряющий монохроматический пучок не приводит к фотохимическим превращениям молекул вещества (для фотодинамических агентов метод имеет ограничения).
В случае отклонений от закона Бугера-Ламберта-Бера необходимо строить градуировочные графики и рассчитывать относительную ошибку абсорбционного анализа. Например, соотношение между ошибками измерения оптической плотности (ΔАλ) и пропусканием раствора вещества (ΔТ) выражается
Для оценки достоверности полученных данных с применением разработанного нами метода проводили контрольные измерения количества инкапсулированного в липосомы вещества с применение следующих методов.
1. Метод хроматографического разделения незагруженной в липосомы фракции вещества от включенного в липосомы препарата с последующим фотометрическим определением незагруженной фракции (пример 1).
2. Биологический тест, основанный на оценке цитотоксической активности инкапсулированного препарата (пример 2).
В зависимости от природы инкапсулируемого в липосому вещества (сродства к водной фазе) патентуемый метод определения предполагает возможность оценки концентрации широкого спектра соединений, обладающих различным индексом гидрофильно/гидрофобного баланса).
1. Для оценки соединений гидрофильной природы достаточным является количественное фотометрическое определение концентрации препарата в водной фазе, причем в широком диапазоне поглощения (220-620 нм).
2. Для оценки соединений гидрофобной природы достаточным является количественное фотометрическое определение концентрации препарата в органической фазе хлороформа, в диапазоне поглощения (330-620 нм).
3. Для оценки соединений амфифильной природы необходимо количественное фотометрическое определение концентрации препарата в обоих фазах, в диапозоне поглощения (330-620 нм).
Сужение диапазона длин волн, в которых можно проводить количественное определение концентрации вещества, обусловлено тем фактом, что липиды, стерины и жирные кислоты, входящие в состав липосом, также экстрагируются в органическую фазу применяемого растворителя и поглощают в диапазоне от 260 до 310 нм. Это может внести существенную ошибку в измерения и затруднить интерпретацию полученных результатов.
Во всех случаях необходимо проводить измерение контрольных образцов (липосом без препарата) по вышеприведенной схеме.
Пример 1. Определение содержания доксорубицина в липосомальных препаратах ССЛ-Доксорубицин и АТЛ-25-Доксорубицин
Для определения концентрации загруженного доксорубицина дезинтеграция липосомальных препаратов производилась добавлением 3-кратного объема хлороформа при нагревании до 60°С с последующим центрифугированием при 5000g в течение 5 мин. Это делали следующим образом: в 1,5 мл пробирки эппендорф разливали по 100 мкл образцов липосомальной суспензии, разбавленных 1:1 2М раствором NaCl и для контроля - по 100 мкл раствора доксорубицина известной концентрации в 2М растворе NaCl. Далее добавляли в пробирки по 300 мкл хлороформа (производитель - «Борис Авогадро»), нагревали до 60°С и центрифугировали при 5000 g.
где СM - молярная концентрация вещества, выраженная в моль/л,
А(495) - оптическая плотность (поглощение) при 495 нм,
'Е - коэффициент экстинкции доксорубицина, равный 10650 М-1 см-1,
l - толщина образца (оптический путь), см.
Результаты расчетов приведены в табл.1 в графе «Концентрация цитостатика, μМ».
В случае сложных лекарственных форм цитостатиков, одни из которых представляют собой липосомальные препараты, при изучении их цитотоксического и цитостатического эффекта необходимо учитывать несколько факторов, оказывающих влияние на эти эффекты. Основной из них - это концентрация загруженного агента, которая должна быть по возможности максимальной от исходной концентрации препарата в буфере при получении суспензии. В то же время по данным литературы число молекул доксорубицина в одной липосоме составляет 103-104 и концентрация препарата в липосомальной суспензии не может превышать 200 μМ на мл.
| Таблица 1 | ||||||||
| Содержание компонентов препаратов ССЛ, ССЛ-Доксорубицин Лэнс и Teva (Нидерланды), АТЛ-25, АТЛ-25-Доксорубицин Лэнс и Teva | ||||||||
| Характеристика | Стерически стабилизированные | Антиген-направленные | ||||||
| ССЛ "пустые" | ССЛ-Dox | АТЛ-ICO-25 "пустые" | АТЛ-ICO-25-Dox | |||||
| Серия | 19.02 | 13.04 | 22.12 | 24.12 | 22.12 | 24.12 | 07.12 | 22.12 |
| Концентрация цитостатика, μМ | - | - | 41 | 71 | - | - | 64 | 41 |
| Серия | 20.05 | 22.02 | 20.05 | 08.02 | 02.06 | 08.02 | 02.06 | |
| Концентрация цитостатика, μМ | - | 147 | 345 | - | - | 102 | 293 |
Было определено, что в случае больших величин концентрации происходит спонтанное вытекание агента из везикул наружу. По нашим данным для получения устойчивого цитотоксического эффекта in vitro достаточно концентрации инкапсулированного цитостатика 50-100 μM на мл, однако для достижения хорошего противоопухолевого эффекта in vivo концентрации должны быть выше.
Пример 2. Определение содержания индолокарбазол-нуклеозидпроизводных в липосомальных препаратах с расчетом коэффициента экстинкции.
В этом примере требовалось снять спектры и рассчитать коэффициенты экстинкции нуклеозидпроизводных. Молярные коэффициенты экстинкции рассчитывали по формуле (6)
'E=A(λ)Vp-pa/Mr mв-ваl
Далее по той же методике, что и в Примере 1, проводили измерения оптической плотности на длине волны, соответствующей максимуму поглощения, и рассчитывали концентрации препаратов. Результаты измерений иллюстрируются данными, приведенными в Таблице 2.
| Таблица 2 | ||||||||||||
| Содержание компонентов стерически стабилизированных липосомальных препаратов с гидрохлоридами индоло[2,3-а]пирроло[3,4-с] карбазол нуклеозид-производных | ||||||||||||
| Характеристика | Гексопиранозиды | Пентопиранозиды | ||||||||||
| ССЛ-ЛХС-1098а | ССЛ-ЛХС-1110a | ЛХС-1041а | ЛХС-1063а | |||||||||
| Серия | 08.02 | 22.03 | 25.05 | 25.0 5 | 22.02 | 22.03 | 20.07 | 20.07 | 19.02 | 07.03 | 22.02 | 22.03 |
| Концентрация цитостатика, μМ | 257 | 119 | 165 | 144 | 128 | 66 | 50 | 32 | 116 | 48 | 99 | 41 |
| Серия | 15.07 | 19.07 | 19.07 | 17.06 | 17.06 | 14.07 | ||||||
| Концентрация цитостатика, μМ | 74 | 45 | 27 | 95 | 37 | 43 |
Пример 3. Контрольный эксперимент по проверке концентрации инкапсулированного в липосомы препарата
Липосомальный препарат (200 мкл суспензии) наносят на колонку с Sephadex G25 (2 мл), предварительно уравновешенную фосфатно-солевым буфером (рН 7.4). Элюцию липосомальной фракции проводят в объеме 0.3 объема колонки фосфатно-солевым буфером, при наличие проточного фотометра проводят дополнительный контроль полноты элюции по измерению поглощения на 280 нМ. Неинкапсулированную часть вещества (низкомолекулярное соединение (меньше 1 кДа)) элюируют дополнительно 1.5 мл элюирующего буфера. Собранную фракцию не включенного в липосому вещества определяют фотометрически по формуле (1)
A(λ)='ElCн,
где Сн - молярная концентрация вещества, не включенного в липосомы, моль/л (М),
откуда Сн=Аλ)/'El
Абсолютное количество вещества, не включенного в липосомы, определяют по следующей формуле:
Н=Сн·Vэ·Мr
Где H - количество вещества, не включенного в липосомы (г)
Сн - молярная концентрация в-ва, не включенного в липосомы, моль/л (М),
Vэ - объем элюата, содержащего неинкапсулированное вещество,
Mr - молекулярная масса вещества,
Количество вещества, включенного в липосомы, определяют по формуле (5)
где А - количество вещества, включенного в липосомы,
Т - общее количество вещества (г), взятое для получения липосом,
К - пересчетный коэффициент, равный отношению объему суспензии липосом, взятых для исследования количественного содержания инкапсулированного компонента (V1) к тотальному объему раствора полученных липосом (V2) k=V1/V2,
Н - количество вещества, не включенного в липосомы (г),
Данный метод контроля имеет ограничения и может быть применен для соединений гидрофильной и амфифильной природы.
Пример 4. Контрольный эксперимент по оценке цитотоксической активности липосомально инкапсулированного препарата
Метод тестирования цитотоксического эффекта фармпрепаратов in vitro - МТТ позволяет определить концентрацию цитотоксического агента, необходимую для того, чтобы половина клеток в живой культуре погибла (IC50).
Метод является относительным и основан на данных, полученных при оценке цитотоксической активности липосомальных форм препаратов с разным уровнем инкапсуляции (загрузки). Данный контрольный тест является правомочным для оценки точности получаемых количественных результатов с применением патентуемого метода, поскольку имеется четкая зависимость цитотоксического эффекта препарата от его концентрации. Данный метод контроля может быть применен для соединений гидрофильной, гидрофобной и амфифильной природы.
1. Липосомальную фракцию, полученную после инкапсуляции препарата в липосомы, очищают от неинкапсулированного вещества согласно методу, описанному в примере №1.
2. Снимают кривые цитотоксичности двух липосомальных фракций препарата, отличающихся разной степенью инкапсулирования последнего, используя клеточную линию, чувствительную к воздействию препарата. Для сравнительной количественной оценки содержания препарата в липосомах используют показатель титра липосомального препарата, при котором гибнет 50% клеточной популяции (Ic50) (фиг.1).
Вычисляют корреляционный коэффициент K, равный
где X1 - титр липосомального препарата 1,
Х2 - титр липосомального препарата 2.
Такое же соотношение оценивали с помощью патентуемого нами способа определения концентрации инкапсулированного препарата.
где С1 - концентрация инкапсулированного препарата в липосомальной форме 1,
С2 - концентрация инкапсулированного препарата в липосомальной форме 2.
Сравнение полученных корреляционных показателей K1 и K2 показало что данные величины различаются менее чем на 7% (таблица 1, фиг.2, 3).
Таким образом, в предложенном способе достигается требуемый технический результат, заключающийся в расширении области применения и повышении точности, поскольку исключается требование, что фармпрепарат должен либо обладать собственным спектром флуоресценции в видимой области, либо быть окрашенным флуоресцентным красителем. Отсутствие необходимости использования Тритон-100 для дезинтеграции также повышает точность измерений.
При этом для измерения концентрации используется спектрофотометрическое, а не флуориметрическое оборудование, например спектрофотометр Ultraspec-1100 (Amersham). Метод не требует использования дорогостоящих корреляционных спектрофотометров, поэтому стоимость оборудования для пользования им в 3-5 раз меньше, чем при использовании спектрофлуориметрического метода.
Кроме того, расширяется область применения способа, поскольку реализуется возможность определения концентраций как гидрофольных, так и амфифильных и гидрофобных веществ, а также их содержания в мультикомпонентных системах, когда действующий компонент фармпрепарата представлен не одним, а двумя-тремя веществами.
Источники информации
1. RU 2275619 С2, G01N 21/17, 2006.
2. Goren D, Horowitz AT, Tzemach D, Tarshish M, Zalipsky S, Gabizon A. "Nuclear delivery of doxorubicin via folate-targeted liposomes with bypass of multidrug-resistance efflux pump", Clin Cancer Res. 2000 May; 6(5): 1949-57.
3. Gardner S.C. "Delipidation treatment for large-scale protein purification processing" Thesis for MS in Chem. Engineering, Virginia Polytechnic Inst., 1996.
4. Lukyanov AN, Elbayoumi ТА, Chakilam AR, Torchilin VP. "Tumor-targeted liposomes: doxorubicin-loaded long-circulating liposomes modified with anticancer antibody", J. Control Release. 2004 Nov 5; 100(1): 135-44.
5. V.Torchilin and V.Weissig, "Liposomes 2nd eds., A Practical Approach" ed. Oxford Univercity Press, 2003, 384 pp.
6. Дункан А., Горди В., Джонс Н., Матсен Ф., Сандорфи К., Вест В. «Применение спектроскопии в химии». /Под ред. В.Веста. - М.: ИЛ, 1959, с.659-61.
Способ определения концентрации липосомально инкапсулированных фармацевтических препаратов цитостатиков гидрофильной природы, включающий разрушение липосомальных везикул и последующее измерение концентрации вышедшего в раствор цитостатика, отличающийся тем, что липосомальные везикулы разрушают добавлением к липосомальной суспензии, разбавленной 2М раствором хлорида натрия в соотношении 1:1, 3-кратного объема хлороформа, после чего пробы нагревают до 50-60°С, центрифугируют при 5000 g в течение 5 мин, концентрацию вышедшего в водную фазу цитостатика определяют спектрофотометрически.