Рекомбинантная полинуклеотидная последовательность, характеризующая уникальный трансформационный акт между генетической конструкцией, включающей ген cryiiia, и геномной днк картофеля сорта луговской, ее применение и содержащие эту последовательность клетка, трансгенное растение и его потомство
Иллюстрации
Показать всеИзобретение относится к области генетической инженерии и направлено на получение устойчивого к колорадскому жуку и отвечающего условиям биологической и пищевой безопасности трансгенного картофеля на основе высокопродуктивного отечественного сорта и разработку надежного средства для идентификации соответствующего трансформационного события в геноме растения. В результате проведения агробактериальной трансформации картофеля сорта Луговской генетической конструкцией, содержащей ген cryIIIa, и анализа полученных трансгенных растений, проявляющих устойчивость к колорадскому жуку, отобрана трансгенная линия (трансформационное событие) 1210 амк. В геномной ДНК растений данной линии выявлен и просеквенирован фрагмент, относящийся к области встраивания генетической конструкции и представляющий собой рекомбинантную последовательность, одна часть которой относится к введенной генетической конструкции, а другая - к фланкирующему участку геномной ДНК картофеля сорта Луговской. Предложено использовать выявленную рекомбинантную последовательность в качестве идентификатора данного уникального трансформационного события. 5 н.п. ф-лы, 5 ил., 7 табл.
Реферат
Настоящее изобретение относится к области генетической инженерии и биотехнологии растений и связано с получением и идентификацией устойчивого к колорадскому жуку трансгенного картофеля на основе одного из широко используемых (Луговской - 15% посевной площади в промышленных хозяйствах) российских сортов. Результаты реализации данного изобретения могут быть применены в сельском хозяйстве, пищевой промышленности и многих других областях народного хозяйства, использующих картофель в качестве сырья.
Вред, наносимый посевам картофеля колорадским жуком (Leptinotarsa decemlineata, Say), оценивается в 18% потенциального урожая для крупных государственных производителей картофеля и от 40% до 90% для частных производителей, на долю которых согласно экспертной оценке Министерства сельского хозяйства РФ приходится 90% валового сбора картофеля в РФ. Для борьбы с этим вредителем в растениеводстве применяются различные (механические, химические и биологические) методы, однако большинство механических методов не дает желаемого результата, а использование химических агентов, как правило, оказывает неблагоприятное воздействие на окружающую среду, поскольку пестициды обычно не обладают избирательным действием и поражают в равной степени как вредную, так и полезную энтомофауну, и часто являются источником потенциальных канцерогенов и токсинов широкого спектра действия. Наиболее перспективным сегодня представляется решение этой проблемы с помощью биологических методов защиты растений, особенно методов генной инженерии, направленных на получение трансгенных растений, в клетках которых экспрессируется чужеродный белок, обеспечивающий устойчивость растения к колорадскому жуку, в частности эндотоксин Bacillus thuringiensis.
Уровень техники
Bacillus thuringiensis - грам-положительная спорообразующая бактерия, встречающаяся в природе в различных средах обитания: в почве, на поверхности растений, растительных остатках. B.t. можно отличить от других видов рода Bacillus по наличию формирующихся во время споруляции белковых кристаллов, благодаря которым штаммы B.t. являются эффективными естественными инсектицидами. Такой кристалл может состоять из одного или нескольких белков с молекулярной массой примерно 130 кДа.
Важной особенностью кристаллического Bt-белка является то, что его инсектицидное действие проявляется только в организме насекомых, где под действием специфичных ферментов кишечного тракта он распадается с образованием протоксина, от N-конца которого затем отщепляется фрагмент длиной 65-70 кДа и образуется токсичный для насекомого полипептид (5-эндотоксин B.t.). Токсин распознает специфичные рецепторы на клеточной мембране эпителиальных клеток и формирует в ней поры, что приводит к осмотическому лизису и гибели клетки [1].
δ-эндотоксин B.t. является представителем большого семейства гомологичных белков (семейства Cry-белков), которых к настоящему времени идентифицировано более 130 видов [http://epunix.biols.susx.ac.uk/Home/Neil_Crickmore/Bt/index.html].
При этом каждый представитель Cry-белков активен только в отношении нескольких видов насекомых. Специфичность действия обусловлена тем, что каждый конкретный белок способен взаимодействовать только с рецептором определенного типа, однако есть данные, что значительную роль также играет растворимость кристалла [2]. Члены семейства Cry-белков группируются в подсемейства в соответствии с их специфичностью по отношению к различным семействам насекомых. Так, выделены подсемейства белков, токсичные для Diptera (двукрылые), Lepidoptera (чешуйчатокрылые), Coleoptera (жесткокрылые) [3]. Некоторые B.t.-штаммы активны против представителей других групп насекомых, а также представителей круглых червей - нематод и простейших [4].
Производные Bt-белка начали использовать в качестве инсектицидных препаратов в тридцатых годах прошлого века, но широкое распространение они получили только с началом производства в 1950 году препарата «Thuricide» [5]. Несмотря на репутацию экологически безопасных, биопрепараты на основе Bt-белка не нашли широкого применения из-за ряда недостатков, к которым можно отнести следующие:
- низкая стабильность;
- поверхностное действие (невозможность проникновения в растительные ткани);
- узкая специфичность.
Кристаллический белок быстро разрушается под действием ультрафиолетового излучения и теряет свою активность, поэтому, чтобы достичь экономически значимого эффекта, требуется несколько обработок. Биопрепараты на основе Bt-белка являются несистемными инсектицидами и действуют только при прямом контакте, а следовательно, не активны против «минирующих» насекомых. Поскольку сельскохозяйственные культуры обычно подвергаются нападению не одного, а нескольких видов насекомых вредителей, для борьбы с ними применения одного вида Cry-белка может оказаться недостаточно.
Две первые проблемы могут быть решены с помощью создания трансгенных растений, экспрессирующих определенный вид Cry-белка. В таких растениях количество токсина постоянно возобновляется, он присутствует на постоянном уровне во всех тканях, а следовательно, обеспечивает защиту и от «минирующих» насекомых. Проблема же узкой специфичности может быть решена при одновременной экспрессии нескольких Cry-белков с различным спектром действия.
К настоящему времени из штаммов бактерии Bacillus thuringiensis выделено и охарактеризовано более 100 генов, кодирующих белки, токсичные для насекомых, в том числе и жесткокрылых: cryIII, cryVII, cryIX [6]. Путем замены бактериальных ко донов кодонами, предпочтительными для экспрессии в растениях, последовательности бактериальных генов адаптированы к введению в растительные клетки и использованы для трансформации различных видов культурных растений, таких как картофель [7], рапс [8], рис [9], баклажан [10].
Результатом этих работ явилось получение множества генетически модифицированных линий культурных растений, однако лишь немногие из них официально разрешены для пищевого применения [11].
Это связано с тем, что устоявшаяся практика коммерциализации каждого нового трансгенного растения предусматривает осуществление ряда необходимых исследований, в ходе которых выявляется степень биологической и пищевой безопасности генетически модифицированного организма. Только трансгенные линии (трансформационные события), успешно прошедшие такой контроль, могут быть зарегистрированы как коммерческий продукт.
Кроме того, при использовании генетически модифицированных линий различных культурных растений существует проблема четкого пострегистрационного мониторинга, предполагающего необходимость однозначной идентификации конкретного трансформационного события как в трансгенных растениях, так и в получаемых из них продуктах питания [12, 13, 14, 15, 16, 17].
С учетом высокого видового и сортового полиморфизма генома культурных растений и того, что количество мест встраивания экзогенной генетической конструкции в геном реципиента предположительно составляет более 10000, наиболее надежным способом идентификации трансформационного события можно считать определение нуклеотидной последовательности эндогенных участков, непосредственно прилегающих к введенной в геном генетической конструкции (фланкирующих последовательностей) и последующее детектирование этих последовательностей в геноме растения [18].
Очевидно, что успех разработок, связанных с получением трансгенных растений, во многом определяется свойствами реципиента. В этом плане очень важны его способность к регенерации и трансформации, однако при создании генетически модифицированных линий культурных растений обязательно должны учитываться и агротехнические показатели исходного сорта.
Основные районы РФ, возделывающие картофель, характеризуются большим разнообразием агроклиматических условий. В настоящее время в Государственном реестре селекционных достижений РФ имеется большое разнообразие сортов картофеля, способных давать стабильные и высокие урожаи в различных почвенно-климатических условиях. Особенно важное практическое значение имеет правильный подбор сортов с учетом длительности периода вегетации, необходимого для их полного созревания. В основных зонах товарного картофелеводства России поздние сорта (как правило, зарубежной селекции) обычно не успевают вызреть, вследствие чего клубни сильно повреждаются при уборке и плохо хранятся [19].
В связи с этим, работы Центра «Биоинженерия» РАН, направленные на получение трансгенного картофеля, проводятся на основе лучших сортов отечественной селекции, и выполненное в рамках этого направления настоящее изобретение, которое связано с получением снабженного надежным «идентификатором» генетически модифицированного картофеля, устойчивого к колорадскому жуку, представляется весьма актуальным и перспективным для развития отечественного картофелеводства.
Раскрытие изобретения.
Задачей настоящего изобретения было получение трансгенного картофеля, устойчивого к колорадскому жуку и отвечающего условиям биологической и пищевой безопасности, на основе перспективного отечественного сорта картофеля, а также разработка надежного средства для идентификации соответствующего трансформационного события в геноме трансгенного растения и его вегетативного потомства.
Учитывая то, что большинство коммерческих сортов картофеля, в том числе и основные российские сорта, являются трудно трансформируемыми, а также то, что даже при условии осуществления акта трансформации вероятность трансформационного события, при котором уровень экспрессии введенного гена достаточен для проявления соответствующего фенотипического признака, а экспрессия эндогенных генов растения не нарушена, весьма мала, получение положительного результата при решении поставленной задачи не являлось очевидным фактом.
Однако в результате испытаний, в которых в качестве реципиентов было использовано восемь наиболее распространенных из культивируемых в России сортов картофеля отечественной селекции, на основе сорта Луговской заявителем были получены генетически модифицированные линии устойчивого к колорадскому жуку картофеля.
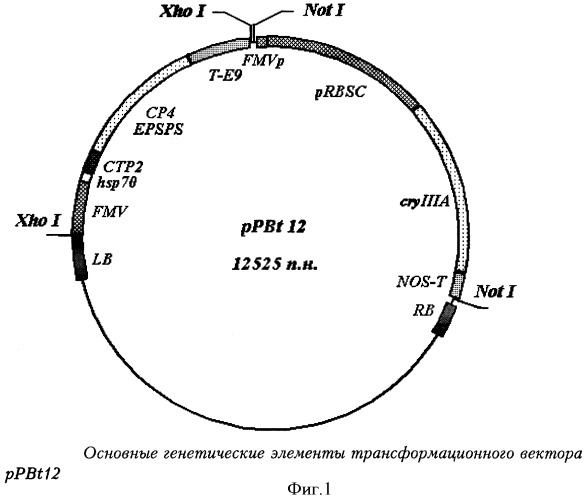
В качестве трансформирующего агента при получении трансгенного картофеля по изобретению использовали бинарный вектор pPBt12, включающий ген cryIIIa. Структура вектора представлена на Фиг.1.
Поскольку процесс трансформации является генотипзависимым, трансформацию сорта картофеля Луговской осуществляли в соответствии с заранее оптимизированным в отношении данного конкретного сорта протоколом [20]. При этом эффективность регенерации (процентное отношение количества полученных регенерантов к общему количеству использованных в эксперименте эксплантов) составила 84,8%, а эффективность трансформации (процентное отношение первичных трансформантов к общему числу регенерантов) по результатам проверки ДНК регенерантов в реакции ПЦР на содержание гена cryIIIa (трансгена) составила 20,8%.
При решении задачи создания надежного «идентификатора» полученного в рамках данного изобретения трансгенного картофеля заявители руководствовались представлением об уникальности трансформационного события (строго определенной комбинации экзогенной и геномной ДНК), определившего новый фенотип растения.
Для выявления вариантов полинуклеотидной последовательности, которые могли бы выполнять роль «идентификатора» уникальных трансформационных событий, результатом которого стало получение генетически модифицированных линий картофеля сорта Луговской, был создан протокол проведения инверсной ПЦР с использованием специфических праймеров, определенных на основании анализа нуклеотидной последовательности переносимой генетической конструкции и позволяющих амплифицировать фрагменты ДНК трансгенных растений, относящиеся к области ее встраивания в геномную ДНК сорта Луговской.
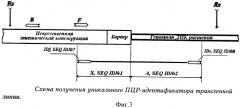
После получения и выделения амплифицированных фрагментов были определены их нуклеотидные последовательности. Оптимальным для выполнения роли «идентификатора» трансгенного картофеля по изобретению (линия 1210 амк, полученная на основе сорта Луговской) был признан фрагмент, который представляет собой комбинацию экзогенной последовательности, включающей сегмент перенесенной синтетической конструкции, и прилежащей к ней (фланкирующей) последовательности геномной ДНК картофеля сорта Луговской (фиг.3).
Полинуклеотидная последовательность отобранного нами «идентифицирующего фрагмента» может быть описана общей формулой Х-А, где
- Х - часть нуклеотидной последовательности введенной генетической конструкции с SEQ ID №1, а
- А - нуклеотидная последовательность фланкирующего участка геномной ДНК картофеля сорта Луговской с SEQ ID №2.
На основании установленных нуклеотидных последовательностей ПЦР-фрагментов геномной ДНК трансгенного картофеля предложен усовершенствованный протокол проведения идентификационной реакции, в которой получение ПЦР-фрагмента длиной 352 нуклеотидов с последовательностью, соответствующей последовательности SEQ ID №1 - SEQ ID №2, возможно только в том случае, если тестируемая геномная ДНК относится к трансформационному событию по изобретению.
Таким образом, предлагаемое изобретение представляет собой группу технических решений, объединяемых общей изобретательской концепцией.
Первый объект изобретения
Рекомбинантная полинуклеотидная последовательность, характеризующая продукт уникального трансформационного события между генетической конструкцией, включающей ген cryIIIa, и геномной ДНК картофеля сорта Луговской, обеспечивающая экспрессию названного гена на уровне, достаточном для проявления у растения признака устойчивости к колорадскому жуку, и имеющая общую формулу Х-А, где Х - часть нуклеотидной последовательности введенной генетической конструкции, соответствующая SEQ ID №1, а А - нуклеотидная последовательность фланкирующего участка геномной ДНК картофеля сорта Луговской, соответствующая SEQ ID №2.
Второй объект изобретения
Клетка растения картофеля сорта Луговской, продуцирующая белок cryIIIa, которая содержит рекомбинантную полинуклеотидную последовательность с общей формулой Х-А, где Х - часть нуклеотидной последовательности введенной генетической конструкции, соответствующая SEQ ID №1, а А - нуклеотидная последовательность фланкирующего участка геномной ДНК картофеля сорта Луговской, соответствующая SEQ ID №2.
Третий объект изобретения - растение устойчивое к колорадскому жуку трансгенного картофеля сорта Луговской, содержащее клетки, которые включают рекомбинантную полинуклеотидную последовательность с общей формулой Х-А, где Х - часть нуклеотидной последовательности введенной генетической конструкции, соответствующая SEQ ID №1, а А - нуклеотидная последовательность фланкирующего участка геномной ДНК картофеля сорта Луговской, соответствующая SEQ ID №2.
Четвертый объект изобретения - вегетативное потомство растения устойчивого к колорадскому жуку трансгенного картофеля сорта Луговской, сохранившее в ряду поколений генотипический признак родительского организма, контролируемый по наличию в геноме рекомбинантной полинуклеотидной последовательности с общей формулой Х-А, где Х - часть нуклеотидной последовательности введенной генетической конструкции, соответствующая SEQ ID №1, а А - нуклеотидная последовательность фланкирующего участка геномной ДНК картофеля сорта Луговской, соответствующая SEQ ID №2.
Пятый объект изобретения - применение рекомбинантной полинуклеотидной последовательности с общей формулой Х-А, где Х - часть нуклеотидной последовательности введенной генетической конструкции, соответствующая SEQ ID №1, а А - нуклеотидная последовательность фланкирующего участка геномной ДНК картофеля Луговской, соответствующая SEQ ID №2, для идентификации генетически модифицированных клеток растения и его вегетативного потомства по изобретению.
Техническим результатом настоящего изобретения является получение производной от отечественного сорта Луговской промышленно применимой линии 1210 амк трансгенного картофеля, устойчивого к колорадскому жуку, обеспеченной надежным средством ее генетической идентификации.
Краткое описание чертежей
Фиг.1 - схема основных генетических элементов трансформационного вектора pPBt12.
Обозначения:
LB - левая фланкирующая последовательность плазмиды Ti A.tumifasciens [27];
FMV - 35S промотор вируса мозаики норичника [28];
Hsp70 - нетранслируемая лидерная последовательность белка теплового шока петуньи hsp 70 [29];
СТР2 - N-терминальный хлоропластный транзитный пептид гена EPSPS Arabidopsis thaliana [30];
СР4 EPSPS - кодирующая область маркерного гена (ген aroA) из бактерии Agrobacterium sp.ssp.CP4 [31];
Т-Е9 - 3'-нетранслируемый район гена малой субъединицы Е9 RuBisCo гороха - терминатор [32];
FMVp - часть энхансерной последовательности промотора 35S вируса мозаики норичника [33];
pRBSC - промотор гена малой субъединицы 1А RuBisCo из Arabidopsis thaliana [34];
cryIIIA - кодирующая последовательность целевого гена cryIIIa [35];
NOS-T - 3'-терминальная область гена нопалин синтетазы (NOS) Arabidopsis thaliana [36];
RB - Правая фланкирующая последовательность - плазмиды Ti A.tumifasciens [37].
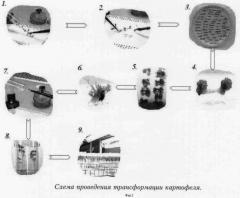
Фиг.2 - схема трансформации картофеля.
Обозначения:
1 - стерильное растение картофеля;
2 - подготовка эксплантов;
3 - со-культивация эксплантов со штаммом агробактерии;
4 - каллус в увеличенном виде;
5 - регенерация;
6 - регенеранты в увеличенном виде;
7 - отбор регенерантов на селективной среде;
8 - отбор трансформантов;
9 - готовая коллекция трансгенных линий.
Фиг.3 - схема получения уникального ПЦР-идентификатора трансгенной линии.
Обозначения:
Rs - сайт разрезания рестриктазой; F, R - праймерная пара для инверсной ПЦР;
Бордер - фланкирующая последовательность вектора; IDf, IDr - праймерная пара для идентификационной ПЦР; А, Х - фрагменты идентификатора трансгенной линии (по п.1 формулы).
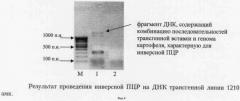
Фиг.4 - Результат проведения инверсной ПЦР на ДНК трансгенной линии 1210 амк.
Обозначения:
М - маркер молекулярной массы ДНК;
1 - продукты ПЦР на препарате ДНК, обработанном рестриктазой PstI, праймерная система отличная от F-R;
2 - контроль чистоты реакции.
Слева указаны положения фрагментов маркера молекулярной массы ДНК.
Стрелкой указан фрагмент, соответствующий специфическому продукту инверсной ПЦР.
Фиг.5 - Результат проведения идентификационной ПЦР с праймерами IDf-IDr на ДНК различных растений картофеля.
Обозначения:
М - маркер молекулярной массы ДНК;
12 - продукт ПЦР на препарате ДНК линии 677234 трансформированного картофеля;
1-11, 13, 14 - продукты ПЦР на препаратах ДНК других линий картофеля.
Стрелка (352 п.н) указывает на пложение искомого продукта ПЦР. Слева указаны положения фрагментов маркера молекулярной массы ДНК.
Осуществление изобретения.
Пример 1. Трансформация растений картофеля сорта Луговской.
Культура исходных растений
Исходные растения, свободные от вирусной и вироидной инфекции в количестве 100 шт., культивировали в асептических условиях в культуре in vitro. Для этого стебли исходных растений нарезали на черенки с одной пазушной почкой и культивировали в вегетационных сосудах на питательной среде, содержащей минеральные соли и витамины (среда Msbase, табл.1) при температуре +18-21°С±1°С в дневное и +15-18°С±1°С в ночное время; фотопериодичности 16 часов день/8 часов ночь (освещенность 120 μЕ) 3-5 недель.
Для трансформации использовали штамм Agrobacterium tumefaciens GV, содержащий плазмиду pPBt12, в состав кассеты экспрессии которой входят промотор FMV, энхансер HSP70+CTP, синтетический аналог гена СР4, терминатор Е9, промотор SSU1A, ген cryIIIa и терминатор NOS, объединенные в генетической конструкции, как показано на Фиг.1.
Подготовка штамма.
Подготовку штамма A.tumefaciens GV проводили следующим образом. Засевали штамм A. tumefaciens GV, штрихом на питательную среду LB (табл.4), содержащую селективные антибиотики стрептомицин, спектиномицин и канамицин в концентрации 50 мг/л каждого, хлорамфеникол в концентрации 25 мг/л, на 3±0,5 суток в темноте, при +26С±1°С.
За два дня до планируемой трансформации засевали смесью колоний первую (I) ночную культуру штамма A.tumefaciens GV объемом 6 мл±0,2 в питательной среде LB (табл.4), содержащей селективные антибиотики стрептомицин, спектиномицин и канамицин в концентрации 50 мг/л каждого, хлорамфеникол в концентрации 25 мг/л, при +26°С±1°С, 100-140±10 об/мин.
За день до сокультивации засевали вторую (II) ночную культуру объемом 6±1 мл. Для этого вносили в питательную среду LB (табл.4), содержащую селективные антибиотики стрептомицин, спектиномицин и канамицин в концентрации 50 мг/л каждого, хлорамфеникол в концентрации 25 мг/л, ночную культуру I в количестве 1/100 от конечного объема. Культивировали при +26°С±1°С и 100-140±10 об/мин.
Первый день трансформации
Концентрировали ночную культуру II, осадив при 3,5±0,5 тыс.об/мин в течение 3±1 мин. Разводили полученный осадок в 5±1 мл жидкой среды (среда СМ, табл.1). Нарезали стебель на сегменты без пазушных почек длиной 5-10±2 мм. Для проведения этапа сокультивации в чашки Петри помещали стерильные бумажные фильтры, равномерно смачивали их небольшим количеством разведенной суспензии штамма A.tumefaciens GV (2±0,5 мл).
Экспланты, полученные из 100 исходных растений, в количестве 564 штук раскладывали на влажном фильтре (по 20-25 штук на одну чашку) для сокультивации на 48±4 часов при 18-21°С±1°С. В контрольном варианте вместо суспензии штамма А.tumefaciens GV использовали такое же количество жидкой питательной среды (среда СМ, табл.1). После проведения этапа сокультивации экспланты не отмывали, так как это не было необходимо.
Третий день трансформации
После сокультивации помещали экспланты на питательную среду (среда CIM, табл.1) для инициации каллусообразования.
Использовали в питательной среде для инициации каллусообразования зеатин в концентрации от 0,3 до 0,9±0,1 мг/л, БАП в концентрации от 0,3 до 0,9±0,1 мг/л и НУК в концентрации от 0,02 до 0,04±0,01 мг/л.
Восьмой день трансформации
Переносили экспланты на чашки со средой RM для регенерации (среда RM, табл.1) с добавлением селективного агента глифосата (N - фосфонометилглицин) в концентрации 4,23 мг/л. В качестве селективного агента использовали глифосат, так как генетическая конструкция содержит синтетический аналог гена СР4 EPSPS, кодирующий фермент 5-енолпирувилшикимат-3-фосфат синтаза, экспрессия которого обеспечивает устойчивость к глифосату.
Для тестирования эффективности процесса регенерации в контрольных вариантах использовали среду для регенерации без добавления селективного агента (среда RM, табл.1).
Использовали в питательной среде для регенерации зеатин в концентрации от 0,3 до 0,9±0,1 мг/л, БАП в концентрации от 0,3 до 0,9±0,1 мг/л и ГКз в концентрации от 0,02 до 0,04±0,01 мг/л.
Через каждые 14 дней
переносили экспланты на свежие чашки Петри со средой для регенерации того же состава.
При появлении регенерантов
срезали регенеранты и переносили их в пробирки, содержащие среду для укоренения (среда RIM, табл.1).
Первичные регенеранты в количестве 476 штук, укоренившиеся на селективной среде, содержащей глифосат в концентрации 4,23 мг/л, считали прошедшими первичный отбор.
Таким образом, эффективность регенерации составила 85%.
Для приготовления сред, представленных в табл.1, готовили раствор MS-солей в деионизованной воде, доводя рН до значения 5,6-5,8±0,1 с помощью растворов 1N КОН и 1N HCl. Стерилизацию сред осуществляли в автоклаве при 1 атм, 121°С в течение 20 минут. После охлаждения среды до +45-50°С добавляли витамины (табл.3), гормоны, антибиотики и селективные агенты (методика приготовления и концентрации исходных растворов см. табл.2) соответственно составу сред и заливали чашки Петри (⊘ 9 см) по 20±5 мл среды в каждую.
| Таблица 1. | |||||
| Состав питательных сред для поддержания культуры in vitro и трансформационного процесса | |||||
| Компоненты | Среда MSbase | Среда СМ | Среда CIM | Среда RM | Среда RIM |
| MS-соли** | + | + | + | + | + |
| Сахароза | 10 мг/л | 30 мг/л | 30 мг/л | 30 мг/л | 30 мг/л |
| Агар | 8-9 мг/л | 8-9 мг/л | 8-9 мг/л | 8-9 мг/л | 8-9 мг/л |
| Витамины | + | + | + | + | + |
| НУК | - | 0,01÷0,04 мг/л | 0,02÷0,04 мг/л | - | - |
| Зеатин | 0,3÷0,9 мг/л | 0,3÷0,9 мг/л | 0,3÷0,9 мг/л | ||
| БАП | 0,3÷0,9 мг/л | 0,3÷0,9 мг/л | 0,3÷0,9 мг/л | ||
| ГК3 | - | - | - | 0,02÷0,04 мг/л | - |
| AgNO3 | - | - | 10 мг/л | 10 мг/л | - |
| Селективный агент, фосфинотрицин | - | - | 10 мг/л | 10 мг/л | 10 мг/л |
| Антибиотик, подавляющий агробактерию (Cb и/или Cf) | - | - | 500 мг/л | 500 мг/л | 500 мг/л |
| ** [21] |
| Таблица 2. | ||
| Приготовление и условия хранения компонентов питательных сред | ||
| Исходные растворы (стоки) 100 мл | Методика приготовления | Хранение |
| Канамицин (Km), 100 мг/мл | Растворить в MQ Н2О* | -20°С*** |
| Хлорамфеникол (Ch), 25 мг/мл | Растворить в этаноле | -20°С |
| Спектиномицин (Sp), 50 мг/мл | Растворить в MQ Н2О | -20°С |
| Стрептомицин (St), 50 мг/мл | Растворить в MQ Н2О | -20°С |
| Карбенициллин (Cb), 100 мг/мл | Растворить в MQ Н2О | -20°С |
| Цефотаксим (Cf), 100 мг/мл | Растворить в MQ Н2О | -20°С |
| НУК (NAA), 0,02 мг/мл | 20 мг порошка + 1 мл 1N NaOH до 100 мл Н2О** | 0°С |
| БАП (ВАР), 1 мг/мл | 100 мг + 1 мл 1N NaOH до 100 мл Н2О** | 0°С |
| ГКЗ (GA3), 0,02 мг/мл | 20 мг порошка + 100 мл 50% этанола** | 0°С |
| Зеатин рибозид (Zeatin), 1 мг/мл | 100 мг порошка + 1 мл 1N NaOH до 100 мл Н2О** | 0°С |
| Глифосат (Gly), 8,455 мг/мл | 84,55 мг порошка + 1 мл IN КОН + до 100 мл MQ H2O | -20°С |
| * - деионизированная вода с помощью установки Milli Q; ** - стерилизовать фильтрованием с помощью мембранных фильтров (Millipore, диаметр пор 0,22 мкм); | ||
| *** - стоки антибиотиков хранятся 1 месяц при 4°С; при -20°С большинство антибиотиков сохраняют стабильность в течение нескольких месяцев. |
| Таблица 3. | |
| Состав комплекса витаминов | |
| Ингредиент | Концентрация, мг/л |
| Никотиновая кислота | 1,0 |
| Пиридоксин * HCl (витаммин В6) | 1,0 |
| Тиамин (витамин В 1) | 1,0 |
| Пантотенат кальция | 1,0 |
| Инозитол | 50,0 |
| Биотин | 1,0 |
| Глицин | 2,0 |
| Фолиевая кислота | 0,5 |
| Таблица 4. | |
| Состав питательной среды Luria-Bertani | |
| Компоненты | Концентрация, г/л |
| Хлорид натрия NaCl | 10,0 |
| Триптон | 10,0 |
| Дрожжевой экстракт | 5,0 |
| Бакто агар | 15,0 |
Пример 2. Подтверждение трансгенной природы полученных регенерантов с помощью ПЦР-анализа.
ПЦР-анализ трансгенных линий
Прошедшие отбор первичные регенеранты в количестве 476 штук проверяли на наличие перенесенной генетической конструкции при помощи ПЦР-анализа с праймерами, специфичными для кодирующей области трансгенной конструкции. Для ПЦР-анализа генома растений на наличие гена cryIIIa использовали праймерную систему pr1 (SEQ ID №3) - pr2 (SEQ ID №4). При условии включения гена cryIIIa в геномную ДНК картофеля применение указанной праймерной пары при проведении ПЦР должно было приводить к образованию фрагмента ДНК длиной 1108 пары нуклеотидов. В случае необходимости провести более детальный анализ получаемых продуктов ПЦР дополнительно мог быть использован рестрикционный анализ.
При расщеплении рестриктазой Pvu II ПЦР-продукт, соответствующий трансгенной вставке, должен распадаться на два фрагмента размером 278 и 830 пар нуклеотидов.
Протокол выделения ДНК.
Для выделения ДНК 25-50 мг растительной ткани (листовая пластинка) растирали в гомогенизаторе в 120 мкл буфера I (50 mM Tris HCl, рН8.0; 10 тМ EDTA; 50 мкг/мл панкреатической РНКазы) до получения гомогенной суспензии. Затем к полученной суспензии добавляли 125 мкл лизирующего буфера II (0.2 М NaOH; 1% додецил сульфата Na). Полученную смесь обрабатывали на качающейся платформе 2 минуты при комнатной температуре +18-21°С±1°С. Далее переносили пробирки в термостат и инкубировали при 65°С в течение 45 минут. По окончании инкубации пробирки охлаждали до температуры 20-25°С и добавляли в каждую по 125 мкл нейтрализующего раствора III (2.5 mM ацетата К, рН 4.5). Содержимое пробирок тщательно перемешивали на качающейся платформе и центрифугировали при 14000 об/мин в течение 10 минут. Надосадочную жидкость переносили в новые микроцентрифужные пробирки, содержащие 500 мкл смолы Wizard MaxiPreps, и далее выделяли ДНК согласно рекомендациям фирмы Promega для набора Wizard Preps. Концентрация ДНК в получаемых препаратах составляла 100-300 мкг/мл. Полученные препараты ДНК были хорошего качества (λ260:λ280>1.8), были пригодны для амплификации и согласно данным электрофоретического анализа содержали РНК в следовых количествах (менее 1%).
Протокол проведения ПЦР.
Были выбраны следующие условия проведения ПЦР:
первый цикл: 94°С - 1 мин, 55°С - 1 мин, 72°С - 1 мин,
последующие 35 циклов: 94°С - 15 с, 55°С - 15 с, 72°С - 20 с,
окончательная полимеризация: - 7 мин.
Анализ продуктов ПЦР проводили при помощи электрофореза в 1% геле агарозы при напряженности электрического поля 6 В/см. Документирование результатов осуществлялось на установке гель - документации BioDoc II (Biometra, Германия). Появление ПЦР-продукта длиной 1108 нуклеотидов (при условии отсутствия его в реакциях, поставленных на контрольной ДНК) свидетельствовало о присутствии искомого гена в геномной ДНК анализируемого растения.
Наличие трансгена было подтверждено для 99 из 476 проанализированных регенерантов. Таким образом, эффективность трансформации составила 20,8%.
Пример 3. Определение уровня экспрессии целевого гена (cryIIIa) в трансгенных растениях.
Для количественного определения уровня экспрессии целевого гена в растениях трансгенной линии использовали метод иммуноферментного анализа.
Получение разведении белка CryIIIa для стандартной кривой титрования.
Перед титрованием стандартного белка CryIIIa исходный раствор с концентрацией 500 мкг/мл разводили в 500 раз (получали раствор А - 1 мкг/мл). Ряд дальнейших разведений для получения стандартной кривой ИФА готовили в соответствии с приведенной ниже табл.5.
| Таблица 5. | |||||||
| Схема разведений стандартного белка | |||||||
| №№ разведений | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Концентрация cryIIIa, мг/мл | 16 | 8 | 4 | 2 | 1 | 0,5 | 0,25 |
| Разведение | 1 | 2 | 4 | 8 | 16 | 32 | 64 |
| № добавляемого р-ра | Буфер | 1 | 2 | 3 | 4 | 5 | 6 |
| Объем добавл. р-ра, мкл | 20 | 400 | 400 | 390 | 350 | 300 | 200 |
| Объем ELISA буфера, мкл | 1230 | 400 | 400 | 390 | 350 | 300 | 200 |
| Суммарный объем смеси, мкл | 1250 | 800 | 800 | 780 | 700 | 600 | 400 |
| Объем остающегося р-р, мкл | 850 | 400 | 410 | 405 | 400 | 400 | 400 |
Получение разведений гомогената растительной ткани для проведения анализа.
Для получения гомогената 25-50 мг растительной ткани (листовая пластинка) растирали в микропробирке на микрогомогенизаторе растительных тканей ПСА RW16 basic в 1х буфере PBS (80 г NaCl, 21.68 г Na2HPO4(x7H2O), 2 г КН2PO4, 2 г KCL, рН 7.3-7.5; 20 г БСА на 1 литр 10-кратного раствора) до получения гомогенной суспезии в соотношении 1 мг ткани на 24 мкл буфера (первичное разведение 1:25). Растирание проводили до получения однородной суспензии без видимых невооруженных глазом неоднородностей.
Ряд дальнейших разведений исследуемого препарата для проведения ИФА готовили в соответствии с табл.6.
| Таблица 6. | |||||||
| Схема разведении исследуемого препарата | |||||||
| №№ | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Концентрация ткани, мг/мл | 1,6 | 0,8 | 0,4 | 0,2 | 0,1 | 0,05 | 0,025 |
| Разведение | 1 | 2 | 4 | 8 | 16 | 32 | 64 |
| № добавляемого р-ра | В | 1 | 2 | 3 | 4 | 5 | 6 |
| Объем добавл. р-ра, мкл | 32 | 400 | 400 | 390 | 350 | 300 | 200 |
| Объем ELISA буфера, мкл | 768 | 400 | 400 | 390 | 350 | 300 | 200 |
| Суммарный объем смеси, мкл | 800 | 800 | 800 | 780 | 700 | 600 | 400 |
| Объем остающегося р-ра, мкл | 400 | 400 | 410 | 405 | 400 | 400 | 400 |
Подготовка иммунологических плашек для проведения анализа.
Исходный раствор (1 мг/мл) поликлональных антител против целевого белка перед покрытием ячеек разводили в 1000 раз. В каждую ячейку плашки наносили по 200 мкл разведенных антител и инкубировали плашку при комнатной температуре в течение 4 часов.
Блокировка ячеек плашки.
Для предотвращения неспецифической сорбции белка после окончания инкубации с поликлональными антителами плашку промывали трижды буфером 1х PBS и наносили в каждую ячейку по 200 мкл 0,2% раствора БСА в 1х PBS с 0,05%. Инкубировали плашку при комнатной температуре в течение 4 часов и трижды промывали буфером 1х PBS. Далее приготовленную плашку хранили при +4°С до момента использования не более 3 суток.
Д. Загрузка плашек исследуемым препаратом.
В соответствующие ячейки плашки вносили по 200 мкл разведений 2-7 стандарта и разведений 2-7 исследуемого гомогената. Нанесения и для стандарта, и для исследуемого образца проводили дважды в независимые ячейки плашки. Инкубировали плашку при комнатной температуре в течение 4 часов или при +4°С в течение ночи. По окончании инкубации трижды промывали ячейки плашки буфером 1х PBS.
Выявление результатов ИФА.
В каждую ячейку плашки вносили по 200 мкл разведенного в 1000 раз раствора конъюгата антител и инкубировали плашку при комнатной температуре +18-21°С±1°С в течение 4 часов или при +4°С в течение ночи. По окончании инкубации трижды промывали ячейки плашки буфером 1х PBS. Далее добавляли в каждую ячейку по 200 мкл раствора хромагена и инкубировали плашку при комнатной температуре, периодически проверяя оптическую плотность раствора в ячейках на плашечном спектрофотометре при длине волны 405 нм. По достижению оптической плотности 1,0-1,2 инкубирование прекращали и проводили окончательное измерение оптической плотности раствора в ячейках.
Ж. Интерпретация результатов ИФА.
Для выявления трансгенных линий картофеля с уровнем экспрессии целевого гена более 10 мкг/г ткани проводили сравнение оптической плотности раствора в ячейках, содержащих одинаковые разведения стандарта и исследуемого раствора. Случаи, когда оптическая плотность раствора в обоих разведениях 5 и 6 исследуемого образца превышала значения оптической плотности соответствующих разведений стандарта, были интерпретированы как уровень экспрессии целевого белка более 10 мкг/г ткани.
Было выявлено 56 трансгенных линий с уровнем экспрессии белка CryIIIa, меньшим или равным 10 мкг/г ткани, и 43 трансгенные линии с уровнем экспрессии белка CryIIIa более 10 мкг/г ткани, которые были переданы для дальнейших исследований.
Пример 4. Получение трансгенной линии.
Полевые испытания.
В 2000 году были проведены ограниченные полевые испытания (зарегистрированный участок №09-П/1999) с целью размножения и наработки клубневого материала полученных трансгенных растений картофеля сорта Луговской.
В период с 2001 по 2003 годы на зарегистрированных МВК ГИД участках №09-П/1999 (ВНИИ Фитопатологии РАСХН, пос. Б.Вяземы, Московская обл.) и №07-П/2002 (Агрофирма «Рогачево», Дмитровский р-н, Московская обл.) были проведены ограниченные полевые испытания полученных трансгенных линий картофеля сорта Луговской. Испытания проводили с целью подтвердить проявление внесенного признака в полевых условиях и отобрать линии, соответствующие исходному сорту по оценке отличимости, однородности и стабильности по международной системе UPOV [22].
По результатам проведенных полевых испытаний 2001-2003 гг. были отобраны 13 линий картофеля сорта Луговской, проявляющие выраженную устойчивость к колорадскому жуку и при этом сохраняющие свойства исходного сорта. Отобранные линии были переданы на анализ копийности вставки гена cryIIIa.
Пример 5. Анализ на копийностъ вставки гена cryIIIa методом гибридизации по С