Гиполипидемическое и противоишемическое средство "серпистен"
Иллюстрации
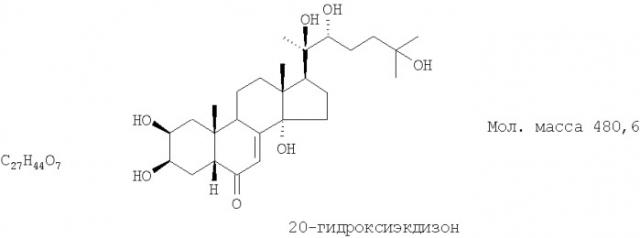
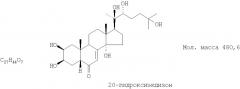
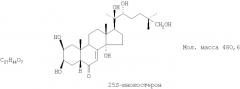
Показать всеИзобретение относится к фармакологии, а именно к лекарственным препаратам противоишемического и гиполипидемического действия, и может быть использовано в качестве нового средства для коррекции нарушений липидного обмена с целью профилактики и лечения дислипидемий, ишемической болезни сердца (ИБС), а также в качестве реабилитационного средства при послеинфарктных состояниях. Средство гиполипидемического и противоишемического действия представляет собой экдистероидсодержащую субстанцию, выделенную из надземной части растений серпухи венценосной Serratula coronata L. (Asteraceae), содержащую смесь 20-гидоксиэкдизона в количестве не менее 75% и 25S-инокостерона в количестве не менее 10%. Данная субстанция обладает выраженным гиполипидемическим действием, значительно снижает содержание общих липидов и холестерина, β-ЛП и триглицеридов. 19 табл., 24 ил.
Реферат
Изобретение относится к фармакологии, а именно к пищевым добавкам и лекарственным препаратам противоишемического и гиполипидемического действия, и может быть использовано в качестве нового средства для коррекции нарушений липидного обмена с целью профилактики и лечения дислипидемий, ишемической болезни сердца (ИБС), а также в качестве реабилитационного средства при послеинфарктных состояниях.
Известны несколько групп липидемических препаратов: статины (ингибиторы синтеза холестерина), фибраты, никотиновая кислота, секвестранты желчных кислот, полиненасыщенные жирные кислоты, антиоксиданты (Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Российские рекомендации. Разработаны Комитетом экспертов Всероссийского научного общества кардиологов. Секция атеросклероза ВНОК. Москва, 2004. 36 С.).
Секвестранты (сорбенты) жирных кислот (СЖК) - холестирамин и колестипол - представляют собой анионообменные смолы, не растворимые в воде и не всасывающиеся в кишечнике. СЖК обладают в основном холестеринпонижающим эффектом. Основной механизм действия СЖК заключается в связывании холестерина (ХС) и желчных кислот, которые синтезируются из ХС в печени. СЖК вызывают дополнительное образование желчных кислот и обеднение печени ХС. При терапии СЖК уровень общего ХС понижается на 10-15%, а липопротеидов низкой плотности (ЛПНП) - на 15-20%. Одновредменно наблюдается небольшое (на 3-5%) повышение уровня липопротеидов высокой плотности (ЛПВП). Недостатком и ограничением применения СЖК является их способность повышать уровень триглицеридов (ТГ). Поэтому препараты этой группы холестирамин и колестипол с осторожностью назначают больным с сопутствующей гипертриглицеридемией (Джанашия П.Х., Назаренко В.А., Николенко С.А. Дислипопротеидемии: клиника, диагностика, лечение. Москва, 2000).
В группу фибратов входят ряд препаратов: клофибрат (в настоящее время вытеснен другими препаратами этого ряда), гемфиброзил, безафибрат, ципрофибрат и фенофибрат. Эти препараты усиливают катаболизм липропротеидов очень низкой плотности (ЛПОНП), а также угнетают синтез ЛПНП и усиливают выведение ХС с желчью. Действуя на метаболизм ЛПОНП, основным эффектом этих препаратов является понижение уровня ТГ (на 20-50%). Уровень ХС и ЛПНП снижается на 10-15%, а содержание ЛПВП несколько увеличивается. Одним из факторов, сдерживающих применение фибратов в целях профилактики ИБС, является отсутствие данных, которые позволили бы утверждать, что длительная терапия фибратами приводит к увеличению выживаемости больных ИБС (Джанашия П.Х., Назаренко В.А., Николенко С.А. Дислипопротеидемии: клиника, диагностика, лечение. Москва, 2000).
Известно, что в повышенных дозах (3-5 г в день) гиполипидемическим действием обладает никотиновая кислота, которая в равной степени уменьшает содержание ХС и ТГ. Известная пролонгированная форма никотиновой кислоты - эндурацин. Имеются данные, что в группе больных, принимавших никотиновую кислоту, в отдаленном периоде смертность от всех причин была на 11% ниже по сравнению с группой плацебо. В то же время никотиновая кислота противопоказана у больных сахарным диабетом и подагрой (Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Российские рекомендации. Разработаны Комитетом экспертов Всероссийского научного общества кардиологов. Секция атеросклероза ВНОК. Москва, 2004. 36 С.).
Для лечения нарушений липидного обмена испытывался и целый ряд других средств, в числе которых были природные и синтетические антиоксиданты (витамины А, Е, С, пробукол), препараты, содержащие полиненасыщенные жирные кислоты (максепа, эйконол), гормонально-заместительные препараты (эстрогены); ряд пищевых добавок (чеснок). Однако по результатам обширных клинических исследований впечатляющих результатов от большинства перечисленных препаратов не получено (Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Российские рекомендации. Разработаны Комитетом экспертов Всероссийского научного общества кардиологов. Секция атеросклероза ВНОК. Москва, 2004. 36 С.).
В арсенале современных гиполипидемических средств наиболее эффективными препаратами являются статины, получаемых как из продуктов жизнедеятельности грибковой флоры, так и синтетическим путем. В настоящее время в России используются ряд препаратов данной группы: ловастатин (Mevacor®), симвастатин (Zocor®), правастатин (Lipostat®), аторвастатин (Liprimar®), флувастатин (Lescol®). Статины отличаются друг от друга физико-химическими (гидрофильно-гидрофобным балансом молекул) и фармакологическими свойствами. Эти свойства обеспечивают различную проходимость препаратов через клеточные мембраны клеток. Ловастатин и симвастатин поступают в печень в виде пролекарства и затем превращаются в активную форму, которая действует как ингибитор ГМГ-КоА-редуктазы, одного из ключевых ферментов синтеза ХС. Все другие препараты этого ряда поступают в организм в активной форме. Наиболее выраженным влиянием на уровень липидов плазмы крови, чем другие статины, обладает новый ингибитор ГМГ-КоА-редуктазы аторвастатин (Пфайзер, Германия), который выбран нами за прототип. Доказано, что статины хорошо переносятся, однако их прием может сопровождаться побочными реакциями в виде болей в животе, метеоризма и запоров. Наиболее опасным осложнением терапии статинами является рабдомиолиз или распад мышечной ткани с возможным повреждением почечных канальцев. В этих случаях терапия статинами должна быть немедленно прекращена (Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Российские рекомендации. Разработаны Комитетом экспертов Всероссийского научного общества кардиологов. Секция атеросклероза ВНОК. Москва, 2004. 36 С.). Другим фактором, сдерживающим применение статинов в отечественной медицинской практике, является дороговизна этих препаратов.
Задачей настоящего изобретения является расширение арсенала средств гиполипидемического и противоишемического действия, получение препарата низкой себестоимости из доступного растительного сырья за счет высокого содержания действующего вещества и воспроизводимости сырьевой базы.
В этом состоит технический результат.
Технический результат достигается тем, что в качестве гиполипидемического и противоишемического средства применяют экдистероидсодержащую субстанцию Серпистен, выделенную из надземной части растений серпухи венценосной Serratula coronata L. (Asteraceae), представляющую собой смесь 20-гидоксиэкдизона в количестве не менее 75% и 25S-инокостерона в количестве не менее 10%.
Известна смесь экдистероидов, выделенных по способу, описанному в патенте РФ №2153346, содержащая 20-гидроксиэкдизона - не менее 75% и 25S-инокостерона - не менее 10% со структурными формулами, указанными ниже, являющихся действующими веществами, проявляющими физиологическую активность, сходную по величине с препаратом-аналогом.
Предлагаемое средство, названное нами Серпистен, представляет собой белый кристаллический порошок, не имещий запаха, мало растворимый в воде, хорошо растворимый в метаноле и 70%-ном этаноле.
Смесь фитоэкдистероидов получают известным способом (по патенту 2153346) следующим образом.
Заготовку сырья, предпочтительно листьев, осуществляют в фазу вегетации, массовой бутонизации или начала цветения. Экспериментально установлено, что в эти фазы развития содержание действующих экдистероидов максимально. Исследование распределения экдистероидов в растениях серпухи венценосной проводили у средневозрастных генеративных особей. По содержанию экдистероидов серпуха венценосная намного превосходит рапонтик сафлоровидный. Использование надземной части растения в отличие от корневищ рапонтика значительно облегчает заготовку и переработку экдистероидсодержащего растительного сырья.
Измельченное растительное сырье (надземная часть растения рода Serratula семейства Asteraceae) неоднократно экстрагируют водой при температуре не выше 100°С не более 1 ч при постоянном перемешивании и соотношении сырье:экстрагент - 1:10 соответственно. Густой водный экстракт упаривают при пониженном давлении, обрабатывают смесью этилацетат-метанол, взятой при соотношении 4:1, или хлороформ-метанол при соотношении 6:1. Процедуру повторяют до полного извлечения экдистероидов из густого экстракта. Органические извлечения упаривают досуха, затем экдистероиды очищают путем хроматографии на оксиде алюминия в системе хлороформ-метанол или этилацетат-метанол возрастающей полярности и перекристаллизацией в системе этилацетат-метанол или этилацетат-этанол при соотношении 9:1.
Пример осуществления способа.
6 кг измельченных листьев растения рода Serratula семейства Asteraceae заливают 60 л воды и экстрагируют в течение 1 часа при температуре 50°С при постоянном перемешивании, затем экстракт сливают, а растительное сырье подвергают повторной экстракции. Объединенный экстракт упаривают в вакуумном роторно-пленочном испарителе при пониженном давлении до 2 л. 2 л густого экстракта обрабатывают трижды 8 л смеси этилацетат-метанол при соотношении 4:1 при постоянном перемешивании и фильтруют. Фильтрат упаривают досуха, остатки объединяют и переносят на колонку с оксидом алюминия и элюируют смесью хлороформ-метанол возрастающей полярности. Элюат собирают в колбы по 1 л и определяют в них содержание экдистероидов методом тонкослойной хроматографии (ТСХ). Целевые фракции, содержащие экдистероиды, упаривают досуха и перекристаллизовывают в смеси этилацетат-метанол (9:1).
Таким образом, способ позволяет получать субстанцию Серпистен, представляющую собой смесь фитоэкдистероидов, содержащую не менее 75% 20-гидроксиэкдизона и не менее 10% инокостерона (Белый кристаллический порошок, не имеет запаха, мало растворим в воде (1,9 г/л), хорошо растворим в 70%-ном этаноле (61 г/л) и метаноле (75 (г/л)).
Выход - 42 г или 0,7% к массе сырья, что составляет 70% к теоретически рассчитанному выходу.
Известен способ выделения 20-гидроксиэкдизона и 258-инокостерона (патент РФ 2155599), позволяющий получить индивидуальные соединения из смеси фитоэкдистероидов и смешивать их в эффективном количестве.
Проверка гиполипидемической и противоишемической активности субстанции Серпистен осуществлялась в ЗАО «Адаптоген» (г.Санкт-Петербург) на модели экспериментальной дислипопротеидемии и инфаркта миокарда в профилактическом и лечебном режиме. Эксперименты выполнялись на нелинейных белых крысах-самцах массой 180-230 г, возрастом 3,5-4 месяца.
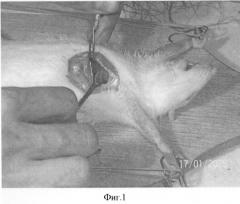
На фиг.1 показана перевязка левой коронарной артерии (экспериментальный инфаркт миокарда) у наркотизированной белой крысы - первый этап - вскрытие грудной клетки. На фиг.2 показан второй этап - лигирование левой коронарной артерии. На фиг.3 - третий этап - ушивание грудной клетки. На фиг.4 заключительный этап - наложение швов на кожу. На фиг.5 представлено снятие ЭКГ у белой крысы через 1 час после перевязки левой коронарной артерии. На фиг.6 - электронная регистрация ЭКГ у белой крысы через 1 час после перевязки левой коронарной артерии. На фиг.7 - ЭКГ крысы, группа - контроль (норма). На фиг.8 - ЭКГ крысы, группа с ЭДЛПЕ - контроль. На фиг.9 - ЭКГ крысы, группа с ЭДЛПЕ + Серпистен. На фиг.10 - частота возникновения экспериментального инфаркта миокарда в экспериментальных группах. На фиг.11 представлена выживаемость экспериментальных животных при ЭИМ на фоне предварительной терапии исследуемыми препаратами. На фиг.12 - ЭКГ крысы группы - контроль через 1 час после перевязки коронарной артерии. На фиг.13 - ЭКГ крысы (контроль), через 7 дней после перевязки коронарной артерии. На фиг.14 - ЭКГ крысы (терапия препаратом Аторвастатин) через 1 час после перевязки коронарной артерии. На фиг.15 - ЭКГ крысы (терапия препаратом Аторвастатин) через 7 дней после перевязки коронарной артерии. На фиг.16 - ЭКГ крысы (терапия препаратом Серпистен) через 1 час после перевязки коронарной артерии. На фиг.17 - ЭКГ крысы (терапия препаратом Серпистен) через 7 дней после перевязки коронарной артерии.
На фиг.18 представлена интактная крыса. Миокард левого желудочка сердца. Отчетливая поперечная исчерченность миофибрилл и четкие ядра кардиомицитов. Окраска по Ван Гизону. Ув. 40×70.
На фиг.19 - контроль. 24 часа. Обширный некроз под эпикардом левого желудочка сердца. Некротизированная ткань гомогенно окрашена эозином. Перифокальный отек и скопление полиморфноядерных лейкоцитов. Гематоксилин-эозин. Ув. 40×7.
На фиг.20 - контроль. 3 суток. Формирование инфаркта под эпикардом левого желудочка. Обширный некроз кардиомиоцитов, отек, лейкоцитарная инфильтрация зоны некроза. Гематоксилин-эозин. Ув. 40×7.
На фиг.21- контроль. 3 суток. Кровоизлияние и стазы крови в миокарде левого желудочка сердца вне зоны ишемии. Гематоксилин-эозин. Ув. 40×7.
На фиг.22 - лечение препаратом Серпистен. 3 суток. Очаг некроза кардиомиоцитов, умеренный отек и лейкоцитарная инфильтрация под эпикардом левого желудочка сердца. Гематоксилин-эозин. Ув. 40×7.
На фиг.23 - контроль. 7 суток. Пролиферативная реакция стромы в зоне некроза: среди гомогенно окрашенных кардиомиоцитов видны лейкоциты и клетки фибробластического ряда. Окраска по Ван-Гизону. Ув. 40×7.
На фиг.24 - лечение препаратом Серпистен. 7 суток. На месте некроза небольшой очаг пролиферации стромы миокарда. Помимо клеток фибробластического ряда видны соединительно-тканные волокна. Окраска по Ван-Гизону. Ув. 40×7.
Карантин. Длительность карантина (акклиматизационного периода) для всех животных составляла 14 дней. В течение карантина проводили ежедневный осмотр каждого животного. Перед началом исследования животные, отвечающие критериям включения в эксперимент, были распределены на группы с помощью метода рандомизации.
Содержание животных. Клетки с животными были помещены в отдельные комнаты. Световой режим: 12 час - свет, 12 час - темнота. Температура воздуха поддерживалась в пределах 19-25°С, относительная влажность - 50-70%. Температура и влажность воздуха регистрировались ежедневно. При изменении погодных условий контролировался воздухообмен в помещении с помощью анемометра и путем измерения содержания в воздухе углекислого газа и аммиака. Был установлен режим проветривания, обеспечивающий около 15 объемов помещения в час, концентрацию СО2 не более 0.15 объемных %, аммиака - не более 0.001 мг/л.
Ежедневный осмотр. В течение исследования каждое животное осматривалось ежедневно. Осмотр включал в себя оценку поведения и общего состояния животных и проводился примерно через 1 час после введения исследуемых веществ.
Моделирование экспериментальной дислипопротеидемии (ЭДЛПЕ).
Для моделирования дислипопротеидемии была использована диета, содержащая в стандартном корме 5% холестерина и 30% насыщенных жиров в виде бараньего жира. Диету применяли в небольших количествах утром, натощак с докармливанием в течение дня. Кроме этого, крысам дополнительно внутрижелудочно вводили 10% масляный раствор холестерина в дозе 100 мг/кг. Холестерин растворяли в переокисленном подсолнечном масле. Длительность диеты составила 24 дня. Интактная группа крыс получала обычную виварную диету. Для верификации полученных изменений в конце этого срока у животных осуществляли забор крови через 6 часов после отнятия корма. Все лабораторные тесты проводились по стандартным методикам [Мед. лаб. технол.]. α-холестерин (α - ХЛ) - унифицированным методом, β-липопротеиды (β-ЛП) (или липопротеиды низкой плотности - ЛПНП) сыворотки крови определяли турбодиметрическим методом; фосфолипиды (ФЛ) - по содержанию общего фосфора.
Экспериментальный инфаркт миокарда (ЭИМ). Моделирование инфаркта миокарда проводили перевязкой левой коронарной артерии по способу [Дьячук Г.И., Лапкина Г.Я., 1992]. Под эфирным рауш-наркозом рассекали кожу и подкожную жировую клетчатку, ткани отделяли по фасции, грудные и межреберные мышцы разъединяли вдоль хода волокон. После вскрытия грудной клетки сердце выводили в операционную рану, левую коронарную артерию прошивали и перевязывали лигатурой. Контроль наступления ишемии миокарда проводили электрокардиографически. После операции рану послойно ушивали (фиг.1-4).
Регистрация электрокардиограмм (ЭКГ). Регистрацию ЭКГ проводили на ненаркотизированных животных с помощью полиграфа RM-6000 (Япония). Крыс помещали в специальные клетки-пеналы из прозрачной пластмассы. В качестве электродов использовали тонкие стальные иглы, введенные подкожно. ЭКГ записывали в I стандартном отведении (фиг.5, 6).
Динамику веса тела крыс определяли на весах ВЛР-500. Сердца животных взвешивали на электронных весах 1602 МР немецкой фирмы «Sartorius».
Содержание восстановленного глутатиона в печени определяли иодометрически [Ellouk-Achard S. et al., 1995], сульфгидрильных групп сыворотки крови - амперометрическим титрованием по [Тимер М., Гедрих И., 1969], содержание гликогена - методом [Кигель Г.Б. Харабаджахьян А.В., 1978].
Кровь для биохимических исследований получали пункцией хвостовой вены крыс.
Активность АлТ, АсТ, КК, ЛДГ сыворотки крови определяли с помощью наборов Био-Ла-Тест Чешской фирмы «Лахема» [Кудрин А.Н., 1953]. Уровень глюкозы в крови и гомогенатах органов определяли ортотолуидиновым методом.
Интенсивность тканевого дыхания в гомогенатах органов определяли манометрическим методом Варбурга [Клиническая..., 1986, Умбрейт В.В., Буррис Р.Х., 1957]. Содержание молочной кислоты определяли по методу Баркера [Подильчак М.Д., 1967], АТФ - хроматографически [Лабораторные методы], а сукцинатдегидрогеназы - по Кигелю [Кигель Г.Б. Харабаджахьян А.В., 1978].
Забитые декапитацией животные подвергались патолого-анатомическому вскрытию и гистологическому исследованию ткани сердца. Сердце фиксировали в 10-15% формалине и заливали в парафин. Парафиновые срезы окрашивали гематоксилин-эозином и по Ван-Гизону.
Состояние антиоксидантной системы животных оценивалось по концентрации диеновых конъюгатов, продуктов, реагирующих с тиобарбитуровой кислотой (ТБК-РП) в плазме крови, активности каталазы и супероксиддисмутазы в эритроцитах.
Оценку концентрации диеновых конъюгатов осуществляли в гептан-изопропанольных экстрактах по методу [Гаврилов В.Г. и др., 1988], концентрацию ТБК-РП в бутанольной фракции проводили по методу [Медицинские..., 2002].
Активность каталазы и суперокисиддисмутазы оценивали в гемолизате эритроцитов по методу [Медицинские..., 2002].
Концентрацию восстановленного глутатиона и активность глутатион-зависимых ферментов (глутатионпероксидаза (ГПО), глутатионредуктаза (ГР), глутатион-S-трансфераза (Г-S-T)) определяли по методикам, описанным в [Медицинские..., 2002].
Статистическую обработку результатов экспериментов проводили по Стьюденту-Фишеру.
Ход эксперимента. Всего было сформировано 4 экспериментальных группы (каждая экспериментальная группа включала по 15 животных):
1. Интактные животные (ложнооперированные)+плацебо.
2. Контрольная группа ЭДЛПЕ + ЭИМ + плацебо;
3. Опытная группа 1 - ЭДЛПЕ + ЭИМ + Аторвастатин (2.0 мг/кг);
4. Опытная группа 2 - ЭДЛПЕ + ЭИМ + Серпистен (5.0 мг/кг);
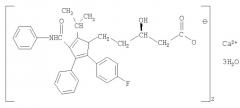
Исследуемые препараты начинали вводить на фоне формирования экспериментальной дислипопротеидемии в течение 24 дней интрагастрально в легкой крахмальной взвеси один раз в сутки до ЭИМ и один раз в сутки курсом 7 дней после ЭИМ. Интактным и контрольным животным (ЭДЛПЕ+ЭИМ) вводили крахмальную взвесь. Сравнительный анализ показателей проводили с препаратом Аторвастатин со структорной формулой.
Распределение экспериментальных животных по группам и исследуемым показателям представлено в таблице 1.
| Таблица 1 | ||||
| Распределение экспериментальных животных по группам и исследуемым показателям, М±m | ||||
| Показатели | Интактные | Контроль | Аторвастатин | Серпистен |
| Всего | 15 | 15 | 15 | 15 |
| ЭКГ исходно | 15 | 15 | 15 | 15 |
| ЭДИПЕ | - | 15 | 15 | 15 |
| ЭКГ после ЭДЛПЕ | 15 | 15 | 15 | 15 |
| ЭИМ Выжило/Всего | 14/15 | 12/15 | 12/15 | 15/15 |
| ЭДЛПЕ + ЭКГ, ЭИМ, 1 час | 14 | 12 | 12 | 15 |
| ЭДЛПЕ + ЭКГ, ЭИМ (7 дней терапии) | 10 | 8 | 8 | 11 |
| Биохимия после ЭДЛПЕ | 8 | 8 | 8 | 8 |
| Биохимия ЭДЛПЕ + ЭИМ, 24 часа | 8 | 8 | 8 | 8 |
| Гистология ЭДЛПЕ + ЭИМ, 24 часа | 2 | 2 | 2 | 2 |
| Гистология ЭДЛПЕ + ЭИМ, 3 дня | 2 | 2 | 2 | 2 |
| Гистология ЭДЛПЕ + ЭИМ, 7 дней | 10 | 8 | 8 | 11 |
| Состояние АОС + биохимия сердца и крови ЭДЛПЕ + ЭИМ, 7 дней | 10 | 7 | 8 | 11 |
Пример 1. Динамика электрокардиограмм (ЭКГ) в условиях ЭДЛПЕ на фоне терапии субстанцией Серпистен.
Результаты исследования динамики ЭКГ не выявили практически никаких различий между исследуемыми группами до начала моделирования экспериментальной дислипопротеидемии (таблица 2, фиг.7).
| Таблица 2 | ||||
| Частота сердечных сокращений (ЧСС) и характер ЭКГ экспериментальных животных до ЭДЛПЕ и начала терапии, М±m | ||||
| Показатели | Интактные | Контроль | Аторвастатин | Серпистен |
| Количество животных | n=15 | n=15 | n=15 | n=15 |
| ЧСС, уд/мин | 369±15 | 396±41 | 387±20 | 382±14 |
| Р, мВ | 0.02±0.008 | 0.03±0.005 | 0.03±0.005 | 0.01±0.008 |
| R, мВ | 0.61±0.075 | 0.60±0.063 | 0.52±0.12 | 0.90±0.05 |
| S, MB | 0.065±0.005 | 0.058±0.01 | 0.055±0.02 | 0.076±0.02 |
| Т, мВ | 0.55±0.05 | 0.37±0.10 | 0.38±0.02 | 0.32±0.17 |
| PQ, мс | 34±12 | 40±3 | 32±18 | 39±2 |
| QT, мс | 59±6 | 55±6 | 50±18 | 49±3 |
Аритмии в экспериментальных группах не зарегистрировано.
После формирования экспериментальной дислипопротеидемии на фоне терапии исследуемыми препаратами во всех группах (кроме интактных животных) наблюдалось достоверное увеличение амплитуды зубца R в 2 раза, что, вероятно, свидетельствует о компенсаторном повышении сократительной силы миокарда с развитием гипертрофии в условиях повышенной нагрузки за счет ЭДЛПЕ и, как следствие, нарушении коронарного кровотока. Достоверных изменений вольтажа зубцов Р и S не зарегистрировано. Изменений проводимости не отмечено (таблица 3). Аритмии в экспериментальных группах не зарегистрировано.
Следует отметить изменение во всех экспериментальных группах зубца Т и сегмента ST по сравнению с интактными животными. Во всех экспериментальных группах с ЭДЛПЕ наблюдалась инверсия зубца Т, депрессия сегмента ST (фиг.8,9). В контрольной группе величина инверсии Т составила 0.34±0.06 мм, которая наблюдалась у 40%. Данные изменения свидетельствуют о развитии коронарной недостаточности средней степени на фоне ЭДЛПЕ.
На фоне терапии препаратом Аторвастатин процент животных с депрессией ST был достоверно ниже в 2 раза, а величина инверсии Т достоверно в 3 раза меньше по сравнению с контролем.
На фоне терапии препаратом Серпистен процент животных с депрессией ST был достоверно ниже в 3 раза, а величина инверсии Т достоверно в 6 раз меньше по сравнению с контролем.
Как свидетельствуют представленные данные, терапия исследуемыми препаратами улучшает коронарный кровоток в условиях экспериментальной дислипопротеидемии.
| Таблица 3 | ||||
| ЧСС и характер ЭКГ экспериментальных животных с ЭДЛПЕ на фоне терапии исследуемыми препаратами, М±m | ||||
| Показатели | Интактные | Контроль | Аторвастатин | Серпистен |
| Количество животных | n=15 | n=15 | n=15 | n=15 |
| ЧСС, уд/мин | 401±34 | 359±43 | 403±19 | 362±12 |
| Р, мВ | 0.02±0.007 | 0.02±0.004 | 0.02±0.001 | 0.028±0.005 |
| R, мВ | 0.77±0.28 | 1.34±0.30* | 1.10±0.17* | 1.09±0.008 |
| S, mb | 0.065±0.005 | 0.058±0.01 | 0.055±0.02 | 0.066±0.02 |
| Т, мВ(+) | 0.56±0.04 | 0.40±0.10 | 0.38±0.01 | 0.33±0.16 |
| Т, мВ(-) | - | 0.34±0.06 | 0.13±0.01* ** | 0.06±0.01* ** |
| % с депрессией ST | - | 40 | 20** | 13** |
| PQ, мс | 36±8 | 41±2 | 33±9 | 38±2 |
| QT, мс | 56±5 | 53±6 | 52±8 | 56±3 |
| Обозначение (*) - различия статистически значимы по сравнению со сроком наблюдения - до начала терапии и моделирования ЭДЛПЕ (таблица 2), при р<0.05.Обозначение (**) - р<0.05 по сравнению с контрольной группой. |
Пример 2. Влияние субстанции Серпистен на частоту возникновения экспериментального инфаркта миокарда.
Анализ ЭКГ выявил распределение животных в опытных группах в зависимости от регистрации подъема сегмента ST, что характеризует наличие экспериментального инфаркта миокарда у животных, с выделением в каждой опытной группе подгрупп с зарегистрированным инфарктом миокарда (ИМ) и без электрокардиографических признаков инфаркта миокарда (БИМ) на сроке 1 час (табл.4, фиг.10). В группе ложнооперированных животных подъема сегмента ST не зарегистрировано.
| Таблица 4 | |||
| Влияние исследуемых препаратов на частоту возникновения экспериментального инфаркта миокарда у подопытных животных, % | |||
| Показатели | Контроль | Аторвастатин | Серпистен |
| Количество животных | n=12 | n=12 | n=15 |
| ИМ,% | 100.0 | 41.7* | 20.0* |
| БИМ, % | 0.0 | 58.3* | 80.0* |
| Обозначение (*) - различия статистически значимы по сравнению контрольной группой, при р<0.05. |
На фоне профилактической терапии Серпистеном наблюдается достоверное снижение частоты возникновения ЭИМ в 5 раз. При применении препарата сравнения Аторвастатина также наблюдалось снижение частоты возникновения ЭИМ, однако менее выраженное (в 2,5 раза).
Об этом косвенно также свидетельствует показатель выживаемости экспериментальных животных при моделировании ИМ (табл.2 и фиг.11).
Выживаемость на фоне терапии препаратом Серпистен была примерно в 1.3 раза выше по сравнению с выживаемостью в контрольной группе.
| Таблица 5 | |||
| Влияние исследуемых препаратов на подъем сегмента ST у экспериментальных животных крыс через 1 час после ЭИМ, М±m | |||
| Показатели | Контроль | Аторвастатин | Серпистен |
| Средняя величина подъема ST, мм | 1.93±0.14 | 1.11±0.11* | 0.73±0.10* |
| Обозначение (*) - различия статистически значимы по сравнению контрольной группой, при р<0,05. |
Величина подъема ST во всех опытных группах достоверно отличается от контроля, причем в группе животных, получавших Серпистен, величина подъема сегмента ST была ниже в 2,6 раза по сравнению с контролем, а в группе Аторвастатина ниже в 1.7 раза.
Уменьшение величины подъема сегмента ST свидетельствует о меньшей площади очага некроза и позволяет зарегистрировать достоверный противоишемический эффект для исследуемого вещества (табл.5, фиг.12)
| Таблица 6 | |||
| Влияние исследуемых препаратов на депрессию сегмента ST у экспериментальных животных с ИМ через 7 дней после ЭИМ, М±m | |||
| Показатели | Контроль | Аторвастатин | Серпистен |
| Средняя величина депрессии ST, мм | 1.24±0.13 | 0.48±0.16* | 0.85±0.10* |
| Обозначение (*) - различия статистически значимы по сравнению контрольной группой, при р<0,05. |
Снижение ST ниже изолинии (депрессия) характеризует постинфарктные ишемические изменения и свидетельствует о недостаточности кровоснабжения, гипоксии миокарда. Как видно из таблицы 6, выраженность депрессии сегмента ST через 7 дней после ЭИМ достоверно отличается от контроля во всех опытных группах.
В группах животных, получавших терапию исследуемьм веществом, депрессия сегмента ST была менее выражена примерно в 1.5 раза (р<0.05) по сравнению с контролем, а на фоне применения препарата сравнения в 2.6 раза.
Полученные результаты свидетельствуют о наличии противоишемического эффекта у Серпистена и повышении устойчивости миокарда к гипоксии на фоне терапии.
Пример 3. Динамика ЭКГ при терапии субстанцией Серпистен на фоне экспериментального инфаркта миокарда.
При дальнейшем анализе для объективного суждения о влиянии исследуемых препаратов на характер ЭКГ-изменений сравнительный анализ электрокардиографических параметров проводился в выделенных подгруппах: с зарегистрированным ИМ и БИМ.
ЭКГ-характеристика группы (контроль)
Динамика ЧСС и показателей ЭКГ крыс с ЭДЛПЕ в контрольной группе ИМ (без лечения) представлена в таблице 7.
| Таблица 7 | ||
| Динамика ЧСС и показателей ЭКГ крыс с ЭДЛПЕ в контрольной группе ИМ (без лечения), М±m | ||
| Показатели | 1 час | 7 дней |
| ЧСС | 309±12 | 342±20 |
| Р | 0.020±0.005 | 0.020±0.008 |
| R | 1.80±0.28 | 0.80±0.19* |
| S | 0.052±0.01 | 0.032±0.01 |
| Т | 1.10±0.17** | 0.52±0.17* |
| PQ | 59±6** | 80±8*** |
| QT | 76±4** | 90±15* ** |
| Обозначения: (*) - различия статистически значимы по сравнению со сроком наблюдения 1 час, при р<0.05, (**) - р<0.05 по сравнению со сроком наблюдения до ЭИМ (таблица 3). |
Аритмии не зарегистрировано.
В контрольной группе с ИМ наблюдалась тенденция к отрицательному хронотропному эффекту (снижение ЧСС на 14%) с последующим небольшим повышением в постинфарктный период - 7 дней, как компенсаторное уменьшение кислородного запроса миокарда; увеличение амплитуды зубца R и достоверное увеличение амплитуды зубца Т (в 1.3-2.5 раза, р<0.05) по сравнению со сроком наблюдения до ЭИМ (1 час после ЭИМ), выраженное уменьшение амплитуды зубцов R, S и Т на сроке наблюдения 7 дней (в 2-1.5-2 раза соответственно) по сравнению со сроком наблюдения 1 час, что характеризует угнетение сократительной активности миокарда в постинфарктный период; стойкие прогрессирующие нарушения атриовентрикулярной и внутрижелудочковой проводимости (удлинение PQ и QT на в 1.5-2 раза по сравнению со сроком наблюдения до ЭИМ) (фиг.12, 13).
ЭКГ-характеристика на фоне терапии препаратом Аторвастатин
Динамика ЧСС и показателей ЭКГ крыс с ЭДЛПЕ на фоне терапии препаратом Аторвастатин ИМ представлена в таблице 8.
| Таблица 8 | ||
| Динамика ЧСС и показателей ЭКГ крыс с ЭДЛПЕ на фоне терапии препаратом Аторвастатин ИМ, М±m | ||
| Показатели | 1 час | 7 дней |
| ЧСС | 309±12** | 342±20** |
| Р | 0.023±0.003 | 0.017±0.00** |
| R | 1.83±0.23** | 0.97±0.20* |
| S | 0.12±0.04 | 0.046±0.01 |
| Т | 0.97±0.18** | 0.58±0.10 |
| PQ | 47±3 | 43±7 |
| QT | 57±8 | 70±13 |
| Обозначения: (*) - различия статистически значимы по сравнению со сроком наблюдения 1 час, при р<0.05, (**) р<0.05 по сравнению со сроком наблюдения до ЭИМ (таблица 3). |
Аритмия не зарегистрирована.
На фоне терапии препаратом Аторвастатин в группе с ИМ через 1 час наблюдалось достоверное повышение амплитуды зубца R в 1.7 раза, Т - в 2.6 раза и тенденция к повышению амплитуды зубца S (в 2 раза) и достоверное стойкое урежение ЧСС. В постинфарктный период на сроке наблюдения 7 дней наблюдалась нормализация амплитуды зубцов R, S и Т (угнетение сократимости миокарда). Отсутствие регистрируемых нарушений атриовентрикулярной проводимости (PQ). Также наблюдалась тенденция к удлинению внутрижелудочковой проводимости (QT) к 7 дню в 1.3 раза по сравнению со сроком наблюдения до ЭИМ (фиг.14, фиг.15).
Динамика ЧСС и показателей ЭКГ крыс с ЭДЛПЕ на фоне терапии препаратом Аторвастатин БИМ представлена в таблице 9.
| Таблица 9 | ||
| Динамика ЧСС и показателей ЭКГ крыс с ЭДЛПЕ на фоне терапии препаратом Аторвастатин БИМ, М±m | ||
| Показатели | 1 час | 7 дней |
| ЧСС | 387±10** | 378±15 |
| Р | 0.021±0.004 | 0.020±0.005 |
| R | 1.47±0.14 | 1.36±0.12 |
| S | 0.062±0.02 | 0.054±0.02 |
| Т | 0.42±0.14** | 0.31±0.11 |
| PQ | 67±5** | 41±4* |
| QT | 72±6 | 53±10 |
| Обозначение (*) - различия статистически значимы по сравнению со сроком наблюдения 1 час, при р<0.05, (**) - р<0.05 по сравнению с группой ЭИМ. |
Аритмия не зарегистрирована.
В группе БИМ на фоне терапии препаратом Аторвастатин через 1 час после перевязки наблюдались схожие изменения ЭКГ. Через 7 дней - также сохранение высокой амплитуды R, отсутствие снижения Т, что свидетельствует о предотвращении развития некротических изменений, нарушений сократимости миокарда и, наоборот, повышению таковой. Зарегистровано достоверное удлинение атриовентрикулярной проводимости по сравнению с группой ЭИМ и удлинение внутрижелудочковой проводимости в виде тенденции по сравнению со сроком наблюдения до ЭИМ, с нормализацией к 7 дню.
ЭКГ-характеристика на фоне терапии препаратом Серпистен
Динамика ЧСС и показателей ЭКГ крыс с ЭДЛПЕ на фоне терапии препаратом Серпистен ИМ представлена в таблице 10.
| Таблица 10 | ||
| Динамика ЧСС и показателей ЭКГ крыс с ЭДЛПЕ на фоне терапии препаратом Серпистен ИМ, М±m | ||
| Показатели | 1 час | 7 дней |
| ЧСС | 282±18** | 349±15* |
| Р | 0.017±0.006 | 0.030±0.010 |
| R | 0.56±0.15** | 1.42±0.06*** |
| S | 0.040±0.02 | 0.130±0.02* ** |
| Т | 1.24±0.13** | 1.14±0.06** |
| PQ | 37±9 | 60±4* ** |
| QT | 60±6 | 70±5** |
| Обозначения: (*) - различия статистически значимы по сравнению со сроком наблюдения 1 час, при р<0.05, (**) - р<0.05 по сравнению со сроком наблюдения до ЭИМ (таблица 3). |
Аритмия не наблюдалась.
На фоне терапии препаратом Серпистен через 1 час после ЭИМ наблюдалось достоверное урежение ЧСС в 1.3 раза, снижение амплитуды зубца R в 2 раза, достоверное увеличение амплитуды зубца Т в 3.3 раза по сравнению со сроком наблюдения до ЭИМ. Через 7 дней - наблюдалось достоверное увеличение ЧСС (нормализация) в 1.2 раза по сравнению со сроком наблюдения 1 час, достоверное увеличение амплитуды зубца R в 2.5 раза (нормализация) по сравнению со сроком наблюдения 1 час; стойкое достоверное увеличение амплитуды зубца Т в 3.5 раза по сравнению со сроком наблюдения до ЭИМ, что свидетельствует от повышении сократительной активности миокарда на фоне терапии препаратом Серпистен; достоверное удлинение атриовентрикулярной проводимости в 1.6 раз по сравнению со сроком наблюдения 1 час и по сравнению со сроком наблюдения до ЭИМ (фиг.16-17). Динамика ЧСС и показателей ЭКГ крыс с ЭДЛПЕ на фоне терапии препаратом Серпистен БИМ представлена в таблице 11.
| Таблица 11 | ||
| Динамика ЧСС и показателей ЭКГ крыс с ЭДЛПЕ на фоне терапии препаратом Серпистен БИМ, М±m | ||
| Показатели | 1 час | 7 дней |
| ЧСС | 383±17* | 394±11* |
| Р | 0.021±0.003 | 0.020±0.003 |
| R | 1.65±0.14* ** | 1.54±0.10** |
| S | 0.054±0.05 | 0.075±0.010* |
| Т | 0.95±0.11** | 0.67±0.10* |
| PQ | 34±8 | 41±7 |
| QT | 55±7 | 57±4 |
| Обозначение (*) - различия статистически значимы по сравнению с группой ИМ, при р<0.05, (**) - р<0.05 по сравнению со сроком наблюдения до ЭИМ (таблица 3). |
Аритмия не зарегистрирована.
В группе БИМ на фоне терапии препаратом Серпистен через 1 час и через 7 дней после перевязки коронарной артерии наблюдалось достоверное увеличение амплитуды зубца R в 1.5-1.4 раза, стойкое увеличение амплитуды Т в 2-3 раза. Отсутствие изменений атриовентрикулярной и внутрижелудочковой проводимости.
Пример 4. Показатели липидного обмена экспериментальных животных после применения субстанции Серпистен на фоне формирования ЭДЛПЕ и после ЭИМ и недельной терапии.
Полученные результаты подтверждают адекватность использованной модели атеросклероза: в контрольной группе (без лечения) з