Препарат рекомбинантного человеческого сывороточного альбумина и способ его получения
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и препаративной биохимии и может быть использовано в биофамакологии и медицине. Клетки дрожжей P.pastoris последовательно трансформируют двумя разными генетическими конструкциями, содержащими ген предшественника человеческого сывороточного альбумина (ЧСА). Полученный штамм-продуцент культивируют в питательной среде. Рекомбинантный ЧСА выделяют из культуральной среды путем осветления указанной среды, а также проведения стадий последовательного центрифугирования при 2000 и 10000 g, ультрафильтрации, диализа и катионообменной хроматографии на колонке Source S. Целевой продукт представляет собой элюат, включающий рекомбинантный человеческий сывороточный альбумин, 50-мМ фосфатный буфер, содержащий 400 мМ хлорида натрия, с рН 9. Применение изобретения позволяет расширить арсенал средств, направленных на получение рекомбинантного ЧСА, и получать рекомбинантный ЧСА в виде продукта, который помимо рекомбинантного ЧСА содержит 50-мМ фосфатный буфер, содержащий 400 мМ хлорида натрия, и имеет рН 9. 2 н.п. ф-лы, 6 ил.
Реферат
Изобретение относится к биофамакологии, препаративной биохимии, биотехнологии и медицине и касается препарата человеческого сывороточного альбумина (ЧСА) и способа его получения.
Альбумин является наиболее распространенным растворимым белком позвоночных и в то же время представляет собой белок с самой высокой концентрацией в плазме.
У людей ЧСА продуцируется в печени в виде глобулярного, негликозилированного белка с молекулярной массой 65 кДа. Данный белок участвует в большом числе существенных функций, которые включают регуляцию кровяного давления в системе циркуляции, а также транспортировку жирных кислот, аминокислот, желчных пигментов и многих молекул сыворотки.
Для поддержания нормального осмотического давления у пациента, страдающего от потери жидкости, такой как в случае хирургической операции, шока, ожога или отека, ЧСА вводят в качестве заменителя плазмы. Для данной цели ЧСА в настоящее время производят путем фракционирования крови, собранной у доноров крови. Однако данный способ получения неизбежно включает опасность контаминации инфекционными агентами, такими как вирус гепатита, вирус иммунодефицита человека и т.д. Поэтому очистка ЧСА из крови человека включает пастеризацию продукта и является очень дорогостоящей.
Клонирование кДНК, кодирующей ЧСА, в экспрессионный вектор, трансформация бактериальных или дрожжевых клеток хозяина с использованием данного вектора, культивирование трансформированных хозяев и выделение полученного таким образом ЧСА, описаны, например, в ЕР 091527, ЕР 366400 и ЕР 612761. Одна из проблем, связанных с выделением ЧСА из рекомбинантных клеток хозяина, основывается на том факте, что остаточные микробные компоненты, такие как бактериальные или дрожжевые белки или липиды, являются высокоантигенными для человека и, таким образом, ЧСА должен быть достаточно очищен.
Тот факт, что ЧСА как белку-носителю присуща связывающая активность в отношении множества микробных продуктов и компонентов культуры ткани, дополнительно усложняет схему счистки и ее результативность.
Это связано с ростом содержания в культуральной жидкости продуктов крови, таких как факторы коагуляции, получаемых путем рекомбинантной экспрессии генов, кодирующих данные факторы. Предполагается, что динамика рынка будет далее повышать относительную стоимость очистки ЧСА из крови. Для обеспечения достаточной поставки ЧСА для фармацевтического применения в данной области разработаны различные альтернативные способы получения ЧСА, в большей части которых применяется рекомбинантная экспрессия генов, кодирующих данный белок.
Наиболее близким техническим решением к заявленному является способ и препарат, описанный в ЕР 0091527, который принят в качестве прототипа.
Техническим результатом заявленного изобретения является повышение выхода ЧСА.
Данный технический результат достигается заявленным способом получения рекомбинантного человеческого сывороточного альбумина (ЧСА), включающим выделение и очистку из содержащего его источника. Для выделения ЧСА предварительно получают клетки дрожжей P.pastoris, стабильно трансформированные рекомбинантным вектором рР1С9, содержащим промотор А0Х1 гена, нативный терминатор и сигнал полиаденилирования АОХ1 гена, ген HIS4 дрожжей Pichia дикого типа и 3′А0Х1 последовательность после сигнала терминации транскрипции из А0Х1 гена, служащая для интеграции в А0Х1 локус, с получением ДНК плазмиды рР1С9/ЧСА5, которая была линеризована по сайтам BgIII и трансформирована в штамм GS115/4CA5 методом электропорации, затем дополнительно получают копию гена ЧСА с помощью вектора pP1CZ@A, позволяющего вести отбор полученных трансформантов за счет гена устойчивости к зеоцину, ДНК плазмиды pP1CZ@A/ЧСА была линеризована по сайту SacI и трансформирована методом электропорации в полученный на предыдущей стадии штамм-продуцент GS115/ЧСА5 с одной копией гена ЧСА. Результирующий штамм-продуцент GS115/Alb2 P.pastoris с двумя копиями гена ЧСА выращивают в питательной среде, затем отобранную культуральную среду осветляют последовательным центрифугированием при 2000 и 10000 g, супернатант концентрируют ультрафильтрацией, диализуют, проводят катионообменную хроматографию на колонке Source S. Адсорбированный ЧСА элюируют фосфатным буфером, элюат содержит рекомбинантный ЧСА.
Полученный ЧСА используют в качестве препарата для различных медицинских целей.
Заявленное изобретение поясняется следующими чертежами.
На фиг.1 - нуклеотидная и аминокислотная последовательности рЧСА.
(а) - нуклеотидная последовательность фрагмента, содержащего кДНК гена человеческого сывороточного альбумина; (b) - соответствующая ей аминокислотная последовательность человеческого сывороточного альбумина.
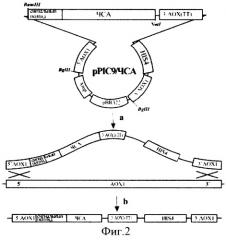
На фиг.2 представлена схема получения экспрессионного штамма GS115/ЧСА5.
(а) - рекомбинация между линеризованной плазмидой рРIС9/ЧСА и хромосомной ДНК P.pastoris; (b) - интегрирование нуклеотидной последовательности, кодирующей человеческий сывороточный альбумин, в АОХ 1 локус хромосомной ДНК P.pastoris.
На фиг.3 - электрофореграмма результатов анализа интеграции экспрессионных единиц ЧСА в геном P.pastoris. М-маркер молекулярного веса фирмы Fermentas (250, 500, 750, 1000, 1500, 2000 п.н.), 1 - ПНР с геномной ДНК P.pastoris GS115, 2 - ПЦР с плазмиды рРIС9/ЧСА, 3-5 - ПНР с геномной ДНК рекомбинантных клонов-продуцентов ЧСА.
На фиг.4 - авторадиограмма результатов анализа встраивания экспрессионной единицы проЧСА в геном P.pastoris. Саузерн-гибридизация зонда, соответствующего последовательности ЧСА, с геномной ДНК штамма GS115 P.pastoris (1) и продуцентов ЧСА (2, 3, 4), обработанной эндонуклеазами BamHI и NotI; маркер молекулярного веса - геномная ДНК фага λ, обработанная эндонуклеазой HindIII (5).
На фиг.5 - электрофоретический анализ в 8% SDS-ПААГ результатов экспрессии (96 часов после индукции) рекомбинантных клонов. 1 - препарат ЧСА промышленного производства (Вауег), 2-7 - 50 мкл осажденной 50% раствором трифторуксусной кислоты культуральной среды рекомбинантных клонов рРIС9/ЧСА1-6 соответственно
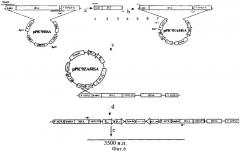
На фиг.6 - схема получения экспрессионного штамма GS115/Аlb2.
(а) - ПЦР гена ЧСА с полученной ранее рРIС9/ЧСА. (b) - клонирование гена проЧСА в вектор pPICZαA. (с) - рекомбинация между линеризованной плазмидой pPICZαA/ЧСА и хромосомной ДНК клона рР1С9/ЧСА5 P.pastoris. (d) - интегрирование нуклеотидной последовательности, кодирующей проЧСА, в 5′АОХ 1 локус хромосомной ДНК клона рР1С9/ЧСА5 P.pastoris. (e) - последовательность, амплифицирующаяся при помощи ПЦР со специфических праймеров, соответствующих 5′- и 3′-концам последовательности проЧСА и лежащая между копиями генов альбумина.
Изобретение осуществляется следующим образом.
ПОЛУЧЕНИЕ ИСХОДНОЙ ЭКСПРЕССИОННОЙ КОНСТРУКЦИИ
Для создания экспрессионной конструкции, содержащей ген ЧСА, был использован вектор pPIC9 (Invitrogen), содержащий следующие обязательные элементы: промотор АОХ1 гена, нативный терминатор и сигнал полиаденилирования АОХ1 гена, ген HIS4 дрожжей Pichia дикого типа и 3′АОХ1 последовательность после сигнала терминации транскрипции из АОХ1 гена, служащая для интеграции в АОХ1 локус. Этот вектор позволяет клонировать нуклеотидную последовательность целевого белка вместе с собственной сигнальной последовательностью (для секреции экспрессируемых продуктов), а также способен комплементировать ауксотрофность по гистидину за счет гена His4. Для клонирования фрагмента белка ЧСА был выбран 5′-концевой сайт BamHI, что позволяет получить нативный N-конец целевого продукта при отщеплении сигнальной последовательности.
Поли(А)+РНК, выделенная из образцов биопсии клеток печени доноров, была использована в качестве матрицы для реакции обратной транскрипции с олиго(dT18) праймером. Фрагмент ДНК, содержащий нуклеотидную последовательность ЧСА (фиг.1 (а)), был амплифицирован методом ПЦР с полученной кДНК с использованием специфических олигонуклеотидов
(5′)-AGTAGGATCCAAACGATGAAGTGGGTAACCTTTATT
(5′)-AGATCATCAGCGGCCGCTTATAAGCCTAAGGCAGCTTG,
комплементарных 5′- и 3′-концам последовательности проЧСА соответственно, и содержащих сайты эндонуклеаз рестрикции BamHI и NotI. ПЦР-продукт размером 1800пар оснований, содержащий последовательность проЧСА, был обработан эндонуклеазами рестрикции BamHI и NotI и клонирован в аналогично рестрицированный вектор рРIС9. Рестрикционный анализ ДНК отобранных положительных клонов показал наличие BamHI - NotI фрагмента величиной 1800 пар оснований. Нуклеотидная последовательность альбумина (V00495) была определена в составе конструкции рРIС9/ЧСА секвенированием по методу Сенгера. ДНК плазмиды рРIС9/ЧСА была линеризована по сайтам BgIII и трансформирована в штамм GS155 (Invitrogen) методом электропорации. Схема получения экспрессионного штамма GS115/ЧСА5 представлена на фиг.2.
Полученные клоны были тестированы на Mut+ или Muts фенотип по росту на чашках с ММ- и MD-агаром. Среди полученных трансформантов были отобраны клоны со слабо выраженным ростом на ММ-агаре (MutS фенотип). Встраивание нуклеотидной последовательности ЧСА в дрожжевой геном было проанализировано при помощи метода ПЦР со специфических праймеров, соответствующих 5′- и 3′-концам последовательности ЧСА, соответственно. В результате ПЦР с геномной ДНК рекомбинантных клонов и вектора рРIС9/ЧСА образовывались фрагменты ДНК размером около 1850 п.н., соответствующие последовательности ЧСА. В качестве контроля использовалась геномная ДНК штамма GS115 (фиг.3).
Интеграция последовательности, кодирующей ЧСА, в геном P.pastoris была также подтверждена результатами гибридизации по Саузерну (фиг.4). Обработанная рестриктазами BamHI и NotI геномная ДНК рекомбинантных клонов была прогибридизована с радиоактивно меченым фрагментом проЧСА. На полученной авторадиограмме можно видеть появление фрагмента размером около 1,8 т.п.н., соответствующего интегрированной в геном последовательности ЧСА, по сравнению с геномной ДНК нетрансформированных клеток штамма GS115 P.pastoris.
Для аналитической экспрессии в качалочных колбах было отобрано несколько клонов. Экспрессия проводилась в течение 4 суток, аликвоты экспрессионной культуры отбирались каждые 24 часа. Для анализа содержания рекомбинантного ЧСА в культуральной среде использовался метод денатурирующего электрофореза в полиакриламидном геле с последующей денситометрией геля (фиг.5).
По результатам денситометрического анализа для дальнейшей работы был выбран клон GS115/ЧСА5 с наибольшим уровнем экспрессии целевого белка (1,5 г/л).
ПОЛУЧЕНИЕ ДОПОЛНИТЕЛЬНОЙ ЭКСПРЕССИОННОЙ КОНСТРУКЦИИ
Для увеличения количества экспрессируемого белка в геном полученного клона GS115/ЧСА5 была интегрирована еще одна копия гена альбумина. Для создания еще одной экспрессионной конструкции, содержащей ген ЧСА, был использован вектор pPICZαA (Invitrogen), позволяющий вести отбор полученных трансформантов за счет гена устойчивости к зеоцину.
Фрагмент ДНК, содержащий нуклеотидную последовательность ЧСА (фиг.1(а)), был амплифицирован методом ПНР с полученной ранее рРIС9/ЧСА с использованием специфических олигонуклеотидов
(5′)-AGTAGGATCCAAACGATGAAGTGGGTAACCTTTATT
(5)′-AGATCATCAGCGGCCGCTTATAAGCCTAAGGCAGCTTG,
комплементарных 5′- и 3′-концам последовательности ЧСА соответственно и содержащих сайты эндонуклеаз рестрикции HindIII и NotI. ПНР-продукт размером 1800 пар оснований, содержащий последовательность проЧСА, был обработан эндонуклеазами рестрикции HindIII и NotI и клонирован в аналогично рестрицированный вектор pPICZαA. Рестрикционный анализ ДНК отобранных положительных клонов показал наличие HindIII - NotI фрагмента величиной 1800 пар оснований. Нуклеотидная последовательность альбумина (V00495) была определена в составе конструкции pPICZαA/ЧСА секвенированием по методу Сенгера. ДНК плазмиды pPICZαA/ЧСА была линеризована по сайту SacI и трансформирована в штамм-продуцент GS115/ЧСА5 (полученный нами ранее и содержащий в геноме одну копию гена альбумина) методом электропорации. Схема получения экспрессионного штамма GS115/Аlb2 представлена на фиг.6.
ПОЛУЧЕНИЕ ШТАММА GS115/Аlb2 МЕТИЛОТРОФНЫХ ДРОЖЖЕЙ P.pastoris
Отбор полученных трансформантов осуществлялся по устойчивости к антибиотику зеоцину. Полученные клоны были тестированы на Mut+ или MutS фенотип по росту на чашках с ММ- и MD-агаром. Среди полученных трансформантов были отобраны клоны со слабо выраженным ростом на ММ-агаре (MutS фенотип). Встраивание второй копии нуклеотидной последовательности проЧСА в дрожжевой геном было проанализировано при помощи метода ПЦР со специфических праймеров, соответствующих 5′- и 3′- концам последовательности ЧСА, амплифицирующих последовательность, лежащую между копиями генов альбумина. В результате ПЦР с геномной ДНК рекомбинантных клонов и вектора pPICZαA/ЧСА образовывались фрагменты ДИК размером около 3500 п.н., соответствующие последовательности вектора pPICZαA (фиг.5(е)). В качестве отрицательного контроля использовалась геномная ДНК штамма GS115 и рРIС9/ЧСА (полученного нами ранее и содержащего в геноме одну копию гена альбумина).
Наличие двух копий, кодирующих ЧСА, в геноме штамма GS115/Аlb2 P.pastoris было подтверждено ПЦР в реальном времени со специфических праймеров (соответствующих 5′- и 3′-областям последовательности проЧСА), при котором скорость накопления продукта зависит от количества копий амплифицирующейся последовательности. Были проведены аналитические экспрессии нескольких клонов, содержащих две копии гена альбумина в геноме, и выбран клон с максимальным уровнем экспрессии - GS115/Аlb2. Экспрессия целевого белка возросла с 1,5 до 2,2 г/л.
КОНТРОЛЬ УРОВНЯ ЭКСПРЕССИИ рЧСА
Экспрессия рекомбинантного ЧСА в качалочных колбах
Выращивание P.pastoris и экспрессию проводили либо на «богатой» среде (BMGY, BMMY), либо на «бедной» (BMG, ВММ).
Индивидуальные колонии P.pastoris были помещены в 250 мл среды BMGY или BMG в качалочные колбы и выращивались со встряхиванием при 30°С до оптической плотности OD600=2. Клетки собирали центрифугированием при 2000 g и индуцировали экспрессию суспендированием клеточного осадка в 50 мл среде BMMY или ВММ, соответственно. Среда BMGY содержала 1% дрожжевого экстракта, 2% пептона, 100 мМ фосфата калия рН 6, 1.34% дрожжевой азотной основы, 4*10-5 биотина, 1% глицерина, среда BMMY вместо глицерина содержала выбранное количество метанола. Среда BMG содержала 100 мМ фосфата калия рН 6, 1.34% дрожжевой азотной основы, 4*10-5 биотина, 1% глицерина, среда ВММ вместо глицерина содержала выбранное количество метанола. Метанол добавлялся до выбранного количества каждые 24 часа.
Детекция уровня экспрессии
Культуральную среду осветляли последовательным центрифугированием при 2000 g и 10000 g. Супернатант отбирали, аликвоту анализировали с помощью электрофореза в 8% денатурирующем полиакриламидном геле по методике Лэммли. Количество белка оценивали денситометрией.
Хроматографическая очистка
Культуральную среду осветляли последовательным центрифугированием при 2000 g и 10000 g. рН осветленной среды доводили до 8,5, центрифугировали 14000 g 15 мин.
К супернатанту добавляли тетрабората натрия до концентрации 0.5 М и выдерживали 12 часов при +4°С. Суспензию центрифугировали 14000 g 15 мин. К супернатанту добавляли каприлат натрия, цистеин, аминогуанидин и 6-ацетил триптофан до концентрации 10 мМ каждого и выдерживали 2 часа при +65°С. Суспензию центрифугировали 14000 g 15 мин, супернатант концентрировали ультрафильтрацией до 1/10 первоначального объема. Концентрированную среду диализовали против хроматографического буфера (50 мМ CH3COONa, 50 мМ NaCl рН=4.5). Среду после диализа центрифугировали 14000 g 15 мин. Катионообменную хроматографию проводили в хроматографическом буфере (50 мМ CH3COONa, 50 мМ NaCl рН 4.5) на колонке Source S (Pharmacia, Швеция). Среду наносили на предварительно уравновешенную колонку со скоростью 10 объемов колонки в час. Колонку промывали тем же буфером до прекращения дрейфа базовой линии. Адсорбированный ЧСА элюировали 50-мМ фосфатным буфером рН 9, содержащим 400 мМ NaCl.
Чистота конечного продукта-ЧСА составила 98%, выход составил 85%.
Проведение масс-спектрометрического анализа
Масс-спектрометрический анализ проводили по методу TOF-MALDI на масс-спектрометре VISION 2000 (ИБХ РАН), детектировали положительно заряженные ионы в линейном режиме для белковых образцов. В качестве материала матрицы использовали 2,5-дигидроксибензойную кислоту. Исследуемый белок наносили на мишень в водном 0,2% растворе трифторуксусной кислоты. Дополнительную калибровку проводили при помощи бычьего сывороточного альбумина.
Триптический гидролиз белка в полиакриламидном геле, окрашенном Coomassie Brilliant Blue (G-250), проводили следующим образом: вырезали кусочек геля размером 4×1 мм, который дважды промывали для удаления красителя путем инкубации в 150 мкл 40% раствора ацетонитрила в 0,1 М NH4HCO3 в течение 20 мин при 56°С. После удаления ацетонитрила и высушивания геля добавляли 3 мкл раствора модифицированного трипсина (Promega...) в 0,05 М NH4HCO3 с концентрацией 10 мкг×мл-1. Гидролиз проводили в течение 2 часов при 37°С, затем к раствору добавляли 5 мкл 0,1% раствор трифторуксусной кислоты в 10% растворе ацетонитрила в воде и тщательно перемешивали. Надгелевый раствор использовали для получения масс-спектров MALDI.
Подготовку образцов для масс-спектрометрического исследования триптического гидролизата проводили следующим образом: на мишени смешивали по 0,5 мкл раствора образца и раствора 2-альфа-циано-5-гидрокси коричной кислоты (2 мг/мл в 60% ацетонитриле) и полученную смесь высушивали на воздухе. Масс-спектры триптического гидролизата белка были получены на время-пролетном масс-спектрометре с источником MALDI Reflex III BRUKER (Германия), оснащенном УФ-лазером (337 нм), в режиме регистрации положительных ионов. Точность измеренных масс - 0,01%.
Идентификацию белка в базе данных последовательностей белков SwissProt по результатам масс-спектрометрического анализа образцов осуществляли с помощью программ Mascot (http://www.matrixscience.com/) и ProteinProspector (http://prospector.ucsf.edu/). При поиске задавали специфичность расщепления трипсином, количество недорезов 5, точность измерения 100 ppm для спектров без внутренних стандартов.
Полученный заявленным способом рекомбинантный человеческий альбумин с аминокислотной последовательностью, показанной на фиг.1(b), может использоваться в качестве препарата для различных медицинских целей. Это дает возможность расширить арсенал препаратов белка и применять указанный препарат вместо ЧСА, полученного из крови, что исключает возможность заражения различными инфекционными агентами.
1. Способ получения рекомбинантного человеческого сывороточного альбумина (ЧСА), включающий выделение и очистку его из источника, отличающийся тем, что для выделения ЧСА предварительно получают клетки штамма дрожжей P. pastoris, стабильно трансформированные генетической конструкцией, полученной путем обработки рестриктазой BglII вектора pPIC9, в который по сайтам BamHI и NotI клонируют ген предшественника ЧСА, и генетической конструкцией, полученной путем обработки рестриктазой Sad плазмиды pPICZαA, в которую по сайтам HindIII и NotI клонируют ген предшественника ЧСА, при этом указанные клетки получают путем введения в клетки штамма GS115 P. pastoris генетической конструкции, полученной путем обработки рестриктазой BglII вектора pPIC9, в который по сайтам BamHI и NotI клонируют ген предшественника ЧСА, отбора из полученных трансформантов клона с наибольшим уровнем экспрессии целевого белка, который обозначают как GS115/ЧСА5, и введения в данный клон генетической конструкции, полученной путем обработки рестриктазой Sad плазмиды pPICZαA, в которую по сайтам HindIII и NotI клонируют ген предшественника ЧСА, полученные клетки штамма дрожжей P. pastoris выращивают в питательной среде, отобранную культуральную среду осветляют последовательным центрифугированием при 2000 и 10000 g, супернатант концентрируют ультрафильтрацией, диализуют, проводят катионообменную хроматографию на колонке Source S, адсорбированный ЧСА элюируют 50 мМ фосфатным буфером, содержащим 400 мМ хлорида натрия, с рН 9, элюат содержит рекомбинантный ЧСА.
2. Продукт, полученный способом по п.1, представляющий собой элюат, включающий рекомбинантный человеческий сывороточный альбумин, 50 мМ фосфатный буфер, содержащий 400 мМ хлорида натрия, с рН 9.