Способ анализа гиматомелановых кислот пелоидов
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к медицинской технологии и фармакологии, и может быть использовано для стандартизации биологически активной субстанции на основе гиматомелановых кислот пелоидов. Способ включает спектрофотометрическое определение раствора гиматомелановых кислот, при этом обработку навески гиматомелановых кислот проводят 0,02 М раствором гидроксида натрия в течение 2 часов на водяной бане, затем доводят рН раствора до 7,4, перед спектрофотометрическим определением анализируют пробу, разводят дистиллированной водой и измеряют оптическую плотность раствора в области значений 310-600 нм, при этом для качественной идентификации исследование проводят при максимумах поглощения 350 и 380 нм, а для количественной оценки гуминовых кислот проводят определение при длине волны 380 нм с использованием калибровочного графика. Изобретение позволяет провести качественный и количественный анализ субстанции на основе гуминовых кислот в течение 15 минут, не считая времени пробоподготовки, которое оставляет 2,5-3,0 часа. Способ обладает более низкой себестоимостью, меньшими трудозатратами, более высокой точностью, чувствительностью и воспроизводимостью. 2 ил., 2 табл.
Реферат
Изобретение относится к медицине, а именно к медицинской технологии, фармакологии, и может быть использовано для стандартизации биологически активной субстанции на основе гиматомелановых кислот пелоидов.
В настоящее время в различных областях сельского хозяйства, промышленности, медицины широко используются препараты на основе гуминовых веществ, но не существует стандарта для оценки их качества. Это способствует тому, что под названием «гуминовые» используются разнообразные препараты, содержащие минимальное количество гуминовых веществ или прогуминовые соединения.
Из всех гуминовых веществ группа гиматомелановых кислот менее изучена. Впервые данная группа специфических органических веществ выделена Гоппе-Зейлером в 1889 году, но затем многие авторы высказывали сомнения в реальном ее существовании, считая, что это этилированная группа гуминовых кислот (Кононова М.М., 1963; Александрова Л.Н., 1980; Stevenson F.G., Bulter H.A., 1969). После исследований Глебовой Г.И. (1980) самостоятельность группы гиматомелановых кислот стала очевидной. В научной литературе информация о гиматомелановых кислотах пелоидов отражена в единичных работах (Агапов А.И., 1999; Аввакумова Н.П., 2003). Вместе с тем, именно эта группа гуминовых веществ обладает важными, с медицинской точки зрения, свойствами - выраженной восстановительной способностью.
Для глубокого изучения гиматомелановых кислот пелоидов с целью использования в медицинской практике, прежде всего необходимо разработать методы их стандартизации: качественный и количественный анализ.
Известна идентификация по совокупности признаков, но эти методы относятся к гиматомелановым кислотам таких биогеохимических объектов как почвы [1], в которых гуминовые вещества формируются и существуют в окислительных условиях.
Существуют способы идентификации гиматомелановых кислот пелоидов по следующим параметрам: элементный состав (содержание углерода, водорода, азота, кислорода); характер ИК-спектров, содержание бензолполикарбоновых кислот, значение коэффициентов экстинкции при определенных длинах волн (Е4:Е6) [2].
Недостатком такого подхода является использование дорогостоящего оборудования, участия специалистов разного профиля, длительность во времени. Проведенные нами в последние годы исследования гиматомелановых кислот, выделенных из низкоминерализованных иловых сульфидных грязей, свидетельствуют о том, что длина волны 465 нм не является самой чувствительной для указанных соединений.
Данный способ является наиболее близким к изобретению по сущности и выбран в качестве прототипа.
Задачей изобретения является создание нового способа оценки качества биологически активной субстанции «гиматомелановые кислоты пелоидов» с использованием наиболее чувствительной длины волны.
Исследуемая субстанция является очищенным экологически чистым препаратом, минерализация которого не превышает 1%, содержание тяжелых металлов не более 3,0·10-4%. Это темно-коричневое, почти черное чешуйчатое твердое вещество, без запаха и вкуса, не растворимо в воде, растворимо в этаноле, в водных растворах щелочей через стадию набухания. Гиматомелановые кислоты являются природным компонентом лечебных грязей безвредны для организма, не вызывают побочного действия, аллергических реакций.
Изучение острой токсичности гиматомелановых кислот было проведено на половозрелых крысах линии Wistar массой 180-200 г. Наблюдение за животными проводили в течение 14 суток. Введение «per os» от 0,5 г/кг до 15 г/кг не вызывало токсического эффекта. Внутримышечное введение от 1 мг/кг до 20 мг/кг также не вызывало гибели животных. Введение большего количества действующего вещества не удается осуществить практически и является необоснованным.
Поставленная задача решается тем, что навеску 0,0500 г тщательно измельченного порошка гиматомелановых кислот помещают в коническую колбу на 100 мл, добавляют 20 мл 0,02 М раствора натрия гидроксида, помещают на 2 часа в водяную баню. Далее доводят рН раствора 0,02 М раствором хлороводородной кислоты до значения 7,4. рН фиксируют с помощью стеклянного электрода на иономере «Анион 4100». Полученный раствор количественно переносят в мерную колбу на 50 мл, доводят дистиллированной водой до метки.
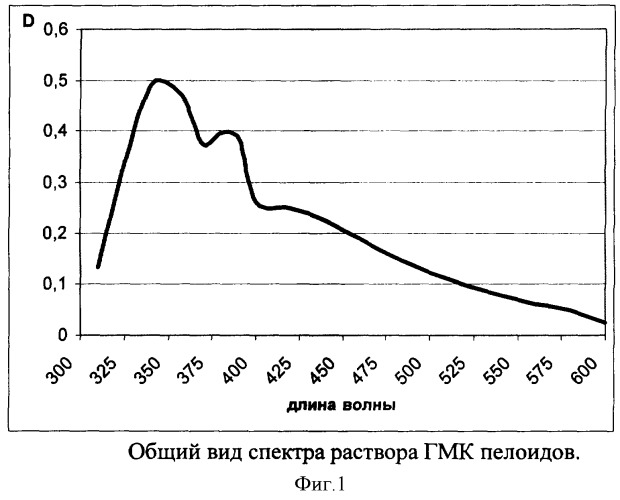
Из исходного раствора берут аликвоту пипеткой Мора 10 мл и помещают в мерную колбу на 100 мл, доводят дистиллированной водой до метки. Полученный раствор фотометрируют на фотоколориметре КФК-3 с использованием кюветы с толщиной 5,08 мм в диапазоне 310-600 нм относительно дистиллированной воды. Для полученных растворов измеряют оптическую плотность. Результаты приведены в таблице 1; вид спектра приведен на фиг.1.
Как видно в области значений 320-400 нм присутствуют две полосы поглощения с максимумами при 350 и 380 нм, которые и берут для качественной идентификации гиматомелановых кислот.
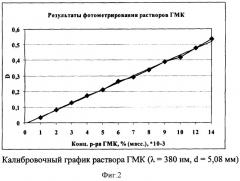
Для количественного определения гиматомелановых кислот авторы предлагают полосу поглощения с максимумом при 380 нм, так она имеет специфичный характер. Для построения калибровочного графика из исходного раствора гиматомелановых кислот берут объемы растворов с шагом 0,1 мл, доводят дистиллированной водой до объема 10 мл и фотометрируют. Результаты измерения оптической плотности приведены в таблице 2; калибровочный график - на фиг.2.
Заявляемый способ позволяет провести качественный и количественный анализ субстанции на основе гуминовых кислот в течение 15 минут, не считая времени пробоподготовки, которое составляет в среднем 2,5-3,0 часа.
Заявляемый способ по сравнению с известными обладает более низкой себестоимостью, меньшими трудозатратами, более высокой точностью, чуствительностью и воспроизводимостью.
Источники информации
1. Г.И.Глебова. Гиматомелановые кислоты почв, их место в системе гумусовых кислот. Автореферат на соискание ученой степени канд.биол.наук. - М.: МГУ, с.10-15.
2. Ф.Н.Гильмиярова, А.И.Агапов, Н.П.Аввакумова. Патент на изобретение №2122414 от 18.04.97. Способ получения препарата на основе гиматомелановых кислот низкоминерализованных иловых сульфидных грязей для физиотерапии. - Бюл. №33 от 17.11.98, 16 с.
| Таблица 1Результаты фотометрирования растворов ГМК при рН 7 (С(ГМК)=0,01%, d=5,08) | |||
| λ (нм) | Оптическая плотность | λ (нм) | Оптическая плотность |
| 310 | 0,132 | 420 | 0,29 |
| 320 | 0,269 | 440 | 0,268 |
| 330 | 0,408 | 460 | 0,236 |
| 340 | 0,485 | 480 | 0,197 |
| 350 | 0,51 | 500 | 0,165 |
| 360 | 0,479 | 520 | 0,138 |
| 370 | 0,399 | 540 | 0,114 |
| 380 | 0,438 | 560 | 0,093 |
| 390 | 0,43 | 580 | 0,077 |
| 400 | 0,295 | 600 | 0,062 |
| Таблица 2Результаты фотометрирования растворов ГМК | |
| Концентрация раствора ГМК, мас.% | Оптическая плотность |
| 1·10-3 | 0,034 |
| 2·10-3 | 0,084 |
| 3·10-3 | 0,127 |
| 4·10-3 | 0,172 |
| 5·10-3 | 0,212 |
| 6·10-3 | 0,266 |
| 7·10-3 | 0,291 |
| 8·10-3 | 0,337 |
| 9·10-3 | 0,389 |
| 10·10-3 | 0,417 |
| 12·10-3 | 0,476 |
| 14·10-3 | 0,536 |
Способ анализа гиматомелановых кислот пелоидов, включающий спектрофотометрическое определение раствора гиматомелановых кислот, отличающийся тем, что обработку навески гиматомелановых кислот проводят 0,02 М раствором гидроксида натрия в течение 2 ч на водяной бане, затем доводят рН раствора до 7,4, перед спектрофотометрическим определением анализируемую пробу разводят дистиллированной водой и измеряют оптическую плотность раствора в области значений 310-600 нм, при этом для качественной идентификации исследование проводят при максимумах поглощения 350 и 380 нм, а для количественной оценки гуминовых кислот проводят определение при длине волны 380 нм с использованием калибровочного графика.