Способы лечения послеоперационной боли введением антагониста фактора роста нервов и композиции, содержащие фактор роста нервов
Иллюстрации
Показать всеИзобретение относится к медицине и касается применения антагониста фактора роста нервов (NGF) для предотвращения или лечения послеоперационной боли. Для этого вводят эффективные количества антагониста фактора роста нервов (NGF) или фармацевтической композиции, содержащей NGF. Антагонист NGF представляет собой антагонистическое антитело против NGF. Введение этого соединения обеспечивает эффективное лечение послеоперационной боли, которая представляет собой отдельное патологическое состояние, за счет воздействия на механизмы, отличные от участвующих в других видах боли. 3 н. и 6 з.п. ф-лы, 2 табл., 10 ил.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Для данной заявки испрошен приоритет на основе предварительной заявки на патент США под регистрационным №60/417237, поданной 8 октября 2002 г., содержание которой полностью включено в качестве ссылки.
ЗАЯВЛЕНИЕ ОТНОСИТЕЛЬНО ФЕДЕРАЛЬНО СПОНСИРОВАННОГО ИССЛЕДОВАНИЯ ИЛИ РАЗРАБОТКИ
Данное изобретение было создано при поддержке Правительства США в соответствии с контрактом №DAAD19-03-C-0006, предоставленной агентством DARPA. Правительство США имеет определенные права на данное изобретение.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к применению антагониста фактора роста нервов (NGF) для предотвращения, облегчения или лечения послеоперационной боли.
УРОВЕНЬ ТЕХНИКИ
Фактор роста нервов (NGF) был первым идентифицированным нейротропином, и его роль в развитии и выживании и периферических, и центральных нейронов была достаточно охарактеризована. Было показано, что NGF является решающим фактором выживания и поддержания в развитии периферических симпатических и эмбриональных сенсорных нейронов и холинергических нейронов основания переднего мозга (Smeyne, et al., Nature 368:246-249 (1994); Crowley, et al., Cell 76:1001-1011 (1994)). NGF стимулирующе регулирует экспрессию нейропептидов в сенсорных нейронах (Lindsay, et al., Nature 337:362-364 (1989)), и его активность опосредована через 2 различных связанных с мембраной рецептора, рецептор тирозинкиназы TrkA и рецептор р75, который структурно связан с другими членами семейства рецепторов фактора некроза опухоли (Chao, et al., Science 232:518-521 (1986)).
В дополнение к воздействиям NGF на нервную систему, появляется все больше данных о его участии в процессах вне нервной системы. Например, было показано, что экзогенно введенный NGF усиливает сосудистую проницаемость (Otten, et al., Eur J Pharmacol. 106:199-201 (1984)), усиливает Т- и В-клеточные иммунные реакции (Otten, et al., Proc. Natl. Acad. Sci. USA 86:10059-10063 (1989)), вызывают дифференцировку лимфоцитов и пролиферацию тучных клеток и вызывают высвобождение растворимых биологических сигналов из тучных клеток (Matsuda, et al., Proc. Natl. Acad. Sci. USA 85:6508-6512 (1988); Pearce, et al., J. Physiol. 372:379-393 (1986); Bischoff, et al., Blood 79:2662-2669 (1992); Horigome, et al., J. Biol. Chem. 268:14881-14887 (1993)). Хотя было показано, что экзогенно добавляемый NGF способен оказывать все указанные эффекты, важно отметить, что лишь изредка было показано, что эндогенный NGF важен при любом из указанных процессов in vivo (Torcia, et al., Cell. 85(3):345-56 (1996)). Поэтому неясно, каков может быть эффект ингибирования биологической активности эндогенного NGF, если он имеет место.
NGF продуцируется рядом типов клеток, включая тучные клетки (Leon, et al., Proc. Natl. Acad. Sci. USA 91:3739-3743 (1994)), В-лимфоциты (Torcia, et al., Cell 85:345-356 (1996)), кератиноциты (Di Marco, et al., J. Biol. Chem. 268:22838-22846)), гладкомышечные клетки (Ueyama, et al., J. Hypertens. 11:1061-1065 (1993)), фибробласты (Lindholm, et al., Eur. J. Neurosci. 2:795-801 (1990)), бронхиальные эпителиальные клетки (Kassel, et al., Clin, Exp.Allergy 31:1432-40 (2001)), почечные мезангиальные клетки (Steiner, et al., Am. J. Physiol. 261:F792-798 (1991)) и миотрубочки скелетных мышц (Schwartz, et al., J. Photochem, Photobiol. B 66:195-200 (2002)). Рецепторы NGF были обнаружены на разнообразных типах клеток вне нервной системы. Например, TrkA был обнаружен на моноцитах, Т- и В-лимфоцитах и тучных клетках человека.
Связь между повышенными уровнями NGF и разнообразными воспалительными состояниями наблюдалась у больных людей, а также на нескольких экспериментальных моделях у животных. Они включают системную красную волчанку (Bracci-Laudiero, et al., Neuroreport. Lett. 4:563-565 (1995)), рассеянный склероз (Bracci-Laudiero, et al., Neurosci. Lett. 147:9-12 (1992)), псориаз (Raychaudhuri, et al., Acta Derm. l'enereol. 78:84-86 (1998)), артрит (Falcimi, et al., Ann. Rheum. Dis. 55:745-748 (1996)), интерстициальный цистит (Okragly, et al., J. Urology 161:438-441 (1991)) и астму (Braun, et al., Eur. J. Immunol. 28:3240-3251 (1998)).
Следовательно, повышение уровня NGF в периферических тканях связано с воспалением, и это наблюдалось при ряде форм артрита. Синовиальная оболочка пациентов, пораженных ревматоидным артритом, проявляет высокие уровни NGF, в то время, как сообщалось о том, что в невоспаленной синовиальной оболочке NGF не выявляется (Aloe, et al., Arch. Rheum. 35:351-355 (1992)). Аналогичные результаты наблюдались у крыс с экспериментально вызванным ревматоидным артритом (Aloe, et al., Clin. Exp. Rheumatol. 10:203-204 (1992)). Сообщалось о повышении уровня NGF у трансгенных мышей с артритом, наряду с увеличением количества тучных клеток (Aloe, et al., Int. J. Tissue Reactions-Exp. Clin. Aspects 15:139-143 (1993)).
Лечение экзогенным NGF ведет к усилению боли и болевой чувствительности. Это иллюстрируется тем обстоятельством, что инъекция NGF ведет к значительному усилению боли и болевой чувствительности и на экспериментальных моделях у животных (Amann, et al., Pain 64, 323-329 (1996); Andreev, et al., Pain 63, 109-115 (1995)) и человека (Dyck, et al., Neurology 48, 501-505 (1997); Petty, et al., Annals Neurol. 36, 244-246 (1994)). Оказывается, что NGF действует через множество механизмов, включая индукцию нейротропина BDNF (Apfel, et al., Mol. Cell. Neurosci. 7(2), 134-142 (1996); Michael, et al., J. Neurosci 17, 8476-8490 (1997)), который в свою очередь изменяет обработку болевых сигналов в спинном мозге (Hains, et al., Neurosci Lett. 320(3), 125-8 (2002); Miletic, et al., Neurosci Lett. 319(3), 137-40 (2002); Thompson, et al., Proc. Natl Acad Sci USA 96(14), 7714-8 (1999)), вызывая изменения периферических и центральных соединений сенсорных нейронов и других передающих боль нейронов в спинном мозге (Lewin, et al., European Journal of Neuroscience 6, 1903-1912 (1994); Thompson, et al., Pain 62, 219-231 (1995)), вызывая изменения роста аксонов (Lindsay, RM, J Neurosci. 8(7), 2394-405 (1998)), вызывая экспрессию рецепторов брадикинина (Peterson et al., Neuroscience 83:161-168 (1998)), вызывая изменения экспрессии генов, ответственных за активацию нервов и проведение в них, в частности, ионных каналов (Boettger, et al., Brain 125(Pt 2), 252-63 (2002); Kerr, et al., Neuroreport 12(14), 3077-8 (2001); Gould, et al., Brain Res 854(1-2), 19-29 (2000)), потенцирование связанного с болью рецептора VR1 (Chuang, et al., Nature 411 (6840), 957-62 (2001)); и вызывая патологические изменения в мышцах (Foster, et al., J. Pathol 197(2), 245-55 (2002)). Многие из указанных изменений происходят непосредственно на передающих болевое ощущение сенсорных нейронах и, очевидно, не зависят от сопутствующего воспаления. Кроме того, существуют, по меньшей мере, 2 других типа клеток, которые, как известно, реагируют на NGF и которые могут участвовать в изменениях ощущения боли или болевой чувствительности. Сообщалось, что первая из них, тучная клетка, реагирует на NGF дегрануляцией (Yan, et al., Clin. Sci. (Lond) 80:565-569 (1991)) или в других исследованиях вызывает или увеличивает продукцию или высвобождения медиатора в сотрудничестве с другими веществами (Pearce and Thompson, J. Physiol. 372:379-393 (1986), Kawamoto, et al., J. Immunol. 164:6412-6419 (2002)). Было ясно показано у крыс, что болевые реакции, опосредованные NGF, по меньшей мере, в некоторой степени опосредованы тучными клетками (Lewin, et al., Eur. J. Neurosci. 6:1903-1912 (1994), Woolf, et al., J. Neurosci. 16:2716-2723 (1996)), хотя потенциальную релевантность этого еще предстоит показать у человека. Также известно, что первичные симпатические нейроны реагируют на NGF и также участвуют в болевой сигнализации (Aley, et al., Neuroscience 71:1083-1090 (1996)). Ясно, что удаление симпатической иннервации модифицирует гиперальгезию, обычно наблюдающуюся в ответ на лечение NGF (Woolf, et al., J. Neurosci. 16:2716-2723 (1996)).
Ежегодно 23000000 пациентов подвергаются хирургическим процедурам. Боль обычно локализуется вблизи участка операции. Послеоперационная боль может иметь 2 клинически важных аспекта, а именно, боль в покое или боль, которая возникает, когда пациент не движется, и механическая боль, которая усиливается движением (кашель/чихание, вставание с постели, физиотерапия и т.д.). Большой проблемой лечения послеоперационной боли при обширных операциях является то, что используемые в настоящее время препараты имеют разнообразные выраженные побочные эффекты, которые задерживают выздоровление, удлиняют госпитализацию и подвергают определенные уязвимые группы пациентов риску тяжелых осложнений. Послеоперационная боль или боль, которая возникает после операции или травматического повреждения, представляет собой серьезную и часто трудноизлечимую медицинскую проблему.
Существуют 2 общие категории медикаментозной терапии для лечения боли, обе из которых имеют недостатки. Первая категория включает нестероидные противовоспалительные препараты (NSAID), которые применяются для лечения незначительной боли, но терапевтическое применение которых ограничивается нежелательными желудочно-кишечными эффектами, такими как эрозия слизистой оболочки желудка, образование пептической язвы или воспаление 12-перстной кишки и толстой кишки. NSAID также могут вызвать токсическое действие на почки при продолжительном применении. И, кроме того, как описано ниже, не очень эффективны для лечения боли, связанной с определенными состояниями, или возникающими при них, включая послеоперационную боль. Вторая категория включает морфин и родственные опиоиды, которые применяются для лечения боли от умеренной до тяжелой, но терапевтическое применение которых ограничено ввиду нежелательных эффектов, таких как седативный эффект, спутанное сознание, запор, подавление дыхания, почечная колика, толерантность к продолжительному применению и риск зависимости. Поэтому необходимы соединения, которые можно применять для лечения боли, с меньшим количеством или отсутствием побочных эффектов.
Боль часто классифицируют как «воспалительную», «нейропатическую» или «висцеральную», но данные традиционные общие обозначения имеют присущие им проблемы. Они привносят механистическую аналогию или идентичность среди всех источников боли в пределах одной из указанных очень общих категорий. Действительно, существует много различных типов воспалительной боли и источников боли, которые не являются ни воспалительными, ни нейропатическими. Кроме того, типы боли, которые имеют воспалительный компонент, и/или традиционно именуются «воспалительными», не означают, что другие физиологические аспекты не участвуют в болевом состоянии. Например, и остеоартрит, и интерстициальный цистит должны были бы быть определены по их названиям как стерильные воспалительные состояния соответственно суставов или мочевого пузыря, но ясно, что боли, связанные с указанными двумя состояниями, механистически совершенно отличны друг от друга. На это указывают различные эффекты данного типа противоболевого лекарственного лечения в отношении указанных типов боли. Большинство пациентов с остеоартритом получают хорошее облегчение боли (по меньшей мере, первоначально) при лечении NSAID. Однако лечение NSAID абсолютно неэффективно при интерстициальном цистите.
Послеоперационная боль (взаимозаменяемо именуемая болью после разреза) часто рассматривается как разновидность воспалительной боли. Хотя в послеоперационной боли может быть «воспалительный» компонент, в нее отчетливо вовлечены дополнительные механизмы. Например, во время операции или другой травмы разрезаются и рвутся и сосуды, и нервы. Это не происходит в ткани, подвергаемой только воспалению. Ясно, что перерезка нерва может вызвать продолжающуюся активность, которая воспринимается как болезненная. Кроме того, перерезка кровеносных сосудов ведет к относительной ишемии ткани, также болезненному стимулу, который не присутствует во время одного воспаления.
Различные механизмы, участвующие в хирургической или вызванной повреждением боли, по сравнению с воспалением, иллюстрируются меняющейся фармакологией и лежащими в основе анатомическими субстратами облегчения боли при двух состояниях. Yamamoto, et al. (Brian Res. 909(1-2):138-144(2001)) показали, что ингибирование спинномозговой кислотной дипептидазы, связанной с N-ацетилом-альфа (NAALADase), вызывает выраженное ослабление механической боли, которая сопровождает воспалительный стимул инъекции каррагинана. Однако в параллельных экспериментах, где NAALADase ингибировали идентичным образом после разреза, не было ослабления механической боли. Данные наблюдения демонстрируют, что биохимия или фармакология, лежащие в основе послеоперационной боли, отличаются от таковых, лежащих в основе воспалительной боли. Анатомические структуры, важные в модуляции болевого ощущения, также были исследованы при послеоперационных и других болевых состояниях (Pogatzki, et al., Anesthesiology, 96(5):1153-1160 (May (2002)). Нисходящие влияния для ствола головного мозга, конкретнее, рострального среднего отдела продолговатого мозга, являются важными медиаторами вторичной гиперальгезии при общих воспалительных, нейропатических и висцеральных болевых состояниях. При повреждении области ствола головного мозга не наблюдалось изменение какой-либо болевой реакции, измеренной после разреза. Данные результаты указывают на то, что первичная и вторичная гиперальгезия после разреза не модулируются нисходящим влиянием из RMM (рострального среднего отдела продолговатого мозга). Отсутствие вклада нисходящих содействующих влияний из RMM во вторичную гиперальгезию после разреза икроножной мышцы поддерживает утверждение о том, что вызванная разрезом боль включала механизмы, отличные от воспалительной и нейропатической боли. В дополнение к очевидным отличиям послеоперационной или вызванной травмой боли от воспалительной, висцеральной или нейропатической боли, эти результаты демонстрируют, что механизмы, участвующие в послеоперационной боли (или боли, вызванной травмой), отчетливо отличаются от других видов боли. Далее, возможность применения конкретного фармакологического (или другого) вмешательства при лечении послеоперационной боли не прогнозируема путем тестирования указанного фармакологического средства или вмешательства на моделях воспалительной, висцеральной или нейропатической боли.
Исчезновение боли в покое и сохранение боли при активности и в ответ на механические стимулы у участка раны также присутствуют у пациентов после операции (Moiniche, et al., Acta Anaesthesiol. Scand. 41:785-9 (1997)). Исследования свидетельствуют о том, что боль в покое и боль, вызываемая в результате разреза, вероятно, передается различными популяциями восходящих волокон и/или различными рецепторами. Кроме применения местных анестетиков для ингибирования этих вызванных реакций, имеется несколько препаратов, которые заметно уменьшают боль при кашле и движении после операции.
Было показано, что предварительное лечение местным анестетиком для блокировки боли во время экспериментального разреза первоначально предотвращает продолжающуюся боль и первичную механическую гиперальгезию. Боль от разреза также исчезает, когда лидокаин инъецируется после травмы. Однако по мере ослабления действия местного анестетика, первичная гиперальгезия возвращается. У пациентов инъекции местных анестетиков, произведенные перед операцией, приблизительно эквивалентны инъекциям, сделанным для уменьшения боли после операции (Moiniche, et al., Anesthesiology 96:725-41 (2002)).
Клинические экспериментальные исследования на людях-добровольцах и преклиническая модель разреза согласуются в том, что введение местного анестетика перед или после разреза приблизительно эквивалентны. Активация центральных нейронов, передающих боль, во время разреза и повышенная чувствительность не являются необходимыми для видов поведения, связанных с болью, через несколько дней. Скорее, в случае разрезов, усиленная реактивность центральных нейронов и боль требуют продолжающейся афферентной входящей импульсации от места разреза. Представляется, что после ослабления действия любого анальгезирующего лечения, проведенного перед разрезом, снова повышается чувствительность хирургической раны и генерируются болевые реакции (Pogatzki, et al., J. Neurophysiol 87:721 (2002)).
Область гиперальгезии (включая не травмированную зону), вызванную разрезами, также картировали. Вторичная гиперальгезия (гиперальгезия вне области повреждения) представляет собой показатель усиленной реактивности центральной нервной системы, т.е. центральной сенсибилизации. Было также отмечено, что область воспалительной гиперемии или красноты (возможно, в результате аксонных рефлексов), вызванная разрезом, отличалась от области гиперальгезии. В отличие от боли в покое и первичной механической гиперальгезии, большая область гиперальгезии никогда не формировалась, когда перед разрезом делали инъекцию местного анестетика. Более того, ее нельзя было устранить инъекцией местного анестетика после разреза. У пациентов после операции в некоторых случаях определенные виды лечения значительно уменьшают область гиперальгезии, но существенно не модифицируют клинические показатели послеоперационной боли (балльные оценки боли и потребление опиоидов). Было показано, что при сокращении области гиперальгезии после колэктомии не происходит существенного уменьшения острой боли, однако это связано с уменьшением количества больных, у которых развилась остаточная боль даже через 6 месяцев после колэктомии (De Kock, et al., Pain 92:373-80 (2001)).
Применение антитела против NGF для лечения хронической висцеральной боли было описано (см. публикацию РСТ №WO 01/78698). Brennan et al. сообщают о введении иммуноадгезина TrkA на крысиной модели послеоперационной боли (см. Society for Neuroscience Abstracts 24(1-2) 880 (1998)).
Все приведенные в настоящем описании ссылки, включая патентные заявки и публикации, полностью включены в качестве ссылки.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано на открытии, что антагонисты NGF эффективны при лечении послеоперационной боли. Лечение направлено на один или несколько аспектов послеоперационной боли, как раскрыто в настоящем описании.
В одном аспекте изобретение включает способ предотвращения или лечения послеоперационной боли (взаимозаменяемо именуемой как «боль после разреза» или «посттравматическая боль») введением антагониста фактора роста нервов (NGF). Было показано в соответствии с изобретением, что антагонисты NGF способны ингибировать или блокировать боль, возникающую в результате послеоперационной боли, включая боль вследствие операции или резаной раны, или травмы.
В другом аспекте изобретение включает способы снижения возникновения послеоперационной боли, облегчения послеоперационной боли, уменьшения послеоперационной боли и/или задержки развития или прогрессирования послеоперационной боли у индивидуума, причем указанные способы включают введение эффективного количества антагониста NGF.
В другом аспекте изобретение включает способы увеличения болевого порога у индивидуума, включающие введение эффективного количества антагониста NGF.
В другом аспекте изобретение включает способы усиления заживления травматической раны, вызванной операцией и/или травмой, у индивидуума, включающие введение эффективного количества антагониста NGF.
В некоторых вариантах реализации боль в покое подавляется, облегчается и/или предотвращается, в некоторых вариантах реализации механически вызванная боль (включая боль в результат движения) подавляется, облегчается и/или предотвращается, и в некоторых вариантах реализации термически вызванная боль подавляется, облегчается и/или предотвращается. В некоторых вариантах реализации механически вызванная боль подавляется, облегчается и/или предотвращается введением антитела против NGF. В некоторых вариантах реализации боль в покое подавляется, облегчается и/или предотвращается введением антитела против NGF. В некоторых вариантах реализации термически вызванная боль подавляется, облегчается и/или предотвращается введением антитела против NGF. В некоторых вариантах реализации аллодиния (т.е., повышенная реакция (т.е., увеличенная болевая чувствительность) на обычно не болевой стимул)) подавляется, облегчается и/или предотвращается, и/или гиперальгезия (т.е., повышенная реакция на обычно болевой или неприятный стимул) подавляется, облегчается и/или предотвращается. В еще одних вариантах реализации аллодиния и/или гиперальгезия является термической или механической (тактильной) по природе, или болью в покое. В некоторых вариантах осуществления, боль представляет собой хроническую боль. В других вариантах реализации боль связана с участком разреза, раны или травмы и/или участком, расположенным близко к участку разреза, раны и/или травмы, в нем или около него.
Антагонист NGF, подходящий для применения в способах по изобретению, представляет собой любое средство, которое может прямо или косвенно привести к сниженной биологической активности NGF. В некоторых вариантах реализации антагонист NGF (например, антитело) связывает (физически взаимодействует с) NGF, связывается с рецептором NGF (таким как рецептор trkA и/или р75) и/или уменьшает (тормозит и/или блокирует) нисходящую передачу сигналов рецептором NGF (например, ингибиторы передачи сигналов киназы). Соответственно, в некоторых вариантах реализации антагонист NGF связывает (физически взаимодействует с) NGF. В другом варианте реализации антагонист NGF связывается с рецептором NGF (таким как рецептор trkA и/или р75). В других вариантах реализации антагонист NGF уменьшает (тормозит и/или блокирует) нисходящую передачу сигналов рецептором NGF (например, ингибиторы передачи сигналов киназы). В других вариантах реализации антагонист NGF ингибирует (уменьшает) синтез и/или высвобождение NGF. В другом варианте реализации антагонист NGF представляет собой антагонист NGF, который не является иммуноадгезином TrkA (т.е., является отличным от иммуноадгезина TrkA). В другом варианте реализации антагонист NGF отличен от антитела против NGF. В другом варианте реализации антагонист NGF отличен от иммуноадгезина TrkA и отличен от антитела против NGF. В некоторых вариантах реализации антагонист NGF связывает NGF (такой как hNGF) и значительно не связывается с родственными нейротропинами, такими как NT-3, NT4/5 и/или BDNF. В некоторых вариантах реализации антагонист NGF выбран из любого одного или нескольких: антитела против NGF, антисмысловой молекулы, направленной на NGF (включая антисмысловую молекулу, направленную на нуклеиновую кислоту, кодирующую NGF), антисмысловую молекулу, направленную на рецептор NGF (такой как TrkA и/или р75) (включая антисмысловую молекулу, направленную на нуклеиновую кислоту, кодирующую рецептор NGF), соединение, ингибирующее NGF, структурный аналог NGF, доминантно-негативную мутацию рецептора TrkA и/или р75, который связывает NGF, антитело против TrkA, антитело против р75 и ингибитор киназы. В другом варианте реализации антагонист NGF представляет собой антитело против NGF. В еще одних вариантах реализации антитело против NGF является гуманизированным (таким как описанное в настоящем описании антитело Е3). В некоторых вариантах реализации антитело против NGF представляет собой антитело Е3 (как описано в настоящем описании). В других вариантах реализации антитело против NGF включает один или несколько CDR антитела Е3 (например, 1, 2, 3, 4, 5 или, в некоторых вариантах реализации, все 6 CDR из Е3). В других вариантах реализации антитело является человеческим. В еще одних вариантах реализации антитело против NGF включает аминокислотную последовательность вариабельной области тяжелой цепи, показанную в таблице 1 (SEQ ID NO:1), и аминокислотную последовательность вариабельной области легкой цепи, показанную в таблице 2 (SEQ ID NO:2). В еще одних вариантах реализации антитело включает модифицированную константную область, такую как константная область, которая является иммунологически инертной, например, не запускает опосредованный комплементом лизис, или не стимулирует антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC). В других вариантах реализации константная область модифицирована, как описано в Eur. J. Immunol. (1999) 29:2613-2624; заявке РСТ №РСТ/GB/01441 и/или в заявке на патент Великобритании №9809951.8.
В некоторых вариантах реализации антагонист NGF связывается с NGF. В еще одних вариантах реализации антагонист NGF представляет собой антитело, которое специфически связывается с NGF (таким как человеческий NGF). В еще одних вариантах реализации антитело связывает по существу тот же эпитоп NGF, что и антитело, выбранное из любого одного или нескольких из следующих мышиных моноклональных антител: MAb 911, MAb 912 и MAb 938 (см. Hongo, et al., Hybridoma 19:215-227 (2000)). В некоторых вариантах реализации антагонист NGF связывается с рецептором trkA. Антагонист NGF может представлять собой моноклональное антитело против человеческого NGF (анти-hNGF), которое способно связываться с hNGF и эффективно ингибировать связывание hNGF с человеческим TrkA (hTrkA) и/или эффективно ингибировать активацию рецептора человеческого TrkA.
Аффинитет связывания антитела против NGF с NGF (таким как hNGF) может составлять от приблизительно 0,10 нМ до приблизительно 1,0 нМ, от приблизительно 0,10 до приблизительно 0,80 нМ, от приблизительно 0,15 до приблизительно 0,75 нМ и от приблизительно 0,18 до приблизительно 0,72 нМ. В одном варианте реализации аффинитет связывания составляет приблизительно от 2 пМ до 22 пМ. В некоторых вариантах реализации, аффинитет связывания составляет приблизительно 10 нМ. В других вариантах реализации аффинитет связывания составляет менее, чем приблизительно 10 нМ. В других вариантах реализации аффинитет связывания составляет приблизительно 0,1 нМ или приблизительно 0,07 нМ. В других вариантах реализации аффинитет связывания составляет менее, чем приблизительно 0,1 нМ или менее, чем приблизительно 0,07 нМ. В других вариантах реализации аффинитет связывания принимает любые значения, меньшие, чем приблизительно из следующих: 100 нМ, приблизительно 50 нМ, приблизительно 10 нМ, приблизительно 1 нМ, приблизительно 500 пМ, приблизительно 100 пМ, или от приблизительно 50 пМ до любых из: приблизительно 2 пМ, приблизительно 5 пМ, приблизительно 10 пМ, приблизительно 15 пМ, приблизительно 20 пМ, или приблизительно 40 пМ. В некоторых вариантах реализации аффинитет связывания принимает любое значение из приблизительно 100 нМ, приблизительно 50 нМ, приблизительно 10 нМ, приблизительно 1 нМ, приблизительно 500 пМ, приблизительно 100 пМ, или от приблизительно 50 пМ, или менее, чем приблизительно 50 пМ. В некоторых вариантах реализации аффинитет связывания принимает любые значения, меньшие, чем приблизительно менее, чем любой из приблизительно 100 нМ, приблизительно 50 нМ, приблизительно 10 нМ, приблизительно 1 нМ, приблизительно 500 пМ, приблизительно 100 пМ, или приблизительно 50 пМ. В других вариантах реализации аффинитет связывания составляет приблизительно 2 пМ, приблизительно 5 пМ, приблизительно 10 пМ, приблизительно 15 пМ, приблизительно 20 пМ, приблизительно 40 пМ или более, чем приблизительно 40 пМ. Как хорошо известно в данной области, аффинитет связывания можно выразить в виде KD, или константы диссоциации, при этом возрастание аффинитета связывания соответствует уменьшению KD. Аффинитет связывания мышиного моноклонального антитела 911 против NGF (Hongo et al., Hybridoma 19:215-227 (2000)) с человеческим NGF составляет приблизительно 10 нМ, а аффинитет связывания гуманизированного антитела Е3 против NGF (описанный здесь) с человеческим NGF составляет приблизительно 0,07 нМ.
Антагонист NGF можно ввести перед, во время и/или после операции, разреза и/или ранения, которые вызывают или связаны с послеоперационной болью. В некоторых вариантах реализации антагонист NGF вводят перед операцией, разрезом или нанесением на раны. Введение антагониста NGF можно осуществить любым путем, известным в данной области, включая: перорально, внутривенно, подкожно, внутриартериально, внутримышечно, внутрисердечно, интраспинально, интраторакально, внутрибрюшинно, интравентрикулярно, сублингвально, и/или трансдермально. В некоторых вариантах реализации антагонист NGF представляет собой антитело против NGF, а введение осуществляется одним или несколькими из следующих путей: внутривенно, подкожно, посредством ингаляции, внутриартериально, внутримышечно, внутрисердечно, интравентрикулярно и внутрибрюшинно. Введение может быть системным, например, внутривенно, или локализованным.
В некоторых вариантах реализации антагонист NGF вводят в дозе приблизительно от 0,1 до 10 мг/кг массы тела, а в других вариантах реализации антагонист NGF вводят в дозе приблизительно от 0,3 до 2,0 мг/кг массы тела.
В другом аспекте изобретение предоставляет композицию для лечения и/или предотвращения послеоперационной боли, содержащую эффективное количество антагониста фактора роста нервов (NGF) в комбинации с одним или несколькими фармацевтически приемлемыми эксципиентами. В некоторых вариантах реализации антагонист NGF представляет собой антитело, которое специфически связывается с молекулой NGF. В другом варианте реализации антагонист NGF представляет собой любой антагонист, упомянутый в настоящем описании.
В другом аспекте изобретение предоставляет набор для использования в любом из описанных здесь способах. В некоторых вариантах реализации набор содержит любой из описанных в настоящем описании антагонистов NGF в комбинации с фармацевтически приемлемым носителем. В другом варианте реализации набор дополнительно содержит инструкции по применению антагониста NGF в любом из описанных в настоящем описании способов.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
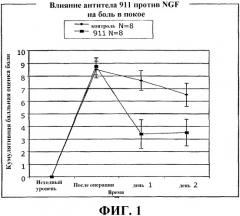
Фиг.1 представляет собой график, отражающий оценку кумулятивной боли в покое, по данным за 24 ч до операции («исходный уровень»), через 2 ч после операции («после операции») и через 1 и 2 дня после операции. «Контроль» относится к лечению антителом против NGF, а «911» относится к животным, получавшим лечение антителом 911 против NGF в дозе 35 мг/мг (также именуемым "MAb 911") (Hongo et al., Hybridoma 19:215-227 (2000)). Лечение антителом против NGF значительно уменьшало послеоперационную боль в покое.
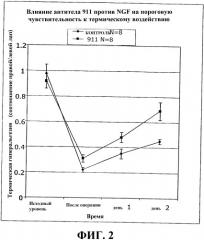
Фиг.2 представляет собой график, отражающий оценку термической боли (гиперальгезии) по данным за 24 ч до операции («исходный уровень»), через 4 ч после операции («после операции») и через 1 и 2 дня после операции. «Контроль» относится к лечению антителом против NGF, а «911» относится к животным, получавшим лечение антителом 911 против NGF в дозе 35 мг/мг. Лечение антителом против NGF значительно уменьшало послеоперационную термическую гиперальгезию.
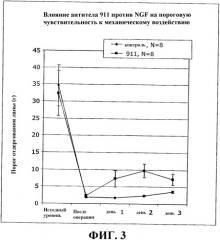
Фиг.3 представляет собой график, отражающий оценку механической боли (гиперальгезии) в ответ на механическую стимуляцию, по данным за 24 ч до операции («исходный уровень»), через 3 ч после операции («после операции») и через 1, 2 и 3 дня после операции. «Контроль» относится к лечению антителом против NGF, а «911» относится к животным, получавшим лечение антителом 911 против NGF. Лечение антителом против NGF в дозе 7 мг/мг уменьшало механически вызванную послеоперационную боль.
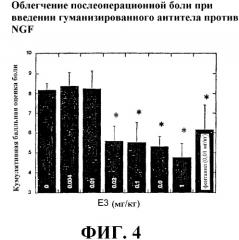
Фиг.4 представляет собой график, отражающий оценку боли в покое, по данным через 24 ч после операции, и показывающий, что лечение гуманизированным антителом Е3 против NGF в дозе 0,02 мг/мг, 0,1 мг/кг, 0,6 мг/кг или 1 мг/кг уменьшало боль. «*» указывает на статистически значимое отличие (p<0,5) от отрицательного контроля.
Фиг.5 представляет собой график, отражающий оценку боли в покое, по данным через 24 ч после операции, и показывающий, что лечение гуманизированным антителом Е3 против NGF в дозе 0,5 мг/кг значимо (p<0,005) уменьшало боль в покое при инъекции через 2 ч после операции.
Фиг.6 представляет собой график, отражающий оценку боли в покое, по данным через 24 ч после операции, и показывающий, что лечение антителом 911 против NGF в дозе 5 мг/кг значимо (p<0,02) уменьшало боль в покое при инъекции за 14 дней до операции.
Фиг.7 представляет собой график, отражающий оценку боли в покое, по данным через 24 ч после операции, и показывающий, что лечение антителом 911 против NGF в дозе 5 мг/кг уменьшало боль в покое при инъекции за 21 день до операции.
Фиг.8 представляет собой график, отражающий оценку участков интактных ран, после разреза и лечения солевым раствором, антителом 911 против NGF в дозе 1 мг/кг или положительным контролем-кеторолаком. Участки интактных ран после лечения антителом 911 против NGF не отличались от участков интактных ран после лечения солевым раствором (отрицательный контроль). Таким образом, лечение антителом 911 против NGF не проявляло воздействия на заживление ран. Напротив, у животных, получавших лечение NSAID кеторолаком (положительный контроль), проявилось значительное уменьшение участков интактных ран.
Фиг.9 представляет собой график, демонстрирующий, что лечение низкомолекулярным антагонистом NGF, K252a, значимо (p<0,005) уменьшало боль в покое после операции при оценке через 3 ч ("3H-P-tmt") после лечения К252а. "1H-P-tmt" относится к 1 ч после лечения К252а.
Фиг.10 представляет собой график, отражающий сравнение лечения антителом 911 против NGF и лечения подобранным по изотипу контрольным антителом. У животных, получавших лечение 1 мг/кг антитела против NGF (911), проявилось значимое уменьшение боли в покое (p<0,05). Напротив, у животных, получавших лечение 1 мг/кг подобранного по изотипу контрольного антитела к вызывающему амнезию белку дрозофилы, проявлялись нормальные уровни боли в покое. Данный эксперимент продемонстрировал, что обезболивающий эффект антитела против NGF был специфичным.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано на выявлении того факта, что введение in vivo терапевтически эффективного количества антагониста NGF, такого как моноклональное антитело против NGF можно использовать для предотвращения и/или лечения послеоперационной боли. Ранее послеоперационную боль лечили высокими дозами опиоидных анальгетиков. Эти средства вызывают нежелательные побочные эффекты, такие как сниженная моторика желудка, седативный эффект, подавление дыхания и почечная колика. Другие обезболивающие средства, такие как NSAID, были относительно неэффективны при лечении этого типа боли. Кроме того, известно, что некоторые NSAID ингибируют заживление ран.
Изобретение включает способы предотвращения или лечения послеоперационной боли у индивидуума (включая млекопитающее, как человека, так и не человека) введением эффективного количества антагониста NGF, такого как антитело против NGF, например, моноклонального антитела против человеческого NGF (анти-hNGF).
В другом аспекте изобретение предоставляет способы облегчения, задержки развития и/или предотвращения прогрессирования послеоперационной боли, включающие введение эффективного количества антагониста NGF индивидууму.
В некоторых вариантах реализации боль в покое подавляется, облегчается и/или предотвращается, а в некоторых вариантах реализации механически вызванная боль (такая как боль в результате движения или другой механической или тактильной стимуляции) подавляется, облегчается и/или предотвращается. В некоторых вариантах реализации термически вызванная боль подавляется, облегчается и/или предотвращается. В некоторых вариантах реализации механически вызванная боль подавляется, облегчается и/или предотвращается введением антитела против NGF. В некоторых вариантах реализации боль в покое подавляется, облегчается и/или предотвращается введением антитела против NGF. В некоторых вариантах реализации термически вызванная боль подавляется, облегчается и/или предотвращается введением антитела против NGF. В некоторых вариантах реализации аллодиния подавляется, облегчается и/или предотвращается, а в некоторых вариантах реализации гиперальгезия подавляется, облегчается и/или предотвращается. В еще одних вариантах реализации аллодиния и/или гиперальгезия является термической или механической (тактильной) по природе, или болью в покое. В некоторых вариантах реализации боль представляет собой хроническую боль. В других вариантах реализации боль связана с участком разреза, раны или травмы и/или участком, расположенным близко к участку разреза, раны и/или травмы, в нем или около него.
Изобретение также включает композиции и наборы для лечения послеоперационной боли, содержащие антагонист NGF, такой как антитело против NGF, например, моноклональное антитело против NGF, для применения в любом из способов, представленных в настоящем описании. В некоторых вариантах реализации антитело против NGF способно эффективно ингибировать связывание NGF с его рецепторами TrkA и/или р75 и/или эффективно ингибировать активацию NGF его рецепторов TrkA и/или р75.
Общие методики
При отсутствии других указаний, в практике настоящего изобретения будут использоваться обычные методики молекулярной биологии (включая рекомбинантные методики), микробиологии, клеточной биологии, биохимии и иммунологии, которые находятся в пределах данной области. Такие методики полностью объясняются в литературе, например Molecular Cloning: A Laboratory Manual, second edition (Sambrook, et al., 1989) Cold Spring Harbor Press; Oligonucleotide Synthesis (M.J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J.E. Cellis, ed., 1998) Academic Press; Animal Cell Culture (R.I. Freshney, ed., 1987); Introduction to Cell and Tissue Culture (J.P. Mather and P.E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J.B. Griffiths, and D.G. Newell, eds., 1993-8) J. Wiley and Sons; Methods in Enzymology (Academic Press, Inc.); Handbook of Experimental Immunology (D.M. Weir and C.C. Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J.M. Miller and M.P. Calos, eds., 1987); Current Protocols in Molecular B