Способ получения алкоксидов алкилолова
Иллюстрации
Показать всеОписан способ получения алкоксидов алкилолова, включающий реакцию дегидратации, по меньшей мере, одного соединения алкилолова, используемого в качестве исходного соединения и выбранного из оловоорганических соединений, имеющих связи олово-кислород-олово, и гидроксисоединения, используемого в качестве реагента, с получением алкоксида алкилолова, соответствующего указанному исходному материалу и реагенту, где указанное исходное соединение и указанный реагент непрерывно подаются в реактор; и низкокипящие компоненты, содержащие воду, выводятся из указанного реактора при непрерывном удалении реакционной жидкости, содержащей алкоксид алкилолова, из нижней части реактора. 16 з.п. ф-лы, 1 табл., 14 ил.
Реферат
Настоящее изобретение относится к способу получения алкоксидов алкилолова, к способу получения эфира угольной кислоты (карбоната) или изоцианата с использованием в качестве катализатора алкоксида диалкилолова, полученного вышеуказанным способом, и к эфиру угольной кислоты или изоцианату, полученному указанным способом.
Алкоксиды алкилолова весьма полезны в качестве катализаторов синтеза или переэтерификации сложных эфиров или реакции вулканизации силиконового полимера или уретана.
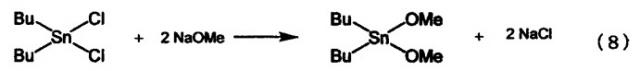
Современными способами получения алкоксидов алкилолова являются, например, способ, в котором в качестве исходного материала используют диалкилдихлоролово (см., например, ссылку на патент [1]); и способ, в котором в качестве исходного материала используют оксид диалкилолова (см., например, ссылку на патент 2). В первом способе, в котором в качестве исходного материала используется диалкилдихлоролово, в качестве вторичного материала используется дорогостоящий алкоголят металла. Кроме того, в этом способе в качестве конечного продукта образуются два моля соли металла на один моль алкоксида диалкилолова, как показано в приведенном ниже уравнении реакции (8), в связи с чем возникает проблема утилизации отходов или т.п. Таким образом, применение первого способа для промышленного производства связано с такими проблемами, как высокая себестоимость и образование большого количества отходов.
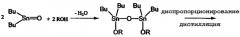
Второй способ, в котором в качестве исходного материала используется оксид диалкилолова, является предпочтительным, поскольку он не дает большого количества отходов. Поэтому были проведены исследования, направленные на получение алкоксидов диалкилолова с применением указанного второго способа. Одним из примеров такого способа производства является способ, в котором алкоксид диалкилолова получают из оксида дибутилолова и спирта путем проведения двухстадийной реакции, как показано в приведенном ниже уравнении реакции (9) (см. ссылку на патент [3]). На первой стадии оксид дибутилолова и спирт подвергают взаимодействию в бензоле или в толуоле при температуре от 80°С до 100°С с последующим удалением образовавшейся воды путем азеотропной перегонки и получением 1,1,3,3-тетрабутил-1,3-диалкоксидистанноксана. На второй стадии указанный дистанноксан подвергают реакции диспропорционирования при температуре от 180°С до 220°С с последующей перегонкой и получением диалкоксида дибутилолова. Указанный способ имеет то преимущество, что он является безотходным, однако реакция диспропорционирования на второй стадии данного способа требует перегонки высококипящего алкоксида диалкилалова при высокой температуре и поэтому потребляет большое количество энергии. Таким образом, применение второго способа для промышленного производства также связано с некоторыми проблемами, такими как, например, потребление большого количества энергии. Кроме того, этот способ имеет низкую производительность.
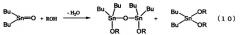
Был описан способ получения диалкоксида диалкилалова непосредственно из оксида диалкилолова и спирта, в котором используется высококипящий спирт, как показано в нижеследующем уравнении реакции (10) (см. ссылку на патент [3]). Поскольку в данном способе реакция протекает при температуре кипения спирта, используемого в качестве реагента, то указанную реакцию осуществляют при температуре, превышающей температуру реакции, проводимой в бензоле или толуоле, с последующим удалением образовавшейся воды в виде азеотропной смеси воды и спирта, используемого в качестве реагента. По сравнению с вышеописанным способом этот способ имеет то преимущество, что он не требует высокотемпературной перегонки высококипящего диалкоксида диалкилолова. Однако поскольку реакцию проводят при температуре кипения спирта, используемого в качестве реагента, то скорость реакции является низкой для спиртов с небольшим числом атомов углерода и даже для спиртов с большим числом атомов углерода. Поэтому указанный способ имеет низкую производительность.
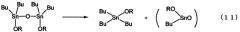
Кроме того, поскольку в вышеописанном способе реакцию проводят в высококипящем спирте при высокой температуре, то фактически образуется большое количество соединения триалкилолова, которое, вероятно, образуется в соответствии с приведенным ниже уравнением реакции (11). Действительно, хорошо известно, что соединения триалкилолова получают путем пиролиза алкоксидов диалкилолова (см. ссылку 1 на не патентную работу), и полученное соединение триалкилолова может образовывать комплексную смесь побочных продуктов реакции, не являющихся диалкоксидом диалкилолова согласно изобретению. Поэтому указанный способ не является предпочтительным, особенно для промышленного производства.
Для увеличения производительности, которая является одной из главных проблем, связанных с применением вышеописанных способов, был разработан способ, где в качестве реагентов используется спирт и эфир угольной кислоты, как показано в уравнении реакции (12) (см. ссылку на патент 2). В этом способе в качестве реагента используется дорогостоящий эфир угольной кислоты, и хотя этот способ является более производительным, чем вышеописанные способы, однако проблема, связанная с применением указанного способа, а именно высокая себестоимость производства, пока остается нерешенной.
[Ссылка на патент 1] US-2700675
[Ссылка на патент 2] US-5545600
[Ссылка на патент 3] NL-6612421
[Ссылка на непатентную работу 1] Journal of Society of Chemical Industry, 72,7 (1969), 1543.
Как описано выше, в общепринятых способах получения алкоксидов алкилолова для повышения производительности всегда применяются дорогостоящие исходные материалы. Поэтому необходимо разработать удобный и высокоэффективный способ получения алкоксидов алкилолова.
В соответствии с этим настоящее изобретение относится к способу промышленного производства алкоксидов алкилолова и, в частности, к способу промышленного и непрерывного производства алкоксидов алкилолова.
После проведения многочисленных исследований, направленных на решение вышеописанных проблем, авторами настоящего изобретения было обнаружено, что если исходный материал, выбранный из группы, состоящей из оловоорганических соединений, каждое из которых имеет связь олово-кислород-олово, и гидроксисоединения, используемого в качестве реагента, непрерывно подается в реактор и низкокипящие компоненты, образующиеся в такой реакции, непрерывно удаляются из реактора, то реакционный раствор, содержащий алкоксид алкилолова, соответствующий исходному материалу и реагенту, может непрерывно выводиться из реактора как компонент, осаждающийся на дне реактора. Таким образом, авторами настоящей заявки было разработано настоящее изобретение.
Более конкретно, объектами настоящего изобретения являются следующие.
[1] Способ получения алкоксидов алкилолова, включающий реакцию дегидратации, по меньшей мере, одного соединения алкилолова, используемого в качестве исходного материала и выбранного из группы, состоящей из оловоорганических соединений, каждое из которых имеет связь олово-кислород-олово, и гидроксисоединения, используемого в качестве реагента, с получением алкоксида алкилолова, соответствующего исходному материалу и реагенту, в котором указанный исходный материал и реагент непрерывно подаются в реактор; низкокипящие компоненты, содержащие воду, удаляются из реактора, и реакционный раствор, который в виде компонента образуется на дне реактора и содержит алкоксид алкилолова, непрерывно выводится из реактора.
[2] Способ по вышеуказанному пункту [1], где вышеописанное, по меньшей мере, одно соединение алкилолова, используемое в качестве исходного материала, представляет собой тетраалкилдиалкокси-1,3-дистанноксан и/или оксид диалкилолова, обычно присутствующий в форме полимера, образующегося в результате полимеризации по связи олово-кислород-олово.
[3] Способ по вышеуказанному пункту [2], где указанный тетраалкилдиалкокси-1,3-дистанноксан представляет собой тетраалкилдиалкокси-1,3-дистанноксан, представленный химической формулой (1):
где R1, R2, R4 и R5, каждый независимо, представляет собой алкильную группу, аралкильную группу или арильную группу; R3 и R6, каждый представляет собой алкильную группу или аралкильную группу; а и b равны целому числу от 0 до 2; а+b равно 2; с и d равны целому числу от 0 до 2; и с+d равно 2.
[4] Способ по вышеуказанному пункту [2], где указанный оксид диалкилолова представляет собой полимер оксида диалкилолова, представленный химической формулой (2):
где R7 и R8, каждый независимо, представляет собой алкильную группу, аралкильную группу или арильную группу; е и f равны целому числу от 0 до 2; и е+f равно 2.
[5] Способ по вышеуказанному пункту [2], где указанный исходный материал представляет собой любой материал, выбранный из мономера, димера (агрегата, состоящего из одного и того же мономера, или агрегата, состоящего из различных мономеров), олигомера или полимера.
[6] Способ по вышеуказанному пункту [1], где описанное выше гидроксисоединение представляет собой спирт, представленный химической формулой (3):
где R9 представляет собой н-бутильную группу; 2-метилпропильную группу; алкильную группу с прямой или разветвленной цепью, имеющей 5-12 атомов углерода; циклоалкильную группу, имеющую 5-12 атомов углерода; алкенильную группу с прямой или разветвленной цепью, имеющей 2-12 атомов углерода; замещенный или незамещенный арил, имеющий 6-19 атомов углерода; или аралкильную группу, имеющую 7-20 атомов углерода и содержащую алкил, выбранный из группы, состоящей из алкила с прямой или разветвленной цепью, имеющей 1-14 атомов углерода, и циклоалкила, имеющего 5-14 атомов углерода.
[7] Способ по вышеуказанному пункту [6], где указанный спирт выбирают из группы, состоящей из 1-бутанола, 2-метил-1-пропанола и алкилового спирта, имеющего 5-8 атомов углерода.
[8] Способ по вышеуказанному пункту [1], включающий стадию непрерывной подачи исходного материала и реагента в реактор для осуществления реакции дегидратации в жидкой фазе или в газожидкой фазе в реакторе; и одновременного выведения высококипящей реакционной смеси в виде жидкости, содержащей полученный алкоксид алкилолова или смесь алкоксидов алкилолова, из нижней части реактора, при непрерывном удалении из реактора низкокипящей реакционной смеси, содержащей образуемую воду в виде газа, путем перегонки.
[9] Способ по вышеуказанному пункту [1] или [8], где указанный реактор включает линии подачи вышеописанного исходного материала и вышеописанного реагента соответственно или линию подачи смешанного раствора, состоящего из вышеописанного исходного материала и вышеописанного реагента; линию удаления низкокипящей реакционной смеси, содержащей воду; и линию выведения высококипящей реакционной смеси.
[10] Способ по вышеуказанному пункту [9], где указанная линия удаления низкокипящей реакционной смеси, содержащей воду, находится в месте удаления газофазных компонентов, и линия выведения высококипящей смеси находится в месте, расположенном ниже места выведения жидкофазного компонента.
[11] Способ по любому из вышеуказанных пунктов [1]-[10], где указанный реактор представляет собой резервуарный реактор или колонный реактор.
[12] Способ по любому из вышеуказанных пунктов [1]-[10], где указанный реактор представляет собой реактор, который включает смесительный резервуар, резервуар для многостадийного смешения, дистилляционную колонну, многоходовую дистилляционную колонну, многоходовую дистилляционную колонну для непрерывной перегонки, насадочную колонну, тонкопленочный испаритель, реактор с носителем, реактор с принудительной циркуляцией, испаритель с падающей пленкой, испаритель с падающей каплей, реактор, имеющий слой со струйным течением жидкости, или колонну-барботер.
[13] Способ по любому из вышеуказанных пунктов [1]-[12], где в указанный реактор подается инертный газ и/или газообразный реагент, и/или газообразное инертное органическое соединение, и/или органический растворитель, образующий азеотропную смесь с водой.
[14] Способ по вышеуказанному пункту [13], где указанный инертный газ выбирают из азота, диоксида углерода и аргона.
[15] Способ по вышеуказанному пункту [1], где вышеописанную реакцию дегидратации проводят при температуре в пределах от 60°С до 160°С.
[16] Способ по вышеуказанному пункту [1], где отношение общего числа молей атомов олова, имеющихся в исходном соединении, к числу молей реагента, то есть отношение исходного соединения к реагенту, находится в пределах от 3 до 100.
[17] Способ по любому из вышеуказанных пунктов [4]-[16], где реакцию дегидратации осуществляют со скоростью дегидратации, определяемой по уравнению (4):
где термин "скорость дегидратации" означает количество воды, которое образуется в процессе реакции дегидратации и выводится из системы за единицу времени [моль·час-1]; Х означает общее число молей [моль] атомов олова, имеющихся в соединении алкилолова, представленном общей формулой (2) и содержащемся в исходном материале; Y означает общее число молей [моль] атомов олова, имеющихся в соединении алкилолова, представленном общей формулой (1) и содержащемся в исходном материале; Т означает температуру [К], при которой осуществляется реакция дегидратации; R представляет собой газовую постоянную, равную 8,314 Дж·моль-1·К-1; и А и В представляют собой коэффициенты, зависящие от типа соединения алкилолова, где коэффициенты А и В в вышеуказанном уравнении (4) зависят от типа соединения алкилолова, используемого в качестве исходного материала, и вычислены исходя из выбранного первичного стандартного вещества. Если исходный материал содержит соединение алкилолова, представленное химической формулой (1), то указанные коэффициенты А и В представляют собой фактор частоты и энергию активации пиролитической реакции первичного стандартного вещества, которым является соединение алкилолова, произвольно выбранное из соединений алкилолова, представленных химической формулой (1) и содержащихся в исходном материале, и эти коэффициенты вычисляют по уравнению (5). Если исходный материал не содержит соединения алкилолова, представленного химической формулой (1), но содержит соединение алкилолова, представленное химической формулой (2), то указанные коэффициенты А и В представляют собой фактор частоты и энергию активации пиролитической реакции первичного стандартного соединения, которым является алкоксид алкилолова, произвольно выбранный из алкоксидов алкилолова, представленных химической формулой (7) и образованных из соединений алкилолова, представленных химической формулой (2) и содержащихся в исходном материале и реагенте, где указанные коэффициенты вычисляют по уравнению (5)
где k означает константу скорости первого порядка [час-1]; А означает фактор частоты [час-1]; В означает энергию активации [Дж·моль-1]; R означает газовую постоянную=8,314 Дж·моль-1·К-1; и Т означает температуру [К], при которой осуществляется пиролитическая реакция. Вышеуказанная константа k представляет собой константу скорости первого порядка для пиролитической реакции, которую вычисляют по уравнению (6)
где k означает константу скорости первого порядка [час-1]; t означает время нагревания; и Х [час] означает коэффициент редукции [моль/моль] по отношению к начальной концентрации первичного стандартного вещества,
где R10, R11, R13 и R14 соответствуют R7 или R8 исходного соединения; g, h, i и j соответствуют е или f исходного соединения; по меньшей мере, один из R12 и R15 соответствует значению R9 указанного реагента; g и h равно целому числу от 0 до 2, g+h=2; i и j равны целому числу от 0 до 2, i+j=2.
[18] Способ получения эфиров угольной кислоты, где используют алкоксиды диалкилолова в качестве катализатора, полученные способом по любому из вышеуказанных п.п. [1] - [17].
[19] Эфир угольной кислоты, полученный с использованием алкоксида диалкилолова, полученного способом по любому одному из вышеуказанных пунктов [1] - [17], в качестве катализатора.
[20] Изоцианат, полученный с использованием эфира угольной кислоты по вышеуказанному пункту [19].
[21] Поликарбонат, полученный с использованием эфира угольной кислоты по вышеуказанному пункту [19].
В способе получения алкоксидов алкилолова согласно изобретению исходный материал и реагент подвергают непрерывной реакции дегидратации с одновременным удалением из системы образующейся воды и продуктов, в результате чего могут быть получены алкоксиды алкилолова с высоким выходом. Таким образом, указанный способ является в высокой степени полезен для его промышленного применения.
Настоящее изобретение отличается тем, что осуществляют непрерывную подачу в реактор исходного материала, содержащего оксид диалкилолова и/или тетраалкилдиалкоксидистанноксан и гидроксисоединение, используемое в качестве реагента, и удаление из реактора низкокипящих компонентов, содержащих воду, с непрерывным образованием реакционного раствора в виде компонента, образующегося в нижней части реактора и содержащего алкоксид алкилолова, соответствующий исходному материалу и реагенту.
Авторами настоящего изобретения было высказано предположение, что реакция взаимодействия оксида диалкилолова со спиртом, в результате которой образуется алкоксид диалкилолова, является равновесной реакцией, представленной уравнениями реакций (13) и (14).
Обычно описанную выше реакцию осуществляют периодическим способом, где образующуюся воду отгоняют при атмосферном давлении или при пониженном давлении. Это вызвано тем, что поскольку равновесие в реакциях, представленных формулами (13) и (14), смещается влево (в сторону реагентов), то для установления равновесия необходимо смещение вправо (в сторону продуктов), и для дальнейшего прохождения реакции требуется выведение образующейся воды из системы. При этом для увеличения скорости реакции эту реакцию осуществляют при высоких температурах.
В результате, если в вышеописанной реакции в качестве реагента используется спирт с большим числом атомов углерода и высокой температурой кипения, то реакция протекает за несколько часов, и если в качестве реагента используется спирт с небольшим числом атомов углерода и низкой температурой кипения, то образуется алкоксид диалкилолова, соответствующий указанному спирту и производительность данной реакции является очень низкой. Известно, что такая реакция, проиллюстрированная реакционной формулой (13), то есть реакция дегидратации оксида диалкилолова спиртом с образованием тетраалкилдиалкоксидистанноксана с количественным выходом протекает относительно легко даже при ее проведении общепринятыми способами. Однако поскольку в реакции, проиллюстрированной реакционной формулой (14), равновесие значительно смещается влево (в сторону реагентов), то вода, образующаяся в этой реакции, быстро реагирует с образовавшимся диалкоксидом диалкилолова и поэтому диалкоксид диалкилолова не может быть получен с высоким выходом. Для получения большего количества нужного продукта в реакции, проиллюстрированной реакционной формулой (14), необходимо использовать большое количество гидроксисоединения. Очевидно, что использование большого количества гидроксисоединения позволяет повышать уровень превращения тетраалкилдиалкокси-1,3-дистанноксана в диалкоксид диалкилолова, однако для этого необходим огромный реактор, и, кроме того, необходимо удалять большое количество непрореагировавшего гидроксисоединения путем перегонки и, следовательно, производительность такой реакции не может быть увеличена.
После интенсивного исследования общепринятых способов авторами настоящего изобретения было обнаружено, что в вышеописанных общепринятых способах образуется большое количество соединения трибутилолова, не являющегося целевым соединением, поскольку реакция, осуществляемая этими способами, протекает при высоких температурах и в течение длительного периода времени, хотя это явно не описано в документах. В частности, при осуществлении реакции общепринятым периодическим способом возникают серьезная проблема, связанная с образованием побочного продукта триалкилолова, описанного выше (на фиг.1 показана реакция пиролиза, в процессе которой происходит превращение 1,1,3,3-тетрабутил-1,3-бис(2-этилгексилокси)дистанноксана в соединение трибутилолова), поскольку из-за низкой скорости реакции и периодического способа ее осуществления, алкоксид алкилолова, как исходный материал или как продукт, остается в реакторе.
После многочисленных исследований, направленных на решение вышеописанной проблемы, авторами настоящего изобретения было неожиданно обнаружено, что в случае применения способа, который включает непрерывную подачу в реактор исходного материала, выбранного из группы, состоящей из оксидов диалкилолова, тетраалкилдиалкоксидистанноксанов и их смесей, а также реагента, то есть гидроксисоединения; удаление низкокипящих компонентов из реактора; и непрерывное выведение реакционного раствора, как компонента, накапливающегося на дне реактора, который содержит алкоксид алкилолова, соответствующий исходному материалу и реагенту; указанная реакция осуществляется за короткий промежуток времени и имеет высокую производительность по сравнению с реакциями, проводимыми общепринятыми периодическими способами, и более того в этой реакции ингибируется образование побочного продукта трибутилолова.
В частности, авторы настоящего изобретения пришли к выводу, что скорость образования алкоксидов алкилолова общепринятыми периодическими способами значительно ограничена скоростью удаления образующейся воды, и затем они обнаружили, что эта проблема может быть решена путем применения способа, который включает быстрое и непрерывное удаление образующейся воды из системы и одновременно с этим быстрое и непрерывное выведение из этой системы полученного продукта, а именно алкоксида алкилолова; и который позволяет получать алкоксид диалкилолова с высоким выходом. Авторами настоящего изобретения было также обнаружено, что способ согласно изобретению позволяет снижать уровень образования побочного соединения, а именно соединения трибутилолова.
Ниже, в первую очередь, будут описаны исходные материалы, используемые в настоящем изобретении.
Исходный материал представляет собой композицию, содержащую оксид диалкилолова и/или тетраалкилдиалкоксидистанноксан. Такая композиция может содержать только один тетраалкилдиалкоксидистанноксан или произвольное количество оксида диалкилолова, который является предшественником тетраалкилдиалкоксидистанноксана. В частности, как реакция, проиллюстрированная реакционной формулой (13), в которой тетраалкилдиалкоксидистанноксан получают из оксида диалкилолова, так и реакция, проиллюстрированная реакционной формулой (14), в которой диалкоксид диалкилолова получают из тетраалкилдиалкоксидистанноксана, представляют собой реакции дегидратации, и поэтому алкоксид диалкилолова может быть получен даже из исходного соединения, содержащего произвольное количество оксида диалкилолова.
Тетраалкилдиалкоксидистанноксанами, используемыми в настоящем изобретении, могут быть тетраалкилдиалкоксидистанноксаны, представленные нижеследующей химической формулой (1), а также их мономеры, агрегаты, олигомеры или полимеры, имеющие структуру, представленную химической формулой (1).
где R1, R2, R4 и R5, каждый независимо, представляет собой алкильную группу, аралкильную группу или арильную группу; R3 и R6, каждый представляет собой алкильную группу или аралкильную группу; а и b равны целому числу от 0 до 2; а+b равно 2; с и d равны целому числу от 0 до 2; с+d равно 2.
Примерами R1, R2, R4 и R5 в тетраалкилдиалкоксидистанноксанах, представленных химической формулой (1), являются алкильные группы, а именно алифатические углеводородные группы, имеющие 1-12 атомов углерода, и циклоалкильные группы, а именно алифатические углеводородные группы, имеющие 5-12 атомов углерода, такие как метил, этил, пропил, бутил (его изомеры), пентил (его изомеры), гексил (его изомеры), гептил (его изомеры), октил (его изомеры), нонил (его изомеры), децил (его изомеры), ундецил (его изомеры), додецил (его изомеры), 2-бутенил, циклобутенил, циклобутил, циклопентил, циклогексил, циклопентил, циклопентадиенил и циклогексенил; аралкильные группы, имеющие 7-20 атомов углерода, такие как бензильная и фенилэтильная группы; и арильные группы, имеющие 6-20 атомов углерода, такие как фенильная, толильная и нафтильная группы. Эти группы могут содержать простую эфирную связь, либо они могут быть галогенированными углеводородными группами, в которых все атомы водорода или часть атомов водорода каждой углеводородной группы заменены атомами галогена и которыми являются нонафторбутил и гептафторбутил (их изомеры), однако эти группы не ограничиваются указанными выше примерами. Предпочтительно, R1, R2, R4 и R5 представляют собой низшие алкильные группы. Более предпочтительно, они представляют собой алкильные группы с прямой или разветвленной цепью, имеющей 1-8 атомов углерода. Могут быть также использованы группы вышеописанных типов с еще большим числом атомов углерода, однако такие группы иногда негативно влияют на текучесть или выход алкоксидов диалкилолова. R1, R2, R4 и R5 в тетраалкилдиалкоксидистанноксанах, представленных химической формулой (1) могут быть одинаковыми или различными.
R3 и R6 представляют собой алкильную группу с прямой или разветвленной цепью, имеющей 1-12 атомов углерода; циклоалкильную группу, имеющую 5-12 атомов углерода; или алкенильную группу с прямой или разветвленной цепью, имеющей 2-12 атомов углерода; и аралкильные группы, имеющие 7-20 атомов углерода, которые включают замещенный или незамещенный арил, имеющий 6-19 атомов углерода; и алкильную группу, выбранную из группы, состоящей из алкилов с прямой или разветвленной цепью, имеющей 1-14 атомов углерода, и циклоалкилов, имеющих 5-14 атомов углерода. Эти группы могут содержать простую эфирную связь, либо они могут быть галогенированными углеводородными группами, в которых все атомы водорода или часть атомов водорода каждой углеводородной группы заменены атомами галогена, и которыми являются нонафторбутил и гептафторбутил (их изомеры), однако эти группы не ограничиваются указанными выше примерами. Предпочтительно, R3 и R6 представляют собой низшие алкильные группы. Более предпочтительно, они представляют собой н-бутильную группу, 2-метилпропильную группу или алкильные группы с прямой или разветвленной цепью, имеющей 5-9 атомов углерода. Могут быть также использованы группы вышеописанных типов с еще большим числом атомов углерода, однако такие группы иногда негативно влияют на текучесть или выход алкоксидов диалкилолова. R3 и R6 в тетраалкилдиалкоксидистанноксанах, представленных химической формулой (1), могут быть одинаковыми или различными.
Примерами тетраалкилдиалкоксидистанноксанов, представленных химической формулой (1), являются:
тетраалкилдиалкоксидистанноксаны и
тетраалкилдиаралкилоксидистанноксаны, такие как
1,1,3,3-тетраметил-1,3-ди(н-бутокси)дистанноксан,
1,1,3,3-тетраметил-1,3-бис(2-метилпропилокси)дистанноксан, 1,1,3,3-тетраметил-1,3-дипентилоксидистанноксан (его изомеры),
1,1,3,3-тетраметил-1,3-дигексилоксидистанноксан (его изомеры),
1,1,3,3-тетраметил-1,3-дигептилоксидистанноксан (его изомеры),
1,1,3,3-тетраметил-1,3-диоктилоксидистанноксан (его изомеры),
1,1,3,3-тетраметил-1,3-динонилоксидистанноксан (его изомеры),
1,1,3,3-тетраметил-1,3-дидецилоксидистанноксан (его изомеры),
1,1,3,3-тетраметил-1,3-дибензилоксидистанноксан,
1,1,3,3-тетраметил-1,3-дифенилэтоксидистанноксан,
1,3-дибутил-1,3-диметил-1,3-ди(н-бутокси)дистанноксан,
1,3-дибутил-1,3-диметил-1,3-бис(2-метилпропил)дистанноксан,
1,3-дибутил-1,3-диметил-1,3-дипентилоксидистанноксан (его изомеры),
1,3-дибутил-1,3-диметил-1,3-дигексилоксидистанноксан (его изомеры),
1,3-дибутил-1,3-диметил-1,3-дигептилоксидистанноксан (его изомеры),
1,3-дибутил-1,3-диметил-1,3-диоктилоксидистанноксан (его изомеры),
1,3-дибутил-1,3-диметил-1,3-динонилоксидистанноксан (его изомеры),
1,3-дибутил-1,3-диметил-1,3-дидецилоксидистанноксан (его изомеры),
1,3-дибутил-1,3-диметил-1,3-дибензилоксидистанноксан,
1,3-дибутил-1,3-диметил-1,3-дифенилэтоксидистанноксан,
1,3-дибутил-1,3-диэтил-1,3-ди(н-бутокси)дистанноксан,
1,3-дибутил-1,3-диэтил-1,3-бис(2-метилпропил)дистанноксан,
1,3-дибутил-1,3-диэтил-1,3-дипентилоксидистанноксан (его изомеры),
1,3-дибутил-1,3-диэтил-1,3-дигексилоксидистанноксан (его изомеры),
1,3-дибутил-1,3-диэтил-1,3-дигептилоксидистанноксан (его изомеры),
1,3-дибутил-1,3-диэтил-1,3-диоктилоксидистанноксан (его изомеры),
1,3-дибутил-1,3-диэтил-1,3-динонилоксидистанноксан (его изомеры),
1,3-дибутил-1,3-диэтил-1,3-дидецилоксидистанноксан (его изомеры),
1,3-дибутил-1,3-диэтил-1,3-дибензилоксидистанноксан,
1,3-дибутил-1,3-диэтил-1,3-дифенилэтоксидистанноксан,
1,3-дибутил-1,3-дипропил-1,3-ди(н-бутокси)дистанноксан,
1,3-дибутил-1,3-дипропил-1,3-бис(2-метилпропил)дистанноксан (его изомеры),
1,3-дибутил-1,3-дипропил-1,3-дипентилоксидистанноксан (его изомеры),
1,3-дибутил-1,3-дипропил-1,3-дигексилоксидистанноксан (его изомеры),
1,3-дибутил-1,3-дипропил-1,3-дигептилоксидистанноксан (его изомеры),
1,3-дибутил-1,3-дипропил-1,3-диоктилоксидистанноксан (его изомеры),
1,3-дибутил-1,3-дипропил-1,3-динонилоксидистанноксан (его изомеры),
1,3-дибутил-1,3-дипропил-1,3-дидецилоксидистанноксан (его изомеры),
1,3-дибутил-1,3-дипропил-1,3-дибензилоксидистанноксан,
1,3-дибутил-1,3-дипропил-1,3-дифенилэтоксидистанноксан,
1,1,3,3-тетрабутил-1,3-ди(н-бутокси)дистанноксан,
1,1,3,3-тетрабутил-1,3-бис(2-метилпропил)дистанноксан,
1,1,3,3-тетрабутил-1,3-дипентилоксидистанноксан (его изомеры),
1,1,3,3-тетрабутил-1,3-дигексилоксидистанноксан (его изомеры),
1,1,3,3-тетрабутил-1,3-дигептилоксидистанноксан (его изомеры),
1,1,3,3-тетрабутил-1,3-диоктилоксидистанноксан (его изомеры),
1,1,3,3-тетрабутил-1,3-динонилоксидистанноксан (его изомеры),
1,1,3,3-тетрабутил-1,3-дидецилоксидистанноксан (его изомеры),
1,1,3,3-тетрабутил-1,3-дибензилоксидистанноксан,
1,1,3,3-тетрабутил-1,3-дифенилэтоксидистанноксан,
1,1,3,3-тетрафенил-1,3-ди(н-бутокси)дистанноксан,
1,1,3,3-тетрафенил-1,3-бис(2-метилпропил)дистанноксан,
1,1,3,3-тетрафенил-1,3-дипентилоксидистанноксан (его изомеры),
1,1,3,3-тетрафенил-1,3-дигексилоксидистанноксан (его изомеры),
1,1,3,3-тетрафенил-1,3-дигептилоксидистанноксан (его изомеры),
1,1,3,3-тетрафенил-1,3-диоктилоксидистанноксан (его изомеры),
1,1,3,3-тетрафенил-1,3-динонилоксидистанноксан (его изомеры),
1,1,3,3-тетрафенил-1,3-дидецилоксидистанноксан (его изомеры),
1,1,3,3-тетрафенил-1,3-дибензилоксидистанноксан,
1,1,3,3-тетрафенил-1,3-дифенилэтоксидистанноксан,
1,1,3,3-тетра(трифторбутил)-1,3-ди(н-бутокси)дистанноксан,
1,1,3,3-тетра(трифторбутил)-1,3-бис(2-метилпропил)дистанноксан (его изомеры),
1,1,3,3-тетра(трифторбутил)-1,3-дипентилоксидистанноксан (его изомеры),
1,1,3,3-тетра(трифторбутил)-1,3-дигексилоксидистанноксан (его изомеры),
1,1,3,3-тетра(трифторбутил)-1,3-дигептилоксидистанноксан (его изомеры),
1,1,3,3-тетра(трифторбутил)-1,3-диоктилоксидистанноксан (его изомеры),
1,1,3,3-тетра(трифторбутил)-1,3-динонилоксидистанноксан (его изомеры),
1,1,3,3-тетра(трифторбутил)-1,3-дидецилоксидистанноксан (его изомеры),
1,1,3,3-тетра(трифторбутил)-1,3-дибензилоксидистанноксан,
1,1,3,3-тетра(трифторбутил)-1,3-дифенилэтоксидистанноксан,
1,1,3,3-тетра(пентафторбутил)-1,3-ди(н-бутокси)дистанноксан,
1,1,3,3-тетра(пентафторбутил)-1,3-бис(2-метилпропил)дистанноксан,
1,1,3,3-тетра(пентафторбутил)-1,3-дипентилоксидистанноксан (его изомеры),
1,1,3,3-тетра(пентафторбутил)-1,3-дигексилоксидистанноксан (его изомеры),
1,1,3,3-тетра(пентафторбутил)-1,3-дигептилоксидистанноксан (его изомеры),
1,1,3,3-тетра(пентафторбутил)-1,3-диоктилоксидистанноксан (его изомеры),
1,1,3,3-тетра(пентафторбутил)-1,3-динонилоксидистанноксан (его изомеры),
1,1,3,3-тетра(пентафторбутил)-1,3-дидецилоксидистанноксан (его изомеры),
1,1,3,3-тетра(пентафторбутил)-1,3-дибензилоксидистанноксан,
1,1,3,3-тетра(пентафторбутил)-1,3-дифенилэтоксидистанноксан,
1,1,3,3-тетра(гептафторбутил)-1,3-ди(н-бутокси)дистанноксан,
1,1,3,3-тетра(гептафторбутил)-1,3-бис(2-метилпропил)дистанноксан (его изомеры),
1,1,3,3-тетра(гептафторбутил)-1,3-дипентилоксидистанноксан (его изомеры),
1,1,3,3-тетра(гептафторбутил)-1,3-дигексилоксидистанноксан (его изомеры),
1,1,3,3-тетра(гептафторбутил)-1,3-дигептилоксидистанноксан (его изомеры),
1,1,3,3-тетра(гептафторбутил)-1,3-диоктилоксидистанноксан (его изомеры),
1,1,3,3-тетра(гептафторбутил)-1,3-динонилоксидистанноксан (его изомеры),
1,1,3,3-тетра(гептафторбутил)-1,3-дидецилоксидистанноксан (его изомеры),
1,1,3,3-тетра(гептафторбутил)-1,3-дибензилоксидистанноксан,
1,1,3,3-тетра(гептафторбутил)-1,3-дифенилэтоксидистанноксан,
1,1,3,3-тетра(нонафторбутил)-1,3-ди(н-бутокси)дистанноксан,
1,1,3,3-тетра(нонафторбутил)-1,3-бис(2-метилпропил)дистанноксан,
1,1,3,3-тетра(нонафторбутил)-1,3-дипентилоксидистанноксан (его изомеры),
1,1,3,3-тетра(нонафторбутил)-1,3-дигексилоксидистанноксан (его изомеры),
1,1,3,3-тетра(нонафторбутил)-1,3-дигептилоксидистанноксан (его изомеры),
1,1,3,3-тетра(нонафторбутил)-1,3-диоктилоксидистанноксан (его изомеры),
1,1,3,3-тетра(нонафторбутил)-1,3-динонилоксидистанноксан (его изомеры),
1,1,3,3-тетра(нонафторбутил)-1,3-дидецилоксидистанноксан (его изомеры),
1,1,3,3-тетра(нонафторбутил)-1,3-дибензилоксидистанноксан и
1,1,3,3-тетра(нонафторбутил)-1,3-дифенилэтоксидистанноксан.
При этом может быть использовано одно соединение, выбранное из описанной выше группы тетраалкилдиалкоксидистанноксанов, либо могут быть использованы два или несколько соединений, выбранных из этой группы, в виде смеси.
Оксиды диалкилолова, используемые в настоящем изобретении, представлены нижеследующей формулой (2). Хотя эти соединения представлены структурной формулой (2), однако такими соединениями могут быть мономеры, агрегаты, олигомеры или полимеры. Известно, что оксиды диалкилолова не существуют в форме мономера, поскольку двойная связь, такая как Sn=O, обычно не может образовываться, и поэтому они существуют в форме полимера, образующегося в результате полимеризации по связи олово-кислород-олово, как показано в нижеследующей формуле (15).
где R7 и R8, каждый независимо, представляет собой алкильную группу, аралкильную группу или арильную группу; е и f равны целому числу от 0 до 2, и е+f равно 2.
где R16 и R17, каждый представляет собой группы, как определено выше для R7 и R8, k и l имеют значения, как определено выше для е и f, и n равно целому числу 2 или более. Структура концевой группы не известна, и поэтому она не указана.
Примерами R7 и R8 в оксидах диалкилолова, представленных формулой (2), являются алкильные группы, а именно алифатические углеводородные группы, имеющие 1-12 атомов углерода, и циклоалкильные группы, а именно алифатические углеводородные группы, имеющие 5-12 атомов углерода, такие как метил, этил, пропил (его изомеры), бутил (его из