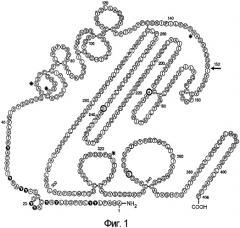
Производные фактора vii свертывания крови
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и может быть использовано для получения фактора VII свертывания крови человека. Получают производные полипептида фактора VII с аминокислотными заменами Q250C, R396C и Р406С или с цистеином присоединенным к С-концу нативной последовательности фактора VII. Производные получают с использованием трансгенных технологий в эукариотических клетках-хозяевах млекопитающих. Изобретение позволяет получать производные фактора VII с сохраненной активностью коагуляционного фактора VII человека и с повышенной способностью конъюгировать с ПЭГ, по сравнению с природной формой полипептида. 7 н. и 13 з.п. ф-лы, 2 ил.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение связано с новыми производными человеческого фактора VII свертывания крови, полипептидами фактора VII, а также полинуклеотидными конструкциями, кодирующими такие полипептиды, векторами и хозяйскими клетками, содержащими и экспрессирующими эти полинуклеотиды, фармацевтическими композициями, содержащими производные фактора VII, применениями и способами лечения.
ОСНОВА СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Свертывание крови представляет собой процесс, состоящий из комплексного взаимодействия различных компонентов (или факторов) крови, которые в конечном счете способствуют образованию фибринового сгустка. Обычно компоненты крови, которые участвуют в том, что принято называть "каскадом" свертывания, представляют собой ферментативно неактивные протеины (проферменты или зимогены), которые превращаются в протеолитические ферменты под действием активатора (который, в свою очередь, является фактором свертывания). Факторы свертывания, которые подверглись такому превращению, обычно называют "активными факторами", и для их обозначения обычно добавляют букву "a" к названию фактора свертывания (например, фактор VIIa).
Инициация гемостатического процесса опосредована образованием комплекса между тканевым фактором, экспонированным в результате повреждения сосудистой стенки, и фактором VIIa. Затем под действием этого комплекса происходит превращение факторов IX и X в их активные формы. Фактор Xa способствует превращению ограниченных количеств протромбина в тромбин на клетках, несущих тканевый фактор. Тромбин активирует тромбоциты и факторы V и VIII, превращая их в факторы Va и VIIIa, оба из которых являются кофакторами в дальнейшем процессе, ведущем к полному тромбиновому взрыву. Такой процесс включает в себя выработку фактора Xa под действием фактора IXa (в комплексе с фактором VIIIa) и возникает он на поверхности активированных тромбоцитов. В заключение тромбин способствует превращению фибириногена в фибрин, что приводит к образованию фибринового сгустка.
Фактор VII представляет собой следовой гликопротеин плазмы, который циркулирует в крови в виде одноцепочечного зимогена. Этот зимоген является каталитически неактивным. Одноцепочечный фактор VII может быть превращен в двухцепочечный фактор VIIa под действием фактора Xa, фактора XIIa, фактора IXa, фактора VIIa или тромбина in vitro. Фактор Xa, по-видимому, является основным физиологическим активатором фактора VII. Превращение зимогенного фактора VII в активированную двухцепочечную молекулу происходит при расщеплении внутренней пептидной связи Arg152-Ile153.
Зачастую бывает необходимо стимулировать или селективно блокировать у субъекта каскад свертывания крови. Фактор VIIa используется для осуществления контроля нарушений, связанных с кровотечением, которые вызваны рядом причин, таких как дефициты факторов свертывания (например, при гемофилии A и B или дефиците факторов свертывания XI или VII) или ингибиторы факторов свертывания. Фактор VIIa используется также для контролирования избыточного кровотечения, возникающего у субъекта с нормально функционирующим каскадом свертывания (отсутствие дефицитов факторов свертывания или ингибиторов какого бы то ни было из факторов свертывания крови). Такое кровотечение может, например, быть вызвано дефектом функционирования тромбоцитов, тромбоцитопенией или болезнью фон Виллебранда. Кровотечение представляет собой серьезную проблему в связи с хирургическими вмешательствами и иными формами повреждения тканей.
Европейский патент No. 200,421 (ZymoGenetics) связан с нуклеотидной последовательностью, кодирующей человеческий фактор VII, и рекомбинантной экспрессией фактора VII в клетках млекопитающих.
Публикация Dickinson et al. (Proc. Natl. Acad. Sci. USA 93,14379-14384,1996) связана с полипептидами фактора VII, в которых Lys157, Val158, Glu296, Met298, Asp334, Ser336 или Lys337 индивидуально заменена на Ala. Публикация Iwanaga et al. (Thromb. Haemost (supplement august 1999), 466, abstract 1474) связана с вариантами фактора VIIa, в котором имеет место делеция остатков 316-320 или в котором остатки 311-322 заменены соответствующими остатками из трипсина.
Антикоагулянты, такие как гепарин, кумарин, производные кумарина, производные индандиона или другие агенты, могут быть использованы для селективного блокирования каскада свертывания у пациента, например, в процессе почечного диализа или при лечении тромбоза глубоких вен, диссеминированного внутрисосудистого свертывания (DIC), а также при других медицинских нарушениях. Например, лечение гепарином или экстракорпоральная обработка цитратным ионом (Патент США No. 4,500,309) могут быть использованы при диализе для предотвращения свертывания в процессе проведения лечения. Гепарин также используется для предупреждения тромбоза глубоких вен у больных, подвергающихся оперативному вмешательству.
Однако лечение гепарином и другими антикоагулянтами может вызвать нежелательные побочные эффекты. Доступные антикоагулянты обычно проявляют свое действие во всем организме, а не специфически в сайте образования сгустка. Гепарин, например, может вызвать тяжелое кровотечение. Кроме того, имея время полужизни приблизительно 80 минут, гепарин быстро выводится из крови, что вызывает необходимость частых введений. Поскольку гепарин действует как кофактор для антитромбина III (AT III), а AT III быстро истощается при лечении DIC, зачастую трудно установить правильную дозу гепарина, необходимую для непрерывного мониторинга AT III и уровней гепарина. Гепарин также является неэффективным при экстремальном истощении AT III. Кроме того, длительное применение гепарина может также усилить агрегацию тромбоцитов и уменьшить число тромбоцитов, он также участвует в развитии остеопороза. Производные индандиона могут также вызывать токсические побочные эффекты.
Вдобавок к антикоагулянтам, кратко описанным выше, было обнаружено, что целый ряд природно образующихся белков обладает противосвертывающей активностью. Например, Reutelingsperger (U. S. Pat. No. 4,736,018) выделил антикоагулянтные белки из аорты быка и пуповинных артерий человека. В публикации Maki et al. (U. S. Pat. No. 4,732,891) описаны антикоагулянтные белки, полученные из плаценты человека. Кроме того, AT III был предложен в качестве лечебного антикоагулянта (Schipper et al., Lancet 1 (8069): 854-856 (1978); Jordan, U. S. Pat. No. 4,386,025; Bock et al., U. S. Pat. No. 4,517,294).
Приблизительно у 30% или более пациентов, подвергнутых ангиопластике, эндартерэктомии или обходному сосудистому шунту, тромбоз и/или пролиферация клеток гладких мышц в интиме вызывают ре-окклюзию сосуда и, как следствие этого, невозможность реконструктивной хирургии. Такое закрытие сосуда вследствие операции известно под названием рестеноза. Происхождение явления рестеноза связывают с комплексным взаимодействием биологических процессов, включая отложение тромбоцитов и тромбообразование, высвобождение хемотаксических и митогенных факторов, а также миграцию и пролиферацию клеток гладкой мускулатуры сосудов в интиме расширенного артериального сегмента.
Ингибирование аккумуляции тромбоцитов в сайтах механического повреждения может ограничивать скорость рестеноза у человека. В то время как в сайтах острого сосудистого повреждения происходит накопление тромбоцитов, выработка тромбина в этих сайтах может быть ответственна за активацию тромбоцитов и их последующее накопление.
Международная заявка No. WO 92/15686 связана с инактивированным фактором VIIa, полинуклеиновой кислотой и с линиями клеток млекопитающих, продуцирующих инактивированный фактор VIIa, а также с композициями, содержащими инактивированный фактор VIIa, для ингибирования свертывания крови.
Международная заявка No. WO 94/27631 связана со способами ингибирования рестеноза сосудов, активности тканевого фактора и отложения тромбоцитов.
Международная заявка No. WO 96/12800 связана со способом лечения острого закрытия коронарной артерии, включающим в себя введение пациенту композиции, которая содержит инактивированный фактор VIIa в сочетании с тканевым активатором плазминогена или стрептокиназой.
Большинство белков, поступающих в круг кровообращения, из организма млекопитающих быстро выводится почками. Эту проблему можно частично обойти путем введения большого количества белка или же путем повторных введений. Однако более высокие дозы белка могут вызвать образование антител, которые могут связывать и инактивировать белок и/или облегчать клиренс белка из организма пациента. Повторное введение белка в терапевтических целях в основном неэффективно и может оказаться опасным, так как это может вызвать аллергическую реакцию.
Различные попытки разрешить проблемы, связанные с белковой терапией, включают в себя микроинкапсулирование, липосомные системы доставки, введение слитых белков и химическую модификацию. Наиболее многообещающим из них на сегодняшний день является модификация терапевтического белка путем ковалентного прикрепления полимеров полиалкиленоксида, в частности, полиэтиленгликолей (ПЭГ). Например, в патенте США No. 4,179,337 описано применение ПЭГ или пропиленгликоля, связанного с белками, для обеспечения физиологически активной неиммуногенной водорастворимой полипептидной композиции. У Nucci et al. описано несколько белков, которые были модифицированы путем добавления ПЭГ, включая аденозиндезаминазу, L-аспарагиназу, интерферон-альфа-2b (IFN-α2b), супероксиддисмутазу, стрептокиназу, тканевый активатор плазминогена (tPA), урокиназу, уриказу, гемоглобин, интерлейкины, интерфероны, TGF-бета, EGF и другие факторы роста (Nucci et al., 1991, Adv. Drug Delivery Rev. 4: 133-151). Результатом таких попыток стало некоторое удлинение времени полужизни этих белков и уменьшение иммуногенности этих белков.
Обычно ПЭГилирование белков включает в себя активацию ПЭГ функциональными группами, которые будут реагировать с лизиновыми остатками на поверхности белка. Если белок полностью модифицирован, активность белка обычно утрачивается. Модификационные процедуры, которые дают возможность частичного ПЭГилирования белка, обычно приводят к потере активности приблизительно только на 50% и существенному увеличению времени его полужизни в сыворотке, так что суммарная эффективная доза белка уменьшается.
Современное развитие методов ПЭГилирования белков связано с использованием активированных ПЭГ-реагентов, которые взаимодействуют с тиоловыми группами белков, что приводит в результате к ковалентному связыванию ПЭГ с цистеином, который встроен вместо природно образующегося лизина в белке. У Shaw et al. (Патент США No. 5,166,322) описаны специфические варианты IL-3, которые содержат цистеин, встроенный в специфические сайты внутри природно образующейся аминокислотной последовательности. Затем сульфгидрильные реактивные соединения (например, активированный полиэтиленгликоль) прикрепляются к указанным цистеинам в результате реакции с конкретным вариантом IL-3. У Katre et al. (Патент США No. 5,206,344) описаны специфические варианты IL-2, которые содержат цистеин, встроенный в специфические сайты внутри природно образующейся аминокислотной последовательности. В дальнейшем конкретный вариант IL-2 реагирует с активированным полиэтиленгликолевым реагентом, прикрепляя этот фрагмент к цистеину.
В данной области техники все еще существует потребность в улучшенных полипептидах фактора VII, имеющих пролонгированную прокоагулянтную или антикоагулянтную активность. В частности, существует потребность в полипептидах фактора VII, которые имели бы увеличенное время полужизни в сыворотке без нежелательных побочных эффектов, таких как системная активация системы свертывания и кровотечения, соответственно, ассоциированные с традиционной терапией, и которые можно было бы вводить в относительно низких дозах, с тем, чтобы избежать введения более массивных доз белка.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение связано с новыми полипептидами фактора VII свертывания крови, имеющими такую же самую или повышенную активность по сравнению с фактором VIIa дикого типа и с производными фактора VII, имеющими повышенные времена полужизни в сыворотке.
Были идентифицированы области в молекуле фактора VIIa, в которых могут быть произведены изменения в первичной структуре, а также другие модификации, которые не вызывают изменения или снижения биологической активности фактора VIIa. Области внутри структуры фактора VIIa, которые были идентифицированы как неучаствующие в связывании с тканевым фактором или с фактором X, включая аминокислоты в положениях 247-260, а также от 393 до 406 положений в последовательности SEQ ID NO: 1. В частности, аминокислоты в положениях Q250, R396 и P406 последовательности SEQ ID NO: 1 были изучены с точки зрения включения цистеина (Cys). Включение цистеиновых остатков сопровождалось конъюгацией с химической группой, например, полиэтиленгликолем (ПЭГ), с тем, чтобы увеличить время полужизни производного фактора VII в циркуляции. Цистеин вводили в C-концевую последовательность SEQ ID NO: 1 (обозначается как 407C), что сопровождалось конъюгацией с полиэтиленгликолем. Кроме того, такое добавление цистеина в C-концевую последовательность SEQ ID NO: 1 не сопровождается снижением протеолитической активности полипептидов фактора VIIa. Указанные производные фактора VII, например полипептид фактора VII, конъюгированный с молекулой ПЭГ, являются терапевтически применимыми в ситуациях, когда желательно пролонгированное действие полипептидов фактора VII, например, в ситуациях, когда повторное введение или же введение большего количества полипептида фактора VII является нежелательным или проблематичным. Кроме того, полипептиды фактора VIIa согласно изобретению со встроенными аминокислотами (например, остатком цистеина), способными конъюгировать с химической группой в положениях молекулы фактора VIIa, которые не влияют на протеолитическую активность, могут быть использованы для встраивания любой функциональной группы конъюгата фактора VII.
В первом аспекте, настоящее изобретение связано с полипептидом фактора VII, содержащим аминокислотную последовательность SEQ ID NO: 1 или ее варианты, где аминокислота заменена другой аминокислотой, где другая аминокислота способна конъюгировать с химической группой и где полипептид фактора VII по существу имеет такую же или более высокую активность по сравнению с активностью рекомбинантного человеческого фактора VIIa дикого типа.
Во втором аспекте, настоящее изобретение связано с полипептидом фактора VII, содержащим аминокислотную последовательность SEQ ID NO: 1 или ее варианты, где аминокислота, соответствующая аминокислоте в положении, выбранном из 247-260, 393-405 или 406 последовательности SEQ ID NO: 1, заменена другой аминокислотой. Следует понимать, что любая аминокислота в положении, выбранном из положений 247-260, 393-405 или 406 последовательности SEQ ID NO: 1, может быть заменена другой аминокислотой без существенного снижения активности полипептида фактора VII.
В третьем аспекте, настоящее изобретение связано с полипептидом фактора VII, содержащим аминокислотную последовательность SEQ ID NO: 1 или ее варианты, где аминокислота, соответствующая аминокислоте, выбранной из R396, Q250 или P406 последовательности SEQ ID NO: 1, заменена другой аминокислотой. Следует понимать, что первая буква в обозначениях R396, Q250 и P406 представляет собой аминокислоту, встречающуюся в указанном положении в природном варианте последовательности SEQ ID NO: 1.
В другом аспекте, изобретение связано с полипептидом фактора VII, содержащим аминокислотную последовательность SEQ ID NO: 1 или ее вариант, где аминокислота способна к конъюгации с химической группой, встроенной внутри последовательности SEQ ID NO: 1 или ее варианта в положении, где полипептид фактора VII обладает по существу такой же или более высокой активностью по сравнению с активностью рекомбинантного человеческого фактора VIIa дикого типа. Подразумевается, что аминокислота может быть встроена внутрь последовательности SEQ ID NO: 1 и без замены какой-либо аминокислоты. Вставка аминокислоты может быть осуществлена в том же положении внутри последовательности SEQ ID NO: 1, где в дальнейшем будет произведена аминокислотная замена. Таким образом, в одном из воплощений, за вставкой будет следовать аминокислотная замена, или наоборот.
В другом аспекте, изобретение связано с полипептидом фактора VII, содержащим аминокислотную последовательность SEQ ID NO: 1 или ее вариант, где аминокислота способна к конъюгации с химической группой, добавленной к N- или C-концу последовательности SEQ ID NO: 1 или ее варианта.
Термин "аминокислота", используемый в настоящем описании, означает одну или более аминокислот. Подразумевается, что аминокислота, заменяющая аминокислоту в полипептиде фактора VII или встроенная в этот полипептид, или же добавленная к полипептиду фактора VII, способна к конъюгации с любой химической группой, которая будет способствовать повышению истинной молекулярной массы полипептида фактора VII. Такая конъюгация с химической группой включает в себя, но не ограничивается ковалентным прикреплением полиэтиленгликоля (ПЭГ), монометокси-полиэтиленгликоля, декстрана, поли-(N-винилпирролидон)полиэтиленгликоля, гомополимеров пропиленгликоля, сополимера полипропиленоксида/этиленоксида, полипропиленгликоля, полиоксиэтилированных полиолов (например, глицерина) и поливинилового спирта, коломиновых кислот или других полимеров на основе углеводов, аминокислотных полимеров и биотиновых производных.
Предпочтительной химической группой является биосовместимый, нетоксичный, неиммуногенный и водорастворимый полимер. Предпочтительно химической группой является любой водорастворимый полимер в любых пропорциях.
Такая аминокислотная замена, вставка или добавка и конъюгирование с химической группой происходит без существенного снижения прокоагулянтной активности активированной формы производного фактора VII по сравнению с активностью рекомбинантного человеческого фактора VIIa дикого типа.
Используемый здесь термин "полипептид фактора VII" означает любой протеин, содержащий аминокислотную последовательность 1-406 нативного человеческого фактора VII (SEQ ID NO: 1) или его вариантов. Сюда включены, не ограничиваясь ими, человеческий фактор VII, человеческий фактор VIIa и их варианты.
Используемый здесь термин "фактор VII", или "FVII", означает продукт, состоящий из неактивированной формы (фактор VII). Используемый здесь термин "фактор VIIa", или "FVIIa", означает продукт, состоящий из активированной формы (фактор VIIa). Сюда включены белки, которые имеют аминокислотную последовательность 1-406 нативного человеческого фактора VII или фактора Factor VIIa. Сюда включаются также и белки со слегка модифицированной аминокислотной последовательностью, например, модифицированным N-концом, включая N-концевые аминокислотные делеции или добавки, такие, что образующиеся белки в существенной степени сохраняют активность фактора VIIa. В рамках приведенного выше определения, термин "фактор VII" или "фактор VIIa" также включает в себя природные аллельные варианты, которые могут существовать и возникать у того или иного индивидуума. Могут варьировать также степень и локализация гликозилирования или других посттрансляционных модификаций, в зависимости от того, какие выбраны хозяйские клетки, а также от природы клеточного окружения клеток-хозяев.
Под используемыми здесь терминами "вариант" или " варианты" подразумевается человеческий фактор VII, имеющий последовательность SEQ ID NO: 1, где одна или более аминокислот родительского белка заменены другой аминокислотой и/или где одна или более аминокислот родительского белка подвергнуты делеции и/или где одна или более аминокислот вставлены в родительский белок и/или одна или более аминокислот добавлены к родительскому белку. Такая добавка может иметь место либо на N-конце, либо на C-конце родительского белка, либо на них обоих.
Под термином "по существу такая же или более высокая активность по сравнению с активностью рекомбинантного человеческого фактора VIIa дикого типа" здесь подразумевается активность, составляющая более чем 70% активности рекомбинантного человеческого фактора VIIa дикого типа. В одном воплощении, указанная активность составляет более чем 80% активности рекомбинантного человеческого фактора VIIa дикого типа. В другом воплощении, указанная активность составляет более чем 90% активности рекомбинантного человеческого фактора VIIa дикого типа. Еще в одном воплощении, указанная активность составляет более чем 100% активности рекомбинантного человеческого фактора VIIa дикого типа. Еще в одном воплощении, эта активность составляет более чем 120% активности рекомбинантного человеческого фактора VIIa дикого типа. В другом воплощении, эта активность составляет более чем 200% активности рекомбинантного человеческого фактора VIIa дикого типа. В другом воплощении, эта активность составляет более чем 400% активности рекомбинантного человеческого фактора VIIa дикого типа.
Под термином "производное фактора VII" здесь подразумевается полипептид фактора VII, имеющий последовательность SEQ ID NO: 1 или ее вариант, где одна или более аминокислот родительского белка химически модифицированы, например, путем алкилирования, ПЭГилирования, ацилирования, образования сложного эфира или образования амида и пр. Это включает в себя, не ограничиваясь этим, ПЭГилированный человеческий фактор VIIa, цистеин-ПЭГилированный человеческий фактор VIIa и его варианты.
Под термином "ПЭГилированный человеческий фактор VIIa" подразумевается фактор VIIa, имеющий молекулу полиэтиленгликоля, конъюгированную с аминокислотой полипептида человеческого фактора VIIa.
Под термином "цистеин-ПЭГилированный человеческий фактор VIIa" подразумевается фактор VIIa, имеющий молекулу полиэтиленгликоля, конъюгированную с сульфгидрильной группой цистеина, встроенного в человеческий фактор VIIa.
Под термином "другая аминокислота" подразумевается одна или более аминокислот, которые отличны от той аминокислоты, которая в природе встречается в данном положении. Это подразумевает, не ограничиваясь ими, аминокислоты, которые могут быть кодированы полинуклеотидом. Предпочтительно другая аминокислота представляет собой природную L-форму и может кодироваться полинуклеотидом. Специфическим примером может служить L-цистеин (Cys).
Под термином "активность" здесь подразумевается способность полипептида фактора VII превращать его субстрат, фактор X, в активный фактор Xa. Активность полипептида фактора VII может быть измерена путем "анализа протеолиза in Vitro" (см. Пример 6).
Под термином "полиэтиленгликоль", или "PEG", подразумевается соединение полиэтиленгликоля или его производное, в присутствии или в отсутствие связывающих агентов, связывающих или активирующих фрагментов (например, в присутствии тиола, трифлата, трезилата, азирдина, оксирана или предпочтительно в присутствии малеимидного фрагмента). Соединения, такие как малеимидо-монометокси-ПЭГ, являются примерами активированных соединений полиэтиленгликоля согласно изобретению.
В другом аспекте, настоящее изобретение связано с производным фактора VII, содержащим полипептид фактора VII, имеющий аминокислотную последовательность SEQ ID NO: 1 или ее варианты, где аминокислота заменена другой аминокислотой, где указанная другая аминокислота конъюгирована с химической группой, которая увеличивает истинную молекулярную массу полипептида фактора VII с 300 Дальтон приблизительно до 100000 Дальтон, и где производное фактора VII обладает по существу такой же активностью или повышенной активностью по сравнению с рекомбинантным человеческим фактором VIIa дикого типа.
Под термином "химическая группа" здесь подразумевается одна или более химических групп.
В другом аспекте, данное изобретение связано с производным фактора VII, содержащим полипептид фактора VII, включающий в себя аминокислотную последовательность SEQ ID NO: 1 или ее варианты, где аминокислота, соответствующая аминокислоте в положении, выбранном из положений 247-260, 393-405 или 406 последовательности SEQ ID NO: 1, заменена другой аминокислотой, где другая аминокислота конъюгирована с химической группой, которая увеличивает истинную молекулярную массу полипептида фактора VII с 300 Дальтон приблизительно до 100000 Дальтон, и где производное фактора VII обладает по существу такой же активностью или повышенной активностью по сравнению с рекомбинантным человеческим фактором VIIa дикого типа.
В другом аспекте, данное изобретение связано с производным фактора VII, содержащим полипептид фактора VII, включающий в себя аминокислотную последовательность SEQ ID NO: 1 или ее вариант, где аминокислота, соответствующая аминокислоте, выбранной из R396, Q250 или P406 последовательности SEQ ID NO: 1, заменена другой аминокислотой, где другая аминокислота конъюгирована с химической группой, которая увеличивает истинную молекулярную массу полипептида фактора VII в 300 Дальтон приблизительно до 100000 Дальтон, и где производное фактора VII обладает по существу такой же активностью или повышенной активностью по сравнению с рекомбинантным человеческим фактором VIIa дикого типа.
В другом аспекте, данное изобретение связано с производным фактора VII, содержащим полипептид фактора VII, включающий в себя аминокислотную последовательность SEQ ID NO: 1 или ее вариант, где аминокислота встроена в последовательность SEQ ID NO: 1 или ее вариант и где аминокислота конъюгирована с химической группой, которая увеличивает истинную молекулярную массу полипептида фактора VII в 300 Дальтон приблизительно до 100000 Дальтон, и где производное фактора VII обладает по существу такой же активностью или повышенной активностью по сравнению с рекомбинантным человеческим фактором VIIa дикого типа.
Еще в одном аспекте, изобретение связано с производным фактора VII, содержащим полипептид фактора VII, включающий в себя аминокислотную последовательность SEQ ID NO: 1 или ее вариант, где аминокислота добавлена к N- или C-концу последовательности SEQ ID NO: 1 или ее варианту и где аминокислота конъюгирована с химической группой, которая увеличивает истинную молекулярную массу полипептида фактора VII в 300 Дальтон приблизительно до 100000 Дальтон, и где производное фактора VII обладает по существу такой же активностью или повышенной активностью по сравнению с рекомбинантным человеческим фактором VIIa дикого типа.
В другом аспекте, изобретение связано с композицией, содержащей производное фактора VII, содержащее полипептид фактора VII, имеющий аминокислотную последовательность SEQ ID NO: 1 или ее вариант, где аминокислота заменена другой аминокислотой, где другая аминокислота конъюгирована с химической группой, которая увеличивает истинную молекулярную массу полипептида фактора VII в 300 Дальтон приблизительно до 100000 Дальтон, и где производное фактора VII обладает по существу такой же активностью или повышенной активностью по сравнению с рекомбинантным человеческим фактором VIIa дикого типа.
В другом аспекте, изобретение связано с композицией, содержащей производное фактора VII, содержащее полипептид фактора VII, имеющий аминокислотную последовательность SEQ ID NO: 1 или ее вариант, где аминокислота, соответствующая аминокислоте в положении, выбранном из положений 247-260, 393-405 или 406 последовательности SEQ ID NO: 1, заменена другой аминокислотой, где другая аминокислота конъюгирована с химической группой, которая увеличивает истинную молекулярную массу полипептида фактора VII в 300 Дальтон приблизительно до 100,000 Дальтон, и где производное фактора VII обладает по существу такой же активностью или повышенной активностью по сравнению с рекомбинантным человеческим фактором VIIa дикого типа.
В другом аспекте, изобретение связано с композицией, содержащей производное фактора VII, содержащее полипептид фактора VII, имеющий аминокислотную последовательность SEQ ID NO: 1 или ее вариант, где аминокислота, соответствующая аминокислоте, выбранной из R396, Q250 или P406 последовательности SEQ ID NO: 1, заменена другой аминокислотой, где другая аминокислота конъюгирована с химической группой, которая увеличивает истинную молекулярную массу полипептида фактора VII в 300 Дальтон приблизительно до 100,000 Дальтон, и где производное фактора VII обладает по существу такой же активностью или повышенной активностью по сравнению с рекомбинантным человеческим фактором VIIa дикого типа.
В другом аспекте, изобретение связано с композицией, содержащей производное фактора VII, содержащее полипептид фактора VII, имеющий аминокислотную последовательность SEQ ID NO: 1 или ее вариант, где аминокислота вставлена в последовательность SEQ ID NO: 1 или ее вариант, и где аминокислота конъюгирована с химической группой, которая увеличивает истинную молекулярную массу полипептида фактора VII в 300 Дальтон приблизительно до 100000 Дальтон, и где производное фактора VII обладает по существу такой же активностью или повышенной активностью по сравнению с рекомбинантным человеческим фактором VIIa дикого типа.
В другом аспекте, изобретение связано с композицией, содержащей производное фактора VII, содержащее полипептид фактора VII, имеющий аминокислотную последовательность SEQ ID NO: 1 или ее вариант, где аминокислота добавлена к N- или C-концу последовательности SEQ ID NO: 1 или ее варианта и где аминокислота конъюгирована с химической группой, которая увеличивает истинную молекулярную массу полипептида фактора VII в 300 Дальтон приблизительно до 100000 Дальтон, и где производное фактора VII обладает по существу такой же активностью или повышенной активностью по сравнению с рекомбинантным человеческим фактором VIIa дикого типа.
В другом аспекте, изобретение связано с фармацевтической композицией, содержащей производное фактора VII, содержащее полипептид фактора VII, имеющий аминокислотную последовательность SEQ ID NO: 1 или ее вариант, где аминокислота заменена другой аминокислотой, где другая аминокислота конъюгирована с химической группой, которая увеличивает истинную молекулярную массу полипептида фактора VII в 300 Дальтон приблизительно до 100000 Дальтон, и где производное фактора VII обладает по существу такой же активностью или повышенной активностью по сравнению с рекомбинантным человеческим фактором VIIa дикого типа; и, необязательно, фармацевтически приемлемый носитель.
В другом аспекте, изобретение связано с фармацевтической композицией, содержащей производное фактора VII, содержащее полипептид фактора VII, имеющий аминокислотную последовательность SEQ ID NO: 1 или ее вариант, где аминокислота, соответствующая аминокислоте в положении, выбранном из положений 247-260, 393-405 или 406 последовательности SEQ ID NO: 1, заменена другой аминокислотой, где другая аминокислота конъюгирована с химической группой, которая увеличивает истинную молекулярную массу полипептида фактора VII в 300 Дальтон приблизительно до 100000 Дальтон, и где производное фактора VII обладает по существу такой же активностью или повышенной активностью по сравнению с рекомбинантным человеческим фактором VIIa дикого типа; и, необязательно, фармацевтически приемлемый носитель.
В другом аспекте, изобретение связано с фармацевтической композицией, содержащей производное фактора VII, содержащее полипептид фактора VII, имеющий аминокислотную последовательность SEQ ID NO: 1 или ее вариант, где аминокислота, соответствующая аминокислоте, выбранной из R396, Q250 или P406 последовательности SEQ ID NO: 1, заменена другой аминокислотой, где другая аминокислота конъюгирована с химической группой, которая увеличивает истинную молекулярную массу полипептида фактора VII в 300 Дальтон приблизительно до 100000 Дальтон, и где производное фактора VII обладает по существу такой же активностью или повышенной активностью по сравнению с рекомбинантным человеческим фактором VIIa дикого типа; и, необязательно, фармацевтически приемлемый носитель.
В другом аспекте, изобретение связано с фармацевтической композицией, содержащей производное фактора VII, содержащее полипептид фактора VII, имеющий аминокислотную последовательность SEQ ID NO: 1 или ее вариант, где аминокислота вставлена в последовательность SEQ ID NO: 1 или ее вариант, и где аминокислота конъюгирована с химической группой, которая увеличивает истинную молекулярную массу полипептида фактора VII в 300 Дальтон приблизительно до 100000 Дальтон, и где производное фактора VII обладает по существу такой же активностью или повышенной активностью по сравнению с рекомбинантным человеческим фактором VIIa дикого типа; и, необязательно, фармацевтически приемлемый носитель.
В другом аспекте, изобретение связано с фармацевтической композицией, содержащей производное фактора VII, содержащее полипептид фактора VII, имеющий аминокислотную последовательность SEQ ID NO: 1 или ее вариант, где аминокислота добавлена к N- или C-концу последовательности SEQ ID NO: 1 или ее варианта, и где аминокислота конъюгирована с химической группой, которая увеличивает истинную молекулярную массу полипептида фактора VII в 300 Дальтон приблизительно до 100000 Дальтон, и где производное фактора VII обладает по существу такой же активностью или повышенной активностью по сравнению с рекомбинантным человеческим фактором VIIa дикого типа; и, необязательно, фармацевтически приемлемый носитель.
В другом аспекте, изобретение связано с полипептидом инактивированного фактора VII, где полипептид фактора VII дополнительно модифицирован в своем каталитическом центре, причем модификация ингибирует способность полипептида фактора VII активировать плазменный фактор X или IX. В одном воплощении, полипептид инактивированного фактора VII модифицирован в своем каталитическом центре ингибитором сериновой протеиназы. В другом воплощении, полипептид инактивированного фактора VII модифицирован в своем каталитическом центре галометилкетоновым пептидом, выбранным из группы, состоящей из Phe-Phe-Arg-хлорметилкетона, Phe-Phe-Arg-хлорметилкетона, D-Phe-Phe-Arg-хлорметилкетона, D-Phe-Phe-Arg-хлорметилкетона, Phe-Pro-Arg-хлорметилкетона, D-Phe-Pro-Arg-хлорметилкетона, Phe-Pro-Arg-хлорметилкетона, D-Phe-Pro-Arg- хлорметилкетона, L-Glu-Gly-Arg-хлорметилкетона и D-Glu-Gly-Arg- хлорметилкетона, Dansyl-Phe-Phe-Arg-хлорметилкетона, Dansyl-Phe-Phe-Arg-хлорметилкетона, Dansyl-D-Phe-Phe-Arg-хлорметилкетона, Dansyl-D-Phe-Phe-Arg-хлорметилкетона, Dansyl-Phe-Pro-Arg-хлорметилкетона, Dansyl-D-Phe-Pro-Arg-хлорметилкетона, Dansyl-Phe-Pro-Arg-хлорметилкетона, Dansyl-D-Phe-Pro-Arg-хлорметилкетона, Dansyl-L-Glu-Gly-Arg-хлорметилкетона и Dansyl-D-Glu-Gly-Arg-хлорметилкетона.
Термин "полипептид инактивированного фактора VII", используемый в данном описании, означает полипептид фактора VII, не способный активировать плазменный фактор X или IX.
В другом аспекте, изобретение связано с производным инактивированного фактора VII, где полипептид инактивированного фактора VII, содержащий аминокислотную последовательность SEQ ID NO: 1 или ее вариант и имеющий модификацию в своем каталитическом центре, причем модификация ингибирует способность полипептида фактора VII активировать плазменный фактор X или IX, дополнительно конъюгирован с химической группой, которая увеличивает истинную молекулярную массу инактивированного полипептида фактора VII в 300 Дальтон приблизительно до 100000 Дальтон.
В другом аспекте, изобретение связано с производным инактивированного фактора VII, где полипептид инактивированного фактора VII, содержащий аминокислотную последовательность SEQ ID NO: 1 или ее вариант, где аминокислота заменена другой аминокислотой, где эта другая аминокислота может быть конъюгирована с химической группой и где полипептид фактора VII обладает по существу такой же активностью или повышенной активностью по сравнению с рекомбинантным человеческим фактором VIIa дикого типа и имеет модификацию в своем каталитическом центре, причем модификация ингибирует способность полипептида фактора VII активировать плазменный фактор X или IX, дополнительно конъюгирован с химической группой, которая увеличивает истинную молекулярную массу инактивированного полипептида фактора VII в 300 Дальтон приблизительно до 100000 Дальтон.
В другом аспекте, изобретение связано с производным инактивированного фактора VII, где полипептид инактивированного фактора VII, содержащий аминокислотную последовательность SEQ ID NO: 1 или ее вариант, где аминокислота, соответствующая аминокислоте в положении, выбранном из положений 247-260, 393-405 или 406 последовательности SEQ ID NO: 1, заменена другой аминокислотой, и имеющий модификацию в своем каталитическом центре, причем модификация ингибирует способность полипептида фактора VII активировать плазменный фактор X или IX, дополнительно конъюгирован с химической группой, которая увеличивает истинную молекулярную массу ин