Способ получения хиральных сорбентов
Иллюстрации
Показать всеИзобретение относится к технологии получения сорбентов, в частности к получению оптически активных хиральных сорбентов, и может быть использовано в химической, фармацевтической и биохимической промышленности, медицине. Способ получения заключается в том, что проводят модификацию ацетата целлюлозы различной степени ацетилирования выдерживанием в парах мезофазогенных растворителей в закрытой системе при комнатной температуре до степени поглощения паров не более 11 мас.%. Затем фиксируют модифицированную структуру ацетата целлюлозы путем десорбирования поглощенных паров в открытой системе в стандартных условиях. Изобретение обеспечивает упрощение процесса получения сорбента. 3 з.п. ф-лы, 2 табл.
Реферат
Изобретение относится к химической, фармацевтической и биохимической промышленности, медицине, а также к научно-исследовательским и прикладным работам в этих областях и может быть использовано преимущественно для получения оптически активных (хиральных) сорбентов, хиральных селекторов и т.п. на основе уксуснокислых эфиров целлюлозы (ацетатов целлюлозы) для селективного разделения методом «хиральной фильтрации» рацемических смесей энантиомеров (рацематов) оптически активных веществ, в частности рацематов аминокислот, а также для контроля энантиомерной чистоты оптически активных веществ (аминокислот, биологически активных соединений, пестицидов и др.).
Известно, что основная часть выпускаемых современной промышленностью биопродуктов и лекарственных препаратов представляет собой рацемическую смесь L- и D-изомеров. Многие органические соединения (в том числе, лекарства) проявляют максимальную биологическую активность только в форме одного изомера: либо L, реже D [Соросовский образоват. журн. 1998. №1]. Создание высокоэффективных материалов и технологий для разделения таких смесей, контроля их оптической чистоты и т.п. - одна из актуальнейших задач современности.
Селективность взаимодействий при разделении смесей энантиомеров во многом определяется стереоспецифичностью структуры материала сорбента, получаемого чаще всего прививкой к синтетической полимерной матрице различных хиральных групп - фрагментов оптически активных аминов, аминокислот и других хиральных соединений.
Известны сорбенты для препаративной очистки и разделения оптически активных веществ, в частности смесей аминокислот, методом жидкостной хроматографии. Сорбенты получают на основе селикагеля путем прививки к нему различных хиральных селекторов из класса гликопептидных антибиотиков. Способ получения сорбентов заключается в предварительной модификации селикагеля 3-глицидоксипропилтриалкоксисиланом в водно-органическом или водно-щелочном растворе, с дальнейшей иммобилизацией хирального селектора путем химической реакции модифицированного селикагеля с гликопептидными антибиотиками [RU 2255802. 2005; Вестн. Московск. ун-та. Сер. Химия. 2001. Т.42. №4; Приклад, биохим. и микробиол. 2006. Т.42. №6].
Недостатком является проведение сложного целенаправленного синтеза, многостадийность и трудоемкость процесса, необходимость предварительной модификации селикагеля и тщательного подбора антибиотика определенной химической структуры. Кроме того, такие сорбенты разделяют только смеси различных аминокислот и не могут разделять рацемические смеси энантиомеров (L+D) аминокислот.
Известен способ получения сорбентов на основе микрокристаллической триацетилцеллюлозы для разделения энантиомеров 3-(3-Хфенил)-4-трет-бутилтиазолин-2-тиона (где Х-Cl, диметиламин, метокси- и СН3-группы) методом жидкостной хроматографии [Nouu. J. Chim. 1986. V.10. №7]. Микрокристаллическую триацетилцеллюлозу получают частичным гидролизом макроцепей в некристаллических областях полимера в кислой среде при повышенных температурах в течение ˜24 часов.
Недостатком является проведение избирательного гидролиза в аморфных областях триацетатцеллюлозы, использование кислой среды, высокие температуры, большая продолжительность процесса получения сорбента. Данных о способности микрокристаллической триацетилцеллюлозы к разделению энантиомеров других органических соединений не приведено.
Известен способ разделения смеси ароматических кислот и энантиоразделения L- и D-изомеров некоторых ароматических кислот, в частности D,L-α-метоксифенилуксусной и D,L-2-фенилпропановой, методом капиллярного электрофореза с использованием в качестве хирального селектора низкомолекулярного водорастворимого полисахарида хитозана. Способ предусматривает использование кварцевого капилляра, его предварительную обработку 1 М NaOH (1 час), последующее вымачивание в воде (1 час) и дальнейшее модифицирование 0.1%-ным раствором хитозана в ацетатном буфере при рН=5.4 (2 часа). Разделение энантиомеров проводят в ацетатном буфере, содержащем 30 мМ 2-гидроксипропил-β-циклодекстрина при определенном рН и при приложении напряжения 12 кВ. Способ позволяет осуществлять разделение энантиомеров D,L-2-фенилпропановой кислоты при рН=4.8 (α=0.922; RS=1.15), и частичное разделение энантиомеров D,L-α-метоксифенилуксусной кислоты при рН=3.8 (α=0.981; RS=0.64).
Недостатком способа является необходимость предварительного модифицирования капилляра, возможность полного разделения энантиомеров только для одной ароматической кислоты и только в присутствии 2-гидроксипропил-β-циклодекстрина при определенном водородном показателе (рН) и при приложении электрического тока. Применение способа для разделения смесей оптически активных аминокислот в задаче не ставилось.
Наиболее близким к предлагаемому является способ получения сорбента для разделения рацематов оптически активных соединений, включающий ковалентную иммобилизацию на носителе производных циклодекстрина, которую осуществляют путем последовательного взаимодействия аминированного носителя вначале с конденсирующим агентом, затем с реагентом из группы: пер-6-амино-α-цикло декстрин, пер-6-амино-β-циклодекстрин, пер-6-амино-γ-циклодекстрин, а затем с боргидридом металла. Дополнительно полученный сорбент подвергают ацетилированию. Предпочтительно, в качестве носителя используют кремнезем, а в качестве конденсирующего агента - глутаровый диальдегид. Предпочтительно взаимодействия проводят в натрий-фосфатном буферном растворе [RU 2203730, 2003].
Недостатком способа является сложность и многостадийность способа, а именно, необходимость предварительного аминирования исходного носителя, его дальнейшая химическая реакция с образованием ковалентных сшивок с производными циклодекстрина, а также последующее взаимодействие с гидридами металлов и ацетилирование.
Задачей изобретения является создание хиральных сорбентов на основе ацетатов целлюлозы для селективного разделения методом «хиральной фильтрации» рацемических смесей энантиомеров оптически активных веществ, в частности аминокислот, при расширении возможностей способа модифицирования и упрощении способа получения (технологии) готового материала (сорбента).
Поставленная задача решается тем, что в способе получения хиральных сорбентов для разделения рацематов оптически активных веществ, включающем модификацию исходного продукта, согласно решению в качестве исходного продукта выбирают ацетат целлюлозы различной степени ацетилирования, модификацию осуществляют выдерживанием в парах мезофазогенных растворителей в закрытой системе при комнатной температуре до степени поглощения паров не более 11 мас.%, с дальнейшей фиксацией модифицированной структуры ацетата целлюлозы путем десорбирования поглощенных паров в открытой системе в стандартных условиях.
В качестве мезофазогенных растворителей используют растворители из класса диполярных апротонных либо амфипротонных, в которых эфиры целлюлозы образуют лиотропную жидкокристаллическую фазу: нитрометан, и/или диметилформамид, и/или диметилсульфоксид, и/или уксусную кислоту и/или их водные растворы концентрации 1-20%. Ацетат целлюлозы выдерживают в парах нитрометана до степени поглощения паров ацетатом целлюлозы не более 11 мас.%, в парах водных растворов диметилформамида, диметилсульфоксида и уксусной кислоты до степени поглощения паров ацетатом целлюлозы не более 5 мас.%. Полностью ацетилированный триацетат целлюлозы выдерживают в парах нитрометана до степени поглощения паров триацетатом целлюлозы не более 7 мас.%.
Способ основан на специфическом взаимодействии эфира целлюлозы с парами мезофазогенных, т.е. образующих лиотропную жидкокристаллическую фазу с данным полимером, растворителей, либо их разбавленных растворов. Модифицированный соответствующей обработкой ацетат целлюлозы характеризуется измененной пространственной структурой, проявляющей комплементарность к определенным оптическим антиподам и выполняющий роль «хирального фильтра» при пропускании рацемической смеси L- и D-изомеров аминокислот.
Способ осуществляется следующим образом. Навеска воздушно-сухого порошка ацетата целлюлозы (ДАЦ) и/или полностью ацетилированного триацетата целлюлозы (ТАЦ) выдерживается в парах мезофазогенных растворителей или их водных растворов в герметически закрытом сосуде, заполненным на 1/25 часть нитрометаном или водным раствором диметилформамида, диметилсульфоксида и уксусной кислоты фиксированной концентрации (Ср) из диапазона значений Ср=1-20%, при температуре 23±3°С и нормальном атмосферном давлении. Количество поглощенных полимером паров определяли весовым методом, взвешивая навеску до и после набухания в парах мезофазогенных растворителей или их водных растворов на аналитических весах (точность взвешивания составляла ±0.0001 г). Процесс набухания характеризовали величиной степени модификации (См, мас.%), которую рассчитывали по формуле: См=(m-m0)·100%/m0, где m и m0 - массы воздушно-сухой и набухшей навески ДАЦ и/или ТАЦ. Затем для получения хиральных сорбентов проводится фиксация структуры модифицированного ацетата целлюлозы (ДАЦ и/или ТАЦ) путем проведения процесса десорбции поглощенных паров в открытой системе при температуре 23±3°С и нормальном атмосферном давлении.
Пространственную структуру модифицированного ацетата целлюлозы (ДАЦ и/или ТАЦ), подвергшегося набуханию в парах мезофазогенных растворителей или их водных растворов до фиксированной величины степени модификации См и дальнейшему десорбированию поглощенных паров, характеризовали величиной удельного оптического вращения [α] (град), являющегося мерой оптической активности полимера. Оптическое вращение растворов определяли на поляриметре СМ-2 при длине волны λ=589 нм и температуре 20±2°С. Использовали кварцевую кювету длиной 0.5 дм. Концентрация растворов составила 0.5 г/дл. Для растворения ацетатов целлюлозы использовали технологические растворители квалификации ч.д.а.: смесь ацетона с водой (95:5) для ДАЦ, смесь метиленхлорида с этанолом (90:10) для ТАЦ. Удельное оптическое вращение рассчитывали по формуле
где α и α0 - измеряемые углы вращения раствора и растворителя соответственно, градусы; l - длина оптического пути, дм; С - концентрация раствора, г/дл.
Полученные на основе ДАЦ и ТАЦ хиральные сорбенты исследовали на способность к энантиоразделению рацемических смесей L- и D-изомеров аминокислот на примере триптофана, валина, серина и аспарагиновой кислоты квалификации х.ч. Аминокислоты использовали в виде смеси их L- и D-энантиомеров при соотношении 1:1. Для проведения испытаний готовили по точной навеске водные растворы триптофана и валина концентрации 0.12 г/дл и 2 г/дл соответственно и растворы серина и аспарагиновой кислоты концентрации 2 г/дл в 1 Н соляной кислоте. Растворы характеризовали величиной удельного оптического вращения. Величины оптического вращения этих растворов [αp] и растворов индивидуальных L- и D-энантиомеров [αэ] каждой аминокислоты в указанных выше растворителях (справочные данные) приведены в таблице 1.
Стереоспецифичность ацетатцеллюлозных хиральных сорбентов определяли методом «хиральной фильтрации» на специальной разделительной колонке при температуре 23±3°С. Колонка представляла собой стеклянную трубку длиной 17 см и диаметром 1 см, состоящую из двух отсеков: верхний отсек - полая трубка высотой 13.5 см, нижний отсек - стеклянный фильтр с диаметром пор ˜ 0.1 см и высотой 3.0 см. Образец сорбента засыпали в верхний отсек на высоту 3 см и утрамбовывали. Затем через колонку с модифицированным ацетатцеллюлозным сорбентом пропускали фиксированный объем (15 мл) раствора рацемической смеси аминокислоты (1:1). Первую порцию (˜5 мл) фильтрата отбрасывали, вторую - использовали для определения удельного оптического вращения [αi]. Разделение энантиомеров контролировали по изменению величины [α] раствора аминокислоты до (пенетрат) и после (пермеат) прохождения через сорбент. Селективность разделения ϕ (%) определяли по формуле: ϕ=[αi]·100%/[αэ], где [αi] - удельное оптическое вращение пермеата, град; [αэ] - удельное оптическое вращение либо L-, либо D-энантиомера, град.
Максимальное значение степени модификации См ацетата целлюлозы парами мезофазогенных растворителей и/или их водных растворов, обеспечивающее селективное разделение рацемических смесей энантиомеров, определено экспериментально, выбрано для ДАЦ из диапазона См не более 5 мас.% для паров водных растворов уксусной кислоты концентрации Ср=5%, диметилсульфоксида Ср=1-10%, диметилформамида Ср=10-20% и не более 11 мас.% для паров нитрометана, для ТАЦ из диапазона См не более 7 мас.% для паров нитрометана.
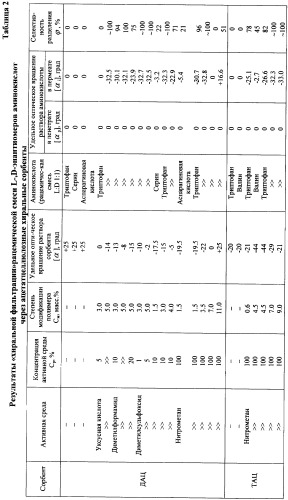
Изобретение поясняется примерами конкретного исполнения и таблицей 2.
Пример 1. Через исходный ДАЦ, охарактеризованный величиной удельного оптического вращения [α]=+25 град., пропускают рацемическую смесь L-, D-энантиомеров (1:1) аминокислот:триптофана, серина, аспарагиновой кислоты. Удельное оптическое вращение пенетрата [αр]=0 град., удельное оптическое вращение пермеата [αi]=0 град. Разделение энантиомеров (рацематов) не происходит.
Пример 2. Исходный ДАЦ с [α]=+25 град. выдерживают в парах уксусной кислоты концентрации Ср=5% до степени модификации См=3.0 мас.%, затем осуществляют десорбцию поглощенных паров. Модифицированный ДАЦ характеризуется величиной удельного оптического вращения [α]=0 град. Аналогично примеру 1, через модифицированный ДАЦ пропускают рацемическую смесь L-, D-энантиомеров (1:1) аминокислоты триптофан: [αp]=0 град., [αi]=0 град. Разделения энантиомеров не наблюдается.
Пример 3. Аналогично примеру 2, ДАЦ выдерживают до См=5.0 мас.%, фиксируют, исследуют и используют для фильтрации: [α]=-14 град., [αр]=0 град., [αi]=-32.5 град. Разделение энантиомеров с выходом L-изомера ˜100%.
Пример 4. Аналогично примеру 2, ДАЦ выдерживают в парах водного раствора диметилформамида концентрации Ср=10% до См=3.0 мас.%, фиксируют, исследуют и используют для фильтрации: [α]=-13 град., [αр]=0 град., [αi]=-30.1 град. Разделение энантиомеров с выходом L-изомера 94%.
Пример 5. Аналогично примеру 4, ДАЦ выдерживают до См=5.0 мас.%, фиксируют, исследуют и используют для фильтрации: [α]=-8 град., [αр]=0 град., [αi]=-32.1 град. Энантиоразделение с выходом L-изомера 100%.
Пример 6. Аналогично примеру 5, ДАЦ выдерживают в парах водного раствора диметилформамида концентрации Ср=20%, фиксируют, исследуют и используют для фильтрации: [α]=-15 град., [αр]=0 град., [αi]=-23.9 град. Энантиоразделение с выходом L-изомера 75%.
Пример 7. Аналогично примеру 2, ДАЦ выдерживают в парах водного раствора диметилсульфоксида концентрации Ср=1% до См=3.0 мас.%, фиксируют, исследуют и используют для фильтрации: [α]=-10 град., [αр]=0 град., [αi]=-32.7 град. Разделение энантиомеров с выходом L-изомера ˜100%.
Пример 8. Аналогично примеру 7, ДАЦ выдерживают в парах водного раствора диметилсульфоксида концентрации Ср=5% до См=5.0 мас.%, фиксируют, исследуют и используют для фильтрации: [α]=-2 град., [αр]=0 град., [αi]=-32.5 град. Разделение энантиомеров с выходом L-изомера ˜100%.
Пример 9. Аналогично примеру 7, ДАЦ выдерживают в парах водного раствора диметилсульфоксида концентрации Ср=10% до См=1.5 мас.%, фиксируют и исследуют: [α]=-17.5 град. Аналогично примеру 1, через модифицированный ДАЦ пропускают рацемическую смесь L-, D-энантиомеров (1:1) аминокислоты серин: [αр]=0 град., [αi]=-3.2 град. Разделение энантиомеров с выходом L-изомера 22%.
Пример 10. Аналогично примеру 9, ДАЦ выдерживают до См=3.0 мас.%, фиксируют и исследуют: [α]=-15 град. Аналогично примеру 2, модифицированный ДАЦ используют для фильтрации: [αр]=0 град., [αi]=-32.3 град. Энантиоразделение с выходом L-изомера ˜100%.
Пример 11. Аналогично примеру 10, ДАЦ выдерживают до См=4.0 мас.%, фиксируют, исследуют и используют для фильтрации: [α]=-5 град., [αр]=0 град., [αi]=-22.9 град. Энантиоразделение с выходом L-изомера 71%.
Пример 12. Аналогично примеру 2, ДАЦ выдерживают в парах нитрометана до См=1.5 мас.%, фиксируют и исследуют: [α]=-19.5 град. Аналогично примеру 1, через модифицированный ДАЦ пропускают рацемическую смесь L-, D-энантиомеров (1:1) аспарагиновой кислоты: [αр]=0 град., [αi]=-5.4 град. Разделение энантиомеров с выходом L-изомера 21%.
Пример 13. Аналогично примеру 12, ДАЦ выдерживают, фиксируют и исследуют: [α]=-19.5 град. Аналогично примеру 2, модифицированный ДАЦ используют для фильтрации: [αр]=0 град., [αi]=-30.7 град. Разделение энантиомеров с выходом L-изомера 96%.
Пример 14. Аналогично примеру 13, ДАЦ выдерживают до См=3.5 мас.%, фиксируют, исследуют и используют для фильтрации: [α]=-22 град.; [αр]=0 град., [αi]=-32.8 град. Разделение энантиомеров с выходом L-изомера ˜100%.
Пример 15. Аналогично примеру 13, ДАЦ выдерживают до См=7.0 мас.%, фиксируют, исследуют и используют для фильтрации: [α]=0 град.; [αр]=0 град., [αi]=0 град. Разделения энантиомеров не наблюдается.
Пример 16. Аналогично примеру 13, ДАЦ выдерживают до См=11.0 мас.%, фиксируют, исследуют и используют для фильтрации: [α]=+25 град.; [αp]=0 град., [αi]=+16.6 град. Разделение энантиомеров с выходом D-изомера 51%.
Выдерживание ацетата целлюлозы в парах нитрометана до См>11 мас.% экономически не целесообразно из-за длительности процесса набухания.
Пример 17. Аналогично примеру 1, через исходный ТАЦ, охарактеризованный [α]=-20 град., пропускают рацемическую смесь L-,D-энантиомеров (1:1) аминокислот:триптофана и валина: [αр]=0 град., [αi]=0 град. Разделение энантиомеров не происходит.
Пример 18. Аналогично примеру 13, исходный ТАЦ с [α]=-20 град выдерживают до См=0.6 мас.%, фиксируют, исследуют и используют для фильтрации: [α]=-21 град.; [αр]=0 град., [αi]=-25.1 град. Энантиоразделение с выходом L-изомера 78%.
Пример 19. Аналогично примеру 18, ТАЦ выдерживают до См=4.5 мас.%, фиксируют и исследуют: [α]=-44 град. Аналогично примеру 17, через модифицированный ТАЦ пропускают рацемическую смесь L-, D-энантиомеров (1:1) аминокислоты валин: [αр]=0 град., [αi]=-2.7 град. Энантиоразделение с выходом L-изомера 45%.
Пример 20. Аналогично примеру 18, ТАЦ выдерживают до См=4.5 мас.%, фиксируют, исследуют и используют для фильтрации: [α]=-44 град.; [αр]=0 град., [αi]=-26.6 град. Разделение энантиомеров с выходом L-изомера 82%.
Пример 21. Аналогично примеру 18, ТАЦ выдерживают до См=7.0 мас.%, фиксируют, исследуют и используют для фильтрации: [α]=-29 град.; [αр]=0 град., [αi]=-32.3 град. Разделение энантиомеров с выходом L-изомера ˜100%.
Пример 22. Аналогично примеру 18, ТАЦ выдерживают до См=9.0 мас.%, фиксируют, исследуют и используют для фильтрации: [α]=-21 град.; [αр]=0 град., [αi]=-33.0 град. Разделение энантиомеров с выходом L-изомера ˜100%.
Таким образом, предлагаемый способ позволяет получать на основе крупнотоннажного полимера - ацетата целлюлозы - хиральные сорбенты для селективного разделения рацемических смесей энантиомеров аминокислот вплоть до получения оптически чистых L-изомеров, а предположительно для селективного разделения рацематов других оптически активных веществ. Способ прост в исполнении, экологически чист, поскольку ведется в закрытой системе, и экономически целесообразен, поскольку осуществляется в стандартных условиях - нормальном давлении и комнатной температуре.
| Таблица 1Величины удельного оптического вращения индивидуальных L- и D-энантиомеров аминокислот и их рацемических смесей | |||
| Аминокислота | Удельное оптическое вращение растворов | ||
| [αэ], град* | [αр], град** | ||
| L-энантиомер | D-энантиомер | Рацемическая смесь L:D (1:1) | |
| Триптофан | -32.1 | +32.9 | 0 |
| Валин | -6.06 | +6.42 | 0 |
| Серин | -14.32 | +14.45 | 0 |
| Аспарагиновая кислота | -25.5 | +25.5 | 0 |
| Примечание: * - справочные данные, ** - экспериментальные данные |
1. Способ получения хиральных сорбентов для разделения рацематов оптически активных веществ, включающий модификацию исходного продукта, отличающийся тем, что в качестве исходного продукта выбирают ацетат целлюлозы различной степени ацетилирования, модификацию осуществляют выдерживанием в парах мезофазогенных растворителей в закрытой системе при комнатной температуре до степени поглощения паров не более 11 мас.% с дальнейшей фиксацией модифицированной структуры ацетата целлюлозы путем десорбирования поглощенных паров в открытой системе в стандартных условиях.
2. Способ по п.1, отличающийся тем, что в качестве мезофазогенных растворителей используют растворители из класса диполярных апротонных либо амфипротонных: нитрометан, и/или диметилформамид, и/или диметилсульфоксид, и/или уксусную кислоту, и/или их водные растворы концентрации 1-20%.
3. Способ по п.2, отличающийся тем, что ацетат целлюлозы выдерживают в парах нитрометана до степени поглощения паров ацетатом целлюлозы не более 11 мас.%, в парах водных растворов диметилформамида, диметилсульфоксида и уксусной кислоты до степени поглощения паров ацетатом целлюлозы не более 5 мас.%.
4. Способ по п.1, отличающийся тем, что для модификации используют полностью ацетилированный триацетат целлюлозы и выдерживают в парах нитрометана до степени поглощения паров триацетатом целлюлозы не более 7 мас.%.