Способ получения фрондозида а и способ стимулирования иммунной системы млекопитающих
Иллюстрации
Показать всеИзобретение относится к иммунологии. Проводят экстрагирование высушенных варочных вод голотурии Cucumaria frondosa или высушенных порошкообразных тканей Cucumaria frondosa смесью хлороформа и метанола при кипячении с обратным холодильником для получения органического экстракта; упаривание экстракта, перерастворение упаренного экстракта в воде, декантирование полученного коллоидного раствора и добавление к нему этилацетата с последующим декантированием водной фазы и хроматографией водной фазы на тефлоновой или силикагельных колонках. Стимулирование иммунной системы млекопитающих, включая стимулирование лизосомальной активности, фагоцитоза и образования активных форм кислорода в макрофагах млекопитающих, зараженных бактериальными клетками, вирусами, простейшими, осуществляют введением фрондозида А оральным или внутрибрюшным, или внутримышечным способом, или их комбинацией в дозах от 1 до 15 мкг/кг, предпочтительно 10 мкг/кг. Изобретение позволяет реализовать указанное назначение. 2 н. и 9 з.п. ф-лы, 1 табл., 4 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к сапонинам, полученным из голотурий, в частности к сапонину, известному как фрондозид А.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Сапонины или гликозиды, состоящие из углеводной цепи и тритерпенового или стероидного агликона, широко распространены в растениях. Присутствие тритерпеновых гликозидов характерно для большинства голотурий, животных относящихся к классу Holothurioidea (тип Echinodermata) и для некоторых губок. Тритерпеновые гликозиды голотурий имеют агликоны ланостанового типа, большинство имеет агликоны с 18(20)-лактонами и относится к голостановому типу. Углеводные цепи гликозидов голотурий состоят из двух - шести моносахаридных остатков, включая ксилозу, хиновозу, глюкозу, 3-О-метилглюкозу и (иногда) 3-O-метилксилозу и могут содержать одну, две или три сульфатные группы. (V.A.Stonik, V.I.Kalinin, S.A.Avilov, "Toxins from Sea Cucumbers (Holothuroids): Chemical Structures, Properties, Taxonomic Distribution, Biosynthesis and Evolution," J. Nat. Toxins. 1999, 8, 235-248)
Благодаря способности формировать комплекс с 5(6)-ненасыщенными стеринами клеточных мембран гликозиды обладают широким спектром биологической активности, включая гемолитическую, антигрибковую, цитотоксическую, и многие другие виды мембранотропного действия. Более того, эти гликозиды известны как имеющие сильное иммуномудулирующее действие при очень низких концентрациях, что может иметь практическое значение. (V.I.Kalinin, M.M.Anisimov, N.G.Prokofieva, S.A.Avilov, S.S.Afiyatullov, V.A.Stonik. "Biological activities and biological role of triterpene glycosides from holothuroids (Echinodermata)". Echinoderm Studies. Vol.5, A.A.Balkema, Rotterdam, p.139-181, 1996). Иммуномодулирующее действие было изучено для нескольких видов голотурий (D.L.Aminin, I.G.Agafonova, E.V.Berdyshev, E.G.Isachenko, S.A.Avilov, V.A.Stonik. "Immunomodulatory Properties of cucumariosides from the Edible Far-Eastern Holothurian Cucumaria japonica," J. Med. Food. 2001, 4, 127-135). Было показано, что большинство эффективных иммуностимуляторов являются моносульфатированными гликозидами, в то время как ди- и трисульфатированные являются иммунодепрессантами. Комплекс холестерина и суммы моносульфатированных гликозидов из Cucumaria japonica (ИСКОМ-подобная композиция) и композиции на его основе также были использованы как иммуностимуляторы (В.А.Стоник, Д.Л.Аминин, В.М.Богуславский, С.А.Авилов, И.Г.Агафонова, А.С.Сильченко, Л.П.Пономаренко, Н.Г.Прокофьева, Е.А.Галкина. Иммуномодулирующий препарат "Кумазид" и фармакологическая композиция на его основе (Заявка на Патент РФ №2004120434/15, приоритет 2.07.2004).
Таким образом, очень важно иметь чистый стандартный гликозид, чтобы обеспечить гарантированный и стабильный иммуностимулирующий эффект. Фрондозид А, объект настоящего изобретения, значительно отличается от других моносульфатированных гликозидов, таких как кукумариозид А2-2, и других кукмариозидов из Cucumaria japonica, для которых сообщались иммуностимулирующие свойства (G.B.Elyakov, V.A.Stonik. "Marine bioorganic chemistry as the base of marine biotechnology" Rus. Chem. Bull. 2003, 52). Таким образом, открытие иммуностимулирующих свойств для фрондозида А в настоящем изобретении является новым и неочевидным из-за следующих отличий между кукумариозидами и фрондозидом А из С.frondosa:
1. фрондозид А имеет 16-ОАс группу при С-16 агликона, а не кетогруппу;
2. фрондозид А имеет ксилозу в качестве третьего моносахаридного остатка, но не глюкозу;
3. фрондозид А не имеет двойной связи в боковой цепи агликона.
Более того, иммуномодулирующее действие фрондозида А является неожиданным и неочевидным, поскольку кукмариозид G1, который имеет очень схожий агликон с той же самой 16-ОАс группой, не обладает аналогичной биологической активностью (Y.I.Grishyn, N.N.Besednova, V.A.Stonik, S.A.Avilov, "Regulation of hemopoesis and immunogenesis by triterpene glycosides of the sea cucumbers" Radiobiologia, 1990, 30, 556).
Cucumaria frondosa обитает в Северо-Атлантических холодных водах и добывается для пищевых целей в штате Мэн и Канаде. В России этот вид голотурий обитает в Баренцовом море. Cucumaria frondosa содержит очень сложную смесь моно-, ди- и трисульфатированных гликозидов, главным образом, пентаозидов. (М.Girard, J.Belanger, J.W.ApSimon, F.-X. Garneau, C. Harvey, J.-R. Brisson. "Frondoside A. A Novel Triterpene Glycoside from the Holothurian Cucumaria frondosa" Can. J. Chem. 1990. 68, 11-18); (J. Findlay, N. Yayli, L. Radics. "Novel sulphated oligosaccharides from the sea cucumber Cucumaria frondosa," J. Nat. Prod. 1992, 55, 93-101); (Yayli, N., Findlay, J. "A Triterpenoid Saponin from Cucumaria frondosa," Phytochemistry. 1999, 50, 135-138); (N.Yayli, "Minor Saponins from the Sea Cucumber Cucumaria frondosa," Indian J. Chem. 2001, 40B, 399-404); (S.A.Avilov, O.A.Drozdova, V.I.Kalinin, A.I.Kalinovsky, V.A.Stonik, E.N.Gudimova, R.Riguera, C.Jimenez. "Frondoside C, a New Nonholostane Triterpene Glycoside from the Sea Cucumber Cucumaria frondosa: Structure and Cytotoxicity of its Desulphated Derivative", Can. J. Chem. 1998, 76, 137-141). В ходе промышленной переработки голотурий в качестве отходов образуются значительные количества варочных вод, содержащих сапонины. Однако иммуномодулирующие свойства индивидуальных гликозидов из С.frondosa никогда не изучались.
Лизосомальная активность является одним из важных маркеров физиологического и биохимического статуса макрофагов. Увеличение количества в них внутриклеточных органелл и увеличение размера этих органелл, так же как увеличение кислотности, свидетельствует об активации некоторых клеточных функций и лизосомальных ферментов, а также о подготовке клеток к фагоцитозу и перевариванию поглощенных частиц. (А.С.Allison, M.R.Young. Vital Staining and Fluorescence Microscopy of Lysosomes. In "Lysosomes in Biology and Pathology". Vol.2, North Holland, Amsterdam, p.600-628, 1969); (C.Millot, "Characterization of Acidic Vesicles in Multidrug-Resistant and Sensitive Cancer Cells by Acridine Orange Staining and Confocal Microspectrofluorometry", J. Histochem. Cytochem. 1997, 45, 1255-1259); (F.Zoccarato, L.Cavallini, A.Alexandre, "The pH-Sensitive Dye Acridine Orange as a Tool to Monitor Exocytosis/Endocytosis in Synaptosomes", J.Neurochem. 1999, 72, 625).
Фагоцитоз является важным механизмом питания в одноклеточных организмах, а также используется для защиты против инфекций в высших позвоночных. Процесс фагоцитоза может наблюдаться и количественно оцениваться как в человеческих полиядерных клетках, так и мышиных макрофагах по включению инородных частиц, таких как флуоресцентно меченные иммунные комплексы и бактериальные частицы. Эта технология позволяет обнаруживать внутриклеточную флуоресценцию, вызванную поглощенными частицами, равно как проводить эффективное погашение флуоресценции зонда во внеклеточной среде трипановым синим. (C.R.Uff, A.G.Pockley, R.K.Phillips. "A Rapid Microplate-Based Fluorometric Assay for Phagocytosis." Immunol Invest. 1993, 22, 407); (CP. Wan, C.S. Park, B.H. Lau. "A Rapid and Simple Microfluorometric Phagocytosis Assay." J Immunol Meth. 1993. 162, 1).
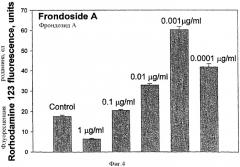
Способность генерировать синглетный кислород, перекись водорода и продукты их взаимодействия друг с другом и с NO, так называемый оксидативный взрыв, также важен для макрофагов, чтобы убивать инфекционные микроорганизмы. Регистрируемое в данном исследовании превращение дигидрородамина 123 в родамин 123 в клетках отражает выработку мышиными макрофагами Н2О2, О2 и пероксинитрита, который ассоциируется с выработкой оксида азота и образованием НАДФ-оксидазозависимого супероксида. Эти активные формы кислорода являются очень токсичными и необходимы для килинга поглощенных микроорганизмов, их окисления и дезинтеграции. (E.W.Childs, K.F.Udobi, J.G.Wood, F.A.Hunter, D.M.Smalley, L.Y.Cheung. "In vivo Visualization of Reactive Oxidants and Leukocyte-Endothelial Adherence Following Hemorrhagic Shock," Shock. 2002. 18, 423 - 7); (S.F.Emmendorffer, M.Hecht, M.-L. Lohman-Mattes, J.Roester. "A Fast Easy Method to Determine the Production of Reactive Oxygene Intermediates by Human and Murine Phagocytes Using Dihydrorodamine 123," J.Immunol. Meth. 1990, 131, 269-275).
В сравнении с выделением сапонинов из растений выделение сапонинов из голотурий существенно отличается в связи со следующими особенностями, как-то: высокополярный характер большинства гликозидов; присутствие более значительных количеств белков, пептидов, липидов, и солей в животных. Большинство обычных приемов выделения гликозидов сводятся к следующим: экстракция сырого животного материала 70% этанолом или метанолом, обессоливание упаренного экстракта на гидрофобном сорбенте таком, как например, XAD-4 и т.д. с последующей хроматографией на силикагеле и дальнейшим выделением индивидуальных веществ с помощью ВЭЖХ. (S.A.Avilov, A.S.Antonov, A.S.Silchenko, V.I.Kalinin, A.I.Kalinovsky, P.S.Dmitrenok, V.A.Stonik, R.Riguera, C.Jimenez, "Triterpene Glycosides from the Far Eastern Sea Cucumber Cucumaria conicospermiumr J. Nat. Prod. 2003, 66, 910-916); (H.D.Chludil, C.C.Muniain, A.M.Seldes, M.S.Maier, "Cytotoxic and Antifungal Triterpene Glycosides from the Patagonian Sea Cucumber Hemoidema spectabilis", J. Nat. Prod. 2002, 65, 860-865).
Однако подобная процедура не подходит для промышленных или полупромышленных целей, поскольку коллоидная природа водного раствора упаренного этанольного или метанольного экстракта, содержащего большое количество частиц различных неполярных соединений, таких как липиды, пигменты и др. может препятствовать протеканию сольвента через колонку с тефлоном или каким-либо иным гидрофобным сорбентом. Выделение гликозидов из варочной воды непосредственно с помощью гидрофобной хроматографии на тефлоне или на каком-либо ином неполярном сорбенте после фильтрации этой варочной воды затруднено, поскольку необратимая сорбция гидрофобных белков будет вести к постепенной потере соответствующей колонкой своих адсорбционных свойств. Протекание сольвента также задерживается коллоидными частицами различных белков. Более того, значительная часть гликозидов может образовать комплекс с гидрофобными белками и быть потерянной при фильтрации.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Задачей настоящего изобретения является создание промышленно пригодного и эффективного способа получения фрондозида А из продуктов промышленной переработки голотурий, особенно из варочных вод, образующихся при такой переработке. Дополнительной задачей настоящего изобретения является создание способа, обеспечивающего стабильное стимулирование и/или восстановление иммунной системы млекопитающих, нуждающихся в этом, и особенно сельскохозяйственных животных или домашних хорьков при опасности вирусных, грибковых или оппортунистических болезней, связанных с уменьшением иммунного ответа у этих млекопитающих.
Дополнительной задачей настоящего изобретения является создание эффективного медицинского препарата для животных с пониженным статусом иммунной системы, особенно людей, инфицированных ВИЧ, а также в ходе лечения болезней с использованием методов радио- и химиотерапии. Вдобавок, такой медикамент может быть использован в такой подходящей форме, как это может быть определено любым человеком, имеющим достаточную терапевтическую квалификацию.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Метод выделения
Настоящее изобретение предусматривает использование хлороформ/метанольной смеси в качестве растворителя в различных пропорциях по отношению к твердому материалу, последующее упаривание и экстракцию этилацетатом и водой и последующую хроматографию водной фазы на тефлоне и колонках с силикагелем. Этот процесс используется для выделения тритерпеновых гликозидов (сапонинов) высокой чистоты, особенно фрондозида А из высушенных варочных вод и размолотых в порошок тканей голотурий, используемых вместо остатка после упаривания варочных вод. Настоящее изобретение также включает метод стимулирования лизосомальной активности макрофагов, фагоцитоза и образования активных форм кислорода у млекопитающих после назначения фрондозида А.
Хотя полярные гликозиды не так легко растворяются в безводных хлороформ/метанольных смесях, неожиданно было найдено, что смесь хлороформа и метанола способна растворять их при повышенной температуре при кипячении с обратным холодильником. Температура может контролироваться путем использования различных соотношений между смесью растворителей и твердым субстратом, поскольку, чем большее количество растворителя добавлено в смесь, тем меньшая температура кипения экстракта будет достигнута. Полная экстракция гликозидов, включая ди- и трисульфатированные пентаозиды, хлороформ/метанолом в приблизительном соотношении 1:1 возможна при количестве растворителя пропорциональном соотношении 4 мл смеси растворителей на 1 г сухой варочной воды при 1,5 часовом кипячении с обратным холодильником или более. Соответственно, при большем количестве растворителя, а именно в пропорциональном соотношении 6 мл смеси растворителя на 1 г сушеной варочной воды, было достигнуто более селективное выделение моносульфатированных гликозидов, преимущественно фрондозида А. Однако прямая хроматография выпаренного и перерастворенного в воде хлороформ/метанольного экстракта на тефлоне не вполне эффективна из-за наличия значительного количества липидного материала. Эффективная делипидизация и удаление пигментов достигается водно/этилацетатной экстракцией. Получаемые при этом водные фазы почти полностью свободны от пигментов и липидов.
Дальнейшее обессоливание на тефлоновом порошке производится путем загрузки водной фазы на тефлон с предварительным разбавлением примерно в 8-10 раз относительно объема колонки; промывания колонки водой до полного обессоливания с последующим элюированием ацетоном (или другим воднорастворимым полярным органическим растворителем, включая метанол, этанол, изопропанол и т.д.) или смесью полярного растворителя и воды при контроле процесса элюирования по ТСХ, что позволяет отделить гликозиды от следовых количеств оставшихся липидов. Водная фаза должна быть упарена досуха после водно/этилацетатной экстракции в случае использования любого гридрофобного сорбента за исключением тефлона для того, чтобы убрать предварительно следы этилацетата.
Дальнейшая очистка гликозидов может быть достигнута обычной хроматографией низкого давления на силикагеле или при использовании простейшей силикагельной флэш-колонки, при этом получается фракция практически чистого фрондозида А, а также фракции, содержащие моно-, ди- и трисульфатированные гликозиды. Чистота фрондозида А, 3-O-метил-β-D-глюкопиранозил-(1→3)-β-D-ксилопиранозил-(1→4)-[β-D-ксилопиранозил-(1→2)]-β-D-хиновопиранозил-(1→2)-4-O-натрий сульфат-β-D-ксило-пиранозил-3-O-голост-7(8)-ен-3β-ол-16β-О-ацетата может быть проверена спектроскопией 13С ЯМР и масс-спектрометрией.
Экстракция животных материалов хлороформ/метанольными смесями обычно используется для выделения липидов и согласно нашим сведениям никогда до этого не использовалась для непосредственной экстракции полярных гликозидов из животного материала и никогда не применялась для выделения гликозидов из варочной воды голотурий или разделения различных гликозидов друг от друга. Авторами неожиданно была обнаружена возможность непосредственной загрузки водной фазы после этилацетатной колонки на тефлоновый порошок без предварительного упаривания ее досуха, что дает значительное упрощение процедуры. Это возможно только на тефлоновом порошке, но не на XAD, о чем ранее не сообщалось.
Процедура, аналогичная описанной выше, может быть использована для выделения биологически активных гликозидов из голотурий, в частности из С.frondosa, при которой метод выделения может включать экстракцию высушенной варочной воды, получаемой при промышленной переработке Cucumaria frondosa или высушенных тканей Cucumaria frondosa смесью хлороформа и метанола при кипячении с обратным холодильником, и упаривание полученного экстракта с последующим экстрагированием остатка этилацетатом и водой один или более раз, чтобы получить водную фазу, которую хроматографируют на тефлоне и силикагельных колонках, собирая фракции фиксированного объема, и затем, тестируя каждую фракцию после упаривания и перерастворения в воде, для тестирования на животных путем орального введения, производя контроль метаболитов и сравнивая результаты с контрольными пустыми пробами.
Само собой разумеется, что методика выделения гликозидов, могущих быть использованных при оральном введении, является только примером, и такие протоколы могут быть модифицированы и оптимизированы любым квалифицированным лицом без каких-либо ограничений, и которые можно представить, сохраняя предмет, цели и смысл заявляемого здесь изобретения.
Тестирование in vivo
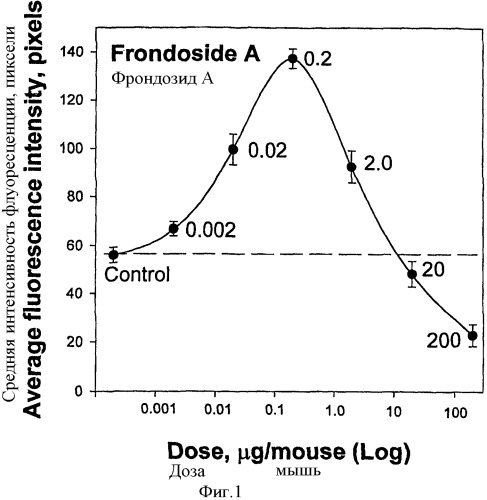
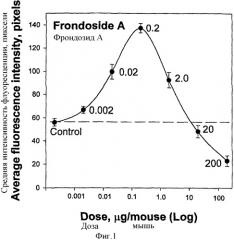
Изобретателями было обнаружено, что фрондозид А, выделенный из С.frondosa, вызывает в диапазоне концентраций от 0,002-2,0 мкг/мышь значительный дозозависимый иммуностимулирующий эффект на перитонеальные макрофаги. Введение низких доз фрондозида А ведет к увеличению числа и объема лизосом, так же как и увеличению их кислотности в мышиных перитонеальных макрофагах, что регистрировалось с помощью флуоресцентного зонда акридинового оранжевого на четвертый день после обработки. Максимальный стимулирующий эффект был обнаружен при концентрации фрондозида А 0.2 мкг/мышь, что приводило более чем к двукратному стимулированию лизосомальной активности. С другой стороны, существенно большие дозы, такие как 20 мкг/мышь и 200 мкг/мышь, вызывали противоположный эффект, показывающий значительное подавление лизосомальной активности, относительно контроля.
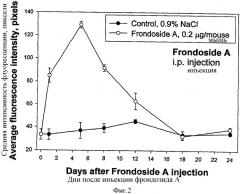
После введения фрондозида А значительное стимулирование происходило даже в первый день после инъекции. Максимальный стимулирующий эффект фрондозида А проявлялся на 4-5-й день после инъекции гликозида. После этого периода эффект плавно уменьшался и возвращался к уровню контроля на 12-й - 18-й день. Таким образом, стимулирующий эффект фрондозида А после однократной инъекции наблюдался в течение двух недель.
Фагоцитоз
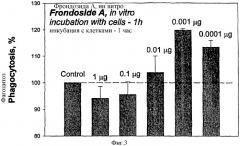
Фрондозид А влияет как дозозависимый иммуномодулятор на поглощение бактериальных клеток Staphylococcus aureus перитонеальными макрофагами мыши in vitro. В концентрации от 0,01-0,0001 мкг/мл, фрондозид А стимулировал фагоцитоз бактерий с максимальным эффектом в 20% при концентрации 0,001 мкг/мл. При концентрации 0,01 мкг/мл гликозид существенно ингибировал фагоцитоз, а при концентрации 0,1 мкг/мл происходило незначительное уменьшение фагоцитоза.
Влияние на образование активных форм кислорода
Фрондозид А оказывает двойственное влияние на образование активных форм кислорода (АФК) или "оксидативный взрыв " в макрофагах in vitro. Этот эффект зависит от используемой концентрации гликозида. При концентрации фрондозида А 0,0001-0,01 мкг/мл обнаруживалось увеличение внутриклеточной флуоресценции в зеленой области, связанной с образованием родамина 123. Максимальный стимулирующий эффект наблюдался при концентрации 0,001 мкг/мл. С другой стороны, фрондозид А, примененный при цитотоксической концентрации 1,0 мкг/мл, значительно ингибировал образование активных форм кислорода, а при концентрации 0,1 мкг/мл был практически неэффективен относительно контрольного уровня.
Данные по влиянию фрондозида А на образование активных форм кислорода и на процессы фагоцитоза в макрофагах близки и показывают, что фрондозид А является прямым иммуномодулятором клеточного иммунитета.
Токсичность
Острая токсичность фрондозида А на белых мышах была определена как 9,9 мг/кг. Гемолитическая активность фрондозида А в тесте с 1%-ной суспензией мышиных эритроцитов составляет 3,50 мкг/мл (ЕС50) или 12,50 мкг/мл (ЕС100). Эмбриотоксичность фрондозида А относительно развивающихся эмбрионов морских ежей составляет 0.98 мкг/мл (ЕС50) или 3,12 мкг/мл (ЕС100).
Эти данные показывают, что эффективные иммуностимулирующие дозы фрондозида А примерно на два порядка ниже токсических доз при биотестировании в тестах как in vivo, так и in vitro.
Стимулирование иммунной системы млекопитающих путем введения фрондозида А в субтоксических дозах никогда ранее не было описано.
Описание иммуностимулирования и болезней, связанных с иммунитетом
Основная защитная функция иммунной системы относится к сопротивлению против вторжения патогенов, включая вирусы, рикетсии, микоплазмы, бактерии, грибы и паразиты всех типов. Таким образом, усиление иммунного ответа, особенно когда он изначально подавлен, улучшает сопротивляемость к инфицированию или инвазии вышеназванными патогенами.
Вторая защитная функция иммунной системы состоит в сопротивлении вживления инородной ткани либо естественной, либо от эмбрионов к материнскому организму или искусственной при трансплантации органов.
Третья защитная функция включает отсутствие реакции на собственные ткани с помощью положительных супрессорных механизмов. При автоиммунных и сходных нарушениях иммунная реактивность направлена на собственные антигены или избыточный, повышенный и несомненно деструктивный иммунный ответ.
В общем, иммунная система включает такие функциональные компоненты как клеточная иммунная система и гуморальный иммунитет. Иммунитет может быть специфичным или неспецифичным, врожденным и т.д. Основная цель иммунотерапии является коррекция различных иммунодефицитных явлений. Иммуномодуляторы нормализуют функционирование некоторых или/и всех частей иммунной системы животных с врожденным или приобретенным иммунодефицитом. Было найдено, что фрондозид А или физиологически приемлемая композиция на его основе действует как иммуностимулятор и усиливает клеточный иммунитет организма.
Таким образом, вещество в соответствии с изобретением или физиологически приемлемая композиция на его основе может быть использовано для лечения болезней, связанных с дефектами в иммунной системе, и/или увеличивать активность иммунной системы выше нормального уровня.
Настоящее изобретение обеспечивает использование фрондозида А или физиологически приемлемых композиций на его основе для производства медикаментов для активации иммунной системы.
Фармацевтическая композиция может быть таблеточной формой, включающей в себя фрондозид А как активное вещество и дополнительно картофельный крахмал и гипс как наполнитель в соотношении на одну таблетку, мг: фрондозид А - 0,05; картофельный крахмал - 45,0; гипс - 5,0 или фрондозид А - 0,005; сорбит - 45,0; стеарат кальция - 5,0.
Физиологически приемлемой композицией на основе фрондозида А может быть ИСКОМ (иммуностимулирующий комплекс, приготовленный на основе сапонина, холестерина, фосфолипида и белкового антигена). ИСКОМ является вакцинной формой, которая сочетает наличие какого-либо антигена и адъювант [Hoglund, S., Dalsgaard, К., Lovgren, К., Sundquist, В., Osterhaus, A. and В. Morein. «Iscoms and immunostimulation with viral antigens». In: Subcellular biochemistry (Ed. Harris, J.R.) Plenum, New York, 1989, p.39-68; Morein, В., Akerblom L. «The iscom - an approach to subunit vaccines». In: Recombinant DNA vaccines. Rationale and strategy (Ed. Isaacson, R.E.) Marcel Dekker, New York, 1992, p.369-386; Morein В., Villacres-Eriksson M., Akerblom L., Ronnberg В., Lovgren K., Sjolander A. 1994. «Mechanisms behind the immune response induced by immunostimulating complexes)). Aids Research and Human Retroviruses 10(S2): S109-S114; Morein В., Lovgren K., Ronnberg В., Sjolander A. and Villacres-Eriksson M. 1995. «Immunostimulating complexes: Clinical potential in vaccine development)). Clinical Immunotherapeutics 3: 461-475.]. Он имеет ячеистую структуру, построенную из сапонинов, холестерина, фосфолипидов, и белка. Обычно ИСКОМ'ы имеют симметрию икосаэдра, имея диаметр 30-40 нм и состоят из 12-нм кольцеобразных субъединиц. Встроенный с ИСКОМ'ом антиген вызывает усиление связанного с клетками иммунного ответа, усиление реакции гиперчувствительности замедленного типа и цитотоксический Т-лимфоцитный ответ при ограничении МНС класса I. Увеличенная экспрессия молекул МНС класса II также отмечается как первично, так и в обратной иммунизации ИСКОМ'ами. Экспериментальные ИСКОМ'овские вакцинные формы вызывают защитный иммунитет к большому числу микроорганизмов, в том числе и к вирусам, включая ретровирусы, паразиты и бактерии в различных видах животных, включая приматов. Использование ИСКОМ'ов как орального или интранасального иммунизационного вектора с естественными или рекомбинантными антигенами представляет новое направление в доставке антигенов, которое может увеличить индуцированный защитный иммунный ответ и может также иметь потенциальное прикладное значение на рынке вакцин для будущего использования в индустрии здоровья животных. ИСКОМ'ы являются стабильными частицами, построенными из сапонинов и липидов, организованных в мультимолекулярные структуры, которые содержат включенные антигены и, как было показано на бактериальных и вирусных моделях, дают увеличение иммунного ответа по различным транспортным маршрутам как на гуморальном, так и клеточном уровнях. Эти уникальные способности делали ИСКОМ'ы превосходными кандидатами для использования в птицеводстве вместе с антипаразитарными, анитивирусными и антибактериальными вакцинами.
ИСКОМ'ы представляют интересный подход к стимулированию гуморального и клеточного иммунного ответа к антипатическим антигенам. Это относительно стабильный, но нековалентносвязанный комплекс сапонинового адъюванта, холестерина и амфипатического антигена. Спектр вирусных капсульных антигенов и невирусных амфипатических антигенов, пригодных для вакцинации человека и встраиваемых в ИСКОМ'ы, включает грипп, корь, бешенство, gp340 из ЕВ-вируса, gpl20 из вируса ВИЧ, Plasmodium falciparum и Trypanosoma cruzi. Процедура приготовления ИСКОМ'ов включает солюбилизацию амфипатических белков в подходящих неионных детергентах, добавлении гликозида, холестерина и фосфатидилхолина. В присутствии амфипатических белков при удалении детергента образуются частицы ИСКОМ. Если в смеси нет белка или антигена, то образуется ИСКОМ'овский матрикс. Уникальными компонентами ИСКОМ'овского матрикса являются сапонины, обладающие аффинностью к холестерину, стабилизируя тем самым комплекс.
Несмотря на их сложность, ИСКОМ'ы относительно просты в приготовлении. В идеале ингредиенты используются в молярном соотношении 1:1:1:1 гликозида, холестерина, фосфатидилхолина и антигена. При использовании центрифуги три последних компонента помещаются на вершину 10-40% сахарозного градиента, содержащего 0.1% гликозид и нейтральный буфер с низкой ионной силой. Пробирка центрифугируется 4 часа при 150000 g, и ИСКОМ'ы скапливаются в зоне 19S примерно в середине градиента. Они последовательно отмываются рецентрифугированием в 20% сахарозе. Если для получения антигена используются детергенты с высокой критической концентрацией мицелл (т.е. когда выделяются белки вирусной оболочки), то тогда рекомендуется диализный метод для получения ИСКОМ'ов. По этому методу три реакционных компонента смешиваются с гликозидом таким образом, чтобы гликозид имел концентрацию 0.1%. Последующий 24-часовой диализ убирает детергент, образуются ИСКОМ'ы, а избыток гликозидов удаляют ультрацентрифугированием в 20% сахарозе. ИСКОМ'ы могут быть введены орально, интранозально или одновременно обоими путями. Оптимальные дозы должны быть определены для суспензии ИСКОМ'ов с конкретными антигенами.
Существует большое число обстоятельств, при которых иммунная система может быть поврежденной или работать неэффективно. Так, например, дефицит иммунной системы обычен для только что рожденных животных. Она также может быть подавлена определенными лекарствами, что может быть связано и их побочным действием, например при химиотерапии опухолей. Неупорядоченное функционирование одной или более составляющих частей иммунной системы, как это бывает при некоторых формах рака, также может приводить к иммунодефициту. Иммунодефицит может быть вызван вирусными инфекциям, включая ВИЧ. Домашние и сельскохозяйственные животные, например свиньи, при содержании на промышленных фермах могут иметь ослабленный иммунитет в результате тесного содержания животных и возникновением в связи с этим обстоятельством возбудителей различных болезней.
Следующий аспект настоящего изобретения раскрывает метод лечения пациентов или других млекопитающих с иммунодефицитом, который заключается во введении млекопитающему (включая человека) эффективных доз фрондозида А или физиологически приемлемых композиций на его основе, включая ИСКОМ или любую ИСКОМ-подобную композицию - это комбинации сапонина с холестерином без фосфолипида и антигена или только без антигена.
Под эффективным количеством понимается количество фрондозида А, которое будет восстанавливать или увеличивать иммунную функцию до нормального уровня, или увеличивать ее выше нормальной, чтобы избавиться от инфекции, бактериальной или вирусной патологии. Введение специфических доз таких иммуномодуляторов может быть определено квалифицированным специалистом в этой области, основываясь на данных, приведенных ниже.
Фрондозид А или физиологически приемлемые композиции на его основе могут быть введены для лечения или профилактики иммунодефицитных млекопитающих как сами по себе, так и в комбинации с другими терапевтическими агентами или противоопухолевыми агентами, например, с другими антивирусными агентами или антираковыми агентами.
Следующим аспектом настоящего изобретения является использование фрондозида А или физиологически приемлемых композиций на его основе, включая ИСКОМ'ы и любые ИСКОМ-подобные композиции для лечения или профилактики острых и хронических вирусных инфекций.
Примерами острых вирусных инфекций, против которых иммунотерапия фрондозидом А или физиологически приемлемыми композициями на его основе, включая ИСКОМ'ы и любые ИСКОМ-подобные композиции, может быть использована, преимущественно в комбинации с антивирусными агентами, которыми являются: вирусы герпеса, инфлуенцы, параинфлюенцы, аденовирусы, ротавирусы, вирусы гепатита А, вирус Алеутской болезни норок и хорьков, вирусы папилломы и энтеровирусы, аренавирусы, риновирусы, полиовирусы, вирус Нью-Кастлской болезни, вирусы бешенства, и, в общем, вирусные патогенезы, вызванные промышленным содержанием сельскохозяйственных животных.
Примерами хронических вирусных инфекций, против которых может быть использована терапия фрондозидом А или физиологически приемлемыми композициями на его основе, включая ИСКОМ'ы или ИСКОМ-подобные композиции, могут быть: персистентная герпесная вирусная инфекция, вирусная инфекция Эпштейна-Барра, инфекция вирусного гепатита и инфекция ВИЧ.
Настоящее изобретение применимо к лечению вирусных гепатитов во всех формах, пять из которых известны к настоящему времени: гепатиты А, В, С, D и Е соответственно.
Являясь ДНК-вирусами, эти вирусы герпесной группы являются источниками большинства обычных вирусных инфекций человека. Эта группа включает герпесный симплекс-вирус (HSV), варицелла зостер-вирус (VZV), цитомегаловирус (CMV); вирус Эпштейна-Барра (EBV) и вирус герпеса человека 6 (HHV6). HSV 1 и HSV 2 относятся к некоторым из наиболее обычных инфекционных агентов человека. Большинство из этих вирусов способны проникать в нервные клетки организма-хозяина; будучи единожды инфицированы, зараженные получают риск повторных клинических приступов инфекции, которые могут раздражать как психологически, так и физиологически.
Одна из групп РНК-вирусов имеет особую практическую важность, это ретровирусы. Ретровирусы образуют подгруппу РНК-вирусов, которая, чтобы реплицироваться, должна сначала обратно транскрибировать РНК их генома в ДНК (под "транскрипцией" условно описывают синтез РНК из ДНК). Будучи в форме ДНК вирусный геном может быть инкорпорирован в геном клетки-хозяина, позволяя ему принять участие в механизм транскрипции в клетке-хозяине с целью репликации. Будучи инкорпорированной, вирусная ДНК практически неотличима от ДНК клетки хозяина, и в этом состоянии вирус может сохраняться для жизни в клетке.
В случае иммуносупрессии в результате ВИЧ-инфекции профилактика может потребоваться тем пациентам, кто диагносцирован как серопозитивный по отношению к ВИЧ-инфекции, то есть имеет антитела к ВИЧ, и тем, у кого имеется прогрессирующая общая лимфоаденопатия (PGL) или ARC (СПИД-индуцированный комплекс), а также пациентам, страдающим от СПИДа, или пациентам, страдающим от СПИДоподобного иммунодефицита, где ВИЧ-инфекция не обнаруживаема, и кому требуется восстановление иммунитета, который не имеет специфичности к какому-либо конкретному вирусу.
Соединения или физиологически приемлемые композиции на их основе, включая ИСКОМ'ы или ИСКОМ-подобные композиции, могут быть применены как сами по себе, так и в комбинации с другими терапевтическими агентами для лечения вышеназванных инфекций или состояний. Комбинированная терапия, в соответствии с представляемым изобретением, состоит во введении фрондозида А или физиологически приемлемой композиции на его основе, включая ИСКОМ'ы или ИСКОМ-подобные композиции и, по крайней мере, одного иного фармакологически активного ингредиента. Эти активные ингредиенты и фармакологически активные агенты могут быть введены вместе или по отдельности и при введении отдельно могут быть введены последовательно или отдельно в любом порядке. Количества активного ингредиента (ингредиентов) и фармакологически активных агентов и относительные графики введения будут выбираться для того, чтобы достичь желаемого комбинированного терапевтического эффекта. Преимущественно комбинативная терапия включает введение одного фрондозида А или физиологически активного функционального производного на его основе, включая ИСКОМ'ы или ИСКОМ-подобные композицией одного из подходящих агентов.
Сообщалось, что по крайней мере 60% пациентов больных СПИДом страдают от пневмонии, вызванной вирусом Pneumocystis carinii (W.T.Huges, "Threatment and Prophylaxis of Pneumocystis carinii pneumoniae" Parasitology Today. 1987, 3, 332-335).
Без интенсивного лечения пневмония Pneumocystis carinii всегда смертельна для иммунодефицитных больных. Наиболее широко используемое лечение от этого состояния является лечение триметоприм-сульфаметаоксазолом (котримоксаолом) и пентамидином. Однако сообщается, что при обоих этих методах лечения имеется лишь примерно 50-70% эффективность относительно больных СПИДом, причем у более чем 50% больных наблюдаются вредные побочные эффекты от триматопорин-сульфаметоксазола или пентамидина (С.В. Wofsy, Antimicrobial Agents Annual. 1986, 1, 377-400).
Таким образом, существует потребность в новых агентах, особенно для профилактики пневмонии P. carinii.
Другим аспектом настоящего изобретения является применение фрондозида А или физиологически приемлемых композиций на его основе, включая ИСКОМ'ы или ИСКОМ-подобные композиции, для лечения и профилактики пневмонии Pneumocystis carinii у млекопитающих, включая человека.
Следующий аспект настоящего изобретения обеспечивает использование фрондозида А и физиологически приемлемых композиций на его основе, включая ИСКОМ'ы или ИСКОМ-подобные композиции, для лечения состояний, вызванных относительным или абсолютным дефицитом Т-клеток, таких как синдром ДиДжорджа, грибковые инфекции, микоплазменные инфекции, туберкулез, проказа и волчанка.
Следующий аспект настоящего изобретения обеспечивает использование фрондозида А или физиологически приемлемой композиции на его основе, включая ИСКОМ'ы или ИСКОМ-подобные композиции, как вакцинного адъюванта. Вакцина может быть, следовательно, приготовлена из антигенного компонента с фрондозидом А.
Фрондозид А может быть введен млекопитающему перорально, парентерально (включая подкожное, кожное, внутримышечное и внутривенное введение), ректально и ингаляцией. Эффективная доза соединения будет зависеть от большого числа факторов, включая особенности пациента, тип иммунодефицита, различные условия, связанные с методом лечения и путем введения.
Для каждой вышеприведенной ситуации такая эффективная доза будет, в общем, колебаться в пределах от 1 до 20 мкг/кг веса человека или млекопитающего в день, предпочтительно в диапазоне от 1 до 15 мкг/кг веса тела в день и наиболее предпочтительно в диапазоне от 8 до 11 мкг/кг веса тела в день; оптимальной дозой является 10 мкг/кг веса тела в день. Вышеприведенные дозы при применении человеком оптимально должны повторно вводиться каждые 10 дней для эффективного стимулирования иммунной системы.
Несмотря на то, что возможно использование фрондозида А при введении его как индивидуального химического вещества, предпочтительнее использовать его в какой-либо лекарственной форме. Формы настоящего изобретения включают в себя фрондозид А, как это приведено выше, вместе с одним или более приемлемыми носителями и, оптимально, с другими терапевтическими ингредиентами. Носитель (носители) должны быть «приемлемы» в смысле быть совместимыми с другими ингредиентами и не отторгать реципиента от них.
Эти формы включают в себя те, которые подходят для перорального, парентерального (включая подкожное, кожное и внутримышечное), внутрилегочного и ректального введения, хотя наиболее подходящий путь будет зависеть, например, от состояния реципиента. Формы могут условно быть представлены в единицах дозирования, таких как капсулы, облатки или таблетки, могут быть приготовлены каким-либо методом, хорошо известным фармакологам. Все методы включают стадию внесения в смесь фрондозида А (действующее начало) с носителем, который состоит из одного или более вспомогательных ингредиентов. В общем, формы готовятся однородными и с первоначально привнесенным в смесь активным ингредиентом с жидкими носителями или отдельно твердыми носителями и активными ингредиентами, а затем, если необходимо, производится преобразование продукта в желае