Рекомбинантная плазмида pt7 pcka::loxpcat обеспечивающая синтез l-треонина в клетках escherichia coli, и рекомбинантный штамм escherichia coli ftr2717 (kccm-10475) - продуцент l-треонина
Иллюстрации
Показать всеИзобретение относится к биотехнологии, в частности генетической инженернии. Сконструирована рекомбинантная плазмида pTΔpckA::loxpcat путем клонирования неполного pckA-гена в рТ7Blue-вектор. Плазмида содержит фрагмент pckA-гена, который включает в себя устойчивый к хлорамфениколу ген и loxP-сайты. Путем трансформации клеток Е.coli плазмидной ДНК pT7ΔpckA::loxpcat получен штамм Е.coli FTR2717 - продуцент L-треонина. Изобретение позволяет существенно повысить выход L-треонина в присутствии высоких концентраций глюкозы. 2 н.з.п. ф-лы, 3 ил., 2 табл.
Реферат
Сущность изобретения
Область техники, к которой относится изобретение
Настоящее изобретение относится к микроорганизму, который продуцирует L-треонин, и к способу получения L-треонина с использованием данного микроорганизма. В частности, настоящее изобретение относится к микроорганизму, который содержит в хромосоме инактивированные гены tdcBC и pckA и существенно улучшает продуктивность L-треонина, что обусловлено инактивацией этих двух генов, а также к способу получения L-треонина с использованием такого микроорганизма.
Описание предшествующего уровня техники
Известно, что L-треонин является незаменимой аминокислотой, которую широко используют в качестве фуражной, кормовой добавки и стимулятора роста животного, а также в качестве компонента в лекарственных водных растворах и дополнительного сырья в медицинских продуктах. В настоящее время в развитых странах L-треонин производят всего пять компаний, в том числе Ajinomoto Company в Японии, и L-треонин в два-три раза дороже лизина, о котором известно, что его высокая ценность на международном рынке обусловлена его высокой ценой, 5000-6000 долларов за тонну. Поэтому для производства L-треонина существует возможность быстрого роста на мировом рынке.
В настоящее время L-треонин получают лишь с помощью методов микробиологической ферментации, в основном используя мутанты, полученные из микроорганизмов дикого типа, включая Escherichia coli, представителей рода Corynebacterium, представителей родаBrevibacterium,представителей рода Serratia и представителей рода Providencia. Примеры таких мутантов включают в себя мутантов, обладающих резистентностью к аминокислотным аналогам или лекарственным средствам, и их ауксотрофов по диаминопимелиновой кислоте, метионину, лизину и изолейцину (Японская патентная публикация № Heisei 2-219582; Корейская патентная публикация № 1998-32951; Appl. Microbiol. Biotechnol., 29:550-553, 1988). Вместе с тем такие мутантные штаммы из-за их ауксотрофных свойств в отношении диаминопимелиновой кислоты или изолейцина убыточны в том плане, что обладают низкой продуктивностью L-треонина и растут только в среде, в которую добавлены дорогостоящие диаминопимелиновая кислота или изолейцин. Иными словами, при использовании мутанта, нуждающегося для своего роста в диаминопимелиновой кислоте, данное ферментативное производство L-треонина требует высоких издержек. В случае использования ауксотрофа по изолейцину ферментационная среда для данного ауксотрофа также должна содержать добавку дорогостоящего изолейцина, что ведет к возрастанию издержек при производстве L-треонина.
Указанные проблемы можно преодолеть путем использования leaky-мутанта по изолейцину, который описан в Корейской патентной публикации № 92-8365, исключающего присутствие в среде изолейцина и продуцирующего большие количества L-треонина по сравнению с известными штаммами. Однако данный классический мутационный способ для селекции новых бактериальных штаммов, способных продуцировать большие количества L-треонина, все же является трудоемким и неэффективным и его самый большой недостаток состоит в том, что он лишь ограниченно улучшает продуктивность L-треонина.
В связи с этим вместо использования данных ауксотрофов с помощью методов метаболической инженерии разработаны другие способы для массового производства L-треонина, в которых используют рекомбинантные микроорганизмы, продуцирующие L-треонин, и которые обладают повышенной активностью ферментов, участвующих в биосинтезе L-треонина. А именно, применяя методы генетической рекомбинации, выделяют гены, соответствующие ферментам, участвующим в метаболизме L-треонина, клонируют выделенные гены в надлежащие генные носители и встраивают их в микробные мутанты для улучшения продуктивности L-треонина в данных мутантах.
Авторы настоящего изобретения ранее разработали способ создания штамма, продуцирующего L-треонин, с использованием таких методов метаболической инженерии, который раскрыт в Корейской патентной заявке № 2001-6976. Подробно, высокого выхода L-треонина можно достичь путем использования рекомбинантного микроорганизма, который обладает одной или несколькими хромосомными копиями гена, кодирующего фосфоенолпируваткарбоксилазу (в дальнейшем именуемую просто "ppc"), которая катализирует образование оксалацетата (ОАА) в качестве предшественника в биосинтезе L-треонина из фосфоенолпирувата (PEP), а также содержит оперон, содержащий гены, кодирующие три фермента, участвующих в биосинтезе L-треонина из аспартата, аспартокиназа 1-гомосериндегидрогеназы (thrA), гомосеринкиназы (thrB) и треонинсинтазы (thrC).
L-треонин синтезируется из аспартата многоступенчатым путем, в котором аспартат образуется из ОАА, преобразуемого в PPC из PEP. Биосинтез L-треонина ингибируется при наличии в среде глюкозы в относительно высокой концентрации по сравнению с темпом бактериального роста и суммарной скоростью цикла трикарбоновых кислот. В данной ситуации экспрессия ppc-гена супрессируется, а экспрессия гена, кодирующего PEP-карбоксикиназу (в дальнейшем именуемую просто "pckA"), катализирующую преобразование ОАА в PEP, повышается. Повышенные уровни pckA приводят к образованию в качестве предшественника биосинтеза аминокислоты PEP из ОАА, где из данного PEP синтезируются другие побочные продукты (Goldie H. Medina V., Mol. Gen. Genet., 220(2):191-196, 1990; Dang et al., E. coli and Salmonella, 1:191-102, 1996). По этой причине pckA-ген необходимо существенно инактивировать с целью получения большого количества L-треонина путем увеличения интенсивности метаболических путей, ответственных за синтез L-треонина.
С другой стороны, известно несколько путей деградации L-треонина, которые включают в себя следующие три пути. Первый включает в себя путь, инициируемый треониндегидрогеназой, производящий α-амино-β-кетобутират. Полученный α-амино-β-кетобутират преобразуется в ацетил-КоА и глицин или же спонтанно распадается до аминоацетона, который преобразуется в пируват. Второй путь связан с треониндегидратазой, производящей α-кетобутират, который в последующем катаболизируется до пропионил-КоА и, в конечном счете, до промежуточного соединения цикла трикарбоновых кислот - сукцинил-КоА. Третий путь использует треонинальдолазу (Neidhardt F.C. et al. Escherichia coli and Salmonella: cellular and molecular biology, 2nd ed. ASM press. Washington DC, pp.369-370). Из них треониндегидратаза представляет собой оперон, который экспрессируется при гипоксии и высоком уровне треонина.
В настоящем изобретении с помощью метода генетической рекомбинации (Корейская патентная заявка № 2002-015380) создан микроорганизм с улучшенной продуктивностью L-треонина в результате специфической инактивации данного гена-оперона (tdcBC).
С другой стороны, в Международной патентной публикации № WO 02/29080 A2 раскрыт способ получения L-треонина с использованием дефектного по pckA-гену микроорганизма, который получают путем введения в штамм микроорганизма дикого типа рекомбинантного вектора, несущего частично делетированный pckA-ген. Однако при использовании указанного микроорганизма остается открытым вопрос об образовании L-треонина, так как пути деградации и внутриклеточного поступления синтезируемого L-треонина все еще активированы в данном микроорганизме.
При осуществлении настоящего изобретения его авторы с целью решения проблем, имеющихся в прототипе, выполнили интенсивное и основательное исследование способов получения микроорганизмов, способных продуцировать большое количество L-треонина даже при их выращивании в среде с высокой концентрацией глюкозы и без деградации производимого L-треонина, и установили, что когда хромосомный pckA-ген данного микроорганизма инактивируется с помощью метода генетической рекомбинации, то микроорганизм с разрушенным tdcBC-опероном, созданный авторами настоящего изобретения, обладает повышенной продуктивностью L-треонина по сравнению с традиционно используемыми микроорганизмами, продуцирующими L-треонин.
По этой причине цель настоящего изобретения заключается в создании микроорганизма, способного эффективно продуцировать большое количество L-треонина.
Краткое изложение сущности изобретения
Для того чтобы осуществить вышеуказанную цель, в настоящем изобретении создали новый штамм E. coli, который содержит в хромосоме инактивированные гены tdcBC и pckA.
У штамма E. coli с инактивированными tdcBC/pckA-генами pckA-ген инактивируют путем введения фрагмента чужеродного pckA-гена, содержащего ген устойчивости к антибиотику и сайт связывания сайт-специфической рекомбиназы на каждом из его концов, в штамм E. coli, содержащий оперон tdcBC, ассоциированный с деградацией L-треонина, который инактивируется, а затем проводили гомологическую рекомбинацию между фрагментом чужеродного pckA-гена и pckA-геном хромосомы для инактивации данного хромосомного pckA-гена.
Кроме того, в настоящем изобретении разработан способ получения L-треонина с использованием штамма E. coli с инактивированным tdcBC/pckA-геном.
Краткое описание чертежей
Вышеуказанные и иные цели, характеристики и другие преимущества настоящего изобретения станут более понятными из нижеследующего подробного описания вместе с иллюстрируемыми чертежами, в которых
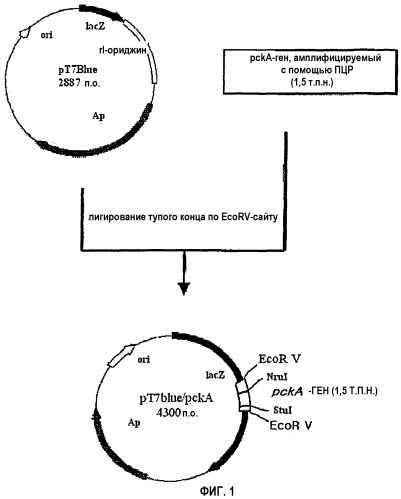
на фиг.1 схематически изображена технология клонирования pckA-гена;
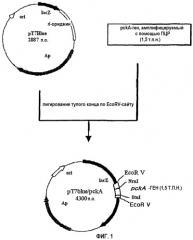
на фиг.2 схематически изображена технология получения рекомбинантного микроорганизма, в который введен фрагмент pckA-гена, содержащий ген устойчивости к хлорамфениколу (cat) и loxP-сайты, ΔpckA::loxpcat; и
на фиг.3 представлена фотография, изображающая результаты Саузерн-блоттинга, в котором идентифицирован ген устойчивости к хлорамфениколу (cat), встроенный в pckA-ген хромосомы штамма E. coli, продуцирующего L-треонин (дорожка 1: рекомбинантный штамм, отобранный в присутствии хлорамфеникола в соответствии с настоящим изобретением; дорожка 2: родительский штамм TRN212 и дорожка 3: маркер молекулярных масс).
Подробное описание изобретения
Штамм E. coli, который содержит ассоциированный с деградацией L-треонина оперон, специфически инактивируемый с помощью генетической рекомбинации и обладающий повышенной продуктивностью L-треонина вследствие инактивации данного оперона, можно использовать в качестве родительского штамма в настоящем изобретении. Предпочтительный родительский штамм представляет собой штамм E. coli TRN212 (инвентарный номер: KCCM-10353; Корейская патентная заявка № 2002-015380), который создан в настоящем изобретении.
Настоящее изобретение характеризуется получением нового штамма E. coli, продуцирующего большое количество и высокий выход L-треонина в результате инактивирования pckA-гена, вовлеченного в ингибирование синтеза L-треонина в родительском штамме E. coli, содержащем ассоциированный с деградацией L-треонина инактивированный оперон (tdcBC). Инактивация обоих генов, tdcBC и pckA, ведет к предотвращению деградации и внутриклеточного поступления L-треонина, опосредуемого продуктами трансляции tdcBC-оперона, и ингибированию синтеза L-треонина, опосредуемого трансляционным продуктом pckA-гена, и приводит к получению большого количества L-треонина.
Следовательно, в настоящем изобретении создан штамм E. coli с инактивированным геном tdcBC/pckA, который получают путем введения фрагмента чужеродного pckA-гена, включающего в себя ген устойчивости к антибиотику, имеющий сайт связывания сайт-специфической рекомбиназы на каждом из его концов в штамме E. coli, содержащем ассоциированный с деградацией L-треонина оперон tdcBC, который инактивирован, а затем предусматривая гомологическую рекомбинацию между фрагментом чужеродного и содержащегося в хромосоме pckA-гена для инактивации хромосомного pckA-гена.
Кроме того, pckA-ген на хромосоме родительского штамма E. coli инактивируют при удалении встроенного в хромосомный pckA-ген гена устойчивости к антибиотику путем активации сайт-специфической рекомбиназы, экспрессируемой в данном бактериальном штамме, и наличия одной копии связывающего сайта сайт-специфической рекомбиназы в хромосомном pckA-гене.
Инактивирование pckA-гена бактериальной хромосомы осуществляют путем гомологической рекомбинации с фрагментом чужеродного pckA-гена. Фрагмент чужеродного pckA-гена инактивируют путем встраивания в него гена устойчивости к антибиотику. Этот инактивированный фрагмент чужеродного pckA-гена вводят в родительский штамм E. coli, после чего происходит двойная перекрестная рекомбинация между pckA-геном бактериальной хромосомы и фрагментом чужеродного pckA-гена для инактивирования pckA-гена бактериальной хромосомы. Присутствие гена устойчивости к антибиотику в чужеродном инактивируемом pckA-гене облегчает селекцию клеток с инактивируемым pckA-геном.
Неограничивающие примеры гена устойчивости к антибиотику, используемого для инактивации pckA-гена, включают в себя ген устойчивости к хлорамфениколу, ген устойчивости к канамицину, ген устойчивости к гентамицину и ген устойчивости к ампициллину.
С другой стороны, после селекции штамма E. coli с инактивируемым pckA-геном дают возможность экспрессироваться сайт-специфической рекомбиназе для удаления устойчивого к антибиотику гена, встроенного в бактериальную хромосому. То есть ген устойчивости к данному антибиотику встраивают в pckA-ген бактериальной хромосомы вместе со связывающими сайтами сайт-специфической рекомбиназы и удаляют путем активации сайт-специфической рекомбиназы, экспрессируемой в бактериальном штамме. Примеры такой сайт-специфической рекомбиназы включают в себя, без ограничения, сайты связывания FLP, Cre и XerC/D. Удаление гена устойчивости к данному антибиотику позволяет вновь использовать тот же ген устойчивости к данному антибиотику в качестве селективного маркера, если необходимо инактивировать другой ген идентичного бактериального штамма.
Для того чтобы инактивировать хромосомный pckA-ген, в настоящем изобретении используют фрагмент, содержащий ген устойчивости к хлорамфениколу, каждый конец которого присоединен к loxP-сайту. Этот loxP-сайт распознается сайт-специфической рекомбиназой Cre. В результате активизации рекомбиназы Cre, экспрессируемой в штамме E. coli, ген устойчивости к антибиотику, расположенный между двумя loxP-сайтами, удаляется из бактериальной хромосомы.
Экспрессию рекомбиназы Cre в штамме E. coli можно осуществить известным в данной области техники способом. В настоящем изобретении плазмиду pJW168, несущую cre-ген, встраивают в штамм E. coli для экспрессии в нем Cre-фермента.
В одном из вариантов осуществления настоящего изобретения неполный pckA-ген амплифицируют с помощью ПЦР, используя в качестве матрицы геномную ДНК, выделенную из продуцирующего L-треонин штамма E. coli, включающего в себя инактивированный tdcBC-оперон. Амплифицированный неполный pckA-ген клонируют в pT7Blue-вектор (Novagen Co.), получая таким образом рекомбинантный вектор pT7Blue/pckA, содержащий неполный pckA-ген. Кроме того, из ploxpcat2-плазмиды (Betriz Palmeros et al., Gene, 247:255-264, 2000) получают ДНК-фрагмент loxpcat2, содержащий ген устойчивости к хлорамфениколу и loxP-сайты и лигируют с NruI-обработанной pT7Blue/pckA, создавая таким образом рекомбинантную плазмиду pT7ΔpckA::loxpcat, содержащую фрагмент pckA-гена, включающий в себя ген устойчивости к хлорамфениколу и loxP-сайты. Следовательно, в настоящем изобретении создают, как показано выше, рекомбинантную плазмиду pT7ΔpckA::loxpcat.
В другом варианте осуществления настоящего изобретения фрагмент pckA-гена, содержащий ген устойчивости к хлорамфениколу, каждый конец которого присоединен к loxP-сайту, встраивают в штамм E. coli TRN212, содержащий tdcBC-оперон, который инактивируют путем гомологической рекомбинации с использованием устойчивого к канамицину гена, имеющего на каждом из двух его концов loxP-сайт. Затем осуществляют гомологическую рекомбинацию между pckA-геном бактериальной хромосомы и фрагментом чужеродного pckA-гена, содержащего ген устойчивости к хлорамфениколу и loxP-сайты, создавая таким образом рекомбинантный штамм E. coli, содержащий tdcBC-ген и инактивированный pckA-ген хромосомы. Указанный рекомбинантный штамм E. coli был обозначен "FTR2717" и депонирован в Корейском Центре Культур Микроорганизмов (KCCM) 20 марта 2003 г. под инвентарным номером KCCM-10475.
Рекомбинантный штамм E. coli FTR2717 обнаруживает следующие характеристики:
(1) по сравнению со штаммом дикого типа он обладает устойчивостью к аналогам треонина, аналогам лизина, аналогам изолейцина и аналогам метионина;
(2) его хромосома содержит эндогенный ppc-ген и эндогенный треониновый оперон, содержащий гены thrA, thrB и thrC, а также одну или несколько копий экзогенного ppc-гена и экзогенные гены thrA, thrB и thrC;
(3) он включает в себя инактивированный ген-оперон tdcBC, участвующий в деградации L-треонина; и
(4) он включает в себя инактивированный pckA-ген, вовлеченный в ингибирование синтеза L-треонина, и поэтому он производит большое количество L-треонина при высокой концентрации глюкозы в среде.
Лучшего понимания настоящего изобретения можно добиться с помощью нижеследующих примеров, которые представлены для иллюстрации и не должны рассматриваться в качестве ограничения настоящего изобретения.
ПРИМЕР 1: Клонирование pckA-гена
Получен рекомбинантный вектор, несущий pckA-ген (см. фиг.1). Вначале из штамма E. coli TRN212 (инвентарный номер: KCCM-10353), включающего в себя tdcBC-оперон и продуцирующего L-треонин (QIAGEN Co.), выделяют с использованием QIAGEN Genomic-tip system бактериальную геномную ДНК. Используя выделенную геномную ДНК в качестве матрицы, осуществляют ПЦР для амплификации неполной, около 1,5 т.п.н., области pckA-гена. В данной ПЦР используют набор праймеров, состоящий из прямого и обратного праймера, представленных соответственно в SEQ ID NO: 1 и 2. Условия ПЦР включают 30 циклов денатурации при 94°C в течение 30 сек, отжига при 55°C в течение 30 сек и удлинения при 72°C в течение 1 мин 30 сек.
Полученные продукты ПЦР подвергают электрофорезу в 0,8% агарозном геле, после чего из геля вырезают полосу в 1,5 т.п.н. Из этой вырезанной полосы путем очистки выделяют 1,5 т.п.н. ДНК-фрагмент с использованием набора DNA Gel Purification Kit (QIAGEN Co.) и клонируют его в EcoRV-обработанный pT7Blue-вектор (Novagen Co.) путем лигирования по тупым концам при 16°C, создавая таким образом рекомбинантный вектор pT7Blue/pckA, содержащий неполный pckA-ген. Затем c помощью вектора pT7Blue/pckA штамм E. coli NM522 трансформируют и наносят мазком на твердую среду (LB: 1% NaCl, 1% триптона, 0,5% дрожжевого экстракта), содержащую ампициллин (100 мг/л), с последующей инкубацией в течение ночи при 37°C. Выращенные на твердой среде колонии инокулируют в 3 мл жидкой среды, содержащей ампициллин, с последующей инкубацией в течение ночи при 37°C. С использованием набора QIAGEN mini prep kit (QIAGEN Co.) из культивированных бактерий выделяют плазмидную ДНК и исследуют ее размер. Кроме того, ориентацию pckA-гена определяют с помощью Nrul и Stulрестрикционного картирования. После этого плазмидную ДНК обрабатывают рестриктазой Nrul и подвергают электрофорезу в 0,7% агарозном геле. Из этого геля вырезают полосу размером около 4,3 т.п.н., и из вырезанной полосы путем очистки выделяют фрагмент 4,3 т.п.н.
ПРИМЕР 2: Конструирование рекомбинантного вектора, несущего инактивируемый pckA-ген, и получение штамма E. coli с инактивированным pckA-геном.
2-1) Конструирование рекомбинантного вектора, несущего инактивируемый pckA-ген.
1,2 т.п.н. loxpcat-фрагмент, который содержит устойчивый к хлорамфениколу ген, имеющий loxP-сайт на каждом конце, получают путем обработки рестриктазой HincII плазмиды ploxpcat2 (плазмиды, несущей устойчивый к хлорамфениколу ген, имеющий на своих концах loxP-сайты; Beatriz Palmeros et al., Gene, 247:255-264, 2000, Professor G. Gosset, University of Mexico). Полученный ДНК-фрагмент в 1,2 т.п.н. лигируют с Nrul-обработанной pT7Blue/pckA, полученной в примере 1 путем лигирования по тупым концам, создавая таким образом рекомбинантный вектор pT7ΔpckA::loxpcat длиной почти в 5,7 т.п.н. и содержащий инактивированный pckA-ген (см. фиг.2).
2-2) Получение штамма E. coli с инактивированным pckA-геном.
Рекомбинантный вектор pT7ΔpckA::loxpcat, полученный в примере 2-1), встраивают в штамм E. coli NM522. Данный трансформированный штамм NM522 наносят мазком на твердую среду (LB: 1% NaCl, 1% триптона, 0,5% дрожжевого экстракта), содержащую ампициллин и хлорамфеникол, с последующей инкубацией в течение ночи при 37°C. Выращенные на данной среде колонии инокулируют в 3 мл жидкой среды, содержащей ампициллин и хлорамфеникол, с последующей инкубацией в течение ночи при 37°C. Из данной бактериальной культуры с использованием набора QIAGEN mini prep kit выделяют плазмидную ДНК и исследуют ее размер, а также ориентацию встроенного pckA-гена. После этого плазмидную ДНК подвергают двойной обработке с помощью PstI и KpnI и электрофорезу в 0,7% агарозном геле. Из геля вырезают полосу в 2,7 т.п.н. и из этой полосы путем очистки выделяют фрагмент размером 2,7 т.п.н.(ΔpckA::loxpcat).
Полученный фрагмент pckA-гена, ΔpckA::loxpcat, содержащий устойчивый к хлорамфениколу ген, имеющий на своих концах loxP-сайты, встраивают путем электропорации в продуцирующий L-треонин штамм E. coli TRN212 (инвентарный номер: KCCM-10353). Затем трансформированный штамм TRN212 наносят мазком на твердую среду, содержащую хлорамфеникол, чтобы отобрать только устойчивые к хлорамфениколу клетки, получая в результате селекции клетки, в которых хромосомный pckA-ген замещен фрагментом чужеродного pckA-гена (ΔpckA::loxpcat). С помощью Саузерн-блот-анализа в соответствии с таким же способом, что и в нижеприведенном экспериментальном примере 1, определяют, действительно ли в отобранных клонах специфически разрушен хромосомный pckA-ген.
Отобранные клоны, идентифицированные с помощью Саузерн-блот-анализа на наличие специфически разрушенного в хромосоме pckA-гена, трансформируют pJW168-плазмидой (подарок от Prof. Guillermo Gosset из Университета в Мехико), которая содержит cre-ген, кодирующий сайт-специфическую рекомбиназу, распознающую loxP-сайты. Эти трансформированные клетки культивируют в течение ночи в культуральной среде, содержащей 10 мМ L-арабинозы, для удаления устойчивого к хлорамфениколу гена, встроенного в искомую бактериальную хромосому. Затем культуральную жидкость 107-кратно разбавляют и наносят мазком на твердую среду LB с добавлением ампициллина (100 мг/л) с последующей инкубацией в течение ночи при 30°C. Каждую из 100 колоний, выращенных на твердой среде, инокулируют в две 3 мл порции жидкой среды LB, содержащей или не содержащей ампициллин, с последующей инкубацией в течение ночи при 30°C. Определяют колонии, которые погибли в среде, содержащей хлорамфеникол, но выжили в среде, не содержащей хлорамфеникола. При проведении такой селекции отбирают лишь те клоны, которые имеют делецию по устойчивому к хлорамфениколу гену.
ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 1: Оценка разрушения в хромосоме pckA-гена с помощью Саузерн-блоттинга.
Штамм TRN212 в качестве родительского штамма и один из хлорамфеникол-устойчивых клонов, отобранных в примере 2-2), культивируют в течение ночи в 3 мл жидкой среды, содержащей хлорамфеникол (15 мг/л). Затем с использованием набора QIAGEN genomic kit 20 из культуры клеток выделяют геномную ДНК и обрабатывают ее в течение ночи с помощью EcoRV. Полученные в результате ДНК-фрагменты разделяют по их размеру в 0,7% агарозном геле. После электрофореза разделенные ДНК-фрагменты переносят на найлоновую мембрану (Biodyne B membrane, Young Sci.) в течение ночи путем капиллярного переноса (Molecular Cloning, Vol. 1, pp.6.31-6.38). Мембрану высушивают и затем экспонируют в УФ-свете (120 mJ/cm2 SpectroLinker™) для иммобилизации ДНК-фрагментов в данной мембране (Molecular Cloning, Vol. 1, pp.6.45). Полученную мембрану инкубируют в прегибридизационном растворе I (Roche #1093657) при 55°C в течение 2 ч и гибридизуют с денатурированным ДНК-зондом в термостате для гибридизации (BAMBINO 230300) при 55°C.
ДНК-зонд готовят следующим образом. Вначале, с использованием набора QIAGEN, выделяют плазмиду ploxpcat2 и обрабатывают ее с помощью HincII для получения ДНК-фрагмента (около 1,2 т.п.н.), содержащего устойчивый к хлорамфениколу ген, имеющий loxP-сайт на каждом из обоих концов. Выделенный 1,2 т.п.н. фрагмент кипятят в воде в течение 5 мин и быстро охлаждают на льду, получая таким образом одноцепочечную ДНК. Полученную одноцепочечную ДНК метят DIG-UDP, используя набор DIG Labeling and Detection Kit (Roche #1093657), путем инкубации в течение ночи при 37°C.
После гибридизации мембрану отмывают с помощью отмывочных растворов I и II (Roche #1093657) для удаления неспецифически связавшихся ДНК-молекул. Эту отмытую мембрану инкубируют в прегибридизационном растворе II (Roche #1093657) при комнатной температуре в течение 30 мин, а затем при комнатной температуре в течение 30 мин подвергают взаимодействию с анти-DIG-антителом, специфически связывающимся с DIG-UTP. Мембрану отмывают с помощью отмывочного раствора III (Roche #1093657) для удаления неспецифически связавшихся анти-DIG-антител и с помощью набора Labeling and Detection Kit (Roche #1093657)проявляют при комнатной температуре до появления видимых полос. Полученные результаты представлены на фиг.3.
Как показано на фиг.3, в случае родительского штамма TRN212 полоса не детектируется (дорожка 2), поскольку штамм TRN212 не содержит устойчивого к хлорамфениколу гена. Напротив, хлорамфениколустойчивый клон, отобранный в соответствии с настоящим изобретением, обнаруживает полосу около 3,6 т.п.н. (дорожка 1). Полученные результаты свидетельствуют о том, что соответствующие селективные клоны содержат на своей хромосоме устойчивый к хлорамфениколу ген.
ПРИМЕР 3: Сравнение селективных клонов, продуцирующих L-треонин, при их культивировании в колбах Эрленмейера.
Среди окончательно отобранных рекомбинантных клонов E. coli из примера 2-2), в которых был удален встроенный устойчивый к хлорамфениколу ген, тридцать клонов оказались продуктивными в отношении L-треонина. Каждый из них культивируют в колбе Эрленмейера, содержащей культуральную среду, приготовленную в соответствии с составом, представленным ниже в таблице 1. Затем для каждой культуральной жидкости определяют выход L-треонина. Вкратце, после выращивания на твердой LB-среде при 32°C каждого из тридцати клонов одиночную колонию каждого клона инокулируют одной петлей в 25 мл указанной культуральной среды и культивируют при 32°C и 250 об/мин в течение 48 ч. После центрифугирования каждой культуральной жидкости полученный супернатант разбавляют дистиллированной водой в 250 раз. Концентрацию L-треонина в таком разбавленном супернатанте измеряют с помощью ВЭЖХ. Полученные результаты представлены ниже в таблице 2.
| ТАБЛИЦА 1 | |
| Питательные вещества | Количество на 1 л |
| Глюкоза | 70 г |
| Сульфат аммония | 28 г |
| KH2PO4 | 1,0 г |
| MgSO4·7H2O | 0,5 г |
| FeSO4·7H2O | 5 мг |
| MnSO4·8H2O | 5 мг |
| Карбонат кальция | 30 г |
| L-метионин | 0,15 г |
| Дрожжевой экстракт | 2 г |
| рН (7,0) |
| ТАБЛИЦА 2 | ||||
| Число клонов | 2 | 5 | 14 | 9 |
| Выход L-треонина (г/л) | 20-23 | 23-24,5 | 24,5-26 | >26 |
В родительском штамме TRN212 выход L-треонина составляет 23 г/л. Как показано в таблице 2, из тридцати протестированных клонов двадцать восемь обнаруживают лучшую продуктивность по L-треонину, чем родительский штамм TRN212. В частности, девять клонов демонстрируют выход L-треонина, превышающий 26 г/л, что примерно на 13,04% выше, чем выход в родительском штамме TRN212. Из тридцати клонов был отобран один клон с наивысшим выходом L-треонина (более 26 г/л) и обозначен как "FTR2717 (инвентарный номер: KCCM-10475)".
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Как указано выше, в настоящем изобретении создан микроорганизм с инактивированным pckA-геном, который получают путем встраивания устойчивого к антибиотику гена в хромосомную ДНК родительского штамма E. coli, продуцирующего высокие уровни L-треонина, а именно штамма E. coli, содержащего участвующий в деградации L-треонина tdcBC-оперон, который инактивируется при осуществлении процедуры рекомбинации ДНК.
Так как собственный хромосомный tdcBC-оперон инактивируется, данный микроорганизм в соответствии с настоящим изобретением обладает действием, предотвращающим деградацию и внутриклеточное поступление L-треонина. Кроме того, вследствие инактивации pckA-гена, участвующего в ингибировании синтеза L-треонина, микроорганизм согласно изобретению обладает более действенными путями биосинтеза L-треонина. По этой причине микроорганизм согласно изобретению пригоден для массового производства L-треонина, так как он может в большом количестве и с высоким выходом производить L-треонин даже в присутствии высоких концентраций глюкозы.
1. Рекомбинантная плазмида pT7ΔpckA::loxpcat, обеспечивающая синтез L-треонина в клетках Escherichia coli и содержащая фрагмент pckA-гена, который включает в себя устойчивый к хлорамфениколу ген и loxP-сайты, которая получена путем клонирования неполного pckA-гена в рТ7Blue-вектор с образованием рТ7Blue/pckA-плазмиды, обработки ее NruI и лигирования с loxpcat-ДНК-фрагментом, полученным из plохрсat2-плазмиды и содержащим устойчивый к хлорамфениколу ген и loxpcat2-сайты.
2. Штамм Escherichia coli FTR2717 (КССМ-10475) - продуцент L-треонина, трансформированный рекомбинантной плазмидой по п.1.