Способ очистки бактериального цитолизина
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой способ очистки бактериального цитолизина, такого как пневмококковый пневмолизин. Данный способ включает выращивание культуры клеток, экспрессирующих бактериальный цитолизин, приготовление экстракта из культуры, содержащей бактериальный цитолизин, связывание растворимого агрегированного бактериального цитолизина, содержащегося в экстракте, с гидрофобным хроматографическим сорбентом в присутствии детергента в условиях высокой концентрации соли и элюции бактериального цитолизина в присутствии детергента в условиях низкой концентрации соли. Одностадийная хроматография позволят более эффективно и просто очищать цитолизин посредством связывания растворимого агрегированного цитолизина с гидрофобным хроматографическим сорбентом в присутствии детергента и высокой концентрации соли. 40 з.п. ф-лы, 5 ил., 2 табл.
Реферат
Область применения
Настоящее изобретение относится к области очистки бактериальных цитолизинов и, в частности, к способу очистки пневмолизина. Пневмолизин представляет собой белок из Streptococcus pneumoniae, обладающий хорошими антигенными свойствами, который является подходящим компонентом вакцины против инфекции, вызываемой S. pneumoniae, или среднего отита. Способ по изобретению включает нестандартную и эффективную стадию очистки пневмолизина в одну хроматографическую стадию посредством его связывания с гидрофобной колонкой в присутствии детергента и высокой концентрации соли. В этом способе преимущественно используют такое свойство бактериальных цитолизинов, как их высокое сродство к ароматическим соединениям, подобным холестерину, в частности, в агрегированном состоянии, и поэтому этот способ будет широко применяться для очистки членов данного семейства токсинов.
Тиол-активированные цитолизины образуют известную группу бактериальных токсинов, наиболее известным из которых является стрептолизин О (BiHington et al., FEMS Microbiol. Lett. (2000), 182; 197-205). Эти токсины оказывают литическое действие на эукариотические клетки посредством образования пор в клеточной мембране. Окисляющие агенты отрицательно влияют на их цитолитическую активность, тогда как восстанавливающие агенты могут восстанавливать эту активность. Члены этой группы имеют 30-60% сходства в первичной аминокислотной последовательности и содержат почти константную ундекапептидную последовательность вблизи С-конца. Холестерин представляет собой главный рецептор в клетках-мишенях для этих токсинов. Цитолизины связываются с холестеринсодержащими мембранами и олигомеризуются с образованием трансмембранных пор, имеющих диаметр до 30 нм и состоящих из 40-80 мономерных субъединиц. Связывание мембранного холестерина вызывает конформационное изменение в мономере токсина, приводящее к последующим событиям олигомеризации, встраивания в мембрану и образования поры.
Streptococcus pneumoniae является возбудителем некоторых заболеваний человека, включающих в себя пневмонию, бактериемию, менингит, средний отит и синусит. Иногда эти заболевания могут приводить к смерти, несмотря на применение антибиотиков. Появление устойчивых к антибиотикам штаммов S. pneumoniae усугубляет проблемы, вызываемые этим патогеном. В связи с этим, важно разработать эффективные вакцины против S. pneumoniae.
Поливалентные пневмококковые вакцины, содержащие очищенные капсульные полисахариды, имеются в продаже уже в течение нескольких лет. Их применение ограничивается слабой иммуногенностью, особенно в группах высокого риска, включающих в себя детей в возрасте до 7 лет, пожилых людей и людей с серповидно-клеточной анемией, множественной миеломой, циррозом печени или алкоголизмом. Они также обеспечивают серотип-специфическую защиту, и только 23 из 90 известных серотипов охватываются существующими препаратами. Это будет обеспечивать защиту против 90% серотипов, обнаруженных в американской популяции, но только против примерно 70% серотипов, обнаруженных в азиатских популяциях. В последнее время стали применять конъюгированную семивалентную вакцину, которая имеет аналогичные проблемы защиты против всех пневмококковых штаммов.
Пневмолизин (Ply) представляет собой тиол-активированный цитолизин (53 кДа), обнаруженный во всех штаммах S. pneumoniae, который высвобождается при автолизе и вносит вклад в патогенез S. pneumoniae. Он представляет собой высококонсервативный белок лишь с несколькими аминокислотными заменами, встречающимися среди белков Ply различных серотипов. Высокая степень консервативности пневмолизина и его иммуногенность делают его возможным кандидатом в качестве компонента вакцины. Однако Ply дикого типа не пригоден для включения в вакцины для применения у людей из-за его токсичности. Ply вызывает повреждение в клеточных мембранах благодаря взаимодействию с мембранным холестерином и олигомеризации с образованием пор в мембране. Консервативный цистеинсодержащий мотив, обнаруженный вблизи С-конца, вовлечен в литическую активность. Предполагают, что мутации в Ply снижают эту токсичность (WO 90/06951, WO 99/03884).
Двухстадийный способ очистки пневмолизина был описан Lock с соавт. (Microbial. Pathogenesis (1996) 21; 71-83). Рекомбинантный пневмолизин очищали из культуры клеток E.coli, используя комбинацию ионообменной и гель-фильтрационной хроматографии. Этот способ включает стадии приготовления экстракта и пропускания его через колонку с ДЭАЭ-Сефарозой, а затем через колонку с Сефакрилом C200-HR. Этот способ может быть использован для очистки рекомбинантного или нативного пневмолизина.
Куо с соавт. описал способ очистки рекомбинантного слитого белка, состоящего из GST (глутатион-S-трансферазы) и пневмолизина (Infection and Immunity (1995) 63; 2706-2713). Слитый белок экспрессируют в культуре E.coli, и клеточный лизат наносят на глутатион-агарозный гель. Слитый белок элюируют глутатионом, а тромбин может быть использован для расщепления слитого белка. Белки снова пропускали через колонку с глутатион-агарозой для удаления GST. Аффинно очищенный пневмолизин затем очищали с использованием колоночной хроматографии на гидроксилапатите.
Mitchell с соавт. описал способ очистки пневмолизина с использованием гидрофобной хроматографии (ВВА (1989) 1007; 67-72). В условиях, которые использовали авторы (250 мМ соли), пневмолизин оказался неспособным прочно связываться с колонкой, несмотря на то, что его движение замедлялось, и пневмолизин элюировался в виде широкого пика. Дополнительные стадии определения того, какие фракции содержали чистый пневмолизин, концентрирование положительных фракций, повторное нанесение на колонку и элюция малым объемом воды были необходимы, для того чтобы преодолеть проблему, возникшую вследствие непрочного связывания пневмолизина с сорбентом колонки.
Существует постоянная потребность в улучшении вакцин против S. pneumoniae. Включение Ply компонента является перспективным, хотя токсичность этого белка остается проблемой. Необходима также разработка быстрой и эффективной методики очистки больших количеств пневмолизина. Описанные выше способы включают применение многостадийной очистки со стадиями промежуточного анализа и концентрирования. В настоящем изобретении предложен более эффективный способ очистки, в котором преимущественно используют одностадийную хроматографию, которая может быть использована для очистки больших количеств пневмолизина.
Описание графических материалов
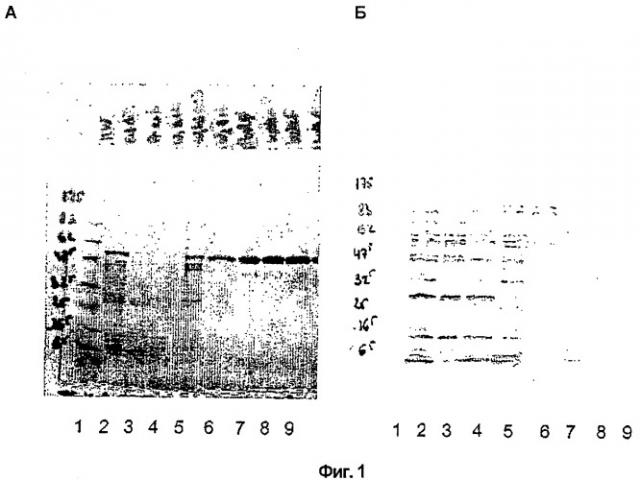
Фиг.1 - Результаты электорофореза в ПААГ (полиакриламидном геле) с ДСН (додецилсульфатом натрия), демонстрирующие очистку пневмолизина. Следующие образцы подвергали электрофорезу в ПААГ с ДСН: дорожка 1 - стандарты молекулярных масс, дорожка 2 - супернатант клеточного экстракта, дорожка 3 - проскок через фенил-сефарозу, дорожка 4 - первая промывка фенил-сефарозы, дорожка 5 - вторая промывка фенил-сефарозы, дорожка 6 - промывка фенил-сефарозы 0,5 М NaCl, дорожка 7 - элюция фенил-сефарозы низкосолевым буфером, дорожка 8 - пневмолизин после стадий денатурации/ренатурации, дорожка 9 - пневмолизин после стерилизующей фильтрации.
Панель А демонстрирует гель после окрашивания кумасси голубым. Панель Б демонстрирует гель после процедуры вестерн-блоттинга с использованием антител к белкам E.coli для проверки на загрязнение этими белками.
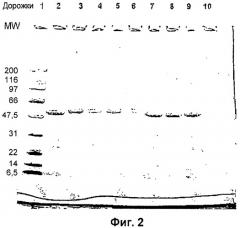
Фиг.2 - Анализ методом электрофореза в ПААГ с ДСН пневмолизина, модифицированного GMBS (N-(γ-малеимидобутирилокси)сукцинимидным эфиром) и окрашенного кумасси голубым.
Следующие образцы подвергали электрофорезу в ПААГ с ДСН: дорожка 1 - стандарты молекулярных масс, дорожка 2 - немодифицированный пневмолизин, дорожка 3 - PLY, обработанный GMBS в молярном соотношении GMBS/лизин 4/1, дорожка 4 - PLY, обработанный GMBS в молярном соотношении GMBS/лизин 4/1 и инкубированный в течение 7 дней при 37°С, дорожка 5 - PLY, обработанный GMBS в молярном соотношении GMBS/лизин 8/1, дорожка 6 - PLY, обработанный GMBS в молярном соотношении GMBS/лизин 8/1 после инкубации в течение 7 дней при 37°С, дорожка 7 - PLY, обработанный сульфо-NHS (сульфо-N-гидроксисукцинимида) ацетатом в молярном соотношении NHS/лизин 10/1, дорожка 8 - PLY, обработанный NEM (N-этилмалеимидом), дорожка 9 - PLY, обработанный NEM после инкубации в течение 7 дней при 37°С.
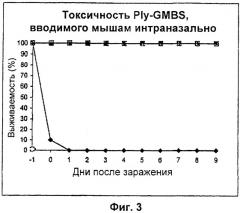
Фиг.3 - Токсичность GMBS-обработанного пневмолизина, вводимого мышам интраназально. Линия, обозначенная ромбиками, показывает выживаемость мышей, зараженных 2 мкг нативного пневмолизина. Линия, обозначенная квадратиками, показывает выживаемость мышей, зараженных 10 мкг GMBS-обработанного пневмолизина.
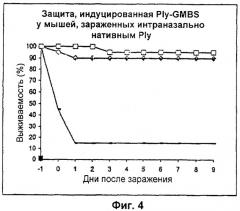
Фиг.4 - Защита, индуцированная GMBS-обработанным пневмолизином у мышей, зараженных интраназально нативным пневмолизином. Линия, обозначенная прямоугольниками, показывает выживаемость мышей, привитых только адъювантом. Линия, обозначенная ромбиками, показывает выживаемость мышей, привитых нативным пневмолизином. Линия, обозначенная квадратиками, показывает выживаемость мышей, привитых 10 мкг GMBS-обработанного пневмолизина.
Фиг.5 - Защита, индуцированная прививкой PhtD и GMBS-обработанным пневмолизином у мышей, зараженных интраназально пневмококковым штаммом D39 типа 2. Линия, обозначенная прямоугольниками, представляет выживаемость мышей, привитых только адъювантом. Линия, обозначенная ромбиками, представляет выживаемость мышей, привитых PhtD. Линия, обозначенная квадратиками, представляет выживаемость мышей, привитых PhtD и GMBS-обработанным пневмолизином.
Подробное описание
Способы
Способ по изобретению представляет собой способ очистки такого бактериального цитолизина, как пневмолизин. Цитолизин, например пневмолизин, очищают, используя только одну стадию колоночной хроматографии, не требующую повторного нанесения на колонку. Белок в агрегированной форме связывается с гидрофобной колонкой в присутствии детергента и соли. В этих условиях некоторые белки связываются с колонкой, что позволяет выполнить очистку цитолизина в одну стадию.
Для целей данного изобретения растворимый агрегат цитолизина, предпочтительно пневмолизина, представляет собой агрегированную форму цитолизина, которая остается в супернатанте после центрифугирования при 30000g в течение 20 минут. Растворимый агрегат удерживается на гидрофобном хроматографическом сорбенте, предпочтительно фенил-сефарозе, в присутствии высокой концентрации соли, предпочтительно 1 М. Возможно, растворимый агрегат является коллоидным.
Цитолизин, предпочтительно пневмолизин, связывается с колонкой в форме растворимого агрегата. Нанесение агрегатов на колонку является нетрадиционным приемом по разным причинам, включая закупорку колонки или фильтров и потерю материала. Однако благодаря использованию детергента, который уменьшает размер агрегатов с образованием растворимого агрегата, обнаружено, что эти агрегаты прочно связываются с колонкой при денатурирующих условиях, но могут быть элюированы с чистотой по меньшей мере 50%, 60%, 70%, 80%, предпочтительно 90%, 95%, более предпочтительно 97%, 98%, 99%, как определено с помощью электрофореза в ПААГ с ДСН, без неблагоприятного воздействия на фильтры колонки. Способ предпочтительно дает выход по меньшей мере 100, 200, 500, 700, более предпочтительно 1000, 1500, 1700 или 1900 мг цитолизина, предпочтительно пневмолизина, на литр ферментации. Предпочтительно, по меньшей мере, 1%, 2%, 5%, 7%, 9% или 10% белка из ферментирующей культуры извлекают в виде очищенного цитолизина, предпочтительно пневмолизина.
В способе используют способность цитолизинов, таких как пневмолизин, связываться с холестерином и другими ароматическими соединениями. Это связывание является особенно прочным в том случае, когда цитолизин агрегирован, позволяя цитолизину связываться в присутствии детергента. Этот способ может быть распространен на другие члены семейства цитолизинов, поскольку все члены обладают способностью связываться с ароматическими соединениями и образовывать поры. В действительности, этот способ может быть использован для очистки других семейств белков, которые связываются с холестерином или другими ароматическими соединениями и/или образуют поры, предпочтительно и то, и другое.
Согласно первому воплощению предложен способ очистки бактериального цитолизина, включающий стадии:
а) выращивания культуры клеток, экспрессирующих бактериальный цитолизин;
б) приготовления экстракта из культуры, содержащей бактериальный цитолизин;
в) связывания растворимого агрегированного бактериального цитолизина, содержащегося в экстракте, с гидрофобным хроматографическим сорбентом в присутствии детергента (предпочтительно алифатического детергента) при высокой концентрации соли (предпочтительно 0,5-2 М соли);
г) элюции бактериального цитолизина в присутствии детергента (предпочтительно алифатического детергента) при низкой концентрации соли (предпочтительно 0-0,2 М соли).
Во втором воплощении предложен способ очистки бактериального цитолизина, включающий стадии:
а) выращивания культуры клеток, экспрессирующих бактериальный цитолизин;
б) приготовления экстракта из культуры, содержащей бактериальный цитолизин;
в) связывания бактериального цитолизина, содержащегося в экстракте, с гидрофобным хроматографическим сорбентом в присутствии раствора, содержащего 0,5-2 М соли и 0,1-5% детергента;
г) элюции бактериального цитолизина с использованием раствора с низкой концентрацией соли (предпочтительно 0-0,2 М соли), содержащего 0,1-5% детергента.
В любом из вышеуказанных воплощений способ по изобретению предпочтительно включает дополнительные стадии:
д) удаления детергента из бактериального цитолизина;
е) солюбилизации бактериального цитолизина путем добавления денатурирующего агента;
ж) удаления денатурирующего агента из бактериального цитолизина.
Способ по изобретению может быть использован преимущественно для очистки пневмококкового пневмолизина. Другие цитолизины, которые могут быть очищены этим способом по изобретению, включают в себя пиолизин из A. pyogenes, цереолизин из В. cereus, турингиолизин О из В. thuringiensis, латероспоролизин из В. latersporus, биферментолизин из С. bifermentans, ботулинолизин из С. botulinum, шовулизин (chauveolysin) из С. chauvoel, гистолитиколизин из С. histolyticum, эдематолизин из С. novyi типа А, перфринголизин О из С. perfringens, септиколизин из С. septicum, сорделлилизин из С. sordellii, тетанолизин из С. tetani, иванолизин О из L. ivanovi, листериолизин О из L. monocytogenes, зеелигерилизин (seeligerilysin) О из L. seeligeri, альвеолизин из Р. alvei, стрептолизин О из S. pyogenes, S. canis или S. equisimilis, интермедилизин из S. intermedius, суилизин из S. suis или пневмолизин из S. pneumoniae, которые могут быть токсинами дикого типа или генетически модифицированными токсинами с низкими уровнями токсичности, такие как PdA и PdB, описанные выше.
Под пневмолизином или Ply подразумевается нативный пневмолизин из пневмококка или рекомбинантный пневмолизин, пневмолизин дикого типа или мутантные формы пневмолизина (например, пневмолизины, описанные в WO 90/06951 и WO 99/03884). Возможно, пневмолизин может также означать любой фрагмент пневмолизина или любой вариант пневмолизина, который имеет 70, 80, 90 или 95% идентичности аминокислотной последовательности пневмолизина дикого типа, который все еще сохраняет способность очищаться способами по изобретению, что легко определит специалист в данной области техники.
В предпочтительных воплощениях по изобретению один и тот же детергент присутствует на стадиях (б) и (в), (б) и (г), (в) и (г), более предпочтительно на стадиях (б), (в), (г), предпочтительно в концентрации 0,1%-5% (масс./об.). Для целей данного изобретения алифатический детергент определяют как по существу алифатический детергент с недостаточным ароматическим характером для предупреждения связывания цитолизина с колонкой на стадии (в). Предпочтительно детергент будет иметь одно или меньше ароматических колец, более предпочтительно не будет иметь ни одного ароматического кольца. На стадии (б) детергент преимущественно разрушает более крупные агрегаты цитолизина до меньших агрегатов, которые образуют растворимый агрегат. На стадиях (в) и (г) детергент преимущественно сохраняет растворимое агрегированное состояние цитолизина, позволяя ему с высокой аффинностью связываться с колонкой при высокой концентрации соли.
Цитолизин, предпочтительно пневмолизин, экспрессируется в культуре бактериальных клеток, предпочтительно S. pneumoniae, E.coli или, альтернативно, в дрожжевых клетках, клетках насекомых, клетках млекопитающих или в любой другой экспрессионной системе, подходящей для его экспрессии. В экспрессионных системах, которые дают высокие выходы пневмолизина, пневмолизин часто агрегирует сам по себе, и способ по изобретению является идеальным для его очистки. Предпочтительно пневмолизин экспрессируется с высокими выходами, так что его содержание составляет в итоге более 2, 3, 4, 5, 7 или 10% тотального белка в экспрессионной системе. Предпочтительно пневмолизин находится в агрегированной форме и поэтому в основном не имеет гемолитической активности. Например, экспрессия в Е.coli в ферментере под промотором фага λ или другими промоторами, которые разрешают высокий уровень экспрессии, хорошо известны специалистам в данной области техники.
Предпочтительно цитолизин выделяют из экспрессионной системы в виде агрегата. Альтернативно экспрессионная система с меньшим выходом может обеспечить растворимый цитолизин. В этом случае рН экстракта, содержащего цитолизин, предпочтительно пневмолизин, доводят до значения ниже 7,5, что позволяет цитолизину агрегировать в течение по меньшей мере 8 часов, предпочтительно по меньшей мере 24 часов.
Приготовление экстракта на стадии (б) предпочтительно включает одну или более чем одну стадию механического разрушения клеток и/или обработки клеток детергентом. Если цитолизин получен способом с высоким выходом, он остается в форме агрегатов, но эти агрегаты должны быть достаточно маленькими, для того чтобы оставаться в супернатанте после центрифугирования образца в условиях, необходимых для осаждения нерастворимого клеточного дебриса. Предпочтительно используемый детергент согласно изобретению представляет собой алифатический детергент, который не содержит ароматических колец, предпочтительно ионный детергент, более предпочтительно катионный или анионный детергент и более предпочтительно лауроилсаркозинат натрия. Предпочтительные детергенты способны солюбилизировать цитолизин, при этом оставляя его в форме маленьких агрегатов, которые связываются с гидрофобной колонкой, не вызывая закупорки фильтров, присоединенных к колонке. Предпочтительные детергенты способны уменьшать размер агрегатов пневмолизина, позволяя агрегатам пневмолизина становиться достаточно маленькими, для того чтобы оставаться в супернатанте после центрифугирования образца при 30000g в течение 20 минут. Такие растворимые агрегаты очищаются как таковые на гидрофобной колонке. Детергент присутствует в концентрации 0,1-5%, предпочтительно от 0,5% до 3% (масс./об.), более предпочтительно 0,75-2%, наиболее предпочтительно примерно 1%. Предпочтительно детергент можно отдиализовать.
После механического разрушения клеток культуры и/или разрушения их с помощью детергента на стадии (б) способ по изобретению включает цетрифугирование клеточного материала и сбор супернатанта в виде экстракта, который следует наносить на хроматографический сорбент на стадии (в). Цитолизин предпочтительно присутствует в супернатанте в виде растворимых агрегатов.
В способе по изобретению используют гидрофобную хроматографию для очистки пневмолизина в одну стадию. Колоночный сорбент на стадии (в) предпочтительно содержит ароматические группы, предпочтительно фенильные группы и более предпочтительно представляет собой фенил-сефарозу.
Раствор, используемый на стадии (в) и/или стадии (г) во время нанесения и элюции с колонки, содержит ионный детергент, предпочтительно катионный или анионный детергент, предпочтительно детергент, который растворим при концентрациях соли выше 0,5 М, более предпочтительно этот детергент представляет собой лауроилсаркозинат натрия. Используемый детергент представляет собой детергент, который будет уменьшать размер агрегатов цитолизина, предпочтительно пневмолизина, позволяя цитолизину присутствовать в образце в виде растворимого агрегата, так что он будет связываться с гидрофобными колоночным сорбентом без необратимого застревания на колонке. Детергент присутствует в концентрации предпочтительно 0,1-5%, предпочтительно 0,5-3% (масс./об.), более предпочтительно 0,75-2%, наиболее предпочтительно примерно 1%.
Раствор, используемый на стадии (в) и/или (г), содержит соль, предпочтительно соль, выбранную из группы, состоящей из хлорида натрия, хлорида магния, хлорида аммония, сульфата натрия, сульфата магния, сульфата аммония, фосфата натрия, фосфата магния, фосфата аммония, и является предпочтительно забуференным при рН 6-8, предпочтительно при рН около 7. Может быть использован любой буфер, способный поддерживать рН в диапазоне от 5 до 9.
Раствор, используемый для связывания цитолизина с колонкой, в способе по изобретению содержит высокую концентрацию соли, предпочтительно 0,6-2 М, более предпочтительно примерно 1 М. Концентрацию соли выбирают таким образом, чтобы пневмолизин оставался в растворимой агрегированной форме и был способен связываться с гидрофобным хроматографическим сорбентом.
Возможно, стадия (в) может включать дополнительную стадию промывки колонки при промежуточной концентрации соли около 0,5 М или концентрации соли, способствующей удалению любых слабо связанных примесей.
В способе по изобретению используют нисходящий градиент соли для элюции пневмолизина с колонки. Предпочтительно, раствор с низкой концентрацией соли, используемый для создания градиента соли на стадии (г), содержит 0-0,1 М соли, более предпочтительно 0-40 мМ соли. Альтернативно может быть использована ступенчатая элюция низкосолевым буфером, используемым на стадии (г), содержащим 0-0,2 М соли, более предпочтительно 0-40 мМ соли.
К способу по изобретению могут быть добавлены возможные стадии, если это предпочтительно для денатурации пневмолизина и последующей его ренатурации посредством удаления денатурирующего агента. Эти возможные стадии гарантируют получение чистого цитолизина, предпочтительно пневмолизина, с нативной структурой. Первая возможная стадия (д) включает удаление детергента диафильтрацией, диализом или разбавлением. Эта стадия предпочтительно включает диафильтрацию/диализ против буфера с рН 8-10, предпочтительно около 9, более предпочтительно, чтобы буфер был способен поддерживать щелочные значения рН, наиболее предпочтительно буфер представляет собой ДЭА (диэтаноламин). Раствор предпочтительно имеет низкую ионную силу, предпочтительно 10-50 мМ, более предпочтительно около 25 мМ. Диафильтрацию или диализ предпочтительно проводят при 4°С, но в качестве альтернативы проводят при комнатной температуре.
На второй возможной стадии цитолизин, предпочтительно пневмолизин, денатурируют и солюбилизируют путем добавления денатурирующего агента. Предпочтительно денатурирующий агент, используемый на стадии (е), представляет собой гуанидингидрохлорид, более предпочтительно 5-8 М гуанидингидрохлорида, наиболее предпочтительно примерно 6 М гуанидингидрохлорида. Пневмолизин инкубируют с гуанидингидрохлоридом в течение по меньшей мере 10 минут, предпочтительно в течение по меньшей мере 1 часа, более предпочтительно в течение примерно 1 часа.
Цитолизин, предпочтительно пневмолизин, затем приводят в контакт с 5-9 М мочевины, предпочтительно примерно 8 М мочевины на стадии (е). Этого достигают путем диафильтрации или диализа цитолизина, предпочтительно пневмолизина против мочевины. Предпочтительно, один и тот же буфер и рН поддерживают во время смены денатурирующего агента. Предпочтительно, во время смены денатурирующего агента добавляют восстанавливающий агент (ДТТ (дитиотреитол), 2-меркаптоэтанол или глутатион).
Предпочтительно, стадия (е) включает приведение цитолизина, предпочтительно пневмолизина, в контакт с 5-8 М гуанидингидрохлорида с последующей заменой гуанидингидрохлорида на 5-9 М мочевины.
Для того чтобы предотвратить образование нежелательных дисульфидных связей, образующихся в процессе денатурации цитолизина, предпочтительно пневмолизина, желательно обеспечить присутствие восстанавливающего агента по меньшей мере на стадиях (е) и (ж). Предпочтительным восстанавливающим агентом является 0,1-10 мМ ДТТ, предпочтительно примерно 1 мМ ДТТ. Альтернативно используют глутатион или 2-меркаптоэтанол. Предпочтительная концентрация глутатиона составляет 1-50 мМ, более предпочтительно 10-30 мМ.
Возможная стадия (ж) включает удаление денатурирующего агента для ренатурации цитолизина, предпочтительно пневмолизина, предпочтительно путем диафильтрации или диализа против низкосолевого буфера с рН 6-11, предпочтительно с рН около 9. Предпочтительно концентрацию цитолизина, предпочтительно пневмолизина, поддерживают на уровне по меньшей мере 100 мкг/мл, предпочтительно 100-1000 мкг/мл, более предпочтительно около 500 мкг/мл. Возможно, диафильтрацию или диализ проводят против буфера, содержащего пропиленгликоль от 10 до 30%, предпочтительно примерно 15%. Предпочтительно восстанавливающий агент, как описано выше, оставляют на стадии (ж). Диафильтрацию или диализ предпочтительно проводят при 4°С, но в качестве альтернативы проводят при комнатной температуре.
Следующая возможная стадия (з) включает удаление восстанавливающего агента после того, как цитолизин, предпочтительно пневмолизин, был ренатурирован. Этого предпочтительно достигают путем диафильтрации или диализа против низкосолевого буфера с рН 6-11, предпочтительно с рН около 9. Возможно, диафильтрацию или диализ проводят против буфера, содержащего пропиленгликоль от 10 до 30%, предпочтительно примерно 15%. Диафильтрацию или диализ предпочтительно проводят при 4°С, но в качестве альтернативы проводят при комнатной температуре.
В предпочтительных способах по изобретению цитолизин, предпочтительно пневмолизин, ренатурируют таким образом, чтобы его гемолитическая активность восстанавливалась до уровня выше 25%, 50%, 75%, более предпочтительно до уровня выше 90% активности правильно уложенного белка. Для целей данного изобретения 'уложенный' (folded) белок представляет собой белок, имеющий третичную структуру белка, полученного способом при неденатурирующих условиях. В случае пневмолизина дикого типа ожидаемая гемолитическая активность ренатурированного цитолизина составляет 500000-1000000 гемолитических единиц/мг пневмолизина. В случае пневмолизина с точечной мутацией, имеющего сниженную гемолитическую активность, гемолитическая активность ренатурированного цитолизина будет соответственно ниже.
Детоксикация токсина
Цитолизин, очищенный способом по изобретению, предпочтительно пневмолизин, может быть подвергнут дополнительной возможной стадии детоксикации путем химической обработки. Эта дополнительная стадия является особенно предпочтительной, если цитолизин, предпочтительно пневмолизин, будет вводиться животным или человеку. Пневмолизин дикого типа высокотоксичен. Было выделено несколько мутантных белков пневмолизина, которые имеют пониженную токсичность, однако они все же сохраняют остаточную токсичность, которая может создавать проблемы при введении пневмолизина в организм (WO 99/03884, WO 90/06951). Альтернативно он может быть детоксицирован путем конъюгирования с полисахаридами (WO 96/05859).
Способом по изобретению можно детоксицировать цитолизин, например пневмолизин, как дикого типа, так и мутантный, путем химической обработки. В предпочтительных воплощениях используют сшивающий агент, более предпочтительно содержащий одно или более чем одно химическое соединение, выбранное из группы, состоящей из формальдегида, глутаральдегида и сшивающего агента, содержащего N-гидроксисукцинимидную эфирную и/или малеимидную группировку (например GMBS).
Сами способы детоксикации являются аспектом изобретения и могут быть использованы для детоксикации бактериальных токсинов, предпочтительно пневмолизина, полученного другими способами.
В одном воплощении способ детоксикации по изобретению описывает детоксикацию бактериального токсина, включающую обработку токсина химическим соединением, предпочтительно сшивающим агентом, который взаимодействует, предпочтительно избирательно взаимодействует, более предпочтительно специфически взаимодействует с аминогруппами, более предпочтительно с первичными аминогруппами.
Для целей этой заявки сшивающий агент определяют как соединение с по меньшей мере двумя реакционноспособными группами, из которых по меньшей мере одна группа способна взаимодействовать с по меньшей мере одной группой на бактериальном токсине. Еще одна реакционноспособная группа способна взаимодействовать как с группой на бактериальном токсине, так и с отдельным соединением (например, аминокислотой, пептидом, полипептидом, углеводом или полисахаридом).
Предпочтительно химическое соединение или сшивающий агент взаимодействует, более предпочтительно избирательно взаимодействует, наиболее предпочтительно специфически взаимодействует с амино- и сульфгидрильными группами. Предпочтительно химическое соединение взаимодействует с первичной аминогруппой лизина, более предпочтительно сшивающий агент взаимодействует с первичной аминогруппой лизина и сульфгидрильной группой цистеина. Этот способ особенно предпочтителен при детоксикации пневмолизина, поскольку модификация остатков как цистеина, так и лизина ведет к синергическому снижению уровня гемолиза по сравнению с остаточной гемолитической активностью в том случае, когда сшивающий агент взаимодействует только с лизином или цистеином.
Таким образом, согласно альтернативному воплощению предложен способ детоксикации бактериальных токсинов, включающий модификацию цистеинового остатка (возможно, вблизи С-конца токсина), вовлеченного в токсическую активность токсина (предпочтительно литическую активность), включающий обработку токсина сшивающим агентом (предпочтительно гетеробифункциональным сшивающим агентом), который перекрестно сшивает сульфгидрильные группы с другой аминокислотой токсина, расположенной в первичной структуре предпочтительно на расстоянии более 2, 5, 10, 15, 20, 30, 40 аминокислот от цистеина. Предпочтительно другая аминокислота содержит первичную аминогруппу, и более предпочтительно эта аминокислота представляет собой лизин.
В некоторых воплощениях более 50%, 60%, 70%, 80%, 90% или 95% токсина сохраняет молекулярную массу в пределах 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90%, более предпочтительно 1-50%, наиболее предпочтительно 5-10% от его первоначальной молекулярной массы после обработки, как определено с помощью электрофореза в ПААГ с ДСН. Предпочтительно токсин приобретает несколько более высокую молекулярную массу после детоксицирующей обработки вследствие того, что несколько аминокислотных остатков модифицируются путем ковалентного связывания с химическим соединением. Однако способ по изобретению предпочтительно не включает экстенсивное конъюгирование токсина либо путем его ковалентного связывания с другими молекулами токсина с образованием токсина с мультимерной четвертичной структурой, либо путем ковалентного связывания токсина с другими большими белками, полисахаридами или липополисахаридами. Наиболее предпочтительно, чтобы способы, белки или продукты, раскрытые в WO 96/05859, не охватывались данным изобретением.
Способ по изобретению может быть использован для детоксикации бактериальных токсинов. Предпочтительные токсины включают в себя тиол-активируемые цитолизины: пиолизин из A. pyogenes, цереолизин из В. cereus, турингиолизин О из B. thuringiensis, латероспоролизин из В. latersporus, биферментолизин из С. bifermentans, ботулинолизин из С. botulinum, шовулизин (chauveolysin) из С. chauvoel, гистолитиколизин из С. histolyticum, эдематолизин из С. novyi типа А, перфринголизин О из С. perfringens, септиколизин из С. septicum, сорделлилизин из С. sordellii, тетанолизин из С. tetani, иванолизин О из L. ivanovi, листериолизин О из L. monocytogenes, зеелигерилизин (seeligerilysin) О из L. seeligeri, альвеолизин из Р. alvei, стрептолизин О из S. pyogenes, S. canis или S. equisimilis, интермедилизин из S. intermedius, суилизин из S. suis или пневмолизин из S. pneumoniae, которые могут представлять собой токсины дикого типа или генетически модифицированные токсины с низкими уровнями токсичности, такие как PdA и PdB, описанные выше (WO 90/06951 и WO 99/03884).
Способ может быть также использован для детоксикации нейссериальных токсинов FrpA, FrpC (WO 92/01460), FrpB (Microbiology 142; 3269-3274, (1996); J. Bacteriol. 181; 2895-2901 (1999)), NM-ADPRT (13th International Pathogenic Neisseria Conference 2002 Masignani et al., p.135). FrpA и FrpC содержат участок, который является консервативным у этих двух белков, и предпочтительный фрагмент данных токсинов будет представлять собой полипептид, включающий этот консервативный участок, предпочтительно содержащий аминокислоты 227-1004 последовательности FrpA/C.
Способ по изобретению может быть также использован для детоксикации токсинов бордетелл, включая аденилатциклазу (СуаА) (Glaser (1988) Mol. Microbiol. 2; 19-30), дермонекротический токсин (Livey (1984) J. Med, Microbiol. 17; 91-103) и коклюшный токсин (РТ от англ. pertussis toxin) (Munoz et al. (1981) Infect Immun 33; 820-826). Способ по изобретению также используют для детоксикации столбнячного токсина (ТТ от англ. tetanus toxin), дифтерийного токсина (DT от англ. diphtheria toxin) и токсинов из S. aureus и S. epidermidis, включая аутолизин и гемолизин (WO 01/98499, WO 02/59148).
Способы по изобретению приводят к снижению величины токсичности и/или гемолитической активности токсина по меньшей мере на 90%, предпочтительно на 95%, 96%, 98%, 99%, 99,5%, 99,9% или 99,99%. Гемолитическую активность измеряют, используя способ из примера 3, а токсичность может быть измерена способом из примера 5. Нативный пневмолизин имеет гемолитическую активность 500000-1000000 единиц на мг пневмолизина. Некоторые варианты пневмолизина с точечной мутацией имеют пониженные токсичность и гемолитическую активность. Детоксикация варианта пневмолизина может не давать такого большого процентного снижения гемолитической активности из-за более низкой исходной точки, с которой снижается гемолитическая активность, однако предполагают, что большая часть оставшейся гемолитической активности удаляется способами по изобретению.
На стадии детоксикации в способе по изобретению предпочтительно предложена реакция перекрестного сшивания, которая по существу является необратимой. Обратимость оценивают путем мониторинга гемолитической активности детоксицированного токсина непосредственно после детоксикации и после инкубации при температуре около 25°С, предпочтительно выше 30°С, более предпочтительно выше 35°С, наиболее предпочтительно выше 37°С в течение по меньшей мере 5, 6, 7, 8, 9 или 10 дней. По существу необратимая реакция приводит к по существу необратимой детоксикации и определяется как реакция, в которой уровень гемолитической активности возрастает менее чем на 100%, 50%, 40%, 30%, 20%, 10% после инкубации при повышенной температуре, как описано выше. Многие способы детоксикации, например с использованием формальдегидной обработки, приводят к детоксикации, которая является нестабильной и со временем усиливает токсичность.
В предпочтительной стадии детоксикации в способе по изобретению более 50%, 60%, 70%, 80%, 90%, 95% или 98% токсина сохраняет мономерную четвертичную структуру после реакции перекрестного сшивания. Многие сшивающие агенты образуют межмолекулярные перекрестные сшивки (например, формальдегид или глутаральдегид). Это может влиять на иммунологические свойства токсина, поскольку некоторые эпитопы будут скрыты внутри агрегата. Способы по изобретению предпочтительно включают простую модификацию аминокислотных остатков, предпочтительно сульфгидрильных и/или первичных аминогрупп аминокислот, и/или образование преимущественно внутримолекулярных сшивок. Полученная в результате мономерная четвертичная структура позволяет эпитопам оставаться экспонированными на поверхности токсина.
В предпочтительном воплощении стадии детоксикации сшивающий агент является бифункциональным. Предпочтительные сшивающие агенты содержат N-гидроксисукцинимидную эфирную группу, которая избирательно, более предпочтительно специфически взаимодействует с п