Лекарственные формы, содержащие ag013736
Иллюстрации
Показать всеИзобретение относится к лекарственным средствам и касается способа лечения рака молочной железы у человека, включающего введение соединения формулы 1 или его фармацевтически приемлемой соли, где соединение вводят в количестве от 5 до 20 мг на дозу с частотой дозирования два раза в сутки и где способ дополнительно включает совместное введение доцетаксела. Также раскрыт способ лечения рака поджелудочной железы, включающий введение соединения формулы 1 или его фармацевтически приемлемой соли в количестве от 5 до 20 мг на дозу с частотой дозирования два раза в сутки, при этом способ дополнительно включает совместное введение гемцитабина. Предложенный способ лечения рака обеспечивает значительную регрессию опухоли. 2 н. и 6 з.п. ф-лы, 2 ил., 4 табл.
Реферат
Испрашивается приоритет данной заявки согласно предварительной заявке на патент США № 60/460695, поданной 3 апреля 2003 года, и предварительной заявке на патент США № 60/491771, поданной 31 июля 2003 года, содержание которых во всей их полноте включено в данное описание изобретения ссылкой.
Предшествующий уровень техники
Данное изобретение относится к ингибиторам VEGFR (рецептор васкулярного эндотелиального фактора роста), которые полезны для лечения аномального клеточного роста, такого как рак, у млекопитающих. Изобретение также относится к способу использования таких соединений в лечении аномального клеточного роста у млекопитающих, особенно людей, и к фармацевтическим композициям, содержащим такие соединения.
Соединение 6-[2-(метилкарбамоил)фенилсульфанил]-3-Е-[2-(пиридин-2-ил)этенил]индазол, имеющее формулу 1
,
является эффективным и селективным ингибитором тирозинкиназ VEGFR/PDGFR (рецептор васкулярного эндотелиального фактора роста/рецептор тромбоцитарного фактора роста) с широкой предклинической активностью в ксенотрансплантатных моделях рака ободочной кишки, меланомы, рака молочной железы и рака легкого (Hu-Lowe D, Heller, D, Brekken J, Feeley R, Amundson K, Haines M, Troche Г, Kim Y, Gonzales D, Herrman M, Batugo M, Vekich S, Kania R, McTigue M, Gregory S, Bender S, Shalinsky D., Pharmacological Activities of AG 013736, a Small Molecule Inhibitor of VEGF/PDGF Receptor Tyrosine Kinases; Proc. Am. Assoc. Cancer Res.2002: abstract #5357). Было показано, что предклинический опухолевый сосудистый ответ, который оценивали методом магнитно-резонансной визуализации с динамическим усилением контраста, соответствует индексу роста опухоли (Wilmes LJ, Hylton НМ, Wang D, Fleming LM Gibbs J, Kirn Y, Dillon R, Brasch RC, Park JW, Li K-L, Henry RG, Partridge SC, Shalinsky DR, Hu-Lowe D, McShane TM, and Pallavicini MG., AG 013736, a Novel VEGFR TK Inhibitor Suppresses Tumor Growth and Vascular Permeability in Human БТ474 Breast Cancer Xenografts in Nude Mice"; Proc. Am. Assoc. Cancer Res.2003: Abstract #3772).
Краткое изложение сущности изобретения
Согласно данному изобретению предложены лекарственные формы и способы лечения с использованием соединения формулы 1:
,
которое согласно систематической номенклатуре может называться 6-[2-(метилкарбамоил)фенилсульфанил]-3-Е-[2-(пиридин-2-ил)этенил]индазолом.
В одном воплощении данного изобретения предложена лекарственная форма для введения млекопитающему, содержащая соединение формулы 1, его фармацевтически приемлемую соль, сольват или пролекарство или их смесь в количестве, эффективном для обеспечения величины 24-часовой AUC (площадь под кривой) s плазме крови не более 4500 нг·ч/мл соединения формулы 1 или его активных метаболитов после введения млекопитающему. Величины 24-часовой AUC в плазме крови могут быть определены как описано в разделе "Подробное описание изобретения".
В конкретных аспектах этого воплощения верхний предел величины 24-часовой AUC в плазме крови составляет не более 4000 нг·ч/мл, или не более 3000 нг·ч/мл, или не более 2500 нг·ч/мл, или не более 2000 нг·ч/мл, или не более 1500 нг·ч/мл, или не более 1000 нг·ч/мл, или не более 800 нг·ч/мл, или не более 700 нг·ч/мл. Предпочтительно, и в комбинации с любым из указанных верхних пределов величина 24-часовой AUC в плазме крови составляет по меньшей мере 10 нг·ч/мл, или по меньшей мере 25 нг·ч/мл, или по меньшей мере 50 нг·ч/мл, или по меньшей мере 75 нг·ч/мл, или по меньшей мере 100 нг·ч/мл, или по меньшей мере 125 нг·ч/мл. Рассматриваемые диапазоны величин 24-часовой AUC в плазме крови включают диапазоны от любого из указанных нижних пределов до любого из указанных верхних пределов. Конкретные неограничивающие примеры предпочтительных диапазонов включают диапазоны от 25 до 4500 нг·ч/мл, от 50 до 2500 нг·ч/мл, от 75 до 1000 нг·ч/мл, от 100 до 800 нг·ч/мл и от 125 до 700 нг·ч/мл.
В другом воплощении данного изобретения предложена лекарственная форма, содержащая соединение формулы 1, как оно определено выше, его фармацевтически приемлемую соль, сольват или пролекарство или их смесь в количестве не более 30 мг. Следует иметь в виду, что когда все соединение или часть соединения присутствует в лекарственной форме в виде соли, сольвата или пролекарства, его количество представляет собой эквивалентное количество соединения формулы 1, которое специалист в данной области без труда вычислит исходя из молекулярных масс.
В конкретных аспектах этого воплощения верхний предел количества составляет не более 20 мг, или не более 15 мг, или не более 12 мг, или не более 10 мг, или не более 8 мг, или не более 7 мг. Предпочтительно, и в комбинации с любым из указанных верхних пределов это количество составляет по меньшей мере 0,5 мг, или по меньшей мере 1 мг, или по меньшей мере 1,5 мг, или по меньшей мере 2 мг, или по меньшей мере 2,5 мг, или по меньшей мере 3 мг. Рассматриваемые диапазоны включают диапазоны от любого из указанных нижних пределов до любого из указанных верхних пределов. Конкретные неограничивающие примеры предпочтительных диапазонов включают диапазоны от 0,5 до 30 мг, от 1 до 20 мг, от 1,5 до 15 мг, от 2 до 10 мг, от 2,5 до 8 мг и от 3 до 7 мг.
Согласно данному изобретению предложен также способ лечения аномального клеточного роста у млекопитающего, включая человека, путем введения этому млекопитающему соединения формулы 1, как оно определено выше, его фармацевтически приемлемой соли, сольвата или пролекарства или их смеси в количестве, эффективном для обеспечения величины 24-часовой AUC в плазме крови не более 4500 нг·мг/мл соединения формулы 1 или его активных метаболитов после введения млекопитающему. Величины 24-часовой AUC в плазме крови могут быть определены как описано в разделе "Подробное описание изобретения".
В конкретных аспектах этого воплощения верхний предел величины 24-часовой AUC в плазме крови составляет не более 4000 нг·ч/мл, или не более 3000 нг·ч/мл, или не более 2500 нг·ч/мл, или не более 2000 нг·ч/мл, или не более 1500 нг·ч/мл, или не более 1000 нг·ч/мл, или не более 800 нг·ч/мл, или не более 700 нг·ч/мл. Предпочтительно, и в комбинации с любым из указанных верхних пределов величина 24-часовой AUC в плазме крови составляет по меньшей мере 10 нг·ч/мл, или по меньшей мере 25 нг·ч/мл, или по меньшей мере 50 нг·ч/мл, или по меньшей мере 75 нг·ч/мл, или по меньшей мере 100 нг·ч/мл, или по меньшей мере 125 нг·ч/мл. Рассматриваемые диапазоны величины 24-часовой AUC в плазме крови охватывают диапазоны от любого из указанных нижних пределов до любого из указанных верхних пределов. Конкретные неограничивающие примеры предпочтительных диапазонов включают диапазоны от 25 до 4500 нг·ч/мл, от 50 до 2500 нг·ч/мл, от 75 до 1000 нг·ч/мл, от 100 до 800 нг·ч/мл и от 125 до 700 нг·ч/мл.
Согласно данному изобретению предложен также способ лечения аномального клеточного роста у млекопитающего, включая человека, путем введения этому млекопитающему соединения формулы 1, как оно определено выше, его фармацевтически приемлемой соли, сольвата или пролекарства или их смеси в количестве не более 30 мг на дозу. Следует иметь в виду, что когда все соединение или часть соединения присутствует в лекарственной форме в виде соли, сольвата или пролекарства, его количество представляет собой эквивалентное количество соединения формулы 1, которое специалист в данной области без труда вычислит исходя из молекулярных масс.
В конкретных аспектах этого воплощения верхний предел этого количества составляет не более 20 мг, или не более 15 мг, или не более 12 мг, или не более 10 мг, или не более 8 мг, или не более 7 мг. Предпочтительно, и в комбинации с любым из указанных верхних пределов это количество составляет по меньшей мере 0,5 мг, или по меньшей мере 1 мг, или по меньшей мере 1,5 мг, или по меньшей мере 2 мг, или по меньшей мере 2,5 мг, или по меньшей мере 3 мг. Рассматриваемые диапазоны охватывают диапазоны от любого из указанных нижних пределов до любого из указанных верхних пределов. Конкретные не ограничивающие примеры предпочтительных диапазонов включают диапазоны от 0,5 до 30 мг, от 1 до 20 мг, от 1,5 до 15 мг, от 2 до 10 мг, от 2,5 до 8 мг и от 3 до 7 мг.
В конкретном воплощении любого из описанных здесь способов по изобретению аномальный клеточный рост представляет собой рак, включая, но не ограничиваясь ими, рак легкого, рак кости, рак поджелудочной железы, рак кожи, рак в области головы или шеи, кожную или внутриглазную меланому, рак матки, рак яичника, рак прямой кишки, рак анальной области, рак желудка, рак ободочной кишки, рак молочной железы, карциному фаллопиевых труб, карциному эндометрия, карциному шейки матки, карциному влагалища, карциному вульвы, болезнь Ходжкина, рак пищевода, рак тонкого кишечника, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, рак надпочечника, саркому мягкой ткани, рак уретры, рак пениса, рак простаты, хронический или острый лейкоз, лимфоцитарную лимфому, рак мочевого пузыря, рак почки или мочеточника, почечно-клеточный рак, карциному почечной лоханки, новообразования центральной нервной системы (ЦНС), первичную ЦНС лимфому, опухоли позвоночного столба, глиому ствола мозга, аденому гипофиза и их комбинации. В еще одном воплощении указанного способа указанный аномальный клеточный рост представляет собой доброкачественное пролиферативное заболевание, включая псориаз, доброкачественную гипертрофию простаты или рестеноз, но не ограничиваясь ими.
В еще одном воплощении данного изобретения предложен способ ингибирования миграции раковых клеток, опосредованной рецепторами тромбоцитарного фактора роста ВВ (PDGFR ВВ), у млекопитающего путем введения этому млекопитающему терапевтически приемлемого количества соединения формулы 1.
В еще одном воплощении данного изобретения предложен способ ингибирования c-KIT активности у млекопитающего путем введения этому млекопитающему терапевтически приемлемого количества соединения формулы 1.
В других конкретных воплощениях любого из описанных здесь способов по изобретению способ дополнительно включает введение млекопитающему некоторого количества одного или более веществ, выбранных из противоопухолевых агентов, антиангиогенных агентов, ингибиторов сигнальной трансдукции и антипролиферативных агентов, причем эти количества вместе эффективны в лечении указанного аномального клеточного роста. Такие вещества включают вещества, раскрытые в международных публикациях WO 00/38715, WO 00/38716, WO 00/38717, WO 00/38718, WO 00/38719, WO 00/33730, WO 00/38665, WO 00/37107 и WO 00/38786, содержание которых во всей их полноте включено в данное описание изобретения ссылкой.
Примерами противоопухолевых агентов являются митотические ингибиторы, например производные алкалоидов барвинка, такие как винбластин, винорелбин, виндесин и винкристин; колхины аллокохин, галихондрин, колхициновая кислота N-бензоилтриметил-метиловый эфир, доластатин 10, мэйстансин, ризоксин, таксаны, такие как паклитаксел (Taxol™), доцетаксел (Taxotere™), 2'-N-[3-(диметиламино)пропил]глутарамат (производное Taxol™), тиоколхицин, тритилцистеин, тенипозид, метотрексат, азатиоприн, фторурацил, арабинозид цитоцина, 2'2'-дифтордезоксицитидин (гемцитабин), адриамицин и митамицин; алкилирующие агенты, например цисплатин, карбоплатин, оксиплатин, ипроплатин, этиловый эфир N-ацетил-DL-саркозил-L-лейцина (Asaley или Asalex), 1,4-циклогексадиен-1,4-дикарбаминовая кислота, 2,5-бис(1-азирдинил)-3,6-диоксо-, диэтиловый эфир (диазиквон), 1,4-бис(метансульфонилокси)бутан (бисульфан или лейкосульфан) хлорозотоцин, кломезон, цианоморфолинодоксорубицин, циклодизон, диангидроглактитол, флюородопан, гепсульфам, митомицин С, гикантеонемитомицин С, митозоламид, 1-(2-хлорэтил)-4-(3-хлорпропил)пиперазина дигидрохлорид, пиперазиндион, пипоброман, порфиромицин, спирогидантоиновый аналог иприта, тероксирон, тетраплатин, тиотепа, триэтиленмеламин, урацильный азотистый аналог иприта, бис(3-мезилоксипропил)амина гидрохлорид, митомицин, нитрозомочевинные агенты, такие как циклогексил-хлорэтилнитрозомочевина, метилциклогексил-хлорэтилнитрозомочевина, 1-(2-хлорэтил)-3-(2,6-диоксо-3-пиперидил)-1-нитрозомочевина, бис(2-хлорэтил)нитрозомочевина, прокарбазин, дакарбазин, родственные азотистому аналогу иприта соединения, такие как мехлороэтамин, циклофосфамид, ифосамид, мелфалан, хлорамбуцил, натриевый фосфат эстрамусцина, стрптозоин и темозоламид; антиметаболиты ДНК, например 5-фторурацил, цитозинарабинозид, гидроксимочевина, 2-[(3-гидрокси-2-пиринодинил)метилен]-гидразинкарботиоамид, дезоксифторуридин, 5-гидрокси-2-формилпиридинтиосемикарбазон, альфа-2'-дезокси-6-тиогуаназин, афидиколина глицинат, 5-азадезоксицитидин, бета-тиогуаниндезоксирибозид, циклоцитидин, гуаназол, инозингликодиальдегид, макбецин II, пиразолимидазол, кладрибин, пентостатин, тиогуанин, меркаптопурин, блеомицин, 2-хлордезоксиаденозин, ингибиторы тимидилатсинтазы, такие как ралтриксеред и пеметрексереда динатриевая соль, клофарабин, флоксуридин и флударабин; антиметаболиты ДНК/РНК, например L-аланозин, 5-азацитидин, ацивицин, аминоптерин и их производные, такие как N-[2-хлор-5-[[(2,4-диамино-5-метил-6-хиназолинил)-метил]амино]бензил]-L-аспарагиновая кислота, N-[4-[[(2,4-диамино-5-этил-6-хиназолинил)метил]амино]бензил]-L-аспарагиновая кислота, N-[2-хлор-4-[[(2,4-диаминоптеридинил)метил]амино]бензил]-L-аспарагиновая кислота, растворимый антифолат Бейкера, дихлораллил лаусон, бреквинар, фтораф, дигидро-5-азацитидин, метотрексат, N-(фосфоноацетил)-L-аспарагиновой кислоты тетранатриевая соль, пиразофуран, триметрексат, пликамицин, актиномицин D, криптофицин и аналоги, такие как криптофицин-52 или, например, один из предпочтительных антиметаболитов, раскрытых в заявке на Европейский патент № 239362, такой как N-(5-[N-(3,4-дигидро-2-метил-4-оксохиназолин-6-илметил)-N-метиламино]-2-теноил)-L-глутаминовая кислота; ингибиторы факторов роста; ингибиторы клеточного цикла; интеркалирующие антибиотики, например адриамицин и блеомицин; протеины, например интерферон; и антигормоны, например антиэстрогены, такие как Nolvadex™ (тамоксифен) или, например, антиандрогены, такие как Casodex™ (4'-циано-3-(4-фторфенилсульфонил)-2-гидрокси-2-метил-3'-(трифторметил)-пропиоанилид). Такое комбинированное лечение достигается путем одновременного, последовательного или раздельного введения индивидуальных компонентов лечения.
Антиангиогенные агенты включают ингибиторы ММР-2 (матриксной металлопротеиназы 2), ингибиторы ММР-9 (матриксной металлопротеиназы 9) и ингибиторы СОХ-11 (циклооксигеназы II). Примеры полезных ингибиторов СОХ-11 включают CELEBREX™ (алекоксиб), валдекоксиб и рофекоксиб. Примеры полезных ингибиторов матриксных металлопротеиназ раскрыты в WO 96/33172 (дата публикации 24 октября 1996), WO 96/27583 (дата публикации 7 марта 1996), заявке на Европейский патент № 97304971,1 (дата подачи 8 июля 1997), заявке на Европейский патент № 99308617.2 (дата подачи 29 октября 1999), WO 98/07697 (дата публикации 26 февраля 1998), WO 98/03516 (дата публикации 29 января 1998), WO 98/34918 (дата публикации 13 августа 1998), WO 98/34915 (дата публикации 13 августа 1998), WO 98/33768 (дата публикации 6 августа 1998), WO 98/30566 (дата публикации 16 июля 1998), Европейском патенте 606046 (дата публикации 13 июля 1994), Европейском патенте 931788 (дата публикации 28 июля 1999), WO 90/05719 (дата публикации 31 мая 1990), WO 99/52910 (дата публикации 21 октября 1999), WO 99/52889 (дата публикации 21 октября 1999), WO 99/29667 (дата публикации 17 июня 1999), Международной заявке № РСТ/1В98/01113 (дата подачи 21 июля 1998), заявке на Европейский патент № 99302232.1 (дата подачи 25 марта 1999), заявке на патент Великобритании № 9912961.1 (дата подачи 3 июня 1999), предварительной заявке на патент США № 60/148464 (дата подачи 12 августа 1999), патенте США 5863949 (дата выдачи 26 января 1999), патенте США 5861510 (дата выдачи 19 января 1999) и Европейском патенте 780386 (дата публикации 25 июня 1997), которые все во всей их полноте включены в данное описание изобретения ссылкой. Предпочтительными ингибиторами ММР-2 и ММР-9 являются ингибиторы, которые имеют небольшую активность или не имеют активности ингибирования ММР-1. Более предпочтительными являются ингибиторы, которые селективно ингибируют ММР-2 и/или ММР-9 по сравнению с другими матриксными металлопротеиназами (то есть ММР-1, ММР-3, ММР-4, ММР-5, ММР-6, ММР-7, ММР-8, ММР-10, ММР-11, ММР-12 и ММР-13).
Примеры ингибиторов ММР включают AG-3340, RO 32-3555, RS 13-0830 и соединения, указанные в следующем списке:
3-([4-(4-фтор-фенокси)бензолсульфонил]-(1-гидроксикарбамоил-циклопентил)амино]пропионовая кислота,
3-экзо-3-[4-(4-фтор-фенокси)бензолсульфониламино]-8-окса-бицикло[3.2.1]октан-3-карбоновой кислоты гидроксиамид,
(2R,3R)-1-[4-(2-хлор-4-фтор-бензилокси)бензолсульфонил]-3-гидрокси-3-метил-пиперидин-2-карбоновой кислоты гидроксиамид,
4-[4-(4-фтор-фенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты гидроксиамид,
3-[[4-(4-фтор-фенокси)бензолсульфонил]-(1-гидроксикарбамоил-циклобутил)-амино]-пропионовая кислота,
4-[4-(4-хлор-фенокси)бензосульфониламино]тетрагидропиран-4-карбоновой кислоты гидроксиамид,
3-[4-(4-хлор-фенокси)бензолсульфониламино]тетрагидропиран-3-карбоновой кислоты гидроксиамид,
(2R,3R)-1-[4-(4-фтор-2-метил-бензилокси)бензолсульфонил]-3-гидрокси-3-метил-пиперидин-2-карбоновой кислоты гидроксиамид,
3-[[4-(4-фтор-фенокси)бензосульфонил]-(1-гидроксикарбамоил-1-метилэтил)амино]пропионовая кислота,
3-[[4-(4-фтор-фенокси)бензолсульфонил]-(4-гидроксикарбамоил-тетрагидропиран-4-ил)амино]пропионовая кислота,
3-экзо-3-[4-(4-хлор-фенокси)бензолсульфониламино]-8-окса-бицикло[3.2.1]октан-3-карбоновой кислоты гидроксиамид,
3-эндо-3-[4-(4-фтор-фенокси)бензолсульфониламино]-8-окса-бицикло[3.2.1]октан-3-карбоновой кислоты гидроксиамид и
3-[4-(4-фтор-фенокси)бензолсульфониламино]тетрагидрофуран-3-карбоновой кислоты гидроксиамид,
и фармацевтически приемлемые соли, сольваты и пролекарства указанных соединений.
Примеры ингибиторов сигнальной трансдукции включают агенты, которые могут ингибировать EGFR (рецептор эпидермального фактора роста) ответы, такие как антитела к EGFR, антитела к EGF и молекулы, которые являются ингибиторами EGFR; ингибиторы VEGF (васкулярный эндотелиальный фактор роста); и ингибиторы рецептора erbВ2, такие как органические молекулы или антитела, которые связываются с рецептором erbВ2, например HERCEPTIN™ (Genentech, Inc. of South San Francisco, California, USA).
Ингибиторы EGFR раскрыты, например, в WO 95/19970 (дата публикации 27 июля 1995), WO 98/14451 (дата публикации 9 апреля 1998), WO 98/02434 (дата публикации 22 января 1998) и патенте США 5747498 (дата выдачи 5 мая 1998). EGFR-ингибирующие агенты включают, без ограничений, моноклональные антитела С225 и anti-EGFR 22Mab (ImClone Systems Incorporated of New York, New York, USA), соединения ZD-1839 (AstraZeneca), BIBX-1382 (Boehringer Ingelheim), MDX-447 (Medarex Inc. of Annandale, New Jersey, USA) и OLX-103 (Merck & Co. of Whitehouse Station, New Jersey, USA), VRCTC-310 (Ventech Research) и слитый с EGF токсин (Seragen Inc. of Hopkinton, Massachusetts).
Комбинировать или вводить вместе с соединениями формулы 1 можно также ингибиторы VEGF, например SU-5416 и SU-6668 (Sugen Inc. of South San Francisco, California, USA). Ингибиторы VEGF раскрыты, например, в WO 99/24440 (дата публикации 20 мая 1999), Международной заявке PCT/IB 99/00797 (дата подачи 3 мая 1999), WO 95/21613 (дата публикации 17 августа 1995), WO 99/61422 (дата публикации 2 декабря 1999), патенте США 5834504 (дата выдачи 10 ноября 1998), WO 98/50356 (дата публикации 12 ноября 1998), патенте США 5883113 (дата выдачи 16 марта 1999), патенте США 5886020 (дата выдачи 23 марта 1999), патенте США 5792783 (дата выдачи 11 августа 1998), WO 99/10349 (дата публикации 4 марта 1999), WO 97/32856 (дата публикации 12 сентября 1997), WO 97/22596 (дата публикации 26 июня 1997), WO 98/54093 (дата публикации 3 декабря 1998), WO 98/02438 (дата публикации 22 января 1998), WO 99/16755 (дата публикации 8 апреля 1999) и WO 98/02437 (дата публикации 22 января 1998), которые все включены в данное описание изобретения во всей их полноте ссылкой. Другими примерами некоторых конкретных ингибиторов VEGF являются IM862 (Cytran Inc. of Kirkland, Washington, USA), анти-VEGF моноклональные антитела бевацизумаб (Genentech, inc. of South San Francisco, California) и Angiozyme™, синтетический рибозим от Ribozyme (Boulder, Colorado) и Chiron (Emeryville, California).
В комбинации с соединением формулы 1 можно вводить ингибиторы ErbВ2-рецептора, такие как GW-2S2974 (Glaxo Wellcome ple), и моноклональные антитела AR-209 (Aronex Pharmaceuticals Inc. of The Woodlands, Texas, USA) и 2В-1 (Chiron). Такие ингибиторы erbB2 включают ингибиторы, описанные в WO 98/02434 (дата публикации 22 января 1998), WO 99/35146 (дата публикации 15 июля 1999), WO 99/35132 (дата публикации 15 июля 1999), WO 98/02437 (дата публикации 22 января 1998), WO 97/13760 (дата публикации 17 апреля 1997), WO 95/19970 (дата публикации 27 июля 1995), патенте США 5537453 (дата выдачи 24 декабря 1996) и патенте США 5877305 (дата выдачи 2 марта 1999), каждый из которых во всей полноте включен в данное описание изобретения ссылкой. Ингибиторы ErbВ2-рецептора, полезные в настоящем изобретению, также описаны в предварительной заявке на патент США № 60/117341 (дата подачи 27 января 1999) и в предварительной заявке на патент США № 60/117, 346, дата подачи 27 января 1999, которые обе во всей их полноте включены в данное описание изобретения ссылкой.
Другие антипролиферативные агенты, которые можно использовать, включают ингибиторы фермента фарнезил-протеинтрансфераза и ингибиторы рецепторной тирозинкиназы PDGFR, в том числе соединения, раскрытые и заявленные в следующих заявках на патент США: 09/221946 (дата подачи 28 декабря 1998), 09/454058 (дата подачи 2 декабря 1999), 09/501163 (дата подачи 9 февряля 2000), 09/539930 (дата подачи 31 марта 2000), 09/202796 (дата подачи 22 мая 1997), 09/384339 (дата подачи 26 августа 1999) и 09/383755 (дата подачи 26 августа 1999), и соединения, раскрытые и заявленные в следующих предварительных заявках на патент США: 60/168207 (дата подачи 30 ноября 1999), 60/170119 (дата подачи 10 декабря 1999), 60/177718 (дата подачи 21 января 2000), 60/168217 (дата подачи 30 ноября 1999) и 60/200834 (дата подачи 1 мая 2000). Каждая из вышеуказанных заявок и предварительных заявок на патент США во всей ее полноте включена в данное описание изобретения ссылкой.
Соединение формулы 1 можно также использовать с другими агентами, полезными в лечении аномального клеточного роста или рака, включая, без ограничений, агенты, способные усиливать противоопухолевые иммунные ответы, такие как антитела к CTLA4 (антиген 4 цитотоксических лимфоцитов) и другие агенты, способные блокировать CTLA4, и антипролиферативные агенты, например другие ингибиторы фарнезил-протеинтрансферазы. Конкретные антитела к CTLA4, которые можно использовать в настоящем изобретении, включают антитела, описанные в предварительной заявке на патент США 60/113647 (дата подачи 23 декабря 1998), который во всей его полноте включен в данное описание изобретения ссылкой.
В еще одном воплощении данного изобретения предложена фармацевтическая композиция, содержащая соединение формулы 1 или его фармацевтически приемлемую соль, сольват или пролекарство и терапевтически эффективное количество доцетаксела.
В еще одном воплощении данного изобретения предложен способ лечения аномального клеточного роста у млекопитающего, включая человека, путем введения млекопитающему соединения формулы 1 или его фармацевтически приемлемой соли, сольвата или пролекарства и терапевтически эффективного количества доцетаксела. Соединение формулы 1 и доцетаксел можно вводить по отдельности или в одной и той же композиции и можно вводить по одной и той же схеме дозировки или при разных схемах дозировки, как желательно.
Определения
Используемое здесь понятие "аномальный клеточный рост" относится, если не указано иное, к клеточному росту, который не зависит от нормальных регуляторных механизмов (например, потеря контактного ингибирования). Это понятие охватывает аномальный рост (1) опухолевых клеток (опухолей), которые пролиферируют из-за экспрессии мутантной тирозинкиназы или повышенной экспрессии рецепторной тирозинкиназы; (2) доброкачественных и злокачественных клеток других пролиферативных заболеваний, при которых происходит аберрантная активация тирозинкиназы; и (4) любых опухолей, которые пролиферируют под действием рецепторныхтирозинкиназ.
Используемый здесь термин "лечение" означает, если не указано иное, реверсирование, облегчение, сдерживание прогрессирования или предупреждение расстройства или состояния, к которому этот термин применяется, или одного или более симптомов такого расстройства или состояния. Используемый здесь термин "проведение лечения" относится, если не указано иное, к акту лечения как "лечения", которое определено непосредственно выше.
Используемая здесь фраза "фармацевтически приемлемая(ые) соль(и)", если не указано иное, включает в себя соли, образованные кислотными или основными группами, которые могут присутствовать в соединении. Соединения, которые являются основными по своей природе, способны образовывать множество солей с различными неорганическими и органическими кислотами. Кислотами, которые можно использовать для получения фармацевтически приемлемых солей присоединения кислоты таких основных соединений, являются кислоты, которые образуют нетоксичные соли присоединения кислоты, то есть соли, содержащие фармакологически приемлемые анионы, такие как соли ацетат, бензолсульфонат, бензоат, бикарбонат, бисульфат, битартрат, борат, бромид, кальциевый эдетат, камсилат, карбонат, хлорид, клавуланат, цитрат, дигидрохлорид, эдетат, эдисилат, эстолат, эзилат, этилсукцинат, фумарат, глуцептат, глюконат, глутамат, гликолиларсанилат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, йодид, изотионат, лактат, лактобионат, лаурат, малат, малеат, манделат, мезилат, метилсульфат, мукат, напсилат, нитрат, олеат, оксалат, памоат (эмбонат), пальмитат, пантотенат, фосфат/дифосфат, полигалактуронат, салицилат, стеарат, субацетат, сукцинат, таннат, тартрат, теоклат, тозилат, триэтиодод и валерат.
Используемый здесь термин "пролекарство", если не указано иное, означает соединения, являющиеся предшественниками лекарственного средства, которые после введения высвобождают лекарственное средство in vivo в результате химического или физиологического процесса (например, пролекарство в условиях физиологического рН превращается в целевую форму лекарственного средства).
Изобретение также охватывает меченные изотопами соединения, которые идентичны соединениям формулы 1, за исключением того, что один или более атомов заменены атомом, имеющим атомную массу или массовое число, отличающееся от атомной массы или массового числа, обычно обнаруживаемых в природе. Примеры изотопов, которые могут быть введены в соединения по изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы фтора и хлора, например 2H, 3H, 13С, 14С, 15N, 18O, 17O, 31P, 32Р, 35S, 18F и 36Cl соответственно. Соединения по настоящему изобретению, их пролекарства и фармацевтически приемлемые соли и сольваты указанных соединений или указанных пролекарств, которые содержат вышеуказанные изотопы и/или другие изотопы других атомов, входят в объем данного изобретения. Некоторые меченные изотопами соединения по настоящему изобретению, например соединения, в которые введены радиоактивные изотопы, такие как 3H и 14C, полезны в анализах на распределение лекарственного средства и/или субстрата в тканях. Изотопы тритий, то есть 3H, и углерод-14, то есть 14С, особенно предпочтительны благодаря простоте их получения и детектирования. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий, то есть 2H, вследствие большей метаболической стабильности может давать определенные терапевтические преимущества, например увеличение периода полужизни in vivo или снижение требований к дозировке и, следовательно, может быть предпочтительным в некоторых обстоятельствах. Меченные изотопами соединения формулы 1 по данному изобретению и их пролекарства в общем могут быть получены путем проведения процедур, описанных для немеченого соединения, заменяя немеченый реагент легко доступным меченым реагентом. Краткое описание графических материалов
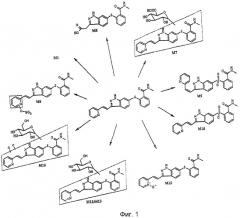
На Фиг.1 представлены метаболиты соединения формулы 1, идентифицированные у собак после введения однократной пероральной дозы 14С-меченого соединения.
На Фиг.2 представлены метаболиты соединения формулы 1, идентифицированные у мышей после введения однократной пероральной дозы 14С-меченного соединения.
Подробное описание изобретения
Соединение формулы 1 может быть получено, как описано в патентах США №№ 6531491 и 6534524 (дата выдачи 11 марта 2003 и 18 марта 2003 соответственно), которые во всей их полноте включены в данное описание ссылкой. Некоторые исходные вещества могут быть получены способами, известными специалистам в данной области, и некоторые синтетические модификации могут быть сделаны способами, известными специалистам в данной области.
Соединение формулы 1 способно образовывать множество разных солей с различными неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемыми для введения млекопитающим, на практике часто желательно сначала выделить соединение формулы 1 из реакционной смеси в виде фармацевтически неприемлемой соли, а затем просто превратить последнюю обратно в соединение - свободное основание путем обработки щелочным реагентом и последующего превращения этого свободного основания в фармацевтически приемлемую соль присоединения кислоты. Соли присоединения кислоты соединений-оснований по данному изобретению легко можно получить путем обработки соединения-основания по существу эквивалентным количеством выбранной минеральной или органической кислоты в среде водного растворителя или в подходящем органическом растворителе, таком как метанол или этанол. При осторожном выпаривании растворителя легко можно получить желаемую соль в виде твердого вещества. Желаемую соль кислоты можно также осадить из раствора свободного основания в органическом растворителе добавлением к этому раствору подходящей минеральной или органической кислоты.
Введение соединения формулы 1 можно осуществлять любым способом, который обеспечивает доставку соединения к месту действия. Эти способы включают пероральные пути, интрадуоденальные пути, парентеральную инъекцию (в том числе внутривенную, подкожную, внутримышечную, внутрисосудистую инъекцию или инфузию), местное и ректальное введение.
Соединение может быть предоставлено, например, в форме, подходящей для перорального введения в виде таблетки, капсулы, пилюли, порошка, препарата пролонгированного высвобождения, раствора, суспензии, для парентеральной инъекции в виде стерильного раствора, суспензии или эмульсии, для местного введения в виде мази или крема или для ректального введения в виде суппозитория. Соединение может быть в стандартных лекарственных формах, подходящих для однократного введения точных доз. Предпочтительно лекарственные формы содержат традиционный фармацевтический носитель или эксципиент и соединение формулы 1 в качестве активного ингредиента. Кроме того, лекарственные формы могут содержать другие медицинские или фармацевтические агенты, носители, адъюванты и т.д.
Примерами форм для парентерального введения являются растворы или суспензии в стерильных водных растворах, например водных растворах пропиленгликоля или декстрозы. Такие лекарственные формы могут быть подходящим образом забуферены, если это желательно.
Подходящие фармацевтические носители включают инертные разбавители или наполнители, воду и различные органические растворители. Фармацевтическая композиция может, если желательно, содержать дополнительные ингредиенты, такие как корригенты, связующие агенты, эксципиенты и тому подобные. Так, для перорального введения можно использовать таблетки, содержащие различные эксципиенты, такие как лимонная кислота, вместе с различными разрыхлителями, такими как крахмал, алгиновая кислота и некоторые сложные силикаты, и связующими агентами, такими как сахароза, желатин и аравийская камедь. Дополнительно, для таблетирования часто используют смазывающие агенты, такие как стеарат магния, лаурилсульфат натрия и тальк. Твердые композиции подобного типа можно также использовать в мягких и твердых желатиновых капсулах. Предпочтительные вещества для них включают лактозу или молочный сахар и высокомолекулярные полиэтиленгликоли. Когда для перорального введения желательны водные суспензии или эликсиры, активное соединение в них можно комбинировать с различными подсластителями или корригентами, красящими веществами или красителями и, если желательно, эмульгирующими агентами или суспендирующими агентами вместе с разбавителями, такими как вода, этанол, пропиленгликоль, глицерин или их комбинации.
В предпочтительных воплощениях лекарственных форм по данному изобретению лекарственная форма представляет собой пероральную лекарственную форму, более предпочтительно таблетку или капсулу.
В предпочтительных воплощениях способов по данному изобретению соединение формулы 1 вводят перорально, например с использованием описанной здесь пероральной лекарственной формы.
Эти способы включают введение соединения формулы 1 в любом желаемом режиме дозировки. В одном конкретном воплощении соединение вводят один раз в день (quaque die, или QD), предпочтительно два раза в день (bis in die, или BID), хотя более или менее частое введение входит в объем данного изобретения. Соединение можно вводить млекопитающему, включая человека, предпочтительно натощак (без пищи или питья в пределах 2 часов до и после введения). Особенно предпочтительна дозировка BID натощак.
Способы приготовления различных лекарственных форм с конкретным количеством соединения формулы 1 известны или очевидны специалистам в данной области. Например, смотри Remington's Pharmaceutical Sciences. Mack Publishing Company, Easter, Pa., 15th Edition (1975).
Величины 24-часовой AUC в плазме крови могут быть определены непосредственно измерением концентраций соединения формулы 1 или его активных метаболитов в плазме крови, например методом жидкостной хроматографии - тандемной масс-спектрометрии (ЖХ-МС/МС) при различных интервалах времени, и вычислением площади под кривой зависимости концентрации в плазме от времени. В данной области хорошо известны подходящие методы вычисления AUC, такие как, например, метод трапецеидальной аппроксимации,
где n означает число точек на графике, и ti и Ci означают время и концентрацию (значения х и у) для i-той точки на графике. Величины 24-часовой AUC могут быть определены путем нормализации измеренных концентраций в плазме крови согласно схеме дозирования. Для получения стандартов концентраций в раствор данного разведения добавляют бисульфит натрия в качестве стабилизатора.
Соединение формулы 1 имеет полезные свойства, относящиеся к модуляции и/или ингибированию киназной активности, ассоциированной с VEGF-R, FGF-R (рецептор фактора роста фибробластов), комплексами CDK (циклинзависимая киназа), СНК1 (чекпойнт киназа 1), CSF-R (рецептор фактора стволовых клеток) и/или LCK (лимфоцит-специфичная протеинтирозинкиназа).
Как показано ниже в примерах, соединение формулы 1 способно индуцировать апопотоз эндотелиальных клеток пуповины человека (HUVEC) in vitro, ингибировать опосредованное VEGF фосфорилирование Akt и eNOS (эндотелиальная синтаза оксида азота) в HUVEC, демонстрировать продолжительное ингибирующее действие на фосфорилирование VEGFR-2 в HUVEC после удаления соединения и ингибировать индуцированную PDGF ВВ миграцию раковых клеток на матриксном белке фибронектине. Соединение формулы 1 может обладать активностью против управляемого PDGFR развития опухоли посредством ингибирования миграции и инвазии.
Соединение формулы 1 также проявляет более сильную активность в ингибировании роста опухоли в комбинации с Taxol™, более предпочтительно с доцетакселем. При комбинированной терапии наблюдалась более значительная регрессия опухоли, чем с использованием каждого из агентов в отдельности.
Настоящее изобретение также относится к способам модулирования или ингибирования протеинкиназной активности, например в ткани млекопитающего, путем введения соединения формулы 1. Активность соединения по изобретению как модулятора протеинкиназной активности, такой как активность киназ, может быть измерена любым из методов, доступных специалистам в данной области, в том числе анализами in vivo и/или in vitro. Примеры подходящих анализов для измерения активности включают анализы, описанные в Parast С. et al., Biochemistry, 37, 16788-16801 (1998); Jeffrey et al., Nature, 376, 313-320 (1995); WIPO Международной публикации WO 97/34876; и WIPO Международной публикации WO 96/14843. Эти свойства можно оценить, например, используя одну или более методик биологического тестирования, изложенных ниже в примерах.
Приведенные ниже примеры и получения дополнительно иллюстрируют и дем