Фармацевтические композиции для лечения неврологических расстройств, содержащие декстрометорфан и хинидин
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к неврологии, и может быть использована при лечении больных с эмоциональной неустойчивостью, невропатической болью, нейродегенеративным заболеванием или мозговой травмой. Предложенные способы лечения неврологических расстройств включают введение средства, содержащего комбинацию декстрометорфана с хинидином. Способы позволяют существенно повысить системную доступность декстрометорфана за счет подавления хинидином метаболизма декстраметорфана, что уменьшает негативные последствия лечения неврологических расстройств. 4 н.п. ф-лы, 20 з.п. ф-лы, 7 ил., 57 табл.
Реферат
Область изобретения
Предложены фармацевтические композиции и способы лечения неврологических расстройств. Композиция включает декстрометорфан в комбинации с хинидином.
Предпосылки изобретения
Пациенты, страдающие от невродегенеративных болезней или мозговых повреждений, таких как вызываемые инсультом или повреждениями головы, зачастую угнетены эмоциональными проблемами, связанными с расстройством или нарушением их здоровья. Психиатры и неврологи используют термины эмоциональная неустойчивость и псевдобульбарный аффект для указания на ряд симптомов, обычно наблюдаемых у пациентов, страдающих от мозгового кровоизлияния, такого как при травме головы, инсульте, опухоли головного мозга или энцефалите, или у тех, кто страдает от прогрессирующего невродегенеративного заболевания, такого как амиотропного латерального склероза (АЛС, также называемого моторным поражением нейрона, или заболеванием Лоу Герига), болезни Паркинсона, болезни Альцгеймера или рассеянного склероза. В огромном большинстве подобных случаев у пациентов с двусторонним поражением (поражением, затрагивающим оба полушария мозга), затронувшим подкорковые структуры передних долей мозга, наблюдается эмоциональная неустойчивость.
Эмоциональная неустойчивость, в отличие от клинических видов реактивной или эндогенной депрессии, характеризуется перемежающимися спазматическими вспышками эмоций (обычно выражающимися в интенсивном, или даже взрывном плаче или смехе) в неподходящее время или при отсутствии какого-либо раздражителя. Эмоциональную неустойчивость или псевдобульбарный аффект описывают терминами эмоциональность, эмоциональная несдержанность, эмоциональная неконтролируемость, чрезмерная эмоциональность, патологическая смешливость и слезливость. Создается ощущение, что симптомы эмоциональной неустойчивости зачастую описывают такими терминами, как "несвязанность", поскольку пациенты совершенно уверены, что вспышка не соответствует конкретной ситуации, но они не могут контролировать выражения своих эмоций.
Эмоциональная неустойчивость, или псевдобульбарный аффект, становится клинической проблемой, когда неспособность контролировать эмоциональные взрывы существенным образом проявляется в семейных, личных или деловых отношениях. Например, бизнесмен на ранней стадии АЛС или болезни Паркинсона может оказаться неспособным высиживать деловые совещания, или пациент может оказаться неспособным посещать общественные места, такие как ресторан или кино, из-за кратковременных, но интенсивных приступов неспособности удержаться от плача или смеха в неподходящее время перед лицом других людей. Эти симптомы могут проявляться даже тогда, когда пациент все еще имеет более чем достаточно энергии и внутренних резервов организма для выполнения физических действий, необходимых для взаимодействия с другими людьми. Подобные вспышки вместе с сопровождающим их ощущением раздражительности, неадекватности и смущения от видимого эффекта, оказываемого на других людей, могут существенно отягчать другие симптомы болезни; они приводят к ощущению остракизма, отчуждения и изоляции и могут сильно затруднить оказание со стороны друзей и членов семьи толерантной и щадящей эмоциональной поддержки пациенту.
Существо изобретения
Существует потребность в дополнительных или улучшенных лечебных формах для лечения эмоциональной неустойчивости и других хронических расстройств, таких как хронические боли. Подобное лечение должно приводить, предпочтительно, по меньшей мере в определенной степени, к улучшению, сравнимому с улучшением от других известных лечебных форм, по меньшей мере, у некоторых пациентов. Желательно наличие способа лечения эмоциональной неустойчивости, по меньшей мере, у некоторых пациентов, страдающих от невротического упадка, такого как прогрессирующее невротическое расстройство.
Предлагается способ лечения эмоциональной неустойчивости, или псевдобульбарного аффекта, и других хронических состояний больных людей, нуждающихся в подобном лечении, без пререуспокоения или иного существенного воздействия на сознание или реактивность. Предлагаемое лечение включает назначение декстрометорфана в комбинации с минимальной дозировкой хинидина.
В первом варианте предлагается способ лечения псевдобульбарного аффекта, или эмоциональной неустойчивости, включающий назначение требующему лечения пациенту декстрометорфана в комбинации с хинидином, причем количество назначаемого декстрометорфана составляет примерно от 20 мг в день до 200 мг в день, а количество назначаемого хинидина составляет примерно от 10 мг в день до менее 50 мг в день.
В аспекте первого варианта псевдобульбарный аффект, или эмоциональная неустойчивость, вызван невродегенеративным заболеванием или состоянием или поражением мозга.
Во втором варианте предлагается способ лечения невропатической боли, включающий назначение требующему лечения пациенту декстрометорфана в комбинации с хинидином, причем количество назначаемого декстрометорфана составляет примерно от 20 мг в день, до 200 мг в день, а количество назначаемого хинидина составляет примерно от 10 мг в день до менее 50 мг в день.
В третьем варианте предлагается способ лечения невродегенеративного заболевания или состояния, включающий назначение требующему лечения пациенту декстрометорфана в комбинации с хинидином, причем количество назначаемого декстрометорфана составляет примерно от 20 мг в день до 200 мг в день, а количество назначаемого хинидина составляет примерно от 10 мг в день до менее чем 50 мг в день.
В аспекте третьего варианта невродегенеративное заболевание или состояние выбирается из группы, состоящей из амиотропного латерального склероза, рассеянного склероза, болезни Паркинсона и болезни Альцгеймера.
В четвертом варианте предлагается способ лечения мозгового поражения, включающий назначение требующему лечения пациенту декстрометорфана в комбинации с хинидином, причем количество назначаемого декстрометорфана составляет примерно от 20 мг в день до 200 мг в день, а количество назначаемого хинидина составляет примерно от 10 мг в день до менее чем 50 мг в день.
В аспекте четвертого варианта мозговое поражение выбирают из группы, состоящей из инсульта, травматического мозгового поражения, ишемической болезни, гипоксии и некроза нейронов.
В аспекте с первого по четвертый вариант декстрометорфан и хинидин назначают в виде одной комбинированной дозы в день.
В аспекте с первого по четвертый вариант декстрометорфан и хинидин назначают также в виде, по меньшей мере, двух комбинированных доз в день.
В аспекте с первого по четвертый вариант количество назначаемого декстрометорфана составляет примерно от 20 мг в день до 45 мг в день.
В аспекте с первого по четвертый вариант количество назначаемого декстрометорфана составляет также примерно от 20 мг в день до 60 мг в день.
В аспекте с первого по четвертый вариант, по меньшей мере, один из компонентов, хинидин или декстрометорфан, имеет форму фармацевтически приемлемой соли.
В аспекте с первого по четвертый вариант фармацевтически приемлемую соль выбирают из группы, состоящей из солей щелочных металлов, солей лития, солей натрия, солей калия, солей щелочноземельных металлов, солей кальция, солей магния, солей лизина, солей N,N′-дибензилэтилендиамина, солей хлоропрокаина, солей хлолина, солей диэтаноламина, солей этилендиамина, солей меглюмина, солей прокаина, солей трис, солей свободных кислот, солей свободных оснований, неорганических солей, солей сульфатов, солей гидрохлорида и солей гидробромида.
В аспекте с первого по четвертый вариант хинидин имеет форму сульфата хинидина, а декстрометорфан - гидробромида декстрометорфана, причем количество назначаемого сульфата хинидина составляет примерно от 30 мг в день до 60 мг в день, а количество назначаемого гидробромида декстрометорфана составляет примерно от 30 мг в день до 60 мг в день
В пятом варианте предлагается способ лечения псевдобульбарного аффекта, или эмоциональной неустойчивости, включающий назначение требующему лечения пациенту декстрометорфана в комбинации с хинидином, причем декстрометорфан и хинидин назначают в комбинированной дозе, а весовое отношение декстрометорфана к хинидину в комбинированной дозе составляет примерно 1:1,25 или менее.
В аспекте пятого варианта псевдобульбарный аффект, или эмоциональная неустойчивость, вызвана невродегенеративным заболеванием или состоянием или поражением мозга.
В шестом варианте предлагается способ лечения невропатической боли, включающий назначение требующему лечения пациенту декстрометорфана в комбинации с хинидином, причем декстрометорфан и хинидин назначают в комбинированной дозе, а весовое отношение декстрометорфана к хинидину в комбинированной дозе составляет примерно 1:1,25 или менее.
В седьмом варианте предлагается способ лечения невродегенеративного заболевания или состояния, включающий назначение требующему лечения пациенту декстрометорфана в комбинации с хинидином, причем декстрометорфан и хинидин назначают в комбинированной дозе, а весовое отношение декстрометорфана к хинидину в комбинированной дозе составляет примерно 1:1,25 или менее.
В аспекте седьмого варианта невродегенеративное заболевание или состояние выбраны из группы, состоящей из амиотропного латерального склероза, рассеянного склероза, болезни Паркинсона и болезни Альцгеймера.
В восьмом варианте предлагается способ лечения поражений мозга, включающий назначение требующему лечения пациенту декстрометорфана в комбинации с хинидином, причем декстрометорфан и хинидин назначают в комбинированной дозе, а весовое отношение декстрометорфана к хинидину в комбинированной дозе составляет примерно 1:1,25 или менее.
В аспекте восьмого варианта поражение мозга выбирают из группы, состоящей из инсульта, травматического поражения мозга, ишемической болезни, гипоксии и некроза нейронов.
В аспекте с пятого по восьмой вариант весовое отношение декстрометорфана к хинидину в комбинированной дозе составляет примерно 1:0,75 или менее.
В аспекте с пятого по восьмой вариант, количество назначаемого хинидина составляет примерно от 20 мг в день до 45 мг в день, а количество назначаемого декстрометорфана составляет примерно от 20 мг в день до 60 мг в день
В аспекте с пятого по восьмой вариант, по меньшей мере, одно вещество из хинидина и декстрометорфана берется в виде фармацевтически приемлемой соли.
В аспекте с пятого по восьмой вариант фармацевтически приемлемую соль выбирают из группы, состоящей из солей щелочных металлов, солей лития, солей натрия, солей калия, солей щелочноземельных металлов, солей кальция, солей магния, солей лизина, солей N,N′-дибензилэтилендиамина, солей хлоропрокаина, солей хлорина, солей диэтаноламина, солей этилендиамина, солей меглюмина, солей прокаина, солей триз, солей свободных кислот, солей свободных оснований, неорганических солей, солей сульфата, солей гидрохлорида и солей гидробромида.
В аспекте с пятого по восьмой вариант хинидин включает сульфат хинидина, а декстрометорфан включает гидробромид декстрометорфана, причем количество назначаемого сульфата хинидина составляет примерно от 30 мг в день до 60 мг в день, а количество назначаемого гидробромида декстрометорфана составляет примерно от 30 мг в день до 60 мг в день
В аспекте с пятого по восьмой вариант назначают одну комбинированную дозу в день.
В аспекте с пятого по восьмой вариант назначают две или более комбинированные дозы в день.
В девятом варианте предлагается фармацевтическая композиция, пригодная для лечения псевдобульбарного аффекта, или эмоциональной неустойчивости, в виде таблеток или капсул, включающих декстрометорфан и хинидин, причем весовое отношение декстрометорфана к хинидину составляет примерно 1:1,25 или менее.
В аспекте девятого варианта, псевдобульбарный аффект, или эмоциональная неустойчивость, вызвана невродегенеративным заболеванием или состоянием, или поражением мозга.
В десятом варианте предлагается фармацевтическая композиция, пригодная для лечения невропатической боли, в виде таблеток или капсул, включающих декстрометорфан и хинидин, причем весовое отношение декстрометорфана к хинидину составляет примерно 1:1,25 или менее.
В одиннадцатом варианте, предлагается фармацевтическая композиция, пригодная для лечения невродегенеративного заболевания или состояния, в виде таблеток или капсул, включающих декстрометорфан и хинидин, причем весовое отношение декстрометорфана к хинидину составляет примерно 1:1,25 или менее.
В аспекте одиннадцатого варианта невродегенеративное заболевание или состояние выбраны из группы, состоящей из амиотропного латерального склероза, рассеянного склероза, болезни Паркинсона и болезни Альцгеймера.
В двенадцатом варианте предлагается фармацевтическая композиция, пригодная для лечения поражений мозга, в виде таблеток или капсул, включающих декстрометорфан и хинидин, причем весовое отношение декстрометорфана к хинидину составляет примерно 1:1,25 или менее.
В аспекте двенадцатого варианта поражение мозга выбирают из группы, состоящей из инсульта, травматического поражения мозга, ишемической болезни, гипоксии и некроза нейронов.
В аспектах с девятого по двенадцатый вариант весовое отношение декстрометорфана к хинидину составляет примерно 1:0,75 или менее.
В аспектах с девятого по двенадцатый вариант хинидин представлен в количестве примерно от 20 мг до 45 мг, а декстрометорфан представлен в количестве примерно от 20 мг до 60 мг.
В аспектах с девятого по двенадцатый вариант, по меньшей мере, одно вещество из хинидина и декстрометорфана берут в виде фармацевтически приемлемой соли.
В аспектах с девятого по двенадцатый вариант фармацевтически приемлемую соль выбирают из группы, состоящей из солей щелочных металлов, солей лития, солей натрия, солей калия, солей щелочноземельных металлов, солей кальция, солей магния, солей лизина, солей N,N′-дибензилэтилендиамина, солей хлоропрокаина, солей хлорина, солей диэтаноламина, солей этилендиамина, солей меглюмина, солей прокаина, солей триз, солей свободных кислот, солей свободных оснований, неорганических солей, солей сульфата, солей гидрохлорида и солей гидробромида.
В аспектах с девятого по двенадцатый вариант хинидин включает сульфат хинидина, а декстрометорфан включает гидробромид декстрометорфана, причем сульфат хинидина представлен в количестве примерно от 30 мг до 60 мг, а гидробромид декстрометорфана представлен в количестве примерно от 30 мг в день до 60 мг.
В тринадцатом варианте предложено применение декстрометорфана и хинидина для приготовления лекарства для лечения псевдобульбарного аффекта, или эмоциональной неустойчивости, причем лекарство приготовляют в виде капсул или таблеток, а декстрометорфан и хинидин находятся в этих капсулах или таблетках в весовом отношении декстрометорфана к хинидину 1:1,25 или менее.
В аспекте тринадцатого варианта псевдобульбарный аффект, или эмоциональная неустойчивость, вызвана невродегенеративным заболеванием или состоянием или поражением мозга.
В четырнадцатом варианте предложено применение декстрометорфана и хинидина для приготовления лекарства для лечения невропатической боли, причем лекарство приготовляют в виде капсул или таблеток, а декстрометорфан и хинидин находятся в этих капсулах или таблетках в весовом отношении декстрометорфана к хинидину 1:1,25 или менее.
В пятнадцатом варианте предложено применение декстрометорфана и хинидина для приготовления лекарства для лечения неврогенеративного заболевания или состояния, причем лекарство приготовляют в виде капсул или таблеток, а декстрометорфан и инидин находятся в этих капсулах или таблетках в весовом отношении декстрометорфана к хинидину 1:1,25 или менее.
В аспекте пятнадцатого варианта невродегенеративное заболевание или состояние выбраны из группы, состоящей из амиотропного латерального склероза, рассеянного склероза, болезни Паркинсона и болезни Альцгеймера.
В шестнадцатом варианте предложено применение декстрометорфана и хинидина для приготовления лекарства для лечения поражений мозга, причем лекарство приготовляют в виде капсул или таблеток, а декстрометорфан и хинидин находятся в этих капсулах или таблетках в весовом отношении декстрометорфана к хинидину 1:1,25 или менее.
В аспекте шестнадцатого варианта поражение мозга выбирают из группы, состоящей из инсульта, травматического поражения мозга, ишемической болезни, гипоксии и некроза нейронов.
В аспектах с тринадцатого по шестнадцатый вариант декстрометорфан и хинидин приготовляют в виде капсул или таблеток в весовом отношении декстрометорфана к хинидину 1:0,75 или менее.
В аспектах с тринадцатого по шестнадцатый вариант, по меньшей мере, одно вещество из хинидина и декстрометорфана берется в виде фармацевтически приемлемой соли.
В аспектах с тринадцатого по шестнадцатый вариант фармацевтически приемлемую соль выбирают из группы, состоящей из солей щелочных металлов, солей лития, солей натрия, солей калия, солей щелочноземельных металлов, солей кальция, солей магния, солей лизина, солей N,N′-дибензилэтилендиамина, солей хлоропрокаина, солей хлорина, солей диэтаноламина, солей этилендиамина, солей меглюмина, солей прокаина, солей триз, солей свободных кислот, солей свободных оснований, неорганических солей, солей сульфата, солей гидрохлорида и солей гидробромида.
В аспектах с тринадцатого по шестнадцатый вариант хинидин включает сульфат хинидина, а декстрометорфан включает гидробромид декстрометорфана, причем сульфатхинидина представлен в количестве примерно от 30 мг до 60 мг, а гидробромид декстрометорфана представлен в количестве примерно от 30 мг до 60 мг.
В аспектах с тринадцатого по шестнадцатый вариант хинидин представлен в количестве примерно от 20 мг до 45 мг, а декстрометорфан представлен в количестве примерно от 20 мг до 60 мг.
Краткое описание чертежей
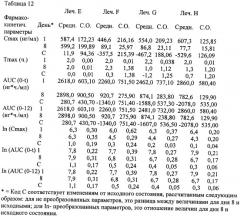
На фиг.1 представлена диаграмма показателей CNS-LS для клинического исследования № 4. Распределения показателей CNS-LS симметричны, они имеют только одно запредельное значение. Эти распределения подтверждают возможность использования ANCOVA для анализа показателей CNS-LS. Как предположено в протоколе исследования, различия в среднем улучшении показателей CNS-LS соответствуют показателям CNS-LS для центра и основания при анализе с использованием линейной регрессии согласно методу ANCOVA Фризона и Полока. Результаты этого анализа показаны в таблице 30. В этой таблице приведены также результаты дополнительного анализа показателей CNS-LS без приведения или с приведением только к основанию.
На фиг.2 представлена диаграмма, показывающая приведенное среднее сокращение показателей CNS-LS для трех лечебных групп из первичного анализа эффективности для участников ITT из клинического исследования № 4. Уменьшение показателя CNS-LS ниже горизонтальной линии статистически существенно отличаются от 30DM/30Q на значительной части указанных уровней.
На фиг.3 представлено распределение объектов, участвовавших в клиническом исследовании № 5, по группам MTD.
Фиг.4 показывает среднюю оценку сна из дневников объектов, участвовавших в клиническом исследовании № 5.
Фиг.5. Средняя оценка интенсивности ощущаемой боли из дневников объектов, участвовавших в клиническом исследовании № 5.
Фиг.6. Средняя оценка активности из дневников объектов, участвовавших в клиническом исследовании № 5.
Фиг.7. Средняя оценка боли из дневников объектов, участвовавших в клиническом исследовании № 5.
Подробное описание предпочтительных вариантов осуществления изобретения
Следующее описание и примеры подробно иллюстрируют предпочтительный вариант настоящего изобретения. Специалистам в данной области очевидно, что имеются многочисленные варианты и модификации данного изобретения, входящие в его объем. Соответственно, описание предпочтительных вариантов не должно считаться ограничивающим объем настоящего изобретения.
Эмоциональная неустойчивость, или псевдобульбарный аффект, связан с рядом неврологических заболеваний, подобных инсульту (Хоуз и др., BMJ, 1989; 298: 991-4), рассеянному склерозу (Котрелл и др., J. NEUROL. PSYCHOPATHOL., 1926; 7: 1-30; Файнштейн и др., ARCH. NEUROL., 1997; 54: 1116-21), амиотропному латеральному склерозу (ALS) (Миллер и др., NEUROL., 1999; 52: 1311-23; Джексон и др., SEMIN. NEUROL. 1998; 18: 27-39; Поек К., Патофизиология эмоциональных расстройств, связанных с повреждением мозга, в П.Дж.Винкен, Г.В.Брюн, издатели, Справочник клинической неврологии, Амстердам, Северо-Голландская издательская компания, 1969, стр.343-67), болезни Альцгеймера (Штаркштейн и др., J. NEUROL. NEUROSURG. PSYCHIATRY, 1995; 59: 55-64) и травматическому поражению мозга (Брукс Н., АСТА NEUROCHIRURGICA SUPPL., 44, 1988; 59-64). Исследования позволили предположить, что псевдобульбарный аффект диагностируется почти у 50% пациентов с ALS (Галлахер Дж.П., АСТА NEUROL. SCAND. 1989; 80: 114-7).
Эмоциональная неустойчивость, или псевдобульбарный аффект, в контексте неврологического поражения может рассматриваться как синдром разъединения, возникающий в результате потери корковых соединений со стволом мозга или мозжечком (Вильсон Сак, J. NEUROL. PSYCHOPATHOL., 1924; IV: 299-333; Парвивзи и др., Brain, 2001; 124: 1708-19). На нейротрансмиттерном уровне проявляются разрушения восходящих и нисходящих дофаминергических связей, возникающих в стволе мозга, разрегуляция дофаминергических проекций на слои и кору головного мозга (Анденсен и др., Stroke, 1994; 25: 1050-2; Росс и др., J. NERV. MENT. DIS., 1987; 175: 165-72; Шав и др.., Учение о мозге в психиатрии, Лондон, Буттенворс, 1982; Удака и др., ARCH. NEUROL. 1984; 41: 1095-6).
Ряд свидетельств показывает, что псевдобульбарный аффект может быть модулирован посредством фармакологического вмешательства. Вольф сообщал в 1979 г., что леводопа оказалась эффективной при лечении патологического смеха (Вольф и др., NEUROL., 1979; 29: 1435-6). Однако при последующем изучении только 10 из 25 объектов удовлетворительно реагировали на лечение (Удака и др., ARCH. NEUROL., 1984; 41: 1095-6). Имеются сообщения о симптоматических успехах при применении других лекарств, включая амантадин, имипрамин, дезипрамин, нортриптулин, амитриптулин, сертралин, флюоксетин, леводопу, метилфенидат и гормон высвобождения тиуротропина (Дарк и др., AUSTR. N. Zeal. J. Psychiatry, 1996; 30: 472-9; Ланнокон и др., CLIN. NEUROPHARM., 1996; 19: 532-5).
Наилучшие ранее известные средства лечения эмоциональной неустойчивости включают амитрифтулин, амантадин и леводопу. Хотя в таких публикациях, как Удака и др., ARCH. NEUROL., 1984; 41: 1095-1096, и Шиффера и др., N. ENGL. J. MED. 1985, 312: 1480-1482, указывается, что эти составы могут эффективно оказывать помощь в уменьшении проявления патологических эмоций у некоторых пациентов, становится ясно, что ни один из этих ранее известных препаратов не является эффективным для всех пациентов, и даже у пациентов, получавших определенное облегчение, эффект был далек от эффективного излечения. Обычной практикой многих клинических неврологов является назначение амитрифтина и амантадина, по одному на прием, в надежде, что один из них сможет оказаться способным обеспечить некоторый уровень улучшения состояния пациента. Однако оба препарата далеки от обеспечения эффективного лечения. Кроме того, леводопа не удовлетворительна, поскольку она оказывает другие действия и является относительно мощным препаратом.
ALS является невродегенеративным заболеванием, вызываемым прогрессирующей потерей верхних и нижних моторных нейронов. До 50 процентов пациентов с ALS проявляют эмоциональную неустойчивость, и она наиболее превалирует у пациентов с бульбарной формой ALS (Галлахер Дж.П., АСТА NEUROL. SCAND., 1989; 80: 114-7). Основываясь на замечании, что экзитотоксичность, вторичная по отношению к ухудшению рециркуляции глютамата, может явиться фактором в этиологии ALS, для его лечения использовали рилузол, подавляющий высвобождения глютамата (Ерусалем и др., NEUROLOGY, 1996; 47: S218-20; Добле A., NEUROLOGY, 1996; 47: S233-41). Рилузол умеренно продлевает период жизни, но не обеспечивает симптоматических улучшений (Бензимон и др., N. ENG. J. MED., 1994, 330: 585-91; Квииечински X., NEUROL. NEUROCHIR. POL., 2001, 35: 51-9).
Поскольку возможность того, что экзитотоксический процесс с вовлечением глютамата этиологически вовлечен в ALS, некоторые исследователи пытались модифицировать или остановить течение ALS путем назначения декстрометорфана (DM). DM является неконкурентным антагонистом N-метил-D-аспартат-чувствительного ионотропного рецептора глютамата, и его действие уменьшает уровень возбудительной активности. Однако DM в значительной степени метаболизуется в декстрорфан (DX) и в ряд других метаболитов. Цитохром Р4502D6 (CYP2D6) является ключевым энзимом, отвечающим за образование DX из DM. На части популяции, 5-10% кавказцев, обнаруживалась уменьшенная активность этого энзима (Гильдебранд и др., EUR. J. CLIN. PHARMACOL., 1989; 36: 315-318). На подобных индивидуумов ссылались, как на "слабых метаболизаторов" DM, в отличие от большинства наблюдавшихся, на которых ссылались, как на "сильных метаболизаторов" DM (Веттикаден и др., Pharm. Res., 1989; 6: 13-9).
Был проведен ряд лабораторных исследований для определения типов лекарств, способных подавлять активность CYP2D6. Из всех исследованных препаратов хинидин (Q) оказался одним из наиболее мощных (Инаба и др., BR. J. CLIN. PHARMACOL., 1986; 22: 199-200). Эти наблюдения привели к гипотезе, что сопутствующее назначение Q может увеличивать концентрацию DM в плазме.
Ряд хронических расстройств, иных, чем эмоциональная неустойчивость, также имеют симптомы, вылечиваемые с большим трудом и зачастую не реагирующие на безопасные, не вызывающие привыкания нестероидные лекарства. Расстройства, подобные трудноизлечимому кашлю, не реагируют на традиционные лекарства и обычно лечатся такими медикаментами, как кодеин, морфин или антивоспалительным стероидом преднизолоном. Эти медикаменты неприемлемы для длительного применения из-за опасных побочных эффектов, долгосрочных рисков здоровью пациента или опасности привыкания. Не имеется удовлетворительного лечения для тяжелых видов чесотки и сыпи, связанных с дерматитом. Использовались средства, подобные преднизолону, и даже трицикличные антидепрессанты, равно как и локальные препараты, однако они не приносили существенного и стойкого облегчения. Хронические боли, вызванные такими явлениями, как инсульт, рак или травма, равно как и невропатическая боль, вызываемая такими обстоятельствами, как диабет и опоясывающий лишай (герпес зостер), например, также представляют собой проблемы, сопротивляющиеся лечению. Невропатические боли включают, например, диабетическую невропатию, постгерпесную невралгию, фантомную боль конечностей, тригеминальную невралгию и ишиас. Постгерпесная невралгия (PHN), являющаяся осложнением опоясывающего лишая, наблюдается примерно у 10% больных герпес зостер. Случаи PHN учащаются с возрастом. Диабетическая невропатия является обычным осложнением диабета при увеличении длительности заболевания. Боли при этих типах невропатий описывают, как обжигающая постоянная боль, зачастую перемежающаяся колющими болями, болями, как от иголочных и булавочных уколов, и болью, подобной зубной боли. Кожа становится чувствительной к неэстетическим ощущениям, даже к легкому прикосновению и к одежде. Боль может усиливаться при активной деятельности температурных изменениях, эмоциональном возбуждении. Боль может быть настолько сильной, что она препятствует повседневной деятельности или приводит к нарушению сна или потере аппетита. Механизм, приводящий к болям этого типа, понят не очень хорошо, однако он может включать перерождение миелизированных нервных волокон. Известно, что при диабетической невропатии перерождение как малых, так и больших нервных волокон приводит к уменьшению порога толерантности к термическому воздействию, боли и вибрациям. Дисфункция как больших, так и малых нервных волокон имеет более тяжелые последствия, когда боль развивается в нижних конечностях. Большинство физиологических измерений на нервах, которые обычно проводились у пациентов, испытывающих невропатическую боль, показывали замедление проводимости нервов со временем. На сегодня лечение невропатической боли далеко не всегда является успешным. По оценкам, хронические боли являются уделом миллионов людей.
Декстрометорфан широко используется в качестве сиропа от кашля, и он показал себя достаточно безопасным при назначении людям, чтобы разрешить его использование без рецепта. Он высокотолерантен при приеме внутрь, как один, так и вместе с хинидином, в дозах до 120 миллиграмм (мг) в день, причем положительный эффект наблюдается и при значительно меньших дозах (например, 30 мг в день) (патент США Смита, № 5.206.248).
Химия декстрометорфана и его аналогов описана в различных источниках, таких как Родд Е.А., издатель, Химия углеродных соединений, ELSEVIER PUBL., N.Y., 1960; Гудман и Гильман, Фармакологические основы терапии, CHOI, BRAIN RES., 1987, 403: 333-336; и патент США № 4.806.543. Он имеет следующую химическую структуру:
Декстрометорфан - это общепринятое название (+)-3-метокси-N-метилморфинана. Он один из класса молекул, являющихся правовращающими аналогами морфиноподобных опиоидов. Термин "опиат" относится к веществам, выделяемым из опия, таким как морфин и кодеин. Термин "опиоид" более широк. Он включает опиаты, а также другие препараты, естественные или синтетические, действующие на млекопитающих, как анальгетики и седативы.
Большинство вызывающих привыкание снимающих боль опиатов, таких как морфин, кодеин и героин, являются левовращающими стереоизомерами (они поворачивают поляризованный свет в так называемом направлении левой руки). Они имеют четыре молекулярных кольца в конфигурации, известной как "морфинанная" структура, которая описывается следующим образом:
В этом описании атомы углерода обычно нумеруют, как показано, и клинообразные связи атомов углерода 9 и 13 показывают, что эти связи поднимаются от плоскости, в которой лежат три других кольца морфинанной структуры. Многие аналоги этой базисной структуры (включая морфин) являются пентациклическими соединениями, имеющими дополнительное кольцо, образованное мостовыми атомами (такими как атомы кислорода) между атомами углерода номера 4 и 5.
Большинство правовращающих аналогов морфина в значительно меньшей степени вызывают привыкание, чем левовращающие соединения. Некоторые из правовращающих аналогов, включая декстрометорфан и декстрорфан, являются энантиомерами морфинанной структуры. В этих энантиомерах кольцо, отходящее от атомов углерода 9 и 13, ориентировано в противоположном направлении от показанного в вышеупомянутой структуре.
Не имея намерения ограничиться каким-либо конкретным механизмом действия, отметим, что декстрометорфан имеет, по меньшей мере, три различных вида рецепторного действия, влияющих на нейроны центральной нервной системы (CNS). Во-первых, он действует как антагонист на рецепторы N-метил-D-аспарата (NMDA). Рецепторы NMDA являются одними из трех главных типов рецепторов возбудительных аминокислот (ЕАА) в CNS нейронах. Поскольку возбуждение рецепторов NMDA приводит к выделению нейронами возбудительных нейротрансмиттерных молекул (главным образом, глютамина, аминокислоты), блокирующее действие декстрометорфана на эти рецепторы уменьшает уровень возбудительного действия в нейронах, имеющих эти рецепторы. Считается, что декстрометорфан действует на узел, связывающий фенциклидин (РСР), который является частью рецепторного комплекса NMDA. Декстрометорфан относительно слаб в своем действии антагониста NMDA, в особенности, в сравнении с такими препаратами, как МК-801 (дизоцильпин) и фенциклидин. Соответственно, при назначении в одобренных дозах не ожидается, что декстрометорфан может вызвать токсический побочный эффект (обсуждено в патенте США № 5.034.400 на имя Олней), который вызывается мощными антагонистами NMDA, такими как МК-801 или РСР.
Декстрометорфан действует также как антагонист на некоторые типы ингибиторных рецепторов; в отличие от рецепторов ЕАА, возбуждение ингибиторных рецепторов подавляет высвобождение возбудительных нейротрансмиттеров пораженных клеток. Первоначально эти ингибиторные рецепторы называли рецепторами сигма опиатов. Однако возник вопрос, являются ли они в действительности рецепторами опиатов, поэтому их теперь обычно называют сигма (А) рецепторами. Последующие эксперименты показали, что декстрометорфан также связывает другой класс ингибиторных рецепторов, довольно близких, но отличных от сигма-рецепторов. Свидетельством того, что не-сигма ингибиторные рецепторы существуют и они связываются декстрометорфаном, является то, что некоторые молекулы, связанные с сигма-рецепторами, полностью не способны блокировать связывание декстрометорфана с определенными типами нейронов, имеющих ингибиторные рецепторы (Мусаччио и др., CELL MOL. NEUROBIOL., 1988 JUN., 8 (2): 149-56; Мусаччио и др., J. PHARMACOL. EXP. THER., 1988 NOV., 247 (2):424-31; Кравизо и др., MOL. PHARMACOL., 1983 MAY, 23 (3): 629-40; Кравизо и др., MOL. PHARMACOL., 1983 MAY, 23 (3): 619-28; и Клейн и др., NEUROSCI. LETT., 1989 FEB. 13, 97 (1-2): 175-80). Эти рецепторы обычно называют в научной литературе "высокосходными рецепторами декстрометорфана" или просто "DM-рецепторами". Используемое здесь понятие "декстрометорфан-связанные ингибиторные рецепторы" включает как сигма-, так и не-сигма-рецепторы, которые вступают в сходно-связанные реакции с декстрометорфаном и которые, при активации декстрометорфаном, подавляют освобождение возбудительных нейротрансмиттеров пораженных клеток (Ларгент и др., MOL. PHARMACOL., 1987 DEC., 32 (6): 772-84).
Декстрометорфан также уменьшает потребление нейронами ионов кальция (Са++). Потребление кальция, происходящее при передаче нервных импульсов, происходит по, по меньшей мере, двум различным типам каналов, известных как N-каналы и L-каналы. Декстрометорфан довольно сильно подавлял потребление кальция у некоторых типов культур нейронов (синаптозомеров), которые содержали N-каналы; он подавлял также потребление кальция, хотя и не так сильно, у других культур нейронов (клеток PC12), которые содержали L-каналы (Карпентер и др., BRAIN RES., 1988 JAN. 26, 439 (1-2): 372-5).
Растущее количество доказательств говорит о том, что декстрометорфан имеет терапевтический потенциал для лечения нескольких нейронных нарушений (Занг и др., CLIN. PHARMACOL. THER. 1992; 51: 647-655; Пальмер Г.С., CURR. DRUG TARGETS, 2001; 2: 241-271; и Лиу и др., J. PHARMACOL. EXP. THER. 2003; 21: 21; Ильм и др., LIFE SCL, 2003; 72: 769-783). Фармакологические исследования показали, что DM в ряде экспериментальных моделей показал себя неконкурентным антагонистом NMDA, обладающим нейрозащитным, антиконвульсивным и антиноцицептическим действием (Десмулес и др., J. PHARMACOL. EXP. THER., 1999; 288: 607-612). Помимо действия как антагонист NMDA и DM, и его основной метаболит, декстрорфан, связываясь с сигма-положениями, подавляет каналы тока кальция и взаимодействует с запертыми высоким потенциалом каналами натрия (Диклсенсон и др., NEUROPHARMACOLOGY, 1987; 26: 1235-1238; Карпентер и др., BRAIN RES., 1988; 439: 372-375; Нетцер и др., EUR. J. PHARMACOL., 1993; 238: 209-216). Последние сообщения указывают на то, что дополнительный нейрозащитный механизм действия DM может включать взаимодействие с воспалительной реакцией, связанной с определенными нейродегенеративными расстройствами, такими как болезнь Паркинсона и болезнь Альцгеймера (Лиу и др., J. PHARMACOL. EXP. THER, 2003; 21: 21). Потенциальная эффективность DM как нейропротектанта исследовалась в ограниченных клинических опытах на пациентах с амиотропным латеральным склерозом (Гредал и др., ACTANEUROL. SCAND. 1997; 96: 8-13; Блин и др., CLIN. NEUROPHARMACOL., 1996; 19: 189-192), болезнью Хатчингсона (Валкер и др., CLIN. NEUROPHARMACOL., 1989; 12: 322-330) и болезнью Паркинсона (Чейз и др., J. NEUROL., 2000; 247 Suppi 2: 1136-42). DM исследовали также на пациентах с различными типами невропатических болей (Мак Квай и др., PAIN, 1994; 59: 127-133; Винк А.И., AM. J. MED., 1999; 107: 17S-26S; Вейнбрум и др., CAN. J. ANAESTH, 2000, 47: 585-596; Санг и др., ANESTHESIOLOGY, 2002, 96: 1053-1061; Хеейсканени др., PAIN, 2002, 96: 261-267; Бен Абрахам и др., CLIN. J. PAIN, 2002; 18: 282-285; Санг С.Н., J. PAIN SYMPTOM MANAGE., 2000; 19: S21-25). Хотя фармакологический профиль DM говорит о клинической эффективности, большинство клинических опытов оказывались разочаровывающими из-за сомнительной эффективности DM в сравнении с применением плацебо.
Некоторые исследователи предполагали, что ограниченная польза от DM, проявле