Применение эритропоэтина в восстановлении после инсульта
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к неврологии, и касается лечения случаев ишемии центральной нервной системы (ЦНС), в частности инсультов. Для этого пациенту вводят эритропоэтин (ЕРО). При этом первую дозу ЕРО вводят в интервале времени после 8 часов и до 24 часов после случая ишемии. Последующую вторую дозу ЕРО вводят в течение от 8 до 24 часов после первой дозы. Дополнительно вводят третью дозу ЕРО в интервале от 20 до 60 часов после случая ишемии. Дозы ЕРО выбирают из диапазона от 2500 до 5000 МЕ/кг. Изобретение позволяет стимулировать функциональное восстановление ЦНС, ингибировать апоптоз и воспаление в ЦНС при отсроченном начале лечения. 3 н. и 23 з.п. ф-лы, 1 табл., 4 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение предоставляет различные режимы дозирования эритропоэтина (ЕРО) для стимуляции восстановления после случая ишемии, такого как инсульт.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Термин "инсульт" относится к резкой недостаточности функции мозга, являющейся результатом окклюзии или разрыва интра- или экстракраниального кровеносного сосуда. Это происходит в том случае, когда один или более кровеносных сосудов в веществе или на поверхности мозга разрываются или закупориваются тромбом, атеросклеротической бляшкой или какой-либо другой частицей (частицами). В результате нервные клетки мозга лишаются снабжения кислородом, и в течение нескольких минут может начаться их гибель. Погибшие клетки мозга не регенерируют и замещаются пропитанными жидкостью полостями, называемыми инфарктами. При инсульте некоторые клетки мозга могут погибать немедленно и безвозвратно. Другие клетки, например расположенные вокруг ишемического очага, могут испытывать острое повреждение и оставаться компрометированными в течение часов. Из уровня техники также известно, что повреждение мозга может продолжаться в течение нескольких дней после первоначального случая ишемии.
Так как пациенты часто не поступают в палату интенсивной терапии немедленно после случившегося инсульта, необходимы новые терапевтические подходы, которые были бы эффективными даже в тех ситуациях, когда лечение начато по прошествии некоторого времени после случившегося инсульта.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение предоставляет режимы дозирования ЕРО после случая ишемии, а также способы лечения субъекта, перенесшего такой случай.
Одно из воплощений настоящего изобретения представляет собой режим дозирования эритропоэтина для стимуляции восстановления после случая ишемии, включающий введение нуждающемуся в этом субъекту терапевтически эффективного количества ЕРО, где первая доза ЕРО вводится в течение от приблизительно 8 до приблизительно 26 часов после случая ишемии, последующая вторая доза ЕРО вводится в течение от приблизительно 8 до приблизительно 26 часов после первой дозы.
Другое воплощение настоящего изобретения представляет собой способ лечения субъекта, перенесшего случай ишемии, включающий введение вышеупомянутому субъекту терапевтически эффективного количества ЕРО, где первая доза ЕРО вводится в течение от приблизительно 8 до приблизительно 26 часов после случая ишемии, последующая вторая доза ЕРО вводится в течение от приблизительно 8 до приблизительно 26 часов после первой дозы.
В следующем воплощении настоящее изобретение предоставляет способ стимуляции функционального восстановления субъекта после случая ишемии, включающий введение вышеупомянутому субъекту терапевтически эффективного количества ЕРО, где первая доза ЕРО вводится в течение от приблизительно 8 до приблизительно 26 часов после случая ишемии, последующая вторая доза ЕРО вводится в течение от приблизительно 8 до приблизительно 26 часов после первой дозы.
В другом воплощении настоящее изобретение также относится к способу уменьшения размера инфаркта у субъекта, получившего начальное введение ЕРО в течение 6 часов после случая ишемии, включающему введение вышеупомянутому субъекту количества ЕРО в дозе между приблизительно 1500 МЕ/кг до приблизительно 4500 МЕ/кг, где первая доза ЕРО вводится в течение от приблизительно 8 до приблизительно 26 часов после начального введения ЕРО, последующая вторая доза ЕРО вводится в течение от приблизительно 8 до приблизительно 26 часов после первой дозы.
В следующем аспекте настоящее изобретение относится к способу ингибирования апоптоза или воспаления в ЦНС субъекта после случая ишемии, включающему введение вышеупомянутому субъекту терапевтически эффективного количества ЕРО, где первая доза ЕРО вводится в течение от приблизительно 8 до приблизительно 26 часов после случая ишемии, последующая вторая доза ЕРО вводится в течение от приблизительно 8 до приблизительно 26 часов после первой дозы.
В некоторых предпочтительных воплощениях данного изобретения первая доза ЕРО вводится в течение приблизительно 24 часов после случая ишемии. Также в некоторых предпочтительных воплощениях данного изобретения вторая доза вводится в течение 24 часов после первой дозы. Предпочтительно, первая доза ЕРО вводится в течение приблизительно 24 часов после случая ишемии, и вторая доза вводится в течение приблизительно 48 часов после случая ишемии. Кроме того, может вводиться третья доза ЕРО в течение от приблизительно 20 часов до приблизительно 60 часов после случая ишемии. Предпочтительно, третья доза ЕРО вводится в течение от приблизительно 8 до 24 часов после второй дозы.
Предпочтительные воплощения настоящего изобретения включают режимы дозирования и способы лечения, где каждая доза ЕРО включает подкожную, внутримышечную, внутривенную или интраперитонеальную инъекцию ЕРО.
Предпочтительные воплощения данного изобретения также включают режимы дозирования и способы лечения, где каждая вводимая доза ЕРО выбирается из интервала от приблизительно 500 МЕ/кг до приблизительно 10000 МЕ/кг. В одном воплощении, особенно для уменьшения размера инфаркта у субъекта, получившего начальное введение ЕРО в течение 6 часов после случая ишемии, каждая вводимая доза ЕРО выбирается из интервала от приблизительно 1500 МЕ/кг до приблизительно 4500 МЕ/кг. Предпочтительно, каждая вводимая доза ЕРО выбирается из от приблизительно 1800 МЕ/кг до приблизительно 4000 МЕ/кг. Более предпочтительно, каждая вводимая доза ЕРО выбирается из от приблизительно 2000 МЕ/кг до приблизительно 3000 МЕ/кг. Наиболее предпочтительно, каждая вводимая доза ЕРО представляет собой приблизительно 2500 МЕ/кг. В другом воплощении, каждая вводимая доза ЕРО выбирается из от приблизительно 2500 МЕ/кг до приблизительно 5000 МЕ/кг. Предпочтительно, если по крайней мере одна вводимая доза ЕРО представляет собой приблизительно 2500 МЕ/кг. Более предпочтительно, если каждая вводимая доза ЕРО представляет собой приблизительно 2500 МЕ/кг.
В более предпочтительных воплощениях данного изобретения случай ишемии представляет собой инсульт. В частности, случай ишемии представляет собой повреждение ЦНС, такое как очаговый ишемический инсульт или острый ишемический инсульт.
Воплощения данного изобретения дополнительно включают режимы дозирования и способы лечения, где эритропоэтин представляет собой длительно действующий ЕРО.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Сопутствующие фигуры иллюстрируют отдельные аспекты изобретения. Краткое описание фигур представляет собой следующее:
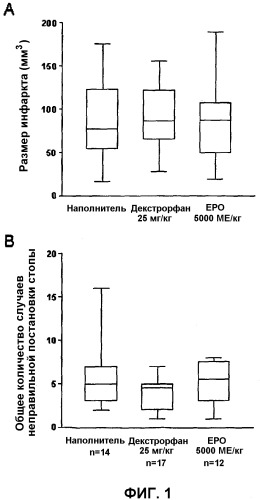
Фиг.1 показывает, что однодневное дозирование не влияет на размер инфаркта или функциональный результат. Блок-схемы (А) и (В) демонстрируют, что декстрорфан и ЕРО, введенные во время окклюзии и вновь через 1 час после окклюзии, были неэффективны для уменьшения (А) размера инфаркта 7-дневной давности или для улучшения (В) функционального результата в сравнении с животными, которым вводился только наполнитель;
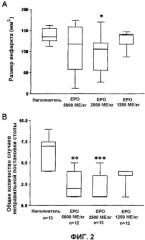
Фиг.2 показывает, что многодневное дозирование эритропоэтина уменьшает размер инфаркта и улучшает функциональный результат. На графике (А) показано статистически достоверное уменьшение объема инфаркта при 2500 МЕ/кг и на графике (В) - заметное улучшение функционального результата при 2500 и 5000 МЕ/кг у крыс, подвергнутых окклюзии средней мозговой артерии (МСАО) и получивших лечение ЕРО на 0 час, 24 час и 48 час после окклюзии, по сравнению с животными, которым вводился наполнитель (*р<0,05; **р<0,01; ***р<0,001);
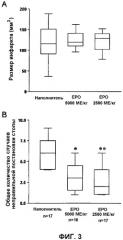
Фиг.3 показывает, что многодневное отсроченное введение ЕРО улучшает функциональный результат независимо от уменьшения размера инфаркта. Введение ЕРО на 6 час, 24 час и 48 час после МСАО не имело воздействия на (А) размер инфаркта в случаях, когда вводили 2500 МЕ/кг или 5000 МЕ/кг; однако (В) оба уровня дозировки отчетливо улучшали функциональный результат (*р<0,05; **р<0,01);
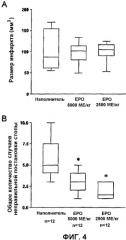
Фиг.4 показывает, что ЕРО, введенный позже, чем через 24 часа после окклюзии, улучшает функциональный результат. Режим дозирования с отсроченным введением начальной дозы ЕРО в течение 24 часов после окклюзии с последующей второй дозой на 48 час (А) был неэффективен для уменьшения размера инфаркта, но (В) отчетливо улучшал функциональный результат (*р<0,01).
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Воплощения настоящего изобретения, описанные ниже, не являются исчерпывающими или ограничивающими изобретение конкретными воплощениями, раскрытыми в последующем подробном описании. Более точно, воплощения описываются так, чтобы другие специалисты в данной области могли понять принципы и практическое осуществление настоящего изобретения. Если ниже не указано конкретно, раскрытия каждого патента, опубликованной патентной заявки и публикации, упоминаемые в последующем описании, являются таким образом включенными в состав заявки в их полноте и для любой из задач изобретения.
Настоящее изобретение предоставляет режим дозирования эритропоэтина для стимуляции восстановления после случая ишемии, включающий введение нуждающемуся в этом субъекту терапевтически эффективного количества ЕРО, где первая доза ЕРО вводится в течение от приблизительно 8 до приблизительно 26 часов после случая ишемии, последующая вторая доза ЕРО вводится в течение от приблизительно 8 до приблизительно 26 часов после первой дозы.
Как используется здесь, "случай ишемии" происходит, когда субъект испытывает временное или постоянное уменьшение кровотока и/или доставки кислорода к центральной нервной системе (ЦНС), что потенциально приводит к повреждению, такому как некроз, или инфаркту неперфузируемой области. Случай ишемии включает, но не ограничивается им, острое повреждение ЦНС, такое как инсульт, травму, такую как травматическое повреждение спинного или головного мозга, преходящую ишемическую атаку, инфаркт, ишемическое реперфузионное повреждение, повреждение сетчатки, ишемию, вызванную трансплантацией органа, ткани или клеток или другими хирургическими операциями. Конкретно, для целей настоящего изобретения, случай ишемии представляет собой случай ишемии мозга, особенно нарушение черепного кровотока. Более конкретно, случай ишемии представляет собой инсульт, включающий, но не ограничиваемый ими, очаговый ишемический инсульт или острую ишемическую атаку.
Как используется здесь, реперфузионная ишемия представляет собой локальное нарушение кровотока в органе, таком как мозг, и последующее, обычно резкое, восстановление кровотока.
Повреждение, возникающее в результате острой ишемической атаки, является динамическим. Повреждение развивается в течение нескольких дней, следующих за начальным инсультом. Многочисленные механизмы, способствующие расширению области гибели нервных клеток и поддерживающих клеток, включают нарушение ионного гомеостаза, повреждение свободными радикалами, усиление токсичности, апоптоз и воспаление (1). Механизмы реконструкции и ремоделирования являются активными в течение от недель до месяцев, последующих за начальным повреждением, в попытке компенсировать, в некоторой степени, происшедшее повреждение (2). Существует возможность для терапевтического вмешательства как в события, связанные с повреждением, так и в процессы восстановления. Один из желательных механизмов лечения представляет собой такой, который может блокировать механизм, индуцирующий гибель клеток, или улучшить восстановительные процессы или, в идеале, и то, и другое. Потенциальными лечебными кандидатами являются молекулы с эритропоэтиновой активностью, присущей природному гемопоэтическому цитокину эритропоэтину.
В последнее время эритропоэтин пользуется значительным вниманием в связи с его действием на негемопоэтические системы, включая его воздействие на нервную систему (4). В центральной нервной системе (ЦНС) эритропоэтин продуцируется и выделяется местно в астроцитах в ответ на гипоксию (5, 6), в то время как эритропоэтиновые рецепторы локализованы в подтипах нейронов, а также в астроцитах и в микроглии (7, 8). Воздействие эритропоэтина на данные типы клеток остается неясным, но показано блокирование гибели запрограммированных клеток in vitro, индуцированное посредством множества различных стимулов, включающих глутамат, гипоксию (9), и удаление сыворотки (10), позволяющие предположить, что он может воздействовать на повышение выживаемости клеток посредством блокирования апоптоза (11). Кроме данного нейропротективного эффекта описано модулирующее воздействие эритропоэтина на воспаление (12) - другая потенциальная цель терапии инсульта. Более того, показано снижение эритропоэтином повреждения, наблюдающееся у подопытных животных с повреждением ЦНС, включающее модели инсульта (14), повреждения спинного мозга (15), травматическое повреждение мозга (14) и повреждение сетчатки (16), и недавно выявлены протективные эффекты при предишемическом состоянии (6).
Привлечение большого внимания к действию эритропоэтина в ЦНС конкретно обусловлено его описанной нейропротективной активностью. Способность эритропоэтина ограничивать повреждение в релевантных моделях повреждения ЦНС в сочетании с данными, свидетельствующими о его потенциальном действии на различные механизмы в процессе заболевания, делает эритропоэтин привлекательным кандидатом для лечения острых расстройств нервной системы, включающих инсульт. Пока точные механизмы, посредством которых эритропоэтин обеспечивает получение данных протективных эффектов, являются неясными, данные о том, что эритропоэтин уменьшает апоптоз в моделях инсульта (10), повреждения спинного мозга (15) и повреждения сетчатки (16) позволяют предположить, что его способность блокировать апоптоз является крайне необходимой функцией. Учитывая, что апоптоз может происходить в течение дней, последующих за начальным случаем ишемии, продолженное дозирование эритропоэтина в дни, последующие за инсультом, может быть необходимо для оптимизации терапевтического эффекта. Несмотря на то, что данные доклинических исследований не были обращены к данной проблеме, описано продолженное введение эритропоэтина продолжительностью свыше нескольких дней с позитивными результатами в пилотном клиническом исследовании, оценивающем эритропоэтин в лечении ишемического инсульта (19).
Природный или нативный эритропоэтин представляет собой гликопротеин с молекулярной массой 30 кДа, контролирующий эритропоэз посредством регуляции дифференцировки, пролиферации и продолжительности жизни эритроидных клеток-предшественников (3). Как описано здесь и как определено в формуле изобретения, термин "ЕРО" включает такие полипептиды и белки, которые имеют способность стимулировать эритропоэз опосредованно через собственный рецептор эритропоэтина. Термин "ЕРО" включает природный или нативный эритропоэтин, а также рекомбинантный человеческий эритропоэтин (r-HuEPO). Также в пределы термина "ЕРО" включаются аналоги эритропоэтина, изоформы эритропоэтина, миметики эритропоэтина, фрагменты эритропоэтина, гибридные эритропоэтиновые белки, вышеупомянутые слитые белковые олигомеры и мультимеры, вышеупомянутые гомологи, вышеупомянутые варианты гликозилированных структур, вышеупомянутые белковые миметики и мутеины, и дальнейшие, независимо от способов их синтеза или производства, которые включают, без ограничения изложенным, рекомбинантные (получаемые из кДНК или генной ДНК), синтетические, трансгенные и способы активации гена, и дополнительно молекулы эриропоэтина, содержащие менее значительные модификации, чем вышеупомянутые. Способы конструирования и синтеза, например, белковых миметиков хорошо известны в данной области и описываются, например, в патентах США №№ 4833092, 4859765; 4853871 и 4863857, раскрытие каждого из которых включено в данное описание в качестве ссылки во всей полноте и для всех целей. В дополнение, полипептиды и белки, обладающие эритропоэтиновой активностью, мелкие молекулы, способные стимулировать эритропоэз, также находятся в пределах термина "ЕРО" и включают, например, вещества с эритропоэтиновой активностью, такие как молекулы, стимулирующие продукцию эритропоэтина через последующие явления активации.
Особенно предпочтительными являются такие молекулы ЕРО, которые обладают способностью стимуляции эритропоэза у млекопитающих. Специфические примеры эритропоэтина включают эпоэтин альфа (EPREX®, ERYPO®, PROCRIT®), новые белки, стимулирущие эритропоэз (NESP™, ARANESP™и дарбепоэтин альфа), такие как гипергликозилированный аналог рекомбинантного человеческого эритропоэтина (Эпоэтин), описанный в европейской патентной заявке ЕР 640619. Другие молекулы ЕРО, рассматриваемые в пределах настоящего изобретения, включают аналоги человеческого эритропоэтина (такие как человеческие белки, связанные с сывороточным альбумином, описанные в международной патентной заявке WO 99/66054), мутанты эритропоэтина, описанные в международной патентной заявке WO 99/38890, эритропоэтин омега, который может быть получен из рестрикционного фрагмента Ара I гена человеческого эритропоэтина, описанного в патенте США 5688679, измененный гликозилированный человеческий эритропоэтин, описанный в международных патентных заявках WO 99/11781 и ЕР 1064951, аналоги эритропоэтина, конъюгированные с ПЭГ, описанные в WO 98/05363, WO 01/76640 или патенте США 5643575. Специфические примеры клеточных линий, модифицированных для экспрессии эндогенного человеческого эритропоэтина, описаны в международных патентных заявках WO 99/05268 и WO 94/12650. Обычно предпочтительной формой ЕРО является очищенный рекомбинантный человеческий ЕРО (r-HuEPO), в настоящее время получаемый и распространяемый под товарными знаками EPREX®, ERYPO®, PROCRIT® или ARANESP™. Раскрытие каждого из патентов и опубликованных патентных заявок, указанных в данном разделе, включено в данное описание в качестве ссылки для любых и всех целей.
Длительно действующие формы ЕРО также рассматриваются и могут применяться в некоторых воплощениях настоящего изобретения для введения в качестве второй или третьей дозы в схеме введения. Как используется здесь, "длительно действующий ЕРО" включает композиции с продолжительным высвобождением и готовые формы ЕРО с увеличенным временем полужизни в циркуляции, достигающимся обычно посредством модификации, такой как снижение уровня иммуногенности и скорости выведения, и инкапсулированием ЕРО в полимерные микросферы. Примеры "длительно действующего ЕРО" включают, но не ограничиваются ими, конъюгаты эритропоэтина с полиэтиленгликолем (ПЭГ), раскрытые в публикации РСТ WO 2002049673 (Burg et al.), ПЭГ-модифицированный ЕРО, раскрытый в публикации РСТ WO 02/32957 (Nakamura et al.), конъюгаты гликопротеинов, обладающие эритропоэтиновой активностью и имеющие по меньшей мере один окисленный углеводный фрагмент, ковалентно связанный с неантигенным полимером, раскрытые в публикации РСТ WO 94/28024 (Chyi et al.), и другие ПЭГ-EPO, полученные с использованием SCM-ПЭГ, SPA-ПЭГ и SBA-ПЭГ. Раскрытие каждой из опубликованных патентных заявок включено в данное описание в качестве ссылки во всей полноте и для всех целей.
Предпочтительными фрагментами полиэтиленгликоля являются фрагменты метоксиполиэтиленгликоля (мПЭГ). Фрагменты предпочтительно присоединяются с использованием производных сукцинимидного эфира видов метоксиполиэтиленгликоля. В одном примере предпочтительное производное сукцинимидного эфира видов метоксиполиэтиленгликоля включает сукцинимидный эфир карбоксиметилированного полиэтиленгликоля (SCM-ПЭГ) следующей формулы:
сукцинимидные производные поли(этиленгликоль)пропионовой кислоты (SPA-ПЭГ) следующей формулы, где R представляет собой С1-8алкил и n является целым числом,
(R-(OCH2CH2)n-O-CH2CH2-CO-OSu);
и сукцинимидные производные поли(этиленгликоль)бутановой кислоты (SBA-ПЭГ) следующей формулы, где R представляет собой С1-8алкил и n является целым числом,
(R-(OCH2CH2)n-O-CH2CH2-CO-OSu).
Способ получения SCM-ПЭГ, SPA-ПЭГ и SBA-ПЭГ хорошо известен в технике. Например, в патенте США № 5672662, принадлежащем Harris et al., описаны активные эфиры ПЭГ и кислот и соответствующие им полимеры, имеющие единственный остаток пропионовой и бутановой кислоты и не имеющие других сложноэфирных связей. Получение SCM-ПЭГ описано, например, Veronese et al. (1989), Journal of Controlled Release, 110: 145-54.
SPA-ПЭГ включает мПЭГ-SPA (метокси-ПЭГ-сукцинимидилпропионат). SBA-ПЭГ включает мПЭГ-SBA (метокси-ПЭГ-сукцинимидилбутаноат). Активированные полимеры, такие как SBA-ПЭГ и SPA-ПЭГ, являются коммерчески доступными и могут быть получены от, например, Shearwater Polymers, Inc., Huntsville, Alabama, U.S.A.
SCM-ПЭГ (R-(OCH2CH2)n-O-CH2-CO-OSu; R представляет собой С1-8алкил и n является целым числом) включает метокси-ПЭГ-сукцинимидный эфир карбоксиметилированного ПЭГ (мПЭГ-SCM). Согласно Greenwald et al., SCM-ПЭГ "реакция с белком могла бы приводить к образованию стабильного амида, однако сообщается, что t1/2 гидролиза [Shearwater Polymers, Huntsville, AL, Jan 1996 catalog, p 46] составляет <1 мин при рН 8, сводя таким образом к минимуму его применимость для модификации белков в водном растворе..." (Bioconjugate Chem., 7 (6), 638-641, 1996).
В настоящее время SCM-ПЭГ может быть обычно синтезирован посредством, например, Delmar Chemicals, Inc, Quebec, Canada.
SCM-ПЭГ, SPA-ПЭГ и SBA-ПЭГ реагируют вначале с первичными аминогруппами лизина и N-концевой аминогруппой. Реакции с ЕРО показаны ниже для SCM-ПЭГ5K, SPA-ПЭГ5K SBA-ПЭГ5K, соответственно, где OSu представлена н-гидроксисукцинимидом, m представляет собой 1-4, а n является целым числом:
(SCM-ПЭГ)CH3O-(OCH2CH2)n-O-CH2-CO-OSU + EPO(NH2)m →
CH3O-(OCH2CH2)n-O-CH2-CO-NH-EPO
(SPA-ПЭГ)CH3O-(OCH2CH2)n-O-CH2CH2-CO-OSU + EPO(NH2)m →
CH3O-(OCH2CH2)n-O-CH2CH2-CO-NH-EPO
(SBA-ПЭГ)CH3O-(OCH2CH2)n-O-CH2CH2CH2-CO-OSU + EPO(NH2)m →
CH3O-(OCH2CH2)n-O-CH2CH2CH2-CO-NH-EPO
Исследуя гипотезу, что эритропоэтин может использоваться в терапии острого повреждения ЦНС, включающего инсульт, и может потенциально ингибировать процессы, ответственные за замедленную нейротоксичность, такие как апоптоз и воспаление, заявители тестировали различные режимы дозирования в попытке определить оптимальную активность эритропоэтина в модели очагового ишемического инсульта. Заявители показывают в этом документе, что многократные дозы, вводимые свыше нескольких дней, могут уменьшать зону инфаркта и улучшать функциональный результат у крыс, подвергнутых постоянной окклюзии средней мозговой артерии (МСАО). В дополнение, отсроченное введение эритропоэтина, даже более, чем приблизительно 24 часов после окклюзии, может улучшать функциональный результат независимо от уменьшения размера инфаркта.
Заявители обнаружили, что режим дозирования с многодневным введением 2500 МЕ/кг эритропоэтина был более эффективен для улучшения результата у крыс, подвергнутых МСАО. В данных исследованиях наблюдаемое уменьшение размера инфаркта было относительно умеренным (30%), что не было неожиданным для молекулы, обладающей антиапоптотическим механизмом действия, в то время как основным путем клеточной гибели, который приводит к увеличению объема инфаркта в постоянной модели очагового ишемического инсульта, является некроз (20).
Настоящее изобретение, таким образом, предоставляет способ лечения субъекта, имеющего случай ишемии, содержащий введение вышеупомянутому субъекту терапевтически эффективного количества эритропоэтина, где первая доза эритропоэтина вводится в течение от приблизительно 8 до приблизительно 26 часов после случая ишемии, последующая вторая доза эритропоэтина вводится в течение от приблизительно 8 до приблизительно 26 часов после первой дозы. Конкретно, лечение субъекта, имеющего случай ишемии, включает стимуляцию восстановления от любых последствий случая ишемии, таких как неврологические повреждения или инфаркты. В одном аспекте восстановление после случая ишемии выражается в уменьшении размера инфаркта. В другом аспекте восстановление после случая ишемии выражается в улучшении функциональных результатов субъекта, таком как улучшение на один или более баллов, полученных определением посредством поведенческой системы баллов. Результат лечения, предоставляемого настоящим изобретением, может оцениваться с использованием способов оценки, хорошо известных в технике, включая, но не ограничиваясь ими, медицинскую визуализирующую систему, такую как магнитно-резонансная визуализация (MRI), CTA (компьютерная томография с ангиографией) и СТ-томограмма (компьютерная томография), неврологический тест, тест с "касанием усов" или тест с неправильной постановкой стопы (19).
Настоящее изобретение также предоставляет способ ингибирования апоптоза или воспаления ЦНС у субъекта после случая ишемии, содержащий введение субъекту терапевтически эффективного количества эритропоэтина, где первая доза эритропоэтина вводится в течение от приблизительно 8 до приблизительно 26 часов после случая ишемии, последующая вторая доза эритопоэтина вводится в течение от приблизительно 8 до приблизительно 26 часов после первой дозы.
Результаты продемонстрировали, что раннее введение эритропоэтина является необходимым для достижения уменьшения размера инфаркта. Эффект был утерян, когда лечение начиналось через 6 часов после окклюзии. В частности, многократные дневные дозы эритропоэтина, вводимые во время окклюзии и через 24 часа и 48 часов после окклюзии в количестве 2500 МЕ/кг в 30%, имеют результатом уменьшение размера инфаркта, что не наблюдалось при уровнях дозировок в 5000 МЕ/кг и 1250 МЕ/кг. Поэтому настоящее изобретение предоставляет способ для уменьшения размера инфаркта у субъекта, получившего начальное введение эритропоэтина в течение 6 часов после случая ишемии, включающий введение вышеупомянутому субъекту эритропоэтина в количестве от приблизительно 1500 МЕ/кг до приблизительно 4500 МЕ/кг на дозу, где первая доза эритропоэтина вводится в течение от приблизительно 8 до приблизительно 26 часов после начального введения эритропоэтина, последующая вторая доза эритопоэтина вводится в течение от приблизительно 8 до приблизительно 26 часов после первой дозы.
Как используется здесь, термин "воздействие" относится к единичной дозе, повторяющимся индивидуальным дозам или к дозированию, которое может осуществляться относительно продолжительно после единственного введения, например, длительно действующего ЕРО, к аппликации, например чрескожного пластыря, содержащего ЕРО, или к имплантации имплантата, содержащего ЕРО.
В дополнение, заявители обнаружили значительное функциональное улучшение у крыс, подвергнутых постоянной МСАО, когда ЕРО вводили в течение приблизительно 24 часов после инсульта. Таким образом, настоящее изобретение также включает способ для стимуляции функционального восстановления у субъекта после случая ишемии, включающий введение вышеупомянутому субъекту терапевтически эффективного количества ЕРО, где первая доза ЕРО вводится в течение от приблизительно 8 до приблизительно 26 часов после случая ишемии, последующая вторая доза ЕРО вводится в течение от приблизительно 8 до приблизительно 26 часов после первой дозы.
В воплощении, соответствующем данному изобретению, ЕРО может вводиться пациенту как третья доза. Третья доза может вводиться предпочтительно в течение от приблизительно 20 часов до приблизительно 60 часов после случая ишемии. В случае если дается третья доза, она может вводиться в течение от приблизительно 8 до приблизительно 24 часов после второй дозы.
Как используется здесь, термин "функциональное восстановление" относится к поведенческому улучшению субъекта после случая ишемии. Функциональное восстановление у животного может оцениваться, например, используя модифицированный тест неправильной постановки стопы Hernandez-Schallert (18), где животное помещается на рабочую решетку с 2 см ячейками между металлическими прутьями диаметром 0,5 см и наблюдается в течение двух минут, в течение которых подсчитывается время его отклонений вперед и назад. Функциональное восстановление у людей может оцениваться посредством инструментов, предназначенных для измерения элементарных неврологических функций, таких как моторная сила, чувствительность и координация, когнитивных функций, таких как память, язык и способность следовать направлениям, а также функциональных возможностей, таких как основная деятельность повседневной жизни или инструментальная деятельность. Восстановление элементарной неврологической функции может измеряться инструментами, такими как NIH шкала перемещения (NIHSS) (31), восстановление когнитивной функции может измеряться нейропсихологическими тестами, такими как Бостонский тест наименований (Boston Naming Test), тест на зрительно-моторную координацию (Trail-making Tests) и Калифорнийский тест устного обучения (California Verbal Learning Test), и деятельность повседневной жизни может измеряться инструментами, такими как ADCS/ADL клиническое исследование болезни Альцгеймера/деятельности повседневной жизни (Alzheimer′s Disease Clinical Studies/Activities of Daily Living), шкала или Бристольская шкала деятельности повседневной жизни (Bristol Activities of Daily Living Scale), все тесты и шкалы известны в технике.
Принцип отсроченной дозировки, как описано здесь, не результативен в уменьшении размера инфаркта. Одним из возможных объяснений данного наблюдения является то, что окрашивание TTC (хлорид 2,3,5-трифенилтетразолия) может неточно отображать область инфаркта. Обращаясь к данной возможности, был выполнен более обширный морфологический анализ на срезах представленных животных и сравнительный анализ ТТС. Интактные нейроны не были выявлены в пределах границ окрашивания ТТС (данные не показаны), говорящей о том, что данный феномен не отвечал наблюдениям авторов. Следовательно, продленное введение ЕРО улучшает функцию независимо от уменьшения размера области инфаркта, возможно, посредством ингибирования отсроченного апоптоза в областях, удаленных от области инфаркта или, возможно, посредством улучшения явлений эндогенной реконструкции и ремоделирования.
Как указано ранее, апоптоз может происходить в течение нескольких дней, последующих за инсультом. Отсроченный апоптоз происходит в ишемической "полутени" и вносит вклад в окончательный объем инфаркта (21, 22). Он также происходит в областях, удаленных от области инфаркта, более вероятно, обусловленный ослаблением трофической поддержки нейронов, которые теряют ключевые проекции внутри области инфаркта. Так как показано, что ЕРО является трофическим для популяций нейронов (10, 23), возможным объяснением для эффектов продленного введения ЕРО является предупреждение продленного апоптоза нейронов, анатомически расположенных на некотором расстоянии от области инфаркта. Оберегание данных популяций нейронов может объяснять сохранение функциональной деятельности, наблюдавшейся в поведенческих оценках авторов.
Не может быть исключено и другое объяснение, что ЕРО улучшает восстановление функциональных процессов посредством поддержки таких реконструктивных и ремоделирующих механизмов как разрастание невритов, формирование синапса, укрепление или появление синапса. Улучшение функции, наблюдавшееся самое раннее на 7 день, свидетельствует против образования новых длительно действующих функциональных соединений, однако, два сообщения говорят о том, что по крайней мере начало реакции приспособления становится явным на 7 день. Kawamate et al. (24), исследующие эффект основного фактора роста фибробластов (bFGF) на модели крысы с очаговым ишемическим инсультом и Stroemer et al., (25) рассматривающие лечение d-амфетамином на аналогичных моделях, наблюдали улучшение функциональной деятельности при лечении лекарственным средством без сопутствующего уменьшения размера инфаркта. Отмечено, что у животных, наблюдавшихся в данном исследовании более двух месяцев, отчетливое поведенческое улучшение наступало на 7 день.
Иммуногистохимические анализы выявили доказательства повышенного разрастания невритов в обоих исследованиях, определенные посредством увеличения экспрессии ассоциированного с ростом белка 43 (GAP43), пик которой приходился на 3 день после окклюзии. Ранее было показано, что ЕРО стимулирует разрастание невритов (26). Сведенные вместе, эти данные позволяют утверждать, что некоторые восстановительные процессы могут инициироваться в течение первых дней после повреждения и что ЕРО может активировать эти ранние процессы, улучшая функциональное восстановление. Другие реорганизационные процессы, такие как появление или укрепление синапсов, могут происходить в более короткие периоды времени, но эффекты ЕРО в данном случае не показаны.
Специалисты в данной области могут легко определить соответствующие количества и способы дозирования при различных обстоятельствах. Количество ЕРО, вводящееся при каком-либо отдельном воздействии, обеспечиваемом любой из частей схемы дозирования, не ограничиваются особым образом, и любое количество ЕРО может вводиться однократно, в качестве части схемы дозирования или в виде режима многократного дозирования в день так долго, пока существенно не проявятся токсические эффекты вследствие введения ЕРО. Как говорилось, и только для цели, обеспечивающей дополнительное руководство и не являвшейся необязательно связанной с ним, обычные терапевтические рекомендации говорят о том, что субъект мог бы желательно получать в каждой дозе ЕРО терапевтически эффективное количество от приблизительно 500 МЕ/кг до приблизительно 10000 МЕ/кг. Предпочтительно, субъект мог бы получать в каждой дозе ЕРО количество от приблизительно 1250 МЕ/кг до приблизительно 5000 МЕ/кг. Более предпочтительно, субъект мог бы получать в каждой дозе ЕРО количество от приблизительно 2500 МЕ/кг. Как упоминается выше, дозирование ЕРО может предоставляться в каком-либо известном или вновь разработанном формате дозирования.
Данное изобретение предусматривает, что в его практическом осуществлении могут использоваться разнообразные пути введения ЕРО. Предпочтительно, каждая доза ЕРО может по желанию быть предоставлена в формате, который может обеспечить воздействие ЕРО на пациента настолько быстро, насколько возможно. Как упоминалось, предусматриваются различные пути введения, включая, но не ограничиваясь внутривенным дозированием, подкожным дозированием, внутримышечным или интраперитонеальным. В той степени, в которой пероральные готовые формы являются или могли бы быть доступными, такие пути введения также учитываются и могут быть особенно пригодными для второго или последующих дозирований ЕРО, как описано в данном документе.
Субъекты, которые могут получать благоприятное воздействие от режима дозирования, конкретно не ограничиваются и могут включать как человека, так и животных, предпочтительно млекопитающих.
Для иллюстрации настоящего изобретения представлен следующий пример, и он не должен рассматриваться как ограничивающий данное изобретение. Данное изобретение будет лучше понято при ссылке на чертежи и примеры, приведенные ниже, но специалисты в данной области легко оценят, что они являются только иллюстративными для изобретения, как описано более полно в формуле изобретения, которая следует далее.
Пример 1
МАТЕРИАЛЫ И СПОСОБЫ
Животные и хирургия МСАО
Методики, включающие использование животных, были одобрены Johnson & Johnson Animal Care and Use Comittee. Самцов крыс Sprague-Dawley (Charles River Laboratories, Raleigh, NC), имеющих массу между 290 г и 320 г, индивидуально помещают в окружение с контролем температуры на 12-часовой (6:00-18:00) световой-темновой цикл и обеспечивают пищей и водой по потребностям. Животных анестезируют 2,5% изофлураном и температуру тела поддерживают при 37°С. Постоянную МСАО проводят по существу, как описано Zimmerman et al. (17). Проводят вентральный разрез и визуализируют как правую, так и левую сонные артерии (ССА). Правую ССА постоянно обтурируют, используя 4-0 шелковую лигатуру. Краниотомию проводят 1 мм спереди и 3-4 мм сбоку от овального отверстия для визуализации правой средней головной артерии (МСА). МСА далее постоянно об