2-пропен-1-оны в качестве индукторов hsp-70
Иллюстрации
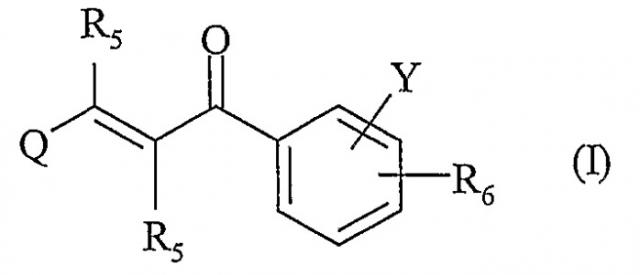
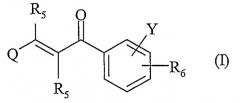
Показать всеНастоящее изобретение относится к новым соединениям ряда 2-пропен-1-она общей формулы I
или их таутомерным формам, стереоизомерам, полиморфам, фармацевтически приемлемым солям, фармацевтически приемлемым сольватам, где Q означает гетероарильный цикл, содержащий до 2 атомов азота. Соединения I индуцируют HSP-70 и полезны при лечении заболеваний, сопровождающих патологический стресс в организмах млекопитающих, включая человека. Описаны также способ лечения с помощью соединений I, фармацевтические композиции на основе этих соединений и применение последних. 5 н. и 21 з.п. ф-лы, 7 табл.
Реферат
Настоящее изобретение относится к новым соединениям ряда 2-пропен-1-она общей формулы (I), их таутомерным формам, стереоизомерам, полиморфам, фармацевтически приемлемым солям, фармацевтически приемлемым сольватам и фармацевтически приемлемым композициям, содержащим вышеперечисленные соединения, где R5, R6, Q и Y имеют нижеуказанные значения.
Настоящее изобретение также относится к способу получения вышеуказанных новых соединений, их таутомерных форм, стереоизомеров, полиморфов, фармацевтически приемлемых солей, фармацевтически приемлемых сольватов и фармацевтически приемлемых композиций, содержащих вышеперечисленные соединения.
Соединения общей формулы (I) полезны для лечения и/или профилактики вызванных ишемией нарушений, таких как удар, инфаркт миокарда, воспалительное нарушение, гепатотоксичность, сепсис, заболевания вирусного происхождения, отторжение аллотрансплантата, опухолевые заболевания, повреждения слизистой желудка, кровоизлияние в мозг, эндотелиальные дисфункции, диабетические осложнения, нейродегенеративные заболевания, посттравматическое неврональное нарушение, острая почечная недостаточность, глаукома и обусловленная старением кожная дегенерация, где основным механизмом является индукция белка теплового шока (HSP).
Документально подтверждено, что белки теплового шока (HSP) играют цитопротективную роль почти во всех живых клетках при различных патологических стрессах посредством механизма, известного как термотолерантность или перекрестная толерантность. Белки теплового шока действуют как молекулярные шапероны или протеазы, что в физиологических условиях включает ряд внутриклеточных функций. Шапероны вовлечены в сборку и укладку олигомерных белков с нарушенной конформацией или денатурированных, тогда как протеазы опосредуют деградацию поврежденных белков.
Белки теплового шока подразделяются на несколько семейств, названия которым присвоены, исходя из приблизительной молекулярной массы (например, HSP-70 в 70 кД, убиквитин, HSP-10, HSP-27, HSP-32, HSP-60, HSP-90 и пр.). HSP-70 является наиболее распространенным HSP, обнаруженным в нормальных клетках. HSP-70 и соответствующая HSP-70 индуцированная форма, называемая HSP-72, обнаружены во всех живых клетках. Следуя за тепловым шоком, синтез указанного HSP нарастает до определенного момента, при котором этот белок становится наиболее распространенным монобелком в клетке.
Хотя некоторые белки самопроизвольно восстанавливают конфигурацию при разведении до низких концентраций денатуранта, in vitro, более крупные, мультидоменные белки часто обладают склонностью к нарушению конформации и агрегации. Следовательно, заражение внутри клеточного окружения с плотной компоновкой обеспечивает эффективный захват ненативных промежуточных структур, удержание в состоянии промежуточных конформаций и, впоследствии, либо восстановление конфигурации, либо деградацию. Молекулярные шапероны, такие как HSP-90, HSP-70 и HSP-60, осуществляют это путем захвата ненативных промежуточных структур, вместе с co-шаперонами и АТФ.
HSP-70 шапероны, например, распознают растяжения гидрофобных остатков полипептидных цепей, которые временно открыты в промежуточных конформациях с начальной укладкой и обычно ограничены гидрофобным ядром в нативном состоянии. Последствие взаимодействий с шапероном состоит поэтому в сдвиге равновесия в укладке белка и реакциях восстановления укладки по пути развития благоприятных событий и сведения к минимуму появления неблагоприятных промежуточных конфигураций, имеющих предрасположенность к агрегации в качестве продуктов с нарушенной конформацией.
За последние годы рядом исследований показано, что основной теплоиндуцируемый белок, HSP-72, является необходимым для защиты клеток и тканей от теплового шока и других стрессов. HSP-72 действует в качестве молекулярного шаперона на восстановление укладки и деградацию поврежденных белков. Это привело к общему предположению, что шапероновые активности HSP-72 определяют основную роль HSP-72 в способности клеток к самозащите от стрессов. При воздействии стрессов, ведущих к массовому разрушению белка и некротической гибели, антиагрегирующая и восстанавливающая укладку белка активности HSP-72 безусловно могут стать необходимыми для защиты клеток. С другой стороны, при воздействии стрессов, ведущих к апоптозу, защитная функция HSP-72 может быть полностью объяснена за счет особой роли рассматриваемого белка в клеточной сигнализации. В этих условиях разрушение белка, само по себе, не является существенным для гибели клеток, поскольку супрессия апоптического сигнального пути восстанавливает жизнеспособность клеток.
Термин «белок теплового шока» является отчасти неправильным, поскольку такие белки не индуцируются одним лишь тепловым шоком. На самом деле, кроме того, что являются конститутивно экспрессированными (составляя до 5-10% от общего содержания белка в нормальных условиях роста), эти белки могут быть в значительной степени индуцированы (до 15% от общего содержания клеточного белка) рядом стимулов, включающих различные патологические стрессы.
Патологические стрессы, индуцирующие экспрессию белка теплового шока, включают широкий ряд состояний, вызванных многими заболеваниями. Синтез белков теплового шока в клетках, подвергнутых таким стрессам, указывает на основной способ защиты клеток от патологических стрессов.
Удар
Одним из таких патологических состояний, где вовлечена защитная роль HSP-70, является церебральное ишемическое повреждение (удар). Церебральная ишемия вызывает серьезное уменьшение поступления крови к тканям головного мозга, в результате чего клетки постепенно гибнут из-за недостатка кислорода. В такой ситуации возникает повышенная экспрессия белка теплового шока в тканях мозга. Транзиторная ишемия индуцирует HSP в головном мозге, и способность нейронной популяции выдерживать ишемическую травму коррелируется с повышенной экспрессией HSP-70. мРНК HSP-70 индуцируется в нейронах на периферии ишемии. Предполагается, что периферическая зона ишемии, пенумбра, восстановлена фармакологическими средствами. Установлено, что в этой зоне белок HSP-70 локализуется главным образом в нейронах [Dienel G.A. et al., J. Cereb. Blood Flow Metab., 1986, Vol. 6, pp. 505-510; Kinouchi H. et al., Brain Research, 1993, Vol. 619, pp. 334-338]. Прямая оценка защитной роли HSP-70 проведена с применением трансгенных мышей с избыточной экспрессией мышиного HSP (HSP-70tg-мышей). В противоположность немутантным однопометным животным высокие уровни матричной РНК HSP и белка были обнаружены в головном мозге HSP-70tg-мышей в нормальных условиях, иммуногистохимический анализ выявил, главным образом, нейронную экспрессию HSP-70. У гетерозиготных HSP-70tg-мышей и соответствующих немутантных однопометных животных перманентная фокальная ишемия головного мозга была вызвана внутрипросветной блокадой средней мозговой артерии. Церебральный инфаркт после 6 часов ишемии, по оценке методом окрашивания телец Ниссля, существенно меньше у HSP-70tg-мышей по сравнению с немутантными однопометными мышами. У HSP-70tg-мышей все еще сохраняется защита против церебрального инфаркта спустя 24 часа после наступления перманентной фокальной ишемии. Данные говорят о том, что HSP-70 может существенно защищать головной мозг от ишемического повреждения [Rajdev S., Hara K, et al., Ann. Neurol., 2000 Jun, Vol. 47 (6), pp. 782-791]. Индуцированный белок теплового шока в 72 кД (HSP-72) играет очень важную роль в ослаблении церебрального ишемического повреждения. Стриарное нейронное выживание существенно возрастает, когда векторы HSP-72 вводят после начала ишемии в каждый стриатум [Hoehn B. et al., J. Cereb. Blood Flow Metab., 2001 Nov, Vol. 21(11), pp. 1303-1309].
Эксперименты доказывают, что неврологические расстройства, вызываемые ишемией, оказывается, снижаются при лечении HSP-индукторами, такими как литий. Эти нейропротективные действия связаны с позитивной регуляцией цитопротективного белка-70 теплового шока в ишемическом полушарии головного мозга [Ren M. et al., Proc. Natl. Acad. Sci. USA., 2003 May 13; Vol. 100 (10), pp. 6210-6215]. Таким образом, индукция HSP-70 оказывает протективное действие на церебральное ишемическое нарушение (удар).
Инфаркт миокарда
Другим патологическим состоянием, аналогичным церебральной ишемии, является инфаркт миокарда, в этом случае тяжелая ишемия даже за относительно короткие периоды времени ведет к обширной гибели кардиомиоцитов. Показано, что индукция HSP-70 оказывает защитное действие против последующей ишемии, как явствует из непосредственной корреляции с постишемической миокардиальной защитой, снижением объема инфаркта и улучшенным метаболическим и функциональным восстановлением. Сверхпродукция индуцированного HSP-70 в зрелых кардиомиоцитах связана с 34% снижением в лактатдегидрогеназе в ответ на ишемическое нарушение [Hutter M. M. et al., Circulation, 1994, Vol. 89, pp. 355-360; Liu X. et al., Circulation, 1992, Vol. 86, pp. II358-II363; Martin J.L., Circulation, 1997, Vol. 96, pp. 4343-4348].
Эксперименты показывают, что предварительная пероральная обработка крыс HSP-индуктором бимокломолом повышает миокардиальный HSP-70 и снижает размер инфаркта в моделях ишемии на крысах [Lubbers N. L. et al., Eur. J. Pharmacol., 2002 Jan 18, Vol. 435 (1), 79-83]. Существует значительная корреляция между индукцией HSP-70 и снижением объема инфаркта после перорального приема бимокломола. Кроме того, бимокломол также улучшает выживаемость клеток в неонатальных кардиомиоцитах крыс посредством увеличения уровней HSP-70 [Polakowski J. S. et al., Eur. J. Pharmacol., 2002 Jan 18, Vol. 435 (1), pp. 73-77].
В дальнейших экспериментах, у трансгенных мышей методом генной инженерии вызывали высокие уровни экспрессии индуцируемого мышами HSP-70 [Marber M. S. et al., J. Clin. Invest., 1995 April, Vol. 95, pp. 1446-1456]. Обнаружено, что в сердце трансгенных мышей, по сравнению с немутантными мышами, наблюдается существенное снижение размера инфаркта, порядка 40%, через 20 минут после глобальной ишемии, и сократительная функция во время периода реперфузии удваивается.
Кроме того, данные, показывающие, что миокардиальный стрессовый белок HSP-70 непосредственно является протективным, получены в результате наблюдения того, что трансфицированные линии миоцитов, экспрессирующих HSP-70, обладают повышенной резистентностью к гипоксическому стрессу [Mestril R. et al., J. Clin. Invest.,1994 February, Vol. 93, pp. 759-767].
Дальнейшие исследования роли сверхпродуцирования HSP-70 посредством генной терапии, направленной на митохондриальную функцию и восстановление желудочков сердца, показали, что позитивная регуляция HSP-70 защищает митохондриальную функцию после ишемического-реперфузионного нарушения и связана с лучшим сохранением миокардиальной функции. Показатели постишемического митохондриального дыхательного контроля, связанные с NAD и FAD, сохранялись лучше и восстановление механической функции было больше у HSP-трансфицированных, чем у контрольных сердец. [Jayakumar J. et al., Circulation, 2001 Sep 18, Vol. 104 (12 Suppl 1), pp. 1303-1307]. Таким образом, приведенные выше данные свидетельствуют, что индукция HSP-70 должна быть полезна для лечения инфаркта миокарда.
Воспалительные нарушения
Еще один пример патологического стресса на тканях и органах, вызывающего индукцию HSP-70, представляют воспалительные заболевания.
Воспаление вызывается активацией фагоцитных клеток, таких как лейкоциты, первоначально моноцитами-макрофагами, которые генерируют высокие уровни активных форм кислорода (ROS), а также цитокины. Как ROS, так и цитокины позитивно регулируют экспрессию белков теплового шока (HSP), тогда как HSP в свою очередь защищают клетки и ткани от вредных эффектов воспаления. На моделях синдрома расстройства дыхания у взрослых in vivo, состояния острого воспаления легких, вызывающего HSP-индукцию, HSP полностью предотвращает летальный исход [Jacquier-Salin M.R. et al., Experientia, 1994 Nov 30, Vol. 50 (11-12), pp. 1031-1038].
HSP оказывает многочисленные защитные действия при воспалении, включая распознавание своего и чужого, усиление иммунных реакций, иммунное защитное действие, термотолерантность и защитное действие против цитотоксичности медиаторов воспаления [Polla B. S. et al., EXS., 1996, Vol. 77, pp.375-91].
Белки теплового шока (HSP) многократно вовлечены в контроль за развитием ревматоидного артрита. Позитивная регуляция экспрессии HSP-70 в синовиальной ткани постоянно наблюдается у пациентов с ревматоидным артритом. Последние исследования показали, что провоспалительные цитокины индуцируют активацию HSF-1 - ДНК-связывания и экспрессию HSP-70 в культивируемых синовиальных фибробластподобных клетках [Georg Schett et. al., J. Clin. Invest., 1998 July, Vol. 102 (2), pp. 302-311]. Поскольку HSP-70 критически вовлечен в укладку белка и может предупреждать гибель апоптических клеток, способствующую синовиальному росту и формированию паннуса, повышенные уровни HSP-70 должны играть решающую роль в сдерживании развития заболевания.
Противовоспалительные средства, такие как NSAID, активируют HSF-1 - ДНК-связывание, и глюкокортикоиды при высоких дозах активируют HSF-1, а также индуцируют экспрессию HSP [Georg Schett et. al., J. Clin. Invest., 1998 July, Vol. 102 (2), pp. 302-311].
HSP-70 играет роль в сдерживании воспаления. Индукция HSP-70 до начала воспаления может снизить органические нарушения [Hayashi Y. et al, Circulation, 2002 Nov 12, Vol. 106 (20), pp. 2601-2607]. Дооперативное введение индукторов HSP-70 представляется полезным для ослабления воспалительной реакции, вызванной условиями искусственного кровообращения (CPB).
Исследования противовоспалительной способности 2-циклопентен-1-она доказывают, что в воспаленной ткани происходит активация фактора теплового шока 1 (HSF 1) с последующей индукцией экспрессии HSP-72, и этот эффект связан с ремиссией воспалительной реакции [Ianaro A. et al., Mol. Pharmacol., 2003 Jul, Vol. 64 (1), pp. 85-93]. Противовоспалительные свойства 2-циклопентен-1-она связывают с экспрессией HSP-72, индуцированной HSF-1 in vivo.
Соиндуктор HSP, BRX-220, исследован на воздействие на холецистокининоктапептид (CCK)-индуцировнаный острый панкреатит у крыс [Rakonczay Z. Jr. et al., Free Radic. Biol. Med., 2002 Jun 15, Vol. 32 (12), pp. 1283-1292]. Панкреатические уровни HSP-60 и HSP-72 значительно снижены у животных, обработанных BRX-220. Кроме того, панкреатическое общее содержание белка, активности амилазы и трипсиногена возрастают с возрастанием активности глутатионпероксидазы. Наблюдается также снижение концентрации трипсиноген-активированного пептида в плазме, панкреатического перокисления липидов, окисления белка и активности Cu/Zn-супероксиддисмутаза. Защитное действие BRX-220 при панкреатите объясняется непосредственным HSP-70-индуцирующим действием BRX-220.
Показано, что общая гипертермия организма крыс приводит к индукции HSP-70, что защищает от последующего церулеин-индуцированного острого панкреатита. Точнее, предупреждает деградацию и дезорганизацию актинового цитоскелетона, важного первоначального компонента панкреатита [Tashiro M. et al., Digestion, 2002, Vol. 65 (2), pp. 118-126], тем самым снижая разрушение, вызываемое вторичным по отношению к воспалению панкреатитом. Таким образом, индукция HSP-70 должна быть полезна для лечения воспалительных нарушений.
Гепатотоксичность
Другим примером патологического стресса, где вовлечена протективная роль HSP-70, является гепатотоксичность. Сверхсинтез белка теплового шока 70 (HSP-70) в печени защищает гепатоциты при различных патологических состояниях. Исследованиями, направленными на изучение влияний индукторов HSP-70 на острую печеночную недостаточность после 95% гепатэктомии, обнаружены существенно ослабленное высвобождение аспартат- или аланинаминотрансферазы и повышение уровня интерлейкина-6 в сыворотке [Oda H. et al, J. Gastrointest. Surg., 2002 May-Jun, Vol. 6 (3), 464-472].
Действие индуктора HSP, хлорида гадолиния, изучено в отношении влияния указанного индуктора на экспрессию металлотионеина и белка теплового шока на модели индуцируемого тиоацетамидом некроза печени in vivo [Andrés D. et al., Biochem. Pharmacol., 2003 Sep 15, Vol. 66 (6), pp. 917-926]. Гадолиний существенно снижает активность миелопероксидазы в сыворотке и концентрацию TNF-альфа и IL-6 в сыворотке, увеличенную тиоацетамидом. Объем некроза, степень окислительного стресса и липоперокисление и активность микросомальной FAD-монооксигеназы значительно снижены. Этот благоприятный эффект связан с повышенной экспрессией HSP-70, следующей за введением гадолиния.
Таким образом, индукция HSP-70 оказывает защитное действие в случае гепатотоксичности.
Сепсис
Еще одним патологическим состоянием, при котором, как установлено, благоприятна индукция HSP-70, является сепсис. Сепсис является тяжелым заболеванием, вызываемым общим инфицированием кровяного русла токсинпродуцирующими бактериями. Индукция HSP посредством терапии тепловым шоком существенно снижает степень смертности от позднего сепсиса. Вовлечение HSP в момент развития сепсиса может усилить основную иммунную защиту от инвазивных патогенов.
Экспрессия HSP-72 и протективная роль указанного HSP исследованы с использованием модели на крысах с применением лигирования слепой кишки и пункции [Yang R. C. et al., Kaohsiung J. Med. Sci., 1998 Nov, Vol. 14 (11), pp. 664-672]. Показано, что индукция экспрессии HSP-70 посредством геранилгеранилацетона защищает от диафрагмальной дисфункции, вызываемой лигированием слепой кишки и перфорацией. Это свидетельствует о зависимой от времени индукции HSP-70 в диафрагме, ослабляющей септическое повреждение диафрагмы [Masuda Y. et al., Crit. Care Med., 2003 Nov, Vol. 31(11), pp. 2585-2591]. Установлено, что GGA индуцирует экспрессию HSP-70 в диафрагме, Этим объясняется основной механизм защитного действия GGA.
Дополнительные эксперименты показывают, что индукция HSP-70 посредством введения арсенита натрия оказывает существенное защитное действие против смертности, вызываемой лигированием слепой кишки и перфорацией [Ribeiro S. P. et al., Crit. Care Med., 1994 Jun, Vol. 22 (6), pp. 922-929]. In vivo инъекция арсенита натрия в отсутствие повышенной температуры тела индуцирует экспрессию HSP-72 в легких и защищает от экспериментального сепсиса. Защитное действие, приводящее к снижению смертности, непосредственно коррелируется с экспрессией белка теплового шока 72 в легких на 18 и 24 час после перфорации.
Обнаружено, что индукция белков теплового шока тепловым стрессом снижает органическое нарушение и смертность в модели внутрибрюшного сепсиса и вызванного сепсисом острого поражения легкого, на крысах [Villar J. et al., Crit. Care Med., 1994 Jun, Vol. 22 (6), pp. 914-921].
Острый респираторный дистресс синдром (ARDS) провоцирует три патологических процесса: неконтролируемое воспаление, аккумуляцию интерстициального/альвеолярного белка и разрушение легочных эпителиальных клеток. Белок теплового шока HSP-70 может ограничивать все три реакции, только если экспрессирован адекватно. Показано, что восстанавливающая экспрессия HSP-70 с использованием аденовирус-опосредованной генной терапии оказывает благоприятное действие [Yoram G. W. et al., J. Clin. Invest., 2002, Vol. 110, pp. 801-806]. Введение HSP-70 существенно снижает интерстициальный и альвеолярный отек наряду с экссудацией белка и резким снижением аккумуляции нейтрофилов. Приблизительно 2-кратно возросшая экспрессия HSP-70 приводит к 68% выживаемости на 48 часов по сравнению с только 25% у необработанных животных. Модуляция продуцирования HSP-70 снижает патологические изменения и улучшает исход в случае экспериментального острого респираторного дистресс синдрома. Таким образом, индукторы HSP-70 должны оказывать протективное действие на сепсис.
Вирусные заболевания
Другим патологическим состоянием, при котором наблюдается индукция HSP-70, является случай вирусных заболеваний. Уже несколько лет известно, что белки теплового шока (HSP) и молекулярные шапероны защищают клетки от вирусной инфекции [Lindquist S. et al., Annu. Rev. Genet., 1988, Vol. 22, pp. 631-637]. Экспериментально показано, что индукция HSP-70 связана с ингибированием инфекционного вирусного продуцирования и синтеза вирусного белка в эпителиальных клетках почек обезьян, инфицированных вирусом везикулярного стоматита (VSV) [Antonio R. et al., J. of Biol. Chem., 1996 Issue of December 13, Vol. 271 (50), pp. 32196-32196]. Патогенная активность вирусного белка R (Vpr) вируса иммунодефицита человека типа 1 (ВИЧ-1) частично связана со способностью указанного белка индуцировать остановку клеточного цикла G2 и апоптоз T-клеток-мишеней. Сверхпродукция HSP-70 снижает Vpr-зависимое блокирование G2 и апоптоз и также снижает репликацию Vpr-позитивного, но не Vpr-дефицитного ВИЧ-1 [Iordanskiy S. et al., J. Virol., 2004 Sep, Vol. 78 (18), pp. 9697-9704]. Индукция HSP-70 посредством простагландина A1 (PGA1) вызывает супрессию продуцирования вируса гриппа [Hirayama E., Yakugaku Zasshi, 2004 Jul, Vol. 124 (7), pp. 437-442].
Антивирусная активность циклопентенонпростагландинов опосредована индукцией HSP-70. Показано, что повышенный синтез HSP-70 оказывает мощное антивирусное действие в некоторых ДНК- и РНК-вирусных моделях - вирус везикулярного стоматита, вирус Синдбис, вирус Сендай, вирус полиомиелита и пр. [Santoro M.G., Experientia, 1994 Nov 30, Vol. 50 (11-12), pp. 1039-1047; Amici C. et al., J. Gen. Virol., 1991 Aug, Vol. 72, pp. 1877-1885; Amici C. et al., J. Virol., 1994 Nov, Vol. 68 (11), pp. 6890-6899; Conti C. et al., Antimicrob. Agents Chemother., 1996 Feb, Vol. 40 (2), 367-372; Conti C. et al., Antimicrob. Agents Chemother., 1999 Apr, Vol. 43 (4), pp. 822-829]. Таким образом, индукция HSP-70 оказывает антивирусное действие.
Отторжение аллотрансплантата
Отторжение аллотрансплантата (трансплантация органа или ткани одного индивидуума другому того же биологического вида, с другим генотипом) является патологическим состоянием, вызывающим индукцию HSP-70. Индукция HSP-70 оказывает защитное действие, сохраняющее функцию органа после трансплантации. Почки могут быть сохранены только на ограниченное время без риска в отношении функции трансплантата и выживаемости. Установлено, что индукция белков теплового шока (HSP) улучшает исход изотрансплантации после более длительного периода хранения на холоде. При гистологическом исследовании предварительная тепловая обработка индуцирует экспрессию HSP-70 и защищает трансплантаты от структурных ишемически реперфузионных нарушений [Wagner M. et al., Kidney Int., 2003 Apr, Vol. 63 (4), pp. 1564-1573]. Наблюдается подавление апоптоза и обнаружено ингибирование активации каспазы-3.
Геранилгеранилацетон, нетоксический индуктор белка теплового шока, исследован на модели ортотопической трансплантации печени на крысах с целью изучения положительного воздействия на тепловое ишемическое-реперфузионное нарушение [Fudaba Y. et al., Transplantation, 2001 Jul 27, Vol. 72 (2), pp. 184-189]. Введение GGA аккумулирует мРНК как HSP-72, так и HSP 90 в печени даже до тепловой ишемии и способствует синтезу HSP-72 и HSP 90 после тепловой ишемии. Кроме того, предварительная обработка GGA также существенно снижает сывороточные уровни альфа-фактора некроза опухоли после реперфузии. Полученные данные показывают, что благоприятные воздействия GGA на ишемически реперфузионное нарушение объясняются как повышенной индукцией HSP, так и последующим превращением. Кроме того, по сравнению с донорами, обрабатываемыми растворителем, где все реципиенты погибают от отсутствия первичной функции, в случае обработки доноров геранилгеранилацетоном (GGA) выживаемость реципиентов на 7 день близка к 90%.
Исследования выявили обратную зависимость между экспрессией HSP и отторжением, с вероятностью того, что повышенные уровни HSP в миокарде приведут к низкому отторжению сердечных трансплантатов [Baba H. A. et al., Transplantation, 1998 Mar 27, Vol. 65 (6), pp. 799-804]. Наблюдается существенное улучшение постишемического восстановления механической функции сердца с HSP-70-генной трансфекцией по сравнению с контролями, при эквивалентных протоколу условиях сохранения трансплантата сердца. Эти результаты подтверждают полученные ранее экспериментальные данные на моделях клеточных культур и были затем расширены для выяснения роли HSP-70 в защите от ишемически реперфузионного нарушения на модели цельного сердца, что ближе к клинической ситуации [Jayakumar J. et al., Circulation, 2000, Vol. 102 [suppl. III], pp. III-302 - III-306].
Реакция на тепловой шок также оказывает защитное действие на ишемию кожного трансплантата. Экспрессия белка теплового шока (HSP) увеличивается in vivo с введением высокой дозы аспирина перед тепловой терапией [Ghavami A. et al., Ann. Plast. Surg., 2002 Jan, Vol. 48 (1), pp. 60-67]. Иммуногистохимия подтверждает экспрессию HSP, и выживаемость кожного трансплантата значительно улучшается. Таким образом, индукция HSP-70 благоприятно действует на сохранение функции органа после трансплантации.
Опухолевые заболевания
Показано также, что индукция HSP-70 благоприятна для терапии новообразований. Установлено, что повышенная экспрессия HSP-70 способна вызывать регрессию опухолей в различных моделях на животных. Белки теплового шока (HSP) вовлечены в развитие резистентности (термотолерантности), являющейся результатом гипертермического стресса, а также усиление клинической реакции некоторых химиотерапевтических средств в раковых опухолях, таких как раковая опухоль предстательной железы. Анализы колониеобразования выявили сенсибилизирующее действие гипертермии при одновременном комбинировании с каждым из химиотерапевтических средств, приводящее к потенцированной локализованной цитотоксичности [Roigas J. et al., Prostate, 1998 Feb 15, Vol. 34 (3), pp. 195-202]. Показано, что синхронное применение химиотерапевтических средств и гипертермии оказывает синергическое цитотоксическое действие на аденокарциному предстательной железы крыс Даннинга. Кроме того, показано, что индукция HSP в термотолерантных клетках, оцененная по индукции HSP-70, приводит к модуляции химиотерапевтически опосредованной цитотоксичности.
Обнаружено, что непосредственная индукция белков теплового шока вносит существенный вклад в иммунитет от рака. Противоопухолевый иммунитет вызывают гипертермией и дополнительно усиливают введением рекомбинантного белка HSP-70 непосредственно в опухоль [Ito A. et al., Cancer Immmunol. Immmunother., 2004 Jan, Vol 53(1), pp. 26-32]. Индукция гипертермии с применением переменного магнитного поля в 500 кГц в комбинации с магнитными катионными липосомами, которые обладают положительным зарядом и генерируют тепло в переменном магнитном поле, наряду с введением рекомбинантного белка HSP-70 в подкожную меланому мышей замедляет рост опухоли за 30-дневный период, и полная регрессия опухолей наблюдается у 20% мышей. Обнаружено также, что у излеченных мышей возникает системный противоопухолевый иммунитет. Другое исследование, проведенное с целью определения, будет ли противоопухолевый иммунитет, вызываемый гипертермией, усиливаться HSP-70-генным переносом [Ito A. et al., Cancer Gene Ther., 2003 Dec, Vol. 10 (12), pp. 918-925], показал, что комбинированная терапия резко останавливает рост опухоли за 30-дневный период, и полная регрессия опухолей наблюдается у 30% мышей. Таким образом, индукция HSP-70 полезна для терапии опухолевых заболеваний.
Повреждения слизистой желудка
Повреждения слизистой желудка, вызываемые пищей, причиняющей вред организму, и Helicobacter инфекцией привратника, составляют еще одно патологическое состояние, вызывающее индукцию HSP-70. Мукоидные клетки слизистой оболочки желудка служат основной защитой от таких повреждений. Первичная культура мукоидных клеток слизистой оболочки желудка желез дна желудка морских свинок обладает типичной реакцией на тепловой шок после воздействия повышенной температуры или обменных нарушений, вызванных такими веществами, как этанол и пероксид водорода, и способна обнаруживать резистентность в отношении этих источников стресса. Белок мРНК HSP-70 индуцируется в слизистой оболочке желудка крыс после стресса и степень индукция находится в обратной зависимости от тяжести повреждений слизистой желудка, что говорит о протективной роли HSP-70 в защите слизистой оболочки желудка [Rokutan K., J. Gastroenterol. Hepatol., 2000 Mar, Vol. 15 Suppl, pp. D12-9].
Кровоизлияние в мозг
Другим патологическим состоянием, вызывающим индукцию HSP-70, является случай кровоизлияния в мозг. Исследования с бимокломолем демонстрируют способность последнего снижать патологический рост проницаемости гематоэнефалического барьера при нарушении мозгового кровообращения, в особенности, если сосудистое нарушение вызывается субарахноидальной аутологичной кровью [Erdo F. et al., Brain Research Bulletin, 1998, Vol. 45 (2), pp.163-166]. Бимокломоль резко снижает участок мозговой ткани с утечкой, определяемой окрашиванием голубым Эвансом, на 39%. Бимокломоль оказывает лечебное действие в случае экспериментального субарахноидального кровоизлияния благодаря соиндукторному действию на экспрессию HSP-72.
Эндотелиальные дисфункции
Различные эндотелиальные дисфункции представляют патологические состояния, приводящие к индукции HSP-70 в клетках организма. Влияние обработки бимокломолем, соиндуктором белков теплового шока, на эндотелиальную функцию и экспрессию белка теплового шока в 72 кД исследовано на спонтанно-гипертензивных крысах [Jednakovits A. et. al., Life Sci., 2000 Aug 25, Vol. 67(14), pp. 1791-1797]. Значительное возрастное ухудшение в релаксации уровней ацетилхолина и васкулярных уровней мРНК HSP-72 наблюдается у SHR животных. Установлено, что эти изменения можно предупредить введением бимокломоля, что свидетельствует о взаимосвязи между сохранением эндотелиальной функции и поддерживаемыми уровнями HSP-72.
Диабетические осложнения
Осложнения, возникающие у диабетических пациентов, такие как невропатия, нефропатия и замедленное заживление ран, составляют патологические состояния, в которые вовлечена протективная роль HSP-70.
(a) Диабетическая невропатия
Считается, что эндоневральная микроангиопатия, вызывающая инфаркты нервов, вовлечена в патогенез диабетической невропатии [Malik R. A. et al., Diabetic Neuropathy: New Concepts and Insights, 1995, pp. 131-135]. Экспериментальные данные дают основания говорить о протективном действии индукции HSP-72 на диабетическую невропатию [Biro K. et. al., Brain Research Bulletin, 1997, Vol. 44 (3), 259-263]. Лечение бимокломолом, благодаря HSP-70-индуцирующей способности последнего, значительно снижает замедление нервной проводимости, моторной на 38% и сенсорной на 42%, что выявляет зависимую от дозы реакцию. Бимокломол также тормозит развитие обычно повышенной ишемической резистентности, вызванной стрептозотоцининдуцированной невропатией, на 71%. Эти эффекты наблюдались при дозах, которые, как известно, индуцируют транскрипцию HSP-72 в других тканях, таких как сердце и почки, в ответ на ишемию.
(b) Диабетическая ретинопатия
Диабетическая ретинопатия связана с нарушением гематоретинального барьера (BRB) и приводит к макулярному отеку, служащему причиной потери зрения при диабете. Показано, что HSP-соиндуктор бимокломол (BRLP-42) эффективен при вызываемой диабетом ретинопатии [Hegedius S. et al., Diabetologia, 1994, Vol. 37, p. 138]. Защитное действие выражается в сниженной степени отека и понижении фоторецепторной зоны, почти нормальном расположении ретинальных пигментных эпителиальных микроворсин и более компактной и уравновешенной ретинальной капиллярной базальной мембране [Biro K. et al, Neuro Report, 1998 Jun 22, Vol.9 (9), pp. 2029-2033]. Улучшения связаны с цитопротективным действием бимокломола на ретинальную нервную ткань и/или нейроны при вызванном диабетом ишемическом клеточном нарушении. Кроме того, показано, что сверхпродукция HSP-70 оказывает протективное действие на ретинальные световые нарушения [Kim J. H. et al., Korean J. Ophthalmol. 2003 Jun, Vol. 17 (1), pp. 7-13].
(c) Длительное заживление ран
HSP вовлечены в регуляцию клеточной пролиферации. Ослабленная экспрессия HSP-70 связана с замедленным заживлением ран у диабетических животных [McMurtry A.L. et al., J. Surg. Res., 1999, Vol. 86, pp. 36-41]. Более быстрое и устойчивое заживление достигается активацией HSP-70 в ране с помощью лазера [Capon A. et al., Lasers Surg. Med., 2001, Vol. 28, pp. 168-175].
Таким образом, индукция HSP-70 полезна для лечения различных диабетических осложнений.
Нейродегенеративные заболевания
Нейродегенеративные нарушения, такие как болезнь Альцгеймера, боковой амиотрофический склероз и болезнь Паркинсона составляют ряд патологических состояний с вовлечением HSP-70, оказывающего протективное действие и замедляющего развитие заболеваний.
(a) болезнь Альцгеймера является нейродегенеративным нарушением, характеризующимся агрегациями бета-амилоидного и тау-белка (нейрофибриллярные клубки). Показано, что повышенные уровни HSP (8-10-кратное увеличение) в различных клеточных моделях способствуют тау-растворимости и тау-связыванию с микроканальцами, снижают нерастворимый тау и являются причиной пониженного тау-фосфорилирования. Таким образом, позитивная регуляция HSP подавляет образование нейрофибриллярных клубков [Dou F. et al., Proc. Natl. Acad. Sci. USA, 2003 Jan 21, Vol. 100 (2), pp. 721-726]. Исследования показывают, что вирусно-опосредованная сверхпродукция HSP-70 предохраняет нейроны от токсических эффектов внутриклеточной бета-амилоидной аккумуляции [Magrané J. et al., J. Neurosci., 2004 Feb 18, Vol. 24 (7), pp. 1700-1706].
(b) Боковой амиотрофический склероз (ALS) является фатальным нейродегенеративным состоянием, при котором гибнут двигательные нейроны спинного мозга и двигательной зоны коры головного мозга, что приводит к прогрессивному параличу. Этиология ALS включает мутацию генного кодирования Cu/Zn-супероксиддисмутазы-1 (SOD1). Лечение аримокломолом, индуктором белков теплового шока (HSP), значительно замедляет прогрессирование болезни у трансгенных мышей, сверхпродуцирующих мутантный SOD1 человека, что отображает фенотип и патологию, очень близкие к наблюдаемым у ALS пациентов [Kieran D. et al., Nat. Med., 2004 April, Vol 10 (4), pp. 402-405; Susanna C. B. et al., Nat. Med., 2004, Vol. 10, pp. 345-347].
(c) Болезнь Паркинсона является общим нейродегенеративным заболеванием, характеризующимся утратой допаминергических нейронов в компактных частях черной субстанции и аккумуляцией белка с нарушенной конформацией, альфа-синуклеина, в агрегациях, называемых тельца Леви и неврит Леви, которые очень цитотоксичны. В патогенез болезни Паркинсона (PD) вовлечены митохондриальная дисфункция, окислительный стресс, неправильная укладка белка, агрегация и нарушение протеосомальной деградации специфических нейронных белков. Позитивная регуляция HSP-70 посредством HSP-70-генного переноса к допаминовым нейронам с помощью рекомбинантного аденоассоциированного вируса в значительной степени защищает допаминергическую систему мышей от MPTP-индуцированной утраты допаминовых нейронов и вызываемого снижения уровней стриарного допамина [Dong Z. et al., Mol. Ther., 2005 Jan, Vol. 11(1), pp. 80-88]. Недавно полученные данные свидетельствуют, что депренил и другие пропаргиламины, применяемые клинически для лечения болезни Паркинсона, повышают нейронную выживаемость увеличением синтеза HSP-70 и других антиапоптических белков [Tatton W. et al., J. Neural. Transm., 2003 May, Vol. 110 (5), 509-515]. Введение HSP-70 альфа-синуклеиновым трансгенным мышам путем скрещивания с мышами, характеризующимися сверхэкспрессией HSP-70, ведет к значительному снижению в потомстве содержания альфа-синуклеина с нарушенной конформацией и агрегацией [Klucken J. et al., J. Biol. Chem., 2004 Jun 11, Vol. 279 (24), pp. 5497-5502]. Недавно полученные данные свидетельствуют, что гельданамицин защищает нейроны от альфа-синуклеиновой токсичности путем повышения HSP-70-опосредованной шапероновой активности [Auluck P. K. et al., J. Biol. Chem., 2005 Jan 28, Vol. 280 (4), pp. 2873-2878].
Таким образом, индукторы HSP-70 полезны в терапии и сдерживании прогрессирования вышеуказанных нейродегенеративных заболеваний.
Посттравматическое неврональное нарушение
Патологический стресс, вызванный посттравматическим неврональным нарушением, вызывает индукцию HSP-70 в неврональных тканях. Предполагается, что экспрессия HSP-70 после травматического повреждения неврональной ткани является частью клеточной реакции, которая вовлечена в восстановление поврежденных белков [Dutcher S. A et al., J. Neurotrauma, 1998, Vol. 15 (6), pp. 411-420]. Было исследовано влияние BRX-220, индуктора HSP-70, на выживаемость поврежденных мотонейронов после раздавливания седалищного нерва крысят [Kalmar B. et al., Exp. Neurol., 2002 Jul, Vol. 176 (1), pp. 87-97]. Установлено, что при обработке BRX-220 выживает значительно большее число нейронов и отсутствует дальнейшая гибель мотонейронов. Спустя 14 дней после нарушения в группе, получавшей BRX 220, выживает 39% мотонейронов по сравнению с 21% для группы с растворителем. Кроме того, в группе, получавшей BRX 220, не наблюдается дальнейшая гибель мотонейронов, на период 10 недель выживает 42% мотонейронов, по сравнению с 15% в необработанной группе. Существует также больше функциональных моторных единиц в мышцах задних конечностей в обработанной группе по сравнению с контролем. Эти данные коррелируются с повышенными уровнями HSP-70, и такое соединение защищает мотонейроны от индуцированной аксотомией гибели клеток по опосредованному HSP-70 механизму. Таким образом, индукция HSP-70 благоприятна при посттравматическом неврональном нарушении.
Острая почеч