Замещенные анилиды никотиновой кислоты, обладающие фунгицидной активностью
Иллюстрации
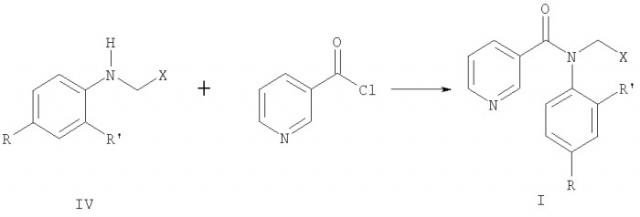
Показать всеИзобретение относится к анилидам никотиновой кислоты общей формулы I
где R означает атом водорода, галогена или бензилоксигруппу, R' означает атом водорода или галогена, Х означает 2-фурил, 2-пиридил, 3-пиридил, незамещенный или замещенный атомом галогена фенил, обладающим фунгицидной активностью. Технический результат: получены новые соединения, которые эффективны против вредоносных грибов. 3 табл.
Реферат
Изобретение относится к химии гетероциклических соединений, а именно к замещенным анилидам никотиновой кислоты общей формулы I, где R означает атом водорода, галогена или бензилоксигруппу, R' означает атом водорода или галогена, Х означает 2-фурил, 2-пиридил, 3-пиридил, незамещенный или замещенный атомом галогена фенил, обладающим фунгицидной активностью.
Замещенные анилиды никотиновой кислоты общей формулы I могут найти применение для борьбы с вредоносными грибами в медицине, ветеринарии, сельском хозяйстве, строительстве.
Известны никотинамиды общей формулы II, где R означает алкил, алкенил, алкокси-группу, R' означает арил, которые эффективны против мучнистой росы бобовых [Пат. US 4504484, 1982].
Наиболее близки по структуре к соединениям формулы I анилиды общей формулы III, где R означает алкил или циклоалкил, R' означает циано-, нитро- или метоксикарбонильную группу, обладающие фунгицидной активностью [Пат. WO 95/25723, 1994].
Однако соединения структур II и III имеют узкий спектр действия и показывают фунгицидную активность только в отношении отдельных видов грибов. Кроме того, к фунгицидам у грибов часто развивается устойчивость.
Техническая задача, решаемая настоящим изобретением, состоит в расширении ассортимента фунгицидов для более эффективной борьбы с вредоносными грибами.
Поставленная задача решается получением замещенных анилидов никотиновой кислоты общей формулы I, обладающих фунгицидной активностью.
Замещенные анилиды никотиновой кислоты общей формулы I могут быть получены взаимодействием замещенных анилинов общей формулы IV, где R, R' и Х имеют те же значения, что и в формуле I, с хлорангидридом никотиновой кислоты:
Аналогичные реакции описаны в литературе [Вейганд-Хильгетаг. Методы эксперимента в органической химии. - М.: Химия, 1968 г. - 944 с.].
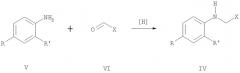
Соединения общей формулы IV могут быть получены известными способами из анилинов общей формулы V, где R и R' имеют те же значения, что и в формуле I, восстановительной конденсацией с альдегидами общей формулы VI, где Х имеет те же значения, что и в формуле I, в присутствии боргидрида натрия или муравьиной кислоты с последующим гидролизом полученного формамида, или восстановлением оснований Шиффа боргидридом натрия, алюмогидридом лития или водородом с использованием катализаторов:
Аналогичные реакции описаны в литературе [Органикум: в 2-х т., пер. с нем. - М.: Мир, 1979].
Изобретение может быть проиллюстрировано следующими примерами.
Пример 1. Раствор 4,28 г (0,04 моль) 2-пиридинкарбальдегида, 3,72 г (0,04 моль) свежеперегнанного анилина и каталитического количества n-толуолсульфокислоты в 36 мл толуола кипятили 6 ч с насадкой Дина-Старка, после чего растворитель отогнали в вакууме. К остатку прибавили 5,25 мл (0,13 моль) 93%-ной муравьиной кислоты и кипятили с обратным холодильником 15 ч, затем прибавили 50 мл 6N соляной кислоты, продолжали кипячение в течение 1,5 ч. Реакционную массу охладили, прибавили 50%-ной водный раствор гидроксида натрия до рН 12. Продукт экстрагировали хлороформом (3×20 мл), экстракт сушили над безводным сульфатом магния, растворитель отогнали в вакууме. Остаток перегоняли в вакууме, собирая фракцию с т.кип. 127-135°С (0,1 мм рт.ст.). После перекристаллизации из смеси гексан-толуол (4:1) получили 3,4 г (45%) N-(пирид-2-илметил)анилина в виде светло-желтых кристаллов с т.пл. 98-99°С. ЯМР 1Н-спектр (δ, м.д., J, Гц): 4.25 с (2Н, СН2), 6.07 с (1Н, NH), 6.50-6.65 м (3Н, СН фен.), 7.06 т (2Н, СН фен., J=7.8). 7.30-7.40 м (1Н, СН пирид.), 7.45-7.53 м (1Н, СН пирид.), 7.75 д (1Н, СН пирид., J=8.9), 8.45 д (1Н, СН пирид., J=4.4).
Пример 2. К 1,91 г (15 ммоль) n-хлоранилина в смеси 75 мл тетрагидрофурана и 25 мл метанола прибавляли при 0°С раствор 3,17 г (17 ммоль) n-бромбензальдегида и 4,3 мл 3N серной кислоты в 15 мл тетрагидрофурана. Смесь перемешивали при 0°С 5 мин, затем прибавляли 1 г (26 ммоль) боргидрида натрия. Смесь выдерживали при комнатной температуре 10 мин и добавляли 30 мл воды. Добавляли гидроксид натрия до рН 9 и экстрагировали хлороформом (3×10 мл). Экстракт сушили над безводным сульфатом натрия, растворитель отгоняли в вакууме. Остаток перекристаллизовывали из 50%-ного этанола. Получили 2,64 г (60%) N-(4-бромбензил)-4-хлоранилина в виде желтых кристаллов с т.пл. 83-85°С. ЯМР 1Н-спектр (δ, м.д., J, Гц): 4.21 с (2Н, СН2), 5.62 с (1Н, NH) 6.82-7.14 А2В2-система (4Н, С6Н4, J=9.5), 7.15-7.33 А2В2-система (4Н, С6Н4, J=8.9).
Пример 3. К 0,68 г (3,8 ммоль) гидрохлорида хлорангидрида никотиновой кислоты в 15 мл хлористого метилена добавляли 1,06 мл (7,6 ммоль) сухого триэтиламина и 0,64 г (3,2 ммоль) N-(пирид-3-илметил)-4-фторанилина. Смесь перемешивали в течение 4 ч, растворитель отгоняли в вакууме, к остатку прибавляли 15 мл воды и экстрагировали хлороформом (3×10 мл). Экстракт промывали 15 мл 10%-ного раствора карбоната калия, водой, сушили над безводным сульфатом магния. Растворитель отгоняли в вакууме, а остаток очищали методом колоночной хроматографии (элюент-хлороформ). Получили 0,66 г (68%) N-(пирид-3-илметил)-4'-фторникотинанилида (соединение 6) в виде белых кристаллов с т.пл. 109-110°С. ЯМР 1Н-спектр (δ, м.д., J, Гц): 5.12 с (2Н, СН2), 7.05 т (2Н, СН фен., J=8.9), 7.12-7.25 м (2Н, СН фен.). 7.25-7.32 м (1Н, СН пирид.), 7.32-7.38 м (1Н, СН пирид.), 7.68-7.75 м (2Н, СН пирид.), 8.44-8,52 м (4Н, СН пирид.).
Пример 4. К 0,677 г (3,8 ммоль) гидрохлорида хлорангидрида никотиновой кислоты в 15 мл хлористого метилена добавляли 1,06 мл (7,6 ммоль) сухого триэтиламина и 0,84 г (3,2 ммоль) N-(пирид-2-илметил)-4-броманилина. Смесь перемешивали в течение 4 ч. Растворитель отгоняли в вакууме, к остатку прибавляли 15 мл воды и экстрагировали хлороформом (3×10 мл). Экстракт промывали 15 мл 10%-ного раствора карбоната калия, водой, сушили над безводным сульфатом магния. Растворитель отгоняли в вакууме, а остаток очищали методом колоночной хроматографии (элюент-хлороформ). Получили 0,51 г (43%) N-(пирид-2-илметил)-4'-бромникотинанилида (соединение 11) в виде желтых кристаллов с т.пл. 108-109°С. ЯМР 1H-спектр (δ. м.д., J, Гц): 5.15 с (2Н, СН2), 7.20-7.42 А2В2-система (4Н, С5Н4, J=8.9), 7.24-7.35 м (2Н, СН пирид.), 7.47 м (1Н, СН пирид.), 7.68-7.82 м (2Н, СН пирид.), 8.45-8.55 м (3H, СН пирид.).
Пример 5. К 0,54 г (3 ммоль) гидрохлорида хлорангидрида никотиновой кислоты в 10 мл хлористого метилена добавляли 0,84 мл (6 ммоль) сухого триэтиламина и 0,73 г (2,6 ммоль) N-(фур-2-илметил)-4-(бензилокси)анилина. Смесь перемешивали в течение 4 ч. Растворитель отгоняли в вакууме, к остатку прибавляли 10 мл воды и экстрагировали хлороформом (3×10 мл). Экстракт промывали 10 мл 10%-ного раствора карбоната калия, водой, сушили над безводным сульфатом магния. Растворитель отгоняли в вакууме, а остаток очищали методом колоночной хроматографии (элюент - хлороформ). Получили 0,68 г (68%) N-(фур-2-илметил)-4'-(бензилокси)никотинанилида (соединение 16) в виде желтого масла. ЯМР 1Н-спектр (δ, м.д., J, Гц): 5.05 с (2Н, СН2), 5.35 с (2Н, ОСН2), 6.30 с (1Н, СН фур.), 6.37 с (1Н, СН фур.), 7.08-7.45 А2В2-система (4Н, C6H4, J=11.0), 7.11-7.20 м (5Н, СН фен.), 7.22-7.35 м (1Н, СН пирид.), 7.60 с (1Н, СН фур.), 7.65-7.73 м (1Н, пирид.), 8.40-8.50 м (2Н, СН пирид.).
ЯМР 1Н-спектры зарегистрированы на приборе Bruker AM300 в DMSO-d6.
Выходы и температуры плавления замещенных анилидов никотиновой кислоты общей формулы I приведены в табл.1, ЯМР 1Н-спектры - в табл.2.
| Таблица 1.Выходы и температуры плавления замещенных анилидов никотиновой кислоты общей формулы I | |||||
| Соединение | R | R' | X | Выход, % | Т.пл., °С |
| 1 | Н | H | 2-фурил | 89 | масло |
| 2 | Н | H | 2-пиридил | 79 | 102-103 |
| 3 | Н | H | 3-пиридил | 74 | 126-127 |
| 4 | F | H | 2-фурил | 70 | масло |
| 5 | F | H | 2-пиридил | 83 | 88-89 |
| 6 | F | H | 3-пиридил | 68 | 109-110 |
| 7 | Cl | H | 2-фурил | 76 | 107-109 |
| 8 | Cl | H | 2-пиридил | 74 | 115-117 |
| 9 | Cl | H | 3-пиридил | 81 | 95-96 |
| 10 | Br | H | 2-фурил | 64 | 92-93 |
| 11 | Br | H | 2-пиридил | 43 | 108-109 |
| 12 | Br | H | 3-пиридил | 40 | 144-145 |
| 13 | F | F | 2-фурил | 81 | масло |
| 14 | F | F | 2-пиридил | 56 | 98-100 |
| 15 | F | F | 3-пиридил | 63 | 111-112 |
| 16 | OCH2Ph | H | 2-фурил | 68 | масло |
| 17 | OCH2Ph | H | 2-пиридил | 77 | 75-76 |
| 18 | OCH2Ph | H | 3-пиридил | 89 | масло |
| 19 | H | H | фенил | 40 | 92-94 |
| 20 | F | H | фенил | 44 | 78-79 |
| 21 | Cl | H | фенил | 49 | 128-129 |
| 22 | Br | H | фенил | 44 | 142-143 |
| 23 | Cl | H | 4-бромфенил | 89 | 136-138 |
| Таблица 2.ЯМР 1Н-спектры замещенных анилидов никотиновой кислоты общей формулы I. | |
| Соединение | δ, м.д., J, Гц |
| 1 | 5.07 с (2Н, СН2), 6.27, 6.37 оба с (по 1Н, CH фур.), 7.05-7.30 м (6Н, С6Н5, СН пирид.), 7.57 с (1Н, CH фур.), 7.60-7.70 м (1Н, CH пирид.), 8.40-8.47 м (2Н, СН пирид.) |
| 2 | 5.13 с (2Н, СН2), 7.12-7.37 м (5Н, С6Н5), 7.24-7.35 м (2Н, СН пирид.), 7.47 м (1Н, СН пирид.), 7.69-7.80 м (2Н, СН пирид.), 8.44-8.55 м (3H, СН пирид.) |
| 3 | 5.15 с (2Н, СН2), 7.10-7.18 м (3Н, СН фен.), 7.18-7.28 м (3Н, 2СН фен., 1СН пирид.), 7.30-7.38 м (1Н, СН пирид.). 7.68-7.75 м (2Н, СН пирид.), 8.40-8.50 м (4Н, СН пирид.) |
| 4 | 5,05 с (2Н, СН2), 6.27, 6.37 оба с (по 1Н, СН фур.), 7.02-7.20 м (4Н, СН фен.), 7.22-7.30 м (1Н, СН пирид.), 7.57 с (1Н, СН фур.), 7.63-7.70 м (1Н, СН пирид.), 8.40-8.50 м (2Н, СН пирид.) |
| 5 | 5.15 с (2Н, СН2), 7.05 т (2Н, СН фен., J=8.9), 7.24-7.35 м (4Н, 2СН фен., 2СН пирид.), 7.47 м (1Н, СН пирид., J=9.6), 7.68-7.82 м (2Н, СН пирид.). 8.45-8.55 м (3Н, СН пирид.) |
| 6 | 5.12 с (2Н, СН2), 7.05 т (2Н, СН фен., J=8.9), 7.12-7.25 м (2Н, СН фен.), 7.25-7.32 м (1Н, СН пирид.), 7.32-7.38 м (1Н, СН пирид.), 7.68-7.75 м (2Н, СН пирид). 8.44-8.52 м (4Н, СН пирид.) |
| 7 | 5.08 с (2Н, СН2), 6.27, 6.37 оба с (по 1Н, СН фур.), 7.05-7.48 А2В2-система (4Н, С6Н4, J=12.5), 7.22-7.33 м (1Н, СН пирид.), 7.58 с (1Н, СН фур.), 7.60-7,72 м (1Н, СН пирид.), 8.40-8.50 м (2Н, СН пирид.) |
| 8 | 5.16 с (2Н, СН2), 7.23-7.46 А2В2-система (4Н, С6Н4, J=8.9), 7.25-7.33 м (2Н, СН пирид.), 7.45 м (1Н, СН пирид.), 7.70-7.82 м (2Н, СН пирид), 8.46-8.57 м (3Н, СН пирид) |
| 9 | 5.13 с (2Н, СН2), 7.10-7.38 А2В2-система (4Н, С6Н4, J=9.5); 7.27-7.39 м (2Н, СН пирид.), 7.80 д (2Н, СН пирид., J=6.3), 8.45-8.56 м (4Н, СН пирид.) |
| 10 | 5.07 с (2Н, СН2), 6.29, 6,37 оба с (по 1Н, СН фур.), 7.08-7.45 А2В2-система (4Н, С6Н4, J=12.0), 7.22-7.35 м (1Н, СН пирид.), 7.58 с (1Н, СН фур.), 7.65-7.73 м (1Н, СН пирид.), 8.40-8.50 м (2Н, СН пирид.) |
| 11 | 5.15 с (2Н, СН2), 7.20-7.42 А2В2-система (4Н, С6Н4 J=8.9), 7.24-7.35 м (2Н, СН пирид.), 7,47 м (1Н, СН пирид.), 7.68-7.82 м (2Н, СН пирид.), 8.45-8.55 м (3Н, СН пирид.) |
| 12 | 5.15 с (2Н, СН2), 7.12-7 42 А2В2-система (4Н, С6Н4, J=8.9), 7.25-7.40 м (2Н, СН пирид.), 7.75 д (2Н, СН пирид., J=5.5), 8.42-8.55 м (4Н, СН пирид.) |
| 13 | 5.06 с (2Н, СН2), 6.30, 6.38 оба с (по 1Н, СН фур.), 7.05-7.18 м (2Н, СН фен.), 7.22-7.35 м (1Н, СН пирид.), 7.46 м (1Н, СН фен.), 7.60 с (1Н, СН фур.), 7.65-7.73 м (1Н, СН пирид.), 8.41-8.49 м (2Н, СН пирид.) |
| 14 | 5.16 с (2Н, СН2), 7.05-7.18 м (2Н, СН фен,), 7.20-7.35 м (2Н, СН пирид.), 7.43 м (1Н, СН фен.), 7.45 м (1Н, СН пирид., J=9.6), 7.70-7.83 м (2Н, СН пирид.), 8.45-8.55 м (3Н, СН пирид.) |
| 15 | 5.14 с (2Н, СН2), 7.00-7.15 м (2Н, СН фен.), 7.25-7,40 м (2Н, СН пирид.), 7.45 м (1Н, СН фен.), 7.75 д (2Н, СН пирид., J=5.5), 8.42-8.55 м (4Н, СН пирид.) |
| 16 | 5.05 с (2Н, СН2), 5.35 с (2Н, ОСН2), 6.30, 6.37 оба с (по 1Н, СН фур.), 7.08-7.45 А2В2-система (4Н, С6Н4, J=11.0), 7.11-7.20 м (5Н, С6Н5), 7.22-7.35 м (1Н, СН пирид.), 7.60 с (1Н, СН фур.), 7.65-7.73 м (1Н, СН пирид.), 8.40-8.50 м (2Н, СН пирид.) |
| 17 | 5.15 с (2Н, СН2), 5.35 с (2Н, ОСН2), 7.11-7.42 А2В2-система (4Н, С6Н4, J=10.0), 7.13-7.20 м (5Н, С6Н5), 7.23-7.36 м (2Н. СН пирид.), 7.50 м (1Н. СН пирид.), 7,67-7.82 м (2Н, СН пирид.), 8.43-8.52 м (3Н, СН пирид.) |
| 18 | 5.15 с (2Н, СН2), 5.36 с (2Н, ОСН2), 7.10-7.39 А2В2-система (4Н, С6Н4, J=9.5), 7.13-7.21 м (5Н, С6Н5), 7.25-7.40 м (2Н, СН пирид.), 7.75 д (2Н, СН пирид., J=5.5), 8.42-8.55 м (4Н, СН пирид.) |
| 19 | 5.15 с (2Н. СН2), 7.10-7.18 м (3Н. СН фен.), 7.18-7.38 м (7Н, 2СН + 5СН фен.), 7.43-7.45 м (1Н, СН пирид.), 7.67 д (1Н, СН пирид., J=6.5), 8.43-8.52 м (2Н, СН пирид.) |
| 20 | 5.10 с (2Н, СН2), 7.05 т (2Н, СН фен., J=8.9), 7.12-7.25 м (2Н, СН фен.), 7.30-7.40 м (5Н, С6Н5), 7.43-7.46 м (1Н, СН пирид.), 7.65 д (1Н. СН пирид., J=6.8), 8.43-8.52 м (2Н, СН пирид.) |
| 21 | 5.10 с (2Н, СН2), 6.84-7.16 А2В2-система (4Н, C6H4, J=9.5), 7.35-7.39 м (5Н, С6Н5), 7.40-7.45 м (1Н, СН пирид.), 7.62 д (1Н, СН пирид., J=6.8), 8.40-8.51 м (2Н, СН пирид.) |
| 22 | 5.10 с (2Н, СН2), 7.12-7.42 А2В2-система (4Н, С6Н4, J=9.0), 7.32-7.39 м (5Н, С6Н5), 7.40-7.45 м (1Н, СН пирид.), 7.62 д (1Н, СН пирид, J=6.8), 8.40-8.51 м (2Н, СН пирид.) |
| 23 | 5.08 с (2Н, СН2), 6.84-7.16 А2В2-система (4Н, С6Н4, J=9.5), 7.18-7.35 А2В2-система (4Н, С6Н4, J=8.9), 7.41-7.46 м (1Н, СН пирид.), 7.62 д (1Н, СН пирид., J=6.8), 8.43-8.51 м (2Н, СН пирид.) |
Пример 6. Испытания на фунгицидную активность соединений проводили in vitro на грибах Venturia inaequalis (V.i.), Rhizoctonia solani (R.s.), Fuzarium oxysporum (F.o.), Sclerotinia sclerotiorum (S.s.), Helminthosporium sativum (H.s.), Fuzarium moniliforme (F.m.) при концентрации активного компонента 30 мг/л. В качестве питательной среды использовали сахарозно-картофельный агар. Инокулированные среды выдерживали в термостате при 25°С в течение 3 суток. Активность соединений определяли как процент подавления роста мицелия гриба по отношению к контролю. В качестве эталона использовали коммерческий фунгицид триадимефон. Фунгицидная активность замещенных анилидов никотиновой кислоты общей формулы I приведена в табл.3.
| Таблица 3.Фунгицидная активность замещенных анилидов никотиновой кислоты общей формулы I | ||||||
| Соединение | Подавление радиального роста мицелия грибов в сравнении с контролем, % | |||||
| V.i. | R.s. | F.o. | F.m. | H.s. | S.s. | |
| 1 | 41 | 15 | 23 | 46 | 53 | 16 |
| 2 | 16 | 12 | 21 | 35 | 13 | 20 |
| 3 | 33 | 21 | 13 | 29 | 30 | 21 |
| 4 | 41 | 18 | 17 | 53 | 34 | 18 |
| 5 | 14 | 11 | 16 | 26 | 16 | 17 |
| 6 | 33 | 27 | 12 | 24 | 26 | 11 |
| 7 | 40 | 25 | 19 | 55 | 30 | 18 |
| 8 | 12 | 15 | 23 | 29 | 18 | 15 |
| 9 | 37 | 33 | 12 | 35 | 21 | 24 |
| 10 | 41 | 33 | 22 | 51 | 28 | 20 |
| 11 | 14 | 11 | 17 | 37 | 11 | 20 |
| 12 | 35 | 37 | 9 | 39 | 15 | 33 |
| 13 | 39 | 18 | 44 | 53 | 40 | 23 |
| 14 | 33 | 25 | 48 | 59 | 49 | 15 |
| 15 | 34 | 15 | 35 | 55 | 38 | 17 |
| 16 | 48 | 51 | 45 | 59 | 49 | 30 |
| 17 | 51 | 56 | 49 | 61 | 49 | 28 |
| 18 | 44 | 48 | 39 | 68 | 43 | 21 |
| 19 | 66 | 74 | 23 | 57 | 72 | 9 |
| 20 | 40 | 43 | 25 | 42 | 60 | 0 |
| 21 | 50 | 69 | 43 | 64 | 80 | 26 |
| 22 | 40 | 71 | 25 | 49 | 49 | 15 |
| 23 | 40 | 74 | 47 | 62 | 77 | 19 |
| Эталон | 54 | 55 | 72 | 85 | 58 | 67 |
Замещенные анилиды никотиновой кислоты общей формулы I,
где R означает атом водорода, галогена или бензилоксигруппу, R' означает атом водорода или галогена, Х означает 2-фурил, 2-пиридил, 3-пиридил, незамещенный или замещенный атомом галогена фенил.