Фармацевтическое средство, содержащее гиалуронан в качестве активного ингредиента
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и касается терапевтического или профилактического средства от воспаления и дисфункции нервной системы, средства, ингибирующего экспрессию генов, связанных с цитокинами, хемокинами, средства, повышающего жизнеспособность нервных клеток, средства, повышающего синаптическую передачу и защищающего синапсы, а также способа лечения и дисфункции нервной системы. Активным компонентом средства является тетрасахарид гиалуронана НА4, содержащий 2 звена, при этом единичным звеном является D-глюкуроновая кислота-β-1,3-D-N-ацетилглюкозамин-β-1,4. Заявленное изобретение позволяет эффективно лечить и препятствовать развитию воспалительных заболеваний нервной системы. 7 н. и 16 з.п. ф-лы, 6 табл., 18 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение касается фармацевтического средства, содержащего гиалуронан в качестве активного ингредиента. Более конкретно, изобретение касается средства для лечения аутоиммунных заболеваний, средства для лечения воспалительных заболеваний, средства для лечения неврологических заболеваний, средства для профилактики аутоиммунных заболеваний, средства для профилактики воспалительных заболеваний и средства для профилактики неврологических заболеваний, средства, повышающего жизнеспособность клеток, ингибитора экспрессии связанных с цитокинами генов и связанных с хемокинами генов, средства, усиливающего синаптическую передачу и защищающего синапсы, содержащего гиалуронан в качестве активного ингредиента. Изобретение также касается фармацевтического средства для лечения спинномозговых травм, астмы и аллергии.
Уровень техники
Гиалуронан - это длинноцепочечный полисахарид, состоящий из повторяющихся звеньев дисахарида, состоящего из D-глюкуроновой кислоты и N-ацетил-D-глюкозамина, причем известна и его олигосахаридная форма. Гиалуронан экстрагируют из такой биологической ткани, как петушиный гребешок, пуповина, кожа или суставная жидкость, либо его получают методом ферментации с помощью стрептококковых бактерий. Поскольку у гиалуронана отсутствуют токсикологические и иммунологические эффекты, он применяется как фармацевтический или косметический компонент, к примеру, в хорошо известном способе лечения артрита с помощью внутрисуставного введения гиалуронана. В дальнейшем описании тетрасахарид гиалуронана обозначается как НА4.
Сообщалось, что НА4 оказывает терапевтическое и ингибирующее действие при хранении органов, заболеваниях печени и язве желудка (см. WO 2002/004471). Известно также, что НА4 обладает эффектом повышения экспрессии стрессового белка и эффектом ингибирования клеточной смерти (см. Xu H, Ito Т, Tawada A, Maeda H, Yamanokuchi Н, Isahara К, Yoshida К, Uchiyama Y, Asari A. Effect of hyaluronan oligosaccharides on the expression of heat shock protein 72. J. Biol. Chem. 2002, 10; 277(19): 17308-14). Кроме того, сообщалось, что олигосахарид гиалуронана обладает целым рядом физиологических активностей (см. Asari A, Novel Functions of Hyaluronan Oligosaccharides. In Science of Hyaluronan Today, Editors: Vincent C. Hascall. Masaki Yanagishita Glycoforum (http://www.glycofbrum.gr.jp/science/hyaluroRan/HA.12/HA12J.html), 2005). Кроме того, известно, что НА4 терапевтически эффективен на модели спинномозговой травмы (см. WO 2004/ 084912).
Множественный склероз зачастую возникает в период от подросткового возраста до сорока лет и сопровождается такими симптомами, как нетвердая походка, слабое зрение, двоение в глазах, затруднения при мочеиспускании, боли и онемение. При возникновении его в детском или юношеском возрасте он иногда сопровождается эпилепсией. Возникает один или несколько патологических очагов, ответственных за эти симптомы, диффузно в мозжечке или спинном мозге. Более того, патологические очаги являются диффузными не только в смысле пространственной диффузности, но и в смысле временной диффузности с внезапным появлением и исчезновением. Патологическое состояние множественного склероза затрагивает иммунную систему, поэтому его относят к аутоиммунным заболеваниям или воспалениям. К тому же, поскольку повреждается спинномозговой нерв, то его относят и к неврологическим заболеваниям.
Жизнеспособность клеток означает активное состояние клетки. Поскольку некоторым заболеваниям присуще снижение жизнеспособности клеток или клеточная денатурация, то улучшение жизнеспособности клеток должно обеспечить терапевтический эффект при таком заболевании. Жизнеспособность клеток можно определить по такому показателю, как способность к окрашиванию красителем Rhodamine 123. Так как митохондрии играют ключевую роль в энергетическом метаболизме, то интенсивность флуоресценции Rhodamine 123 повышается в зависимости от потенциала на мембранах митохондрий. Соответственно, степень окрашивания красителем Rhodamine 123 служит показателем активности митохондрии, а тем самым и показателем степени активности клетки (см. Kim M, Cooper DD, Hayes SF, Spangrude GJ, Rhodamine-123 staining in hematopoietic stem cells of young mice indicates mitochondrial action on rather than dye efflux. Blood, 1998 Jun 191(11): 4106-17).
Цитокин - это обобщенное название, охватывающее белковые факторы (главным образом, гликопротеиды), которые выделяются из клетки, а затем опосредуют такие межклеточные взаимодействия, как эффекты, контролирующие иммунные или воспалительные реакции, антивирусные эффекты, противораковые эффекты и эффекты, регулирующие клеточный рост/дифференцировку. К цитокинам как таковым относятся интерлейкины, интерфероны, факторы некроза опухолей (TNF) и другие. С другой стороны, хемокины определяются как группа хемотактических цитокинов, способных вызывать хемотаксис лейкоцитов. В настоящем изобретении хемокины определяются как понятие, исключенное из цитокинов.
Связанный с цитокинами ген в общем смысле означает ген, который кодирует цитокин, и ген, который регулирует экспрессию данного гена. Известно много связанных с цитокинами генов, и предполагается взаимосвязь между усилением экспрессии связанного с цитокинами гена и заболеванием. Эффективное ингибирование экспрессии связанных с цитокинами генов сильно способствует лечению многих заболеваний.
Раскрытие изобретения
Целью настоящего изобретения является обеспечение средства для лечения аутоиммунных заболеваний, воспалительных заболеваний и неврологических заболеваний. Другой целью изобретения является обеспечение средства для профилактики аутоиммунных заболеваний, воспалительных заболеваний и неврологических заболеваний.
Следующей целью изобретения является обеспечение нового средства, повышающего жизнеспособность клеток.
Соответственно, целью изобретения является обеспечение нового средства, ингибирующего экспрессию связанных с цитокинами генов и связанных с хемокинами генов.
Соответственно, целью изобретения является обеспечение нового средства, усиливающего синаптическую передачу и защищающего синапсы.
Средство для лечения аутоиммунных заболеваний, воспалительных заболеваний и неврологических заболеваний по изобретению, которое достигает вышеописанные цели, содержит гиалуронан в качестве активного ингредиента. Аналогичным образом средство для профилактики аутоиммунных заболеваний, воспалительных заболеваний и неврологических заболеваний по изобретению, которое достигает вышеописанные цели, содержит гиалуронан в качестве активного ингредиента.
Средство, повышающее жизнеспособность клеток по изобретению, которое соответствует вышеописанным целям, содержит гиалуронан в качестве активного ингредиента.
Средство, ингибирующее экспрессию связанных с цитокинами генов и связанных с хемокинами генов по изобретению, которое достигает вышеописанные цели, содержит гиалуронан в качестве активного ингредиента. Таким образом, изобретение совершено на основе того открытия, что гиалуронан обладает новой функцией ингибирования экспрессии связанных с цитокинами генов и связанных с хемокинами генов.
Итак, средство, ингибирующее экспрессию связанных с цитокинами генов и связанных с хемокинами генов по изобретению, содержит гиалуронан в качестве активного ингредиента. Используемый в нем гиалуронан предпочтительно является тетрасахаридом, содержащим 2 звена, при этом единичным звеном является D-глюкуроновая кислота-β-1,3-D-N-ацетилглюкозамин-β-1,4. Особенно важно то, что он может ингибировать экспрессию связанных с провоспалительными цитокинами генов как представляющих вышеописанные гены, связанные с цитокинами.
Средство, усиливающее синаптическую передачу и защищающее синапсы, которое достигает вышеописанные цели, содержит тетрасахарид гиалуронана в качестве активного ингредиента.
Поскольку каждое из этих средств - фармацевтическое средство, повышающее жизнеспособность клеток, ингибирующее экспрессию связанных с цитокинами генов и связанных с хемокинами генов, усиливающее синаптическую передачу и защищающее синапсы по изобретению, содержит гиалуронан в качестве активного ингредиента, они преимущественно могут быть легко получены в большом количестве при сравнительно низких затратах. К тому же, поскольку гиалуронан почти не обладает токсичностью или антигенностью и повышает естественную способность к излечению или профилактике заболеваний, которая присуща тому организму, который он должен защищать, то можно ожидать, что он окажется терапевтическим, профилактическим и ингибиторным средством, обладающим чрезвычайно слабым побочным действием. Таким образом, в соответствии с изобретением можно получить новое фармацевтическое средство, которое эффективно против аутоиммунных заболеваний, воспалительных и неврологических заболеваний. Кроме того, можно получить новое фармацевтическое средство, которое эффективно при лечении заболеваний, объясняемых снижением клеточной активности, а также новое фармацевтическое средство, которое эффективно при лечении заболеваний, объясняемых усилением экспрессии связанных с цитокинами генов и связанных с хемокинами генов.
Краткое описание чертежей
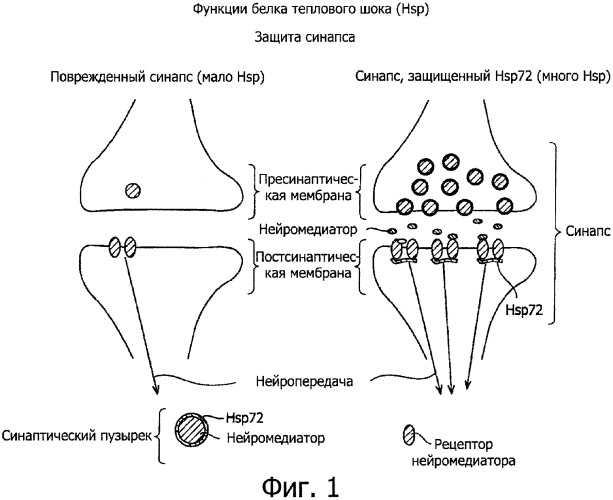
На фиг.1 представлена схема функционирования Hsp72 в синапсе, при этом слева представлен поврежденный синапс, а справа - синапс, защищенный Hsp72.
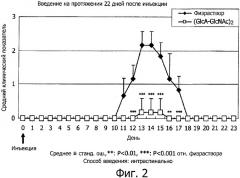
На фиг.2 представлен график, полученный нанесением среднего числа баллов неврологических симптомов ЕАЕ, наблюдавшихся на модели множественного склероза у животных, получавших курс НА4 сразу после инокуляции, по оси ординат, и количество дней после инокуляции в день 0 по оси абсцисс.
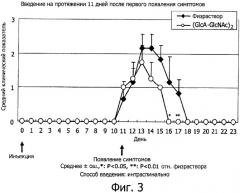
На фиг.3 представлен график, полученный нанесением среднего числа баллов неврологических симптомов ЕАЕ, наблюдавшихся на модели множественного склероза у животных, получавших НА4 на протяжении 11 дней после начала заболевания, по оси ординат, и количество дней после инокуляции в день 0 по оси абсцисс.
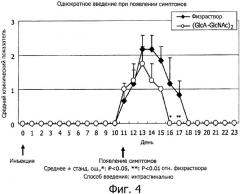
На фиг.4 представлен график, полученный нанесением среднего числа баллов неврологических симптомов ЕАЕ, наблюдавшихся на модели множественного склероза у животных, получавших НА4 однократно сразу после инокуляции, по оси ординат, и количество дней после инокуляции по оси абсцисс.
На фиг.5 представлены фотографии полученных в примере 2 клеток в каждой группе.
На фиг.6 представлены данные, показывающие результаты измерения интенсивности флуоресценции на полученных в примере 2 клетках в каждой группе.
На фиг.7 представлены результаты иммуноокрашивания на Hsp72 в первичном очаге повреждения, при этом (а) фотография среза в каждой группе после окрашивания и (b) данные, представляющие результаты измерения интенсивности света при иммуноокрашивании на Hsp72.
На фиг.8 представлены результаты иммуноокрашивания на Hsp72 во вторичных очагах повреждения, при этом (а) фотография среза в каждой группе после окрашивания и (b) данные, представляющие результаты измерения интенсивности света при иммуноокрашивании на Hsp72.
На фиг.9 представлены результаты иммуноокрашивания на синаптофизин в первичном очаге повреждения, при этом (а) фотография среза в каждой группе после окрашивания и (b) данные, представляющие результаты измерения интенсивности света при иммуноокрашивании на Hsp72.
На фиг.10 представлены результаты иммуноокрашивания на синаптофизин во вторичных очагах повреждения, при этом (а) фотография среза в каждой группе после окрашивания и (b) данные, представляющие результаты измерения интенсивности света при иммуноокрашивании на Hsp72.
На фиг.11 представлены фотография серого и белого вещества после двойного окрашивания на Hsp72 и синаптофизин и фотография серого вещества после двойного окрашивания на Hsp72 и синаптофизин, при этом на фотографии справа Hsp72 окрашен в красный цвет, на фотографии слева синаптофизин окрашен в зеленый цвет, а в центре левая фотография наложена на правую.
На фиг.12 представлены данные, показывающие результаты измерения продукции IL-1α и IL-1β с помощью матрицы на цитокины.
На фиг.13 представлены данные, показывающие результаты измерения продукции IL-6 и TGF-1β с помощью матрицы на цитокины.
На фиг.14 представлены данные, показывающие результаты измерения продукции TNF-α и TNF-β с помощью матрицы на цитокины.
На фиг.15 представлены данные, показывающие результаты измерения продукции IL-6 и TGF-1β методом ELISA.
На фиг.16 представлена схема предполагаемого механизма действия НА4 при лечении множественного склероза.
На фиг.17 представлена схема предполагаемого механизма действия НА4 при лечении спинномозговой травмы.
На фиг.18 представлена схема предполагаемого механизма действия НА4 против астмы и аллергических заболеваний.
Осуществление изобретения
Изобретение более подробно раскрывается ниже. Средство, повышающее жизнеспособность клеток по изобретению, представляет собой фармацевтическое средство, функцией которого является повышение жизнеспособности клеток. Термин "повышающее жизнеспособность клеток" означает, что облегчается физиологическая жизнеспособность клетки или что ингибируется снижение физиологической жизнеспособности клетки. Улучшение жизнеспособности клеток приводит к лечению или облегчению того заболевания, которое снижает клеточную активность, или того заболевания, которое вызывает денатурацию клетки.
Средство, ингибирующее экспрессию связанных с цитокинами генов и связанных с хемокинами генов по изобретению, представляет собой средство, функцией которого является ингибирование экспрессии целого ряда связанных с цитокинами генов и связанных с хемокинами генов. Выражение "ингибирование экспрессии связанных с цитокинами генов и связанных с хемокинами генов" означает, что при сравнении уровня экспрессии соответствующих генов в клетках у животного, не получавшего лечения, с уровнем экспрессии соответствующих генов в клетках у животного, подвергавшегося лечению средством по изобретению, последний будет значительно ниже. Уровень экспрессии можно измерить с помощью ДНК-чипа, полученного при иммобилизации большого числа ДНК-зондов на подложке.
Средство, усиливающее синаптическую передачу, по изобретению проявляет эффект усиления синаптических функций. Средство, защищающее синапсы, по изобретению проявляет эффект восстановления синаптических функций. Средство, усиливающее синаптическую передачу и защищающее синапсы по изобретению, может повышать степень передачи нейромедиатора между пре- и постсинапсом. В пресинапсе находятся синаптические везикулы, содержащие белок теплового шока 72 (Hsp72) и нейромедиатор. В постсинапсе находятся рецепторы Hsp72 и нейромедиатора. Средство, усиливающее синаптическую передачу и защищающее синапсы по изобретению, действует таким образом, что состояние, представленное слева на фиг.1, переходит в состояние, представленное справа, то есть таким образом, что повышается уровень нейромедиатора.
Изобретение подробно раскрывается ниже. При последующем описании терапевтические и профилактические средства, повышающие жизнеспособность клеток, ингибирующие экспрессию связанных с цитокинами генов и связанных с хемокинами генов, усиливающие синаптическую передачу и защищающие синапсы по изобретению, собирательно называются фармацевтическими средствами.
Гиалуронан, содержащийся в фармацевтическом средстве по изобретению, может представлять собой любой дисахарид или более высокомолекулярный сахарид, включающий, по меньшей мере, одно звено дисахарида, у которого β-D-глюкуроновая кислота в положении 1 образует связь с β-D-N-гацетиллюкозамином в положении 3 и который построен в основном из β-D-глюкуроновой кислоты и β-D-N-гацетиллюкозамина, даже если такие элементы связаны с одним или несколькими такими дисахаридными звеньями, соединенными вместе, а также могут применяться и производные типа тех, что содержат защищающие от гидролиза группы типа ацильной группы. Такой сахарид может быть ненасыщенным, и таким ненасыщенным сахаридом, к примеру, может быть невосстановленный концевой сахарид, как правило, глюкуроновая кислота с ненасыщенной связью между атомами углерода в положении 3 и 4. Используемый в изобретении гиалуронан, как правило, может быть экстрагирован из природного материала, к примеру, животного, получен путем микробиологической ферментации, синтезирован химическим или энзиматическим способом. Например, гиалуронан может быть получен из такой биологической ткани, как гребешок, пуповина, кожа или суставная жидкость, методом экстракции и методом очистки, известным в этой области. Кроме того, он может быть получен методом ферментации с помощью стрептококковых бактерий.
В данном изобретении гиалуронан охватывает и олигосахариды гиалуронана, причем можно использовать от низкомолекулярного гиалуронана типа дисахарида, состоящего из одинарного звена дисахарида, описанного выше, и его производных, до высокомолекулярного гиалуронана, у которого средневзвешенный молекулярный вес достигает 4000000. Предпочтительным можно считать такой гиалуронан, у которого средневзвешенный молекулярный вес составляет от 380 до 900000, что обеспечивает отличную проницаемость в ткани, причем более предпочтительным является гиалуронан, состоящий из 2-20 сахаридов.
Предпочтительно низкомолекулярный гиалуронан получают специфически путем уменьшения молекулярного веса гиалуронана одним из известных методов, таких как энзиматическое расщепление, щелочное расщепление, тепловая обработка и обработка ультразвуком (Biochem. 33 (1994) р.6503-6507), либо посредством химического или энзиматического синтеза (Glycoconjugate J. (1993) р.435-439, WO 93/20827). Например, энзиматическое расщепление может осуществляться методом, в котором способный к расщеплению гиалуронана фермент типа ферментов, разлагающих гиалуронан (гиалуронидаза из семенников, гиалуронидаза из Streptomyces, гиалуронидаза SD и др., хондроитиназа АС, хондроитиназа ACII, хондроитиназа ACIII и хондроитиназа АВС), действует на гиалуронан с образованием олигосахарида гиалуронана (см. Shin-Seikagaku Jikkenkoza "Saccharides II - Proteoglycans and Glycosaminoglycans", p.244-248, published in 1991, Tokyo Kagaku Dozin Co., Ltd).
Метод щелочного расщепления, к примеру, может представлять собой процесс, в котором основание, например, 1 н. NaOH, добавляют в водный раствор гиалуронана, который нагревают несколько часов для снижения молекулярного веса, а затем для нейтрализации добавляют кислоту типа соляной кислоты, при этом получая низкомолекулярный гиалуронан. Используемый в изобретении гиалуронан охватывает и его солевую форму, причем фармацевтически приемлемая соль может использоваться при желании для составления композиции препарата. Например, это может быть соль такого щелочного металла, как натрий и калий, соль такого щелочноземельного металла, как кальций и магний, соль такого амина, как три(н-бутил)амин, триэтиламин, пиридин и соли аминокислот.
Фармацевтическим средством настоящего изобретения может быть любой гиалуронан определенного молекулярного веса сам по себе или комбинация препаратов гиалуронана различного молекулярного веса, без ограничений. Фармацевтическое средство содержит гиалуронан в качестве активного ингредиента и может улучшать состояние, по меньшей мере, при одном заболевании, выбранном из группы, состоящей из аутоиммунных заболеваний, воспалительных и неврологических заболеваний, не оказывая неблагоприятного воздействия на живой организм при введении в эффективном количестве млекопитающему, в том числе человеку. Аутоиммунное заболевание, воспаление и неврологическое заболевание может, к примеру, представлять собой множественный склероз. Однако аутоиммунные заболевания и воспаления не ограничиваются множественным склерозом, их примерами являются и ревматизм, системная красная волчанка, воспалительный колит, увеит, нефрит, нефропатия, диабет I типа, атопический дерматит, синдром Шегрена, дефект рецепторов инсулина, васкулит, злокачественная миастения, полимиозит, астма и болезнь Хасимото. Неврологические заболевания не ограничиваются множественным склерозом, например, это может быть неврит, невралгия, нейропаралич, инсульт, церебральный паралич, депрессия, старческое слабоумие, болезнь Паркинсона, болезнь Альцгеймера, болезнь Реклингхаузена, закупорка артерий круга Виллизия, болезнь Краббе, острый диффузный энцефаломиелит, миелорадикулопатия, острый рассеянный энцефаломиелит, нейрооптикомиелит, лейкодистрофия надпочечников, метахроматическая лейкодистрофия, боковой амиотрофический склероз, периферическая невропатия (травма периферического нерва, синдром Гийена-Барре, туннельная невралгия, паралич плечевого сплетения, диабетическая невропатия и др.). Таким образом, фармацевтическое средство, содержащее гиалуронан в качестве активного ингредиента, обладает терапевтическим действием и профилактическим действием против различных аутоиммунных заболеваний, воспалительных заболеваний и неврологических заболеваний, описанных выше.
Также фармацевтическое средство содержит гиалуронан в качестве активного ингредиента и может ингибировать снижение жизнеспособности клеток и/или может активировать клетки, не оказывая неблагоприятного воздействия на живой организм при введении в эффективном количестве млекопитающему, в том числе человеку.
Фармацевтическое средство содержит гиалуронан в качестве активного ингредиента и может ингибировать экспрессию определенных связанных с цитокинами и хемокинами генов, не оказывая неблагоприятного воздействия на живой организм при введении в эффективном количестве млекопитающему, в том числе человеку.
Фармацевтическое средство содержит гиалуронан в качестве активного ингредиента и может усиливать синаптическую передачу и защищать синапсы, не оказывая неблагоприятного воздействия на живой организм при введении в эффективном количестве млекопитающему, в том числе человеку.
Фармацевтическое средство может быть заключено в нужную лекарственную форму само по себе или в комбинации с носителем, наполнителем и другими вспомогательными веществами по желанию, чтобы получить фармацевтический препарат для перорального или парентерального введения (введения в ткань (инъекции), например, внутрисуставно, внутривенно, внутримышечно, подкожно или через зонд и через кожу), интерназального введения, введения через накожный пластырь, и может вводиться пациенту любым способом. В особенности при его применении в качестве средства, повышающего жизнеспособность клеток, предпочтительна лекарственная форма для перорального введения. А при его применении специально в качестве средства, ингибирующего экспрессию определенных связанных с цитокинами генов и связанных с хемокинами генов, желательны лекарственные формы для инъекций и для перорального введения. При его применении специально в качестве средства, усиливающего синаптическую передачу и защищающего синапсы, предпочтительна лекарственная форма для интрадурального введения.
Лекарственная форма для перорального введения, к примеру, может представлять собой твердую форму типа порошка, гранул, капсул и таблеток; жидкую форму типа сиропа, эликсира и эмульсий. Форма типа порошка может быть получена в виде смеси с таким наполнителем, как лактоза, крахмал, кристаллическая целлюлоза, лактат кальция, кислый фосфат кальция, алюмосиликат магния и кремниевый ангидрид. Форма типа гранул может быть получена в процессе мокрой или сухой грануляции с добавлением, помимо вышеперечисленных наполнителей, такого связующего вещества, как сахар, гидроксипропилцеллюлоза, поливинилпирролидон и им подобные, такого связующего, как карбоксиметилцеллюлоза и кальциевая карбоксиметилцеллюлоза, и такого дезинтегрирующего вещества, как карбоксиметилцеллюлоза и кальциевая карбоксиметилцеллюлоза, по желанию. Форма типа таблеток может быть получена таблетированием порошка или гранул, описанных выше, самих по себе или вместе с таким смазочным веществом, как стеарат магния и тальк. Порошок или гранулы, описанные выше, могут быть покрыты основой для кишечно-растворимого покрытия типа гидроксипропилметилцеллюлозы, сополимера фталата и метилметакрилата и им подобных, либо могут быть покрыты этилцеллюлозой, карнаубским воском и гидрогенизированным маслом, образуя при этом кишечно-растворимую форму или форму для замедленного высвобождения. Форма типа твердых капсул может быть получена расфасовкой порошка или гранул, описанных выше, в твердые капсулы. Форма типа мягких капсул может быть получена смешиванием гиалуронана или его соли с глицерином, полиэтиленгликолем, кунжутным маслом, оливковым маслом и др., а затем нанесением желатиновой оболочки. Форма типа сиропа может быть получена растворением подслащивающего вещества типа сахара, сорбита и глицерина вместе с гиалуронаном или его солью в воде. В дополнение к подсластителю и воде можно добавить эфирное масло или этанол для получения эликсира либо добавить гуммиарабик, трагакант, полисорбат 80 или натриевую карбоксиметилцеллюлозу для получения эмульсии или суспензии. В такую жидкую форму можно добавить и ароматизатор, краситель, консервант и др., если нужно.
Лекарственная форма для парентерального применения, к примеру, может представлять собой форму для инъекций, форму для ректального введения, маточное кольцо, форму для нанесения на кожу, средство для ингаляции, аэрозоль, форму для капельного введения и др. Форма для инъекций может быть получена добавлением к гиалуронану или его соли вещества, модифицирующего значение рН, такого как соляная кислота, гидроокись натрия, молочная кислота, лактат натрия, двузамещенный фосфат натрия и однозамещенный фосфат натрия; осмотического агента, такого как хлорид натрия и глюкоза; дистиллированной воды для инъекций, с последующей стерилизацией фильтрованием, а затем заполнением в ампулы. Кроме того, туда можно добавить и маннит, декстрин, циклодекстрин, желатин и т.п., а затем лиофилизировать под вакуумом, получая форму для инъекций, требующую растворения перед употреблением. Также можно получить форму типа эмульсии для инъекций добавлением к гиалуронану или его соли такого эмульгатора, как лецитин, полисорбат 80, полиоксиэтилен и гидрогенизированное касторовое масло, с последующим эмульгированием в воде.
Лекарственная форма для ректального введения может быть получена добавлением к гиалуронану или его соли такой основы для свечей, как моно-, ди- или триглицерид жирных кислот масла какао и полиэтиленгликоль, с последующим нагреванием до расплавления, а затем заливкой в формочку и охлаждением, либо смешиванием гиалуронана или его соли с полиэтиленгликолем, соевым маслом и т.п., с последующим нанесением желатиновой оболочки. Форма для нанесения на кожу может быть получена добавлением к гиалуронану или его соли белого вазелина, пчелиного воска, вазелинового масла, полиэтиленгликоля и т.п., при необходимости с нагреванием, а затем перемешиванием до однородного состояния. Форма типа пластыря может быть получена перемешиванием гиалуронана или его соли вместе с адгезивным средством типа канифоли и полимера алкилакрилата, с последующим нанесением на нетканое полотно и т.д. Средство для ингаляции может быть получено растворением или диспергированием гиалуронана или его соли в таком вытеснителе, как фармацевтически приемлемый инертный газ, с последующим заполнением в устойчивую к давлению емкость.
Способ введения
Хотя способ введения фармацевтического средства настоящего изобретения, содержащего гиалуронан в качестве активного ингредиента, ничем особенно не ограничивается, он может представлять собой интраспинальное, внутривенное, внутрисуставное, интрадуральное, пероральное или интерназальное введение.
Дозировка
Хотя дозировка может быть надлежащим образом подобрана в зависимости от подлежащего лечению заболевания, возраста, общего состояния и веса тела пациента и др., обычно она составляет от 0,05 до 50 мг/кг и вводится раз в день или в разделенных дозах.
Токсичность
Используемый в изобретении гиалуронан почти или совсем не проявлял цитотоксичности в дозе, в которой проявляется биологическая активность фармпрепарата.
ПРИМЕРЫ
Фармацевтическое средство по изобретению дополнительно раскрывается на нижеследующих примерах, которые не предназначены для ограничения технологических рамок изобретения.
Пример 1
В этом примере НА4 применяли при экспериментальном аутоиммунном энцефаломиелите (ЕАЕ), который является моделью множественного склероза, чтобы исследовать его эффективность.
Для модели множественного склероза приобретали 4-недельных крыс Lewis и использовали, когда они достигали 5-недельного возраста. В соответствии с методом Shibaki et al. (Shibaki К, Nomura К, Ono R, Shimazu K. Inhibition of experimental autoimmune encephalomyelitis by ninjineiyoto. Shinkeichiryo 19(2): 159-166, 2002) на одно животное растворяли 300 мкг основного белка миелина морской свинки (GPMBP, Sigma) в 50 мкл PBS, добавляли туда эквивалентное количество полного адъюванта Фрейнда (FCA, Difco) и простерилизованные Mycobacterium tuberculosis (MT, Difco) в концентрации 0,75 мг/мл, а затем по 50 мкл инокулировали в лапки обеих задних конечностей животного.
В этом примере животным из модели множественного склероза давали НА4 сразу после инокуляции или при появлении неврологических симптомов.
Введение тестируемых веществ
В этом примере НА4 готовили в концентрации 1 мг/мл и 10 мг/мл. В частности, НА4 получали методом Tawada et al. (Tawada A, Masa Т, Oonuki Y, Watanabe A, Matsuzaki Y, Asari A. Large-scale preparation, purification, and characterization of hyaluronan oligosaccharides from 4-mers to 52-mers. Glycobiology, 2002, 12(7): 421-6). В качестве контроля использовали физиологический раствор.
В два момента времени, то есть сразу после инокуляции и при возникновении заболевания, подтвержденного наблюдением неврологических симптомов, животным из модели множественного склероза вводили катетер в мозговую полость и осуществляли интрадуральное введение в течение заданного времени. Для непрерывного введения использовали осмотический насос (модель 2004, Alzet). Животных разбивали на опытные группы, приведенные в табл.1.
| Таблица 1 | ||||||
| Группа | Тестируемое вещество | Доза (мкг/день) | Концентрация в дозе (мкг/мл) | Начало введения | Продолжительность обработки | Количество животных |
| 1 | физраствор | - | - | сразу после введения антигена | 22 дня | 6 |
| 2 | НА4 | 6 | 1 | сразу после введения антигена | 22 дня | 6 |
| 3 | НА4 | 6 | 1 | при появлении симптомов* | 11 дней | 4 |
| 4 | НА4 | 60 | 10 | при появлении симптомов* | однократно | 4 |
| * Момент времени соответствует наблюдению ЕАЕ 1-й степени (снижение тонуса хвоста). |
Оценка неврологических симптомов ЕАЕ
Неврологические симптомы в баллах оценивали два работника каждый день после инокуляции антигена по нижеследующей 5-балльной шкале.
Шкала ЕАЕ:
0: нет симптомов,
1: снижение тонуса хвоста,
2: слабость задних конечностей,
3: паралич задних конечностей, иногда сопровождающийся недержанием мочи и кала,
4: паралич задних и передних конечностей.
Результаты
1) Эффект (профилактический) непрерывного интраспинального введения НА4 сразу после инокуляции (провоцирующей пробы) и впоследствии
После инокуляции антигена при непрерывном интраспинальном введении НА4 неврологические симптомы явно ослабевали по сравнению с физраствором (фиг.2). На фиг.2 представлен график, полученный нанесением среднего числа баллов описанных выше неврологических симптомов ЕАЕ по оси ординат и количества дней после инокуляции. При сравнении неврологических симптомов в разгар ЕАЕ клинический показатель в группе физраствора на 13-й день после инокуляции антигена составил 2,2±0,41 балла, тогда как в группе непрерывного введения НА4 на 13-й день он составил 0,2±0,41 балла, что значительно ниже (р<0,001), причем заболевание возникало только в 1/6 случаев в группе непрерывного введения НА4. Приведенные на фиг.2 результаты свидетельствуют, что фармацевтическое средство, содержащее гиалуронан в качестве активного ингредиента, эффективно для профилактики множественного склероза.
2) Эффект (терапевтический) непрерывного интраспинального введения НА4 сразу после возникновения заболевания
После возникновения заболевания непрерывное интраспинальное введение НА4 вызывало явное ослабление неврологических симптомов по сравнению с группой физраствора (фиг.3). На фиг.3 представлен график, полученный нанесением среднего числа баллов описанных выше неврологических симптомов ЕАЕ по оси ординат и количества дней после инокуляции. При сравнении неврологических симптомов в разгар ЕАЕ клинический показатель в группе, получавшей физраствор, на 13-й день после инокуляции антигена составил 2,2±0,41 балла, тогда как в группе непрерывного введения НА4 на 13-й день он составил 1,5±1,0 балла, что значительно ниже. При сравнении продолжительности заболевания: 6,5±0,55 дней в группе, получавшей физраствор, и 4,3±1,5 дня в группе непрерывного введения (glucNac-GlcA)2, проявилось значительное уменьшение в последней группе (р<0,01). Приведенные на фиг.3 результаты свидетельствуют, что фармацевтическое средство, содержащее гиалуронан в качестве активного ингредиента, эффективно для профилактики множественного склероза.
3) Эффект (терапевтический) однократного интраспинального введения НА4 сразу после возникновения заболевания
После возникновения заболевания однократное интраспинальное введение НА4 вызывало явное ослабление неврологических симптомов по сравнению с группой, получавшей физраствор (фиг.4). На фиг.4 представлен график, полученный нанесением среднего числа баллов описанных выше неврологических симптомов ЕАЕ по оси ординат и количества дней после инокуляции. При сравнении неврологических симптомов в разгар ЕАЕ клинический показатель в группе, получавшей физраствор, на 13-й день после инокуляции антигена составил 2,2±0,41 балла, тогда как в группе непрерывного введения НА4 на 13-й день он составил 1,8±0,5 балла, что значительно ниже. При сравнении продолжительности заболевания: 6,5±0,55 дней в группе, получавшей физраствор, и 5,0±1,5 дня в группе непрерывного введения НА4, проявилось значительное уменьшение в последней группе (р<0,001). Приведенные на фиг.4 результаты свидетельствуют, что фармацевтическое средство, содержащее гиалуронан в качестве активного ингредиента, эффективно для профилактики множественного склероза.
Пример 2
В этом примере измеряли эффект фармацевтического средства по изобретению на жизнеспособность клеток с помощью Rhodamine 123. Интенсивность флуоресценции Rhodamine 123 повышается в зависимости от мембранного потенциала митохондрий, которые играют главную роль в энергетическом метаболизме. Соответственно, степень окрашивания Rhodamine 123 служит показателем активности митохондрий, а тем самым и показателем клеточной активности (см. непатентную ссылку 2).
Активируемые клетки
В этом примере использовали клетки К562 (известные как клетки эритролейкемии человека или клетки эритробластоидной лейкемии человека). Клетки К562 приобретали у фирмы Riken, Япония.
В этом примере, касающемся получения тестируемого вещества, НА4 готовили в концентрации 100 нг/мл. В частности, НА4 получали методом Tawada et al. (Tawada A, Masa T, Oonuki Y, Watanabe A, Matsuzaki Y, Asari A. Large-scale preparation, purification and characterization of hyaluronan oligosaccharides from 4-mers to 52-mers. Glycobiology, 2002, 12(7): 421-6), и доводили концентрацию с помощью физиологического раствора.
Экспериментальный метод
Сначала клетки К562 инкубировали в условиях, описанных ниже. Для культивирования клеток К562 использовали среду RPMI-1640. В этом примере клетки инкубировали в группах 1-3, представленных ниже. Каждую группу культивировали в условиях, описанных ниже. В культуральную среду для группы 3 добавляли НА4 (100 нг/мл).
Группа 1: 80 мин при 37°С.
Группа 2: 20 мин при 43°С (тепловая обработка), а затем 60 мин при 37°С.
Группа 3: 20 мин при 43°С (тепловая обработка), а затем 60 мин при 37°С.
После инкубации в каждой группе добавляли Rhodamine 123, растворенный в среде MI. Конечная концентрация Rhodamine 123 составляла 1 мкг/мл. После добавления Rhodamine 123 и инкубации при 37°С в течение 10 мин клетки К562 промывали средой RPMI.
Клетки К562 после промывки инокулировали при 1×104 клеток/мл на 96-луночный планшет и фотографировали с помощью флуоресцентного микроскопа (Nikon). Снимок пересыла