Агонисты рецептора пептида-1, подобного глюкагону, их получение и применение
Иллюстрации
Показать всеНастоящее изобретение относится к агонисту рецептора подобного глюкагону пептида-1, которые могут найти применение для лечения заболеваний, связанных с нарушением гликометаболизма, таких как диабет типа II, нечувствительность к инсулину или ожирение.
В структурной формуле каждый из Ar1 и Ar2 независимо представляет собой замещенный фенил, и группы-заместители указанного замещенного фенила представляют собой одну, две или три группы, выбранные из C1-С6алкоксил, C1-С6-алканоиламино, который замещен гидроксилом (который содержит группы-заместители, включающие в себя гидроксил); С3-С6-циклоалканоиламино, С2-С6-алкеноиламино; бензоиламино, бензилокси-С1-С6-алканоиламино; теноилокси, трет-бутоксиформамидо, адамантанформамидо и манделоиламино; Х представляет собой О; Y представляет собой О. Изобретение также относится к способу получения агониста и к его применению для получения лекарственного средства для лечения заболеваний, связанных с нарушением гликометаболизма. 3 н. и 5 з.п. ф-лы, 2 табл., 2 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к группе агонистов рецептора пептида-1, подобного глюкагону (GLP-1R). В частности, настоящее изобретение относится к группе органических соединений с маленькой молекулой, имеющих замещенное пятичленное гетероциклическое кольцо, которые можно применять в качестве непетидных агонистов GLP-1R. Соединения настоящего изобретения можно применять в качестве лекарственных средств для лечения заболеваний, связанных с нарушением гликометаболизма, таких как диабет типа II, нечувствительность к инсулину, ожирение и т.д. Настоящее изобретение относится также к способу получения указанных агонистов GLP-1R.
УРОВЕНЬ ТЕХНИКИ
Сахарный диабет (DM) является обычным эндокринным метаболическим заболеванием с наследственной тенденцией. Он вызывается в основном абсолютной или относительной гиперсекрецией инсулина и вызывает нарушение метаболизма сахаридов, жиров, белков и затем витаминов, воды и электролитов. Проявления его включают в себя повышение гликемии и глюкозы в моче, а пациенты имеют симптомы полидипсии, полифагии, полиурии, ксеростомии и общей слабости. Распространенность заболевания сахарным диабетом составляет 1-5% и имеет тенденцию к постепенному увеличению. Сахарный диабет, рак и сердечно-сосудистые заболевания называют тремя распространенными по всему свету серьезными заболеваниями. Целью лечения сахарного диабета является исправление нарушения метаболизма углеводов, так чтобы ликвидировать эти симптомы, активировать восстановление функции панкреатических островков, повысить инсулинорезистентность, поддерживать лучшее состояние здоровья и физической силы и предупредить и лечить различные осложнения.
Сахарный диабет обычно делят на два типа: инсулинзависимый сахарный диабет (тип I, IDDM) и инсулиннезависимый сахарный диабет (тип II, NIDDM). Поскольку патогенезы для этих двух типов сахарного диабета являются различными, лекарственные средства для лечения их значительно различаются и являются соответственно следующими.
Сахарный диабет типа I вызывается вирусной инфекцией у наследственно восприимчивого человека, который индуцирует парадоксикальную реакцию островковых клеток посредством иммуномеханизма, так что панкреатические островки начинают повреждаться и даже полностью теряют свою функцию. Приблизительно 5% сахарного диабета является типом I. В настоящее время лекарственные средства для лечения сахарного диабета типа I в основном включают в себя экзогенный инсулин (в том числе человеческий инсулин и животный инсулин), лекарственные средства, обладающие инсулиноподобным действием, инсулиноподобный фактор-1 роста (IGF-1), новый, длительно действующий препарат инсулина, гипогликемические таблетки Jin Qi и т.д.
Сахарный диабет типа II очень редко вызывается прямым повреждением β-островковых клеток, которые снижают секрецию инсулина. И большинство случаев сахарного диабета типа II вызывается комбинацией факторов, которые могут включать в себя генетические признаки, образ жизни, содействие окружающей среды, метаболические нарушения, ожирение и так далее. При этом патологическом состоянии мышечные, печеночные и жировые ткани являются невосприимчивыми к инсулину, тем самым снижая поглощение глюкозы. Большинство больных диабетом страдают сахарным диабетом типа II. В настоящее время лекарственные средства для клинического лечения NIDDM в основном включают в себя сульфонилмочевины, бигуаниды, другие гипогликемические лекарственные средства и адъюванты и т.д.
Гипогликемические лекарственные средства типа сульфонилмочевин связываются с рецепторами на клеточной мембране β-островковых клеток с закрытием каналов калиевых ионов, тем самым блокируя вытекание ионов калия и индуцируя деполяризацию клеточных мембран, так что каналы кальциевых ионов открываются, позволяя внутриклеточным ионам кальция течь внутрь. Повышение концентрации внутриклеточных кальциевых ионов вызывает высвобождение инсулина. Гипогликемические лекарственные средства типа сульфонилмочевин можно разделить на два поколения в соответствии с временем их появления на практике. Первое поколение включает в себя толпропамид и второе поколение включает в себя глибенкламид (эвгликан), гликлазид (диамикрон), глипизид, гликвидон и т.д.
Бигуанидные гипогликемические лекарственные средства ингибируют аппетит, повышают связывание инсулина с рецепторами, активируют анаэробный гликолиз в клетках, ингибирует тканевое дыхание и ингибирует печеночный глюконеогенез. Бигуанидные гипогликемические лекарственные средства в основном включают в себя метформин, фенформин и буформин.
Другие гипогликемические лекарственные средства в основном включают в себя тиазолидиндионовые лекарственные средства (такие как троглитазон, розиглитазон, пиоглитазон и т.д.), β3-адренорецепторные регуляторы, агонисты рецептора глюкагона, агенты, препятствующие метаболизму жирных кислот, ингибиторы α-гликозидазы (такие как акарбоза, воглибоза, миглитол) и ингибиторы альдозаредуктазы и т.д.
В последнее время развитие исследования по связанному с гликометаболизмом эндогенного пептидного гормона обусловило появление новой идеи для лечения сахарного диабета. Когда организм человека потребляет питательные материалы, энтероэндокринные клетки высвобождают энтеропептидный гормон, который в основном включает в себя подобный глюкагону пептид-1 (GLP-1) и глюкозазависимый инсулинотропный пептид (GIP), и регулирует метаболизм посредством воздействия на генерацию инсулина, желудочно-кишечную перестальтику и пролиферацию островковых клеток. GLP-1 секретируется энтеропанкреатическими клетками и активирует аденилатциклазу для синтеза цАМФ посредством очень специфического связывания с рецептором GLP-1β-островковых клеток, так чтобы далее активировать протеинкиназу. Метаболический сигнал (гликометаболизм) и киназный сигнал (связывание GLP-1) действуют совместно на уровне клеточной мембраны, в конце концов вызывая открытие каналов Са2+ и движение потока кальциевых ионов внутрь, так чтобы дополнительно стимулировать секрецию инсулина при ингибировании генерации глюкагона, посредством чего снижается уровень возникающей после приема пищи глюкозы в крови и поддерживается концентрация глюкозы в крови на постоянном уровне. Кроме того, GLP-1 имеет функцию нейрорегуляции и может замедлять желудочное опорожнение и снижать аппетит. Все они являются очень полезными для устранения сахарного диабета. Обычно GLP-1 стимулирует секрецию инсулина в зависимости от концентрации глюкозы в крови. Когда концентрация глюкозы в крови снижается, действие GLP-1 по стимуляции секреции инсулина снижается. Следовательно, действие GLP-1 по снижению глюкозы в крови является самоограниченным и не может вызвать гипогликемию. Таким образом, лекарственные средства с GLP-1-подобным действием являются очень желательными для лечения сахарного диабета. Агонисты GLP-1 R являются одним исследовательским фокусом интернациональных организаций по разработке лекарственных средств. В настоящее время исследования по GLP-1R в основном сфокусированы на полипептидных регуляторах. Например, АС 2993 Amylin Corporation применяют для клинического испытания в США (IND). AC 2993 является полипептидом из 39 аминокислот и обладает действием по активации секреции инсулина, как GLP-1. Поскольку полипептидные лекарственные средства являются неподходящими для перорального введения и легко разрушаются, непептидный регулятор GLP-1R является новым исследовательским направлением в настоящее время.
РАСКРЫТИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является разработка группы органических соединений с небольшой молекулой, являющихся производными пятичленных гетероциклических соединений, которые можно применять в качестве агонистов рецептора подобного глюкагону пептида-1 (GLP-1R), так чтобы подтвердить путь поиска ведущих соединений или лекарственных средств для лекарственных препаратов для лечения сахарного диабета. Другой целью настоящего изобретения является предложение способа получения этих соединений.
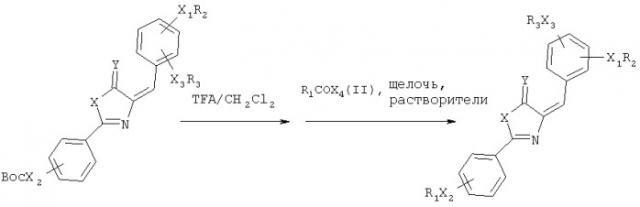
Агонисты рецептора подобного глюкагону пептида-1 согласно настоящему изобретению имеют следующую структурную формулу:
где каждый из Ar1 и Ar2 независимо представляет собой замещенный фенил, и замещенные группы представляют собой одну, две или три группы, выбранные из C1-C6алкоксил; C1-С6-алканоиламино, который замещен гидроксилом (который содержит группы-заместители, включающие в себя гидроксил); С3-С6циклоалканоиламино; С2-С6алканоиламино; бензоиламино; бензилоксиС1-С6алканоиламино; теноилокси; трет-бутоксиформамидо; адамантан формамидо и манделоиламино;
Х представляет собой О;
Y представляет собой О.
Когда Ar1 представляет собой ,
R5 представляет собой теноил и R6 представляет собой C1-C6алкил; X1 - это О; Х2 - это O,
Ar2 представляет собой ,
где R2 представляет собой любую из одной из последующих групп: С1-С6алканоил; замещенный C1-C6алканоил, который замещен гидроксилом (который содержит группы-заместители, включающие в себя гидроксил); С2-С6алкеноил; С3-С6-циклоалканоил; бензоил; бензилоксиС1-С6алканоил; трет-бутоксикарбонил; адамантан формоил; и манделоил; и Х2 - это NH.
Получение соединений настоящего изобретения проводят посредством следующих стадий согласно химическому уравнению:
где каждый из Ar1 и Ar2 независимо представляет собой замещенный фенил и группами-заместителями являются одна, две или три группы, выбранные из следующей группы: трет-бутоксиформамидо и теноилокси; Х представляет собой О и Y представляет собой О,
или согласно следующему химическому уравнению:
где R1, R2 и R3 представляют собой любые из следующих замещенных групп: C1-C6алкил; C1-С6алканоил; замещенный C1-С6алканоил, который замещен гидроксилом; С2-С6алкеноил; С3-С6циклоалканоил; бензоил; бензилоксиС1-С6алканоил; трет-бутоксикарбонил; теноил; адамантанформоил и манделоил; Х представляет собой О; Y представляет собой О; X1 и Х3 - это O; Х2 это NH и Х4 это Cl или ОН.
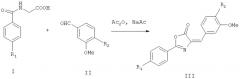
Соединение III получают конденсацией соединений I с соединениями II. Конденсацию проводят в следующих растворителях: дихлорметане, уксусном ангидриде, тетрагидрофуране, диметилфуране, дихлорэтане, толуоле, бензоле, воде, диоксане или смеси указанных выше растворителей. Если необходимо, в реакционную смесь можно добавить некоторые активаторы, такие как пиридин, N-метилморфолин, изобутилхлорформиат, триэтиламин, диэтилпропилэтиламин или DMAP и т.д. Согласно реакционным условиям соединений температура реакции обычно бывает от -78°С до комнатной температуры (например, для соединения Wang 462 и т.д.) или от 50 до 230°С нагреванием (например, для соединения Wang 520 и т.д.). Время реакции определяется в соответствии с определенными реагентами. Развитие реакции обычно определяют анализом ТСХ. После завершения реакции общие методы обработки включают в себя фильтрование с применением насоса, концентрирование реакционного раствора для удаления растворителя, экстракцию и выделение продукта колоночной хроматографией и т.д. Конечный продукт III подтверждают детектированием ЯМР.
Способ синтеза структурного звена замещенного пятичленного гетероциклического кольца настоящего изобретения относится к способам Organic Syntheses, CV 2, 55.
В настоящем изобретении разработаны и синтезированы новые агонисты рецептора подобного глюкагону пептида-1 (GLP-1R). Агонисты GLP-1R настоящего изобретения обладают хорошей способностью связываться с GLP-1R, активируют синтез цАМФ, их можно применять для получения лекарственных средств для лечения заболеваний, связанных с нарушением гликометаболизма, таких как диабет типа II, нечувствительность к инсулину, ожирение и т.д. Они позволяют преодолеть недостаток известного уровня техники, заключающийся в том, что полипептидные регуляторные лекарственные средства являются неподходящими для перорального введения и легко разлагаются. Соединения настоящего изобретения имеют относительно простую структуру и легко могут быть получены.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 показан результат обнаружения экспрессии репортерного гена для соединений настоящего изобретения, которое применяют для оценки активности указанных соединений по стимуляции для GLP-1R. На фиг.1 относительная активность люциферазы, индуцированная 30 нМ положительным стандартом GLP-1, принята за 100%.
На фиг.2 показано влияние соединения 2f на концентрацию цАМФ в 293/GLP-1R-клетках.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение будет далее объясняться со ссылкой на следующие конкретные примеры, но они никоим образом не ограничивают настоящее изобретение.
Способ получения соединений в нижеследующих примерах получения 1-3 в основном включает в себя три нижеследующие методики проведения реакций.
Методика 1
Соединения I и II, ацетат натрия и уксусный ангидрид смешивают, смесь нагревают до плавления (150-230°С) и выдерживают в расплавленном состоянии в течение 1 часа. Затем к реакционной смеси добавляют этанол и смесь охлаждают. Продукт разделяют кристаллизацией с последующим фильтрованием. Жидкий остаток концентрируют для полного удаления растворителей и продукт выделяют колоночной хроматографией.
Методика 2
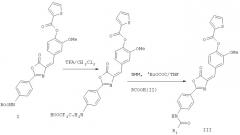
Соединение I растворяют в дихлорметане и раствор охлаждают на низкотемпературной бане при -20°С с последующим добавлением трифторуксусной кислоты и повышением температуры до комнатной температуры. Реакционную смесь анализируют ТСХ до тех пор, пока соединение I не прореагирует полностью. После концентрирования реакционной системы и удаления полностью трифторуксусной кислоты субстрат растворяют в дихлорметане и раствор охлаждают на низкотемпературной бане при -20°С. Затем по порядку добавляют пиридин и ацилхлорид, температуру повышают до комнатной температуры и реакционную смесь анализируют ТСХ. Реакционный раствор концентрируют и продукт выделяют колоночной хроматографией.
Методика 3
Соединение I растворяют в дихлорметане и раствор охлаждают на низкотемпературной бане при -20°С с последующим добавлением трифторуксусной кислоты и повышением температуры до комнатной температуры. Реакционную смесь анализируют ТСХ до тех пор, пока соединение I не прореагирует полностью с последующим концентрированием реакционной системы и удалением полностью трифторуксусной кислоты. Затем соединение II растворяют в тетрагидрофуране (ТГФ) и раствор охлаждают на низкотемпературной бане при -20°С. Затем по порядку добавляют N-метилморфолин (NMM) и CICOOiBu. Продукт реакции соединения I с трифторуксусной кислотой растворяют в тетрагидрофуране и затем переносят в указанную выше смесь шприцем для реакции смеси при комнатной температуре. Анализ реакционной смеси проводят ТСХ. После завершения реакции реакционный раствор концентрируют и продукт выделяют колоночной хроматографией.
Соединения wang 520, wang 337, wang 405, wang 450, wang 520-1 и wang 462-1 получают методикой реакции 1, соединения wang 420, wang 462, wang 524, wang 516, wang 488, wang 568, wang 502, wang 530, wang 504, wang 866, 2f, wang 582, wang 538 и wang 496 получают методикой реакции 2 с применением соединения wang 520 и соединения wang 516-1 и wang 591 получают методикой 3 с применением соединения wang 520.
В нижеследующих примерах получения ЯМР измеряют прибором Mercury-Vx 300M, изготовленным Varian cooperation. Показателями ЯМР являются δ Н/С 7,26/7,77 м.д. (CDCl3); δ Н/С 2,50/39,51 м.д. (ДМСО-d6) и δ Н/С 3,31/49,15 м.д. (метил-d3-овый спирт-d). Агенты предоставлены Changhai Chemistry Agents Cooperation. Продукты очищают в основном колоночной хроматографией. Для разделения применяют силикагель 200-300 меш, силикагель для колоночной хроматографии является плотной и полой моделью (ZLX-11), полученной branch factory of Qingdao Haiyang Chemical plant.
Пример 1
Соединение II (466 мг, 1,78 ммоль), соединение I (576 мг, 1,96 ммоль), ацетат натрия (146 мг, 1,78 ммоль) и 2 мл уксусного ангидрида смешивают при комнатной температуре с последующим нагреванием смеси до 170°С до тех пор, пока смесь не расплавиться, и смесь сохраняют в расплавленном состоянии в течение 1 часа. Затем в образовавшуюся смесь добавляют 2 мл этанола и охлаждают ее до комнатной температуры. Таким образом образованное желтое твердое вещество отделяют и фильтруют. Жидкий остаток концентрируют и растворитель полностью удаляют, получая при этом неочищенный продукт. Неочищенный продукт хроматографируют на колонке с силикагелем с применением смеси петролейный эфир/этилацетат (5:1, об./об.), получая при этом 556 мг продукта, соединения wang 520 (выход 60%).
1Н ЯМР (300 МГц, CDCl3) δ 1,54 (с, 9Н), 3,95 (с, 3Н), 6,79 (ушир., 1Н), 7,16 (с, 1Н), 7,20 (дд, J=4,8 Гц, 3,9 Гц, 1Н), 7,25 (д, J=9,9 Гц, 1Н), 7,53 (д, J=9,0 Гц, 2Н), 7,63 (дд, J=8.4 Гц, 2,1 Гц, 1Н), 7,69 (дд, J=4,8 Гц, 1,2 Гц, 1Н), 8,02 (дд, J=3,9 Гц, 1,2 Гц, 1Н), 8,06 (д, J=8,7 Гц, 2Н), 8,17 (д, J=1,5 Гц, IH).
13C ЯМР (75 МГц, CDCl3) δ 28,17, 55,79, 81,23, 115,28, 117,92, 119,11, 123,09, 125,74, 128,02, 129,29, 129,41, 132,18, 132,75, 133,29, 133,71, 134,99, 141,57, 143,46, 151,37, 152,08, 159,93, 163,13, 167,46.
Соединение II (466 мг, 1,78 ммоль), соединение I (576 мг, 1,96 ммоль), ацетат натрия (146 мг, 1,78 ммоль) и 2 мл уксусного ангидрида смешивают при комнатной температуре с последующим нагреванием смеси до 200°С до тех пор, пока смесь не расплавиться, и смесь сохраняют в расплавленном состоянии в течение 1 часа. Затем в образовавшуюся смесь добавляют 2 мл этанола и охлаждают ее до комнатной температуры. Жидкость концентрируют и растворитель полностью удаляют, получая при этом неочищенный продукт. Неочищенный продукт хроматографируют на колонке с силикагелем с применением смеси петролейный эфир/этилацетат (1:1, об./об.), получая при этом 158 мг соединения wang 462-1.
1H ЯМР (300 МГц, CDCl3, wang 520-1) δ 1,50 (с, 9Н), 3,88 (с, 3Н), 7,27 (с, IH), 7,33-7,37 (2Н), 7,69 (д, J=8,7 Гц, 2Н), 8,01 (д, J=8,7 Гц, 2Н), 8,07 (д, J=3,9 Гц, 1Н), 8,13 (d, J=4.8 Гц, 1Н), 8,22-8,26 (2Н), 9,93 (с, 1Н).
1H ЯМР (300 МГц, CDCl3, wang 462-1) δ 2,22 (с, 3Н), 3,91 (с, 3Н), 7,07 (д, J=8,7 Гц, 1Н), 7,14 (с, 1Н), 7,21 (м, 1Н), 7,42 (м, 1Н), 7,66 (д, J=8,1 Гц, 2Н), 7,71 (д, J=4,8 Гц, 1Н), 7,99 (д, J=8,7 Гц, 1Н), 8,05 (м, 1Н), 8,10 (d, J=8,4 Гц, 2Н), 8,19 (м, 1Н).
Соединение II (1,46 г, 9,6 ммоль), соединение I (1,9 г, 10,7 ммоль), ацетат натрия (0,8 г 9,8 ммоль) и 2,8 мл уксусного ангидрида смешивают при комнатной температуре с последующим нагреванием смеси до 170°С до тех пор, пока смесь не расплавиться, и смесь сохраняют в расплавленном состоянии в течение 1 часа. Затем в образовавшуюся смесь добавляют 5 мл этанола и охлаждают ее до комнатной температуры. Таким образом образованное желтое твердое вещество отделяют и фильтруют, получая при этом 2,0 г продукта, соединение wang 337 (выход 62%).
1H ЯМР (300 МГц, CDCl3) δ 2,35 (с, 3Н), 3,97 (с, ЗН), 7,13 (д, J=8,4 Гц, 1Н), 7,20 (с, 1Н), 7,50-7,56 (2Н), 7,59-7,65 (2Н), 8,12-8,15 (3Н).
Соединение II (262 мг, 1,0 ммоль), соединение I (200 мг, 1,1 ммоль), ацетат натрия (82 мг, 1,0 ммоль) и 1 мл уксусного ангидрида смешивают при комнатной температуре с последующим нагреванием смеси до 170°С до тех пор, пока смесь не расплавится, и смесь сохраняют в расплавленном состоянии в течение 1 часа. Затем в образовавшуюся смесь добавляют 5 мл этанола и охлаждают ее до комнатной температуры. Таким образом образованное желтое твердое вещество отделяют и фильтруют. Жидкий остаток концентрируют и растворитель полностью удаляют, получая при этом неочищенный продукт. Неочищенный продукт хроматографируют на колонке с силикагелем с применением смеси петролейный эфир/этилацетат (6:1, об./об.), получая при этом 235 мг продукта, соединения wang 405 (выход 58%).
1H ЯМР (300 МГц, CDCl3) δ 3,97 (с, 3Н), 7,20 (дд, J=4,8 Гц, 3,9 Гц, 1Н), 7,24 (с, 1Н), 7,26 (д, J=7,8 Гц, 1Н), 7,51-7,57 (2Н), 7,60-7,70 (3Н), 8,02 (дд, J=3,6 Гц, 0,9 Гц, 1Н), 8,14-8,19 (3Н).
Соединение II (262 мг, 1,0 ммоль), соединение I (250 мг, 1,1 ммоль), ацетат натрия (82 мг, 1,0 ммоль) и 4 мл уксусного ангидрида смешивают при комнатной температуре с последующим нагреванием и выдерживанием смеси при 210-230°С в течение 1 часа. Затем в образовавшуюся смесь добавляют 5 мл этанола и охлаждают ее до комнатной температуры. Таким образом образованное желтое твердое вещество отделяют и фильтруют, получая при этом 100 мг продукта, соединения wang 450 (выход 22%).
1H ЯМР (300 МГц, CDCl3) δ 3,97 (с, 3Н), 7,21 (дд, J=4,8 Гц, 3,9 Гц, 1Н), 7,30 (д, J=8,1 Гц, 1Н), 7,37 (с, 1Н), 7,70 (д, J=5,1 Гц, 1Н), 7,73 (дд, J=9,9 Гц, 1,5 Гц, 1Н), 8,02 (д, J=3,9 Гц, 1Н), 8,09 (д, J=1,8 Гц, 1Н), 8,33 (д, J=9,0 Гц, 2Н), 8,40 (д, J=9,3 Гц, 2Н).
Пример 2
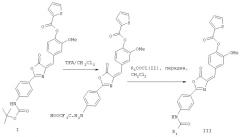
Соединение I (50 мг, 0,1 ммоль) растворяют в 2 мл дихлорметана и раствор охлаждают на низкотемпературной бане при -20°С с последующим добавлением 1 мл трифторуксусной кислоты и постепенным повышением температуры до комнатной температуры. Реакционную смесь анализируют ТСХ до тех пор, пока соединение I не прореагирует полностью. После концентрирования реакционной смеси и удаления полностью трифторуксусной кислоты промежуточное соединение реакции растворяют в 2 мл дихлорметана и смесь охлаждают на низкотемпературной бане при -20°С с последующим добавлением 40 мкл (0,6 ммоль) пиридина и постепенным повышением температуры до комнатной температуры. Реакционную смесь анализируют ТСХ. Реакционный раствор концентрируют и растворители удаляют, получая при этом неочищенный продукт. Неочищенный продукт хроматографируют на колонке с силикагелем с применением смеси петролейный эфир/этилацетат (2:1, об./об.), получая при этом 38 мг продукта, соединения wang 420 (выход 90%).
1H ЯМР (300 МГц, CDCl3) δ 3,94 (с, 3Н), 7,20-7,24 (м, 2Н), 7,27 (д, J=1,8 Гц, 1Н), 7,66 (дд, J=8,1 Гц, 1,5 Гц, 1Н), 7,71 (дд, J=4,8 Гц, 0,9 Гц, 1Н), 7,76 (д, J=9,0 Гц, 2Н), 8,03 (дд, J=3,6 Гц, 0,9 Гц, 1Н), 8,07 (д, J=1,5 Гц, 1Н), 8,14 (d, J=8,7 Гц, 2Н), 8,20 (ушир., 2Н).
Соединение I (50 мг, 0,1 ммоль) растворяют в 2 мл дихлорметана и раствор охлаждают на низкотемпературной бане при -20°С с последующим добавлением 1 мл трифторуксусной кислоты и постепенным повышением температуры до комнатной температуры. Реакционную смесь анализируют ТСХ до тех пор, пока соединение I не прореагирует полностью. После концентрирования реакционной смеси и удаления полностью трифторуксусной кислоты промежуточное соединение реакции растворяют в 2 мл дихлорметана и смесь охлаждают на низкотемпературной бане при -20°С с последующим добавлением 40 мкл (0,6 ммоль) пиридина, добавлением соединения II (27 мкл, 0,39 ммоль) и постепенным повышением температуры до комнатной температуры. Реакционную смесь анализируют ТСХ. Реакционный раствор концентрируют и растворители удаляют, получая при этом неочищенный продукт. Неочищенный продукт хроматографируют на колонке с силикагелем с применением смеси петролейный эфир/этилацетат (1,5:1, об./об.), получая при этом 26 мг продукта, соединения wang 462 (выход 56%).
1H ЯМР (300 МГц, CDCl3) δ 2,19 (с, 3Н), 3,88 (с, 3Н), 7,12 (с, 1Н), 7,20-7,24 (м, 2Н), 7,55 (д, J=1,5 Гц, 1Н), 7,60 (д, J=9,0 Гц, 2Н), 7,71 (дд, J=4,8 Гц, 0,9 Гц, 1Н), 7,77 (ушир., 1Н), 7,97 (д, J=8,7 Гц, 2Н), 8,03 (дд, J=3,9 Гц, 0,9 Гц, 1Н), 8,07 (д, J=1,5 Гц, 1Н).
13С ЯМР (75 МГц, CDCl3) δ 24,66, 55,84, 155,64, 119,55, 120,54, 123,35, 126,15, 128,43, 129,59, 129,87, 132,37, 133,12, 133,52, 134,26, 135,41, 141,85, 143,13, 151,63, 160,63, 163,28, 167,60, 168,99.
Соединение I (40 мг, 0,08 ммоль) растворяют в 2 мл дихлорметана и раствор охлаждают на низкотемпературной бане при -20°С с последующим добавлением 1 мл трифторуксусной кислоты и постепенным повышением температуры до комнатной температуры. Реакционную смесь анализируют ТСХ до тех пор, пока соединение I не прореагирует полностью. После концентрирования реакционной смеси и удаления полностью трифторуксусной кислоты промежуточное соединение реакции растворяют в 2 мл дихлорметана и смесь охлаждают на низкотемпературной бане при -20°С с последующим добавлением 40 мкл (0,6 ммоль) пиридина, добавлением соединения II (23 мкл, 0,2 ммоль) и постепенным повышением температуры до комнатной температуры. Реакционную смесь анализируют ТСХ. Реакционный раствор концентрируют и растворители удаляют, получая при этом неочищенный продукт. Неочищенный продукт хроматографируют на колонке с силикагелем с применением смеси петролейный эфир/этилацетат (5:1, об./об.), получая при этом 15 мг продукта, соединения wang 524 (выход 36%).
1H ЯМР (300 МГц, ДМСО-d6) δ 3,90 (с, 3Н), 7,22 (д, J=5,4 Гц, 1Н), 7,33, (д, J=8,4 Гц, 2Н), 7,39-7,44 (1Н), 7,50-7,58 (2Н), 7,83 (д, J=8,4 Гц), 7,98 (д, J=8,7 Гц, 2Н), 8,04-8,22 (7Н), 10,74 (с, 1Н).
Соединение I (40 мг, 0,08 ммоль) растворяют в 2 мл дихлорметана и раствор охлаждают на низкотемпературной бане при -20°С с последующим добавлением 1 мл трифторуксусной кислоты и постепенным повышением температуры до комнатной температуры. Реакционную смесь анализируют ТСХ до тех пор, пока соединение I не прореагирует полностью. После концентрирования реакционной смеси и удаления полностью трифторуксусной кислоты промежуточное соединение реакции растворяют в 2 мл дихлорметана и смесь охлаждают на низкотемпературной бане при -20°С с последующим добавлением 40 мкл (0,6 ммоль) пиридина, добавлением соединения II (25 мкл, 0,2 ммоль) и постепенным повышением температуры до комнатной температуры. Реакционную смесь анализируют ТСХ. Реакционный раствор концентрируют и растворители удаляют, получая при этом неочищенный продукт. Неочищенный продукт хроматографируют на колонке с силикагелем с применением смеси петролейный эфир/этилацетат (4:1, об./об.), получая при этом 25 мг продукта, соединения wang 516 (выход 62,5%).
1Н ЯМР (300 МГц, ДМСО-d6) δ 1,57 (м, 2Н), 1,63-1,77 (м, 4Н), 1,80-1,89 (м, 2Н), 2,84 (м, 1Н), 3,89 (с, 3Н), 7,31 (м, 2Н), 7,40 (д, J=8,4 Гц,1Н), 7,86 (д, J=9,0 Гц, 2Н), 7,94 (дд, J=8,4 Гц, 1,8 Гц, 1Н), 8,03 (дд, J=3,9 Гц, 1,2 Гц, 1Н), 8,07 (д, J=9,0 Гц, 2Н), 8,10 (дд, J=4,8 Гц, 1,2 Гц, 1Н), 8,18 (д, J=1,8 Гц, 1Н), 10,35 (с, 1Н).
13С ЯМР (75 МГц, ДМСО-d6) δ 25,62, 30,00, 55,97, 115,74, 118,71, 119,04, 123,52, 125,27, 128,51, 128,77, 129,24, 131,19, 132,78, 133,34, 135,43, 135,50, 140,86, 144,42, 151,04, 159,24, 162,91, 166,93, 175,11.
Соединение I (40 мг, 0,08 ммоль) растворяют в 2 мл дихлорметана и раствор охлаждают на низкотемпературной бане при -20°С с последующим добавлением 1 мл трифторуксусной кислоты и постепенным повышением температуры до комнатной температуры. Реакционную смесь анализируют ТСХ до тех пор, пока соединение I не прореагирует полностью. После концентрирования реакционной смеси и удаления полностью трифторуксусной кислоты промежуточное соединение реакции растворяют в 2 мл дихлорметана и смесь охлаждают на низкотемпературной бане при -20°С с последующим добавлением 40 мкл (0,6 ммоль) пиридина, добавлением соединения II (23 мкл, 0,2 ммоль) и постепенным повышением температуры до комнатной температуры. Реакционную смесь анализируют ТСХ. Реакционный раствор концентрируют и растворители удаляют, получая при этом неочищенный продукт. Неочищенный продукт хроматографируют на колонке с силикагелем с применением смеси петролейный эфир/этилацетат (4:1, об./об.), получая при этом 25 мг продукта, соединения wang 488 (выход 64%).
1H ЯМР (300 МГц, ДМСО-d6) δ 0,80 (м, 2Н), 0,85 (м, 2Н), 1,84 (м, 1Н), 3.88 (с, 3Н), 7,28 (с, 1Н), 7,32 (дд, J=5,1 Гц, 3,9 Гц, 1Н), 7,39 (д, J=8,1 Гц, 1Н), 7,85 (д, J=8,7 Гц, 2Н), 7,92 (дд, J=8,4 Гц, 1,5 Гц, 1Н), 8,04 (м, 1Н), 8,05 (д, J=8,7 Гц, 2Н), 8,11 (дд, J=4,8 Гц, 1,2 Гц, 1Н), 8,18 (д, J=1,8 Гц, 1Н), 10,68 (с, 1Н).
13С ЯМР (75 МГц, ДМСО-d6) δ 7,78, 14,83, 55,97, 115,71, 118,73, 118,93, 123,53, 125,32, 128,54, 128,81, 129,32, 131,22, 132,80, 133,36, 135,46, 135,53, 140,88, 144,24, 151,05, 159,29, 162,91, 166,96, 172,44.
Соединение I (40 мг, 0,08 ммоль) растворяют в 2 мл дихлорметана и раствор охлаждают на низкотемпературной бане при -20°С с последующим добавлением 1 мл трифторуксусной кислоты и постепенным повышением температуры до комнатной температуры. Реакционную смесь анализируют ТСХ до тех пор, пока соединение I не прореагирует полностью. После концентрирования реакционной смеси и удаления полностью трифторуксусной кислоты промежуточное соединение реакции растворяют в 2 мл дихлорметана и смесь охлаждают на низкотемпературной бане при -20°С с последующим добавлением 40 мкл (0,6 ммоль) пиридина, добавлением соединения II (23 мкл, 0,2 ммоль) и постепенным повышением температуры до комнатной температуры. Реакционную смесь анализируют ТСХ. Реакционный раствор концентрируют и растворители удаляют, получая при этом неочищенный продукт. Неочищенный продукт хроматографируют на колонке с силикагелем с применением смеси петролейный эфир/этилацетат (4:1, об./об.), получая при этом 26 мг продукта, соединения wang 568 (выход 57%).
1H ЯМР (300 МГц, CDCl3) δ 3,95 (с, 3Н), 4,13 (с, 2Н), 4,68 (с, 2Н), 7,18 (с, 1Н), 7,19-7,26 (м, 2Н), 7,39-7,50 (м, 5Н), 7,63 (дд, J=6,9 Гц, 0,9 Гц, 1Н), 7,69 (дд, J=4,8 Гц, 0,9 Гц, 1Н), 7,74 (д, J=9,0 Гц, 2Н), 8,01 (дд, J=3,6 Гц, 1,2 Гц, 1Н), 8,10 (д, J=8,7 Гц, 2Н), 8,16 (д, J=1,5 Гц, 1Н), 8,56 (с, 1Н).
Соединение I (40 мг, 0,08 ммоль) растворяют в 2 мл дихлорметана и раствор охлаждают на низкотемпературной бане при -20°С с последующим добавлением 1 мл трифторуксусной кислоты и постепенным повышением температуры до комнатной температуры. Реакционную смесь анализируют ТСХ до тех пор, пока соединение I не прореагирует полностью. После концентрирования реакционной смеси и удаления полностью трифторуксусной кислоты промежуточное соединение реакции растворяют в 2 мл дихлорметана и смесь охлаждают на низкотемпературной бане при -20°С с последующим добавлением 40 мкл (0,6 ммоль) пиридина, добавлением соединения II (23 мкл, 0,2 ммоль) и постепенным повышением температуры до комнатной температуры. Реакционную смесь анализируют ТСХ. Реакционный раствор концентрируют и растворители удаляют, получая при этом неочищенный продукт. Неочищенный продукт хроматографируют на колонке с силикагелем с применением смеси петролейный эфир/этилацетат (4:1, об./об.), получая при этом 22 мг продукта, соединения wang 502 (выход 56%).
1H ЯМР (300 МГц, ДМСО-d6) δ 1,81-1,94 (м, 2Н), 2,12-2,28 (м, 4Н), 3,29 (м, 1Н), 3,89 (с, 3Н), 7,31 (с, 1Н), 7,33 (м, 1Н), 7,40 (д, J=7,5 Гц, 1Н), 7,87 (д, J=8,1 Гц, 2Н), 7,94 (д, J=8,1 Гц, 2Н), 8,04-8,08 (2Н), 8,12 (д, J=5,1 Гц, 1Н), 8,19 (с,1Н), 10,20 (с, 1Н).
Соединение I (40 мг, 0,08 ммоль) растворяют в 2 мл дихлорметана и раствор охлаждают на низкотемпературной бане при -20°С с последующим добавлением 1 мл трифторуксусной кислоты и постепенным повышением температуры до комнатной температуры. Реакционную смесь анализируют ТСХ до тех пор, пока соединение I не прореагирует полностью. После концентрирования реакционной смеси и удаления полностью трифторуксусной кислоты промежуточное соединение реакции растворяют в 2 мл дихлорметана и смесь охлаждают на низкотемпературной бане при -20°С с последующим добавлением 40 мкл (0,6 ммоль) пиридина, добавлением соединения II (23 мкл, 0,2 ммоль) и постепенным повышением температуры до комнатной температуры. Реакционную смесь анализируют ТСХ. Реакционный раствор концентрируют и растворители удаляют, получая при этом неочищенный продукт. Неочищенный продукт хроматографируют на колонке с силикагелем с применением смеси петролейный эфир/этилацетат (4:1, об./об,), получая при этом 24 мг продукта, соединения wang 530 (выход 57%).
1H ЯМР (300 МГц, ДМСО-d6) δ 1,20-1,48 (6Н), 1,65-1,81 (4Н), 2,39 (м, 1Н), 3,89 (с, 3Н), 7,32 (с, 1Н), 7,34 (м, 1Н), 7,41 (д, J=8,4 Гц, 1Н), 7,87 (д, J=8,1 Гц, 2Н), 7,95 (d, J=8,1 Гц, 1Н), 8,04 (м,1Н), 8,08 (д, J=8,7 Гц, 2Н), 8,12 (д, J=4,8 Гц, 1Н), 8,20 (м, 1Н), 10,31 (с, 1Н).
Соединение I (40 мг, 0,08 ммоль) растворяют в 2 мл дихлорметана и раствор охлаждают на низкотемпературной бане при -20°С с последующим добавлением 1 мл трифторуксусной кислоты и постепенным повышением температуры до комнатной температуры. Реакционную смесь анализируют ТСХ до тех пор, пока соединение I не прореагирует полностью. После концентрирования реакционной смеси и удаления полностью трифторуксусной кислоты промежуточное соединение реакции растворяют в 2 мл дихлорметана и смесь охлаждают на низкотемпературной бане при -20°С с последующим добавлением 40 мкл (0,6 ммоль) пиридина, добавлением соединения II (23 мкл, 0,2 ммоль) и постепенным повышением температуры до комнатной температуры. Реакционную смесь анализируют ТСХ. Реакционный раствор концентрируют и растворители удаляют, получая при этом неочищенный продукт. Неочищенный продукт хроматографируют на колонке с силикагелем с применением смеси петролейный эфир/этилацетат (6:1, об./об.), получая при этом 4 мг продукта, соединения wang 504 (выход 10%).
1H ЯМР (300 МГц, CDCl3) δ 1,34 (с, 9Н), 3,94 (с, 3Н), 7,15 (с, 1Н), 7,20 (дд, J=4,8 Гц, 3,6 Гц, 1Н), 7,23 (с, 1Н), 7,58 (ушир., 1Н), 7,64-7,69 (2Н), 7,72 (д, J=8,7 Гц, 2Н), 8,02 (дд, J=3,6 Гц, 1,5 Гц, 1Н), 8,08 (д, J=9,0 Гц, 2Н), 8,11 (д, J=1,8 Гц, 1Н).
Соединение I (40 мг, 0,08 ммоль) растворяют в 2 мл дихлорметана и раствор охлаждают на низкотемпературной бане при -20°С с последующим добавлением 1 мл трифторуксусной кислоты и постепенным повышением температуры до комнатной температуры. Реакционную смесь анализируют ТСХ до тех пор, пока соединение I не прореагирует полностью. После концентрирования реакционной смеси и удаления полностью трифторуксусной кислоты промежуточное соединение реакции растворяют в 2 мл дихлорметана и смесь охлаждают на низкотемпературной бане при -20°С с последующим добавлением 40 мкл (0,6 ммоль) пиридина, добавлением соединения II (27 мкл, 0,2 ммоль) и постепенным повышением температуры до комнатной температуры. Реакционную смесь анализируют ТСХ. Реакционный раствор концентрируют и растворители удаляют, получая при этом неочищенный продукт. Неочищенный продукт хроматографируют на колонке с силикагелем с применением CH2Cl2, получая при этом 40 мг продукта, соединения wang 554 (выход 89%).
1H ЯМР (300 МГц, CDCl3) δ 3,83 (с, 3Н), 6,28 (с, 1Н), 7,05 (с, 1Н), 7,16 (д, J=8,1 Гц, 1Н), 7,20 (дд, J=5,1 Гц, 3,6 Гц, 1Н), 7,39-7,41 (2Н), 7,50-7,55 (3Н), 7,60 (д, J=9,0 Гц, 2Н), 7,71 (дд, J=5,1 Гц, 1,2 Гц, 1Н), 7,92 (д, J=8,4 Гц, 2Н), 7,99 (д, J=1,2 Гц), 8,03 (дд, J=3,6 Гц, 0,9 Гц, 2Н), 8,24 (с, 1Н), 8,42 (с, 1Н).
Соединение I (52 мг, 0,1 ммоль) растворяют в 2 мл дихлорметана и раствор охлаждают на низкотемпературной бане при -20°С с последующим добавлением 1 мл трифторуксусной кислоты и постепенным повышением температуры до комнатной температуры. Реакционную смесь анализируют ТСХ до тех пор, пока соединение I не прореагирует полностью. После концентрирования реакционной смеси и удаления полностью трифторуксусной кислоты промежуточное соединение реакции растворяют в 2 мл дихлорметана и смесь охлаждают на низкотемпературной бане при -20°С с последующим добавлением 40 мкл (0,6 ммоль) пиридина, добавлением соединения II (10 мкл, 0,03 ммоль) и постепенным повышением температуры до комнатной температуры. Реакционную смесь анализируют ТСХ. Реакционный раствор концентрируют и растворители удаляют, получая при этом неочищенный продукт. Неочищенный продукт хроматографируют на колонке с силикагелем с применением CH2Cl2, получая при этом 19 мг продукта, соединения wang 866 (выход 44%).
1H ЯМР (300 МГц, ДМСО-d6) δ 3,89 (с, 6Н), 7,33 (дд, J=4,8 Гц, 3,9 Гц, 2Н), 7,36 (с, 2Н), 7,41 (д, J=8,4 Гц, 2Н), 7,93-7,96 (2Н), 7,96 (д, J=8,7 Гц, 4Н), 8,04 (дд, J=3,3 Гц, 0,9 Гц, 2Н), 8,12 (дд, J=4,8 Гц, 0,9 Гц, 2Н), 8,17(д, J=8,7 Гц, 4Н), 8,20 (д, J=1,8 Гц, 2Н), 11,66 (с, 2Н).
Согласно тому же самому способу соединение 2f получают с применением продукта реакции 1 экв. соединения
с трифторуксусной кислотой и 1,5 экв. ацетилхлорида (выход 56%).
1H ЯМР (300 МГц, CDCl3) δ 1,41 (т, J=6,9 Гц, 3Н), 2,24 (с, 3Н), 4,18 (кв., J=6,9 Гц, 2Н), 7,11 (с, 1Н), 7,19 (м, 1Н), 7,45 (м, 2Н), 7,62-7,70 (4Н), 8,02 (м, 1Н), 8,08 (д, J=9,0 Гц, 2Н).
Согласно тому же способу соединение wang 582 получают с применением продукта реакции 1 экв. соединения wang 520 с трифторуксусной кислотой и 1,5 экв. диамантанформилхлорида (выход 38%).