Способ получения 3-хлорсульфонилбензамидов из бензойных кислот
Иллюстрации
Показать всеИзобретение относится к способу получения 3-хлорсульфонилбензамидов, используемых в качестве промежуточного продукта при получении красителей, полимерных материалов, краскообразующих компонентов в пленочной фотографии, пищевых добавок, заменителей сахара, биологически активных и лекарственных веществ широкого спектра действия. Описывается способ получения 3-хлорсульфонилбензамидов взаимодействием бензойной кислоты или ее замещенного с трехкратным избытком хлорсульфоновой кислоты при 100-150°С в течение 1,0-2,5 часов с последующим амидированием продукта реакции реагентом, выбранным из группы, включающей сульфаминовую кислоту, ее N-алкилзамещенное, мочевину, при 80-100°С в течение 1,0-1,5 часов. Предложенный способ позволяет упростить технологию получения 3-хлорсульфонилбензамидов с алифатическими аминными фрагментами и различными, в том числе и электроноакпепторными, заместителями в ароматическом кольце. 1 з.п. ф-лы.
Реферат
Изобретение относится к области органической химии, конкретно к новому способу получения 3-хлорсульфонилбензамидов.
Эти соединения в основном используются в синтезе различных производных сульфокислот, главным образом амидов и сложных эфиров, которые находят широкое применение при получении красителей, различных типов поликонденсационных полимерных материалов, краскообразующих компонентов в пленочной фотографии, пищевых добавок, заменителей сахара, биологически активных и лекарственных веществ широкого спектра действия: химические средства защиты растений, диуретики, натрийуретики, нейролептики, антиконвульсанты, профилактические и терапевтические средства для лечения расстройств сердечно-сосудистой системы и т.п.
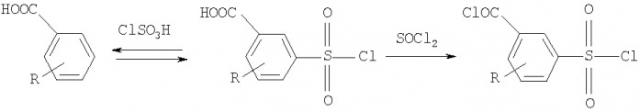
Для получения хлорсульфонилбензамидов в основном применяется способ, основанный на различной реакционной способности хлорангидридной и сульфонилхлоридной групп в дихлорангидридах сульфобензойных кислот в процессах взаимодействия с нуклеофильными агентами /Barr C.R., Salminen I.F., Weissberger A. // The Reaction of 3-Chlorosulfonylbenzoyl Chloride with Amines. - J. Am. Chem. Soc., 1951. - Vol.73. - P.4131-4133/. Синтезируют дихлорангидриды из бензойной кислоты или ее замещенных путем последовательного сульфохлорирования хлорсульфоновой кислотой (ХСК) и дегидроксилирования тионилхлоридом.
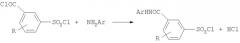
Полученные соединения могут селективно вступать в реакцию по хлорангидридной группе с различными аминами - ароматическими или гетероциклическими - с образованием целевых продуктов /Пат. Брит. №912060, 05.12.62, Пат. Швейцарии №436288, 15.11.1967/.
Однако при использовании данного метода невозможно селективное проведение реакции в случае наиболее реакционноспособных, алифатических аминов, т.к. в этом случае различие в реакционной способности функциональных групп дихлорангидрида нивелируется повышенной активностью реагента. Это обстоятельство существенно ограничивает практическую полезность и область применения этого способа.
В некоторых случаях возможно непосредственное введение сульфогруппы в ядро, уже содержащее карбоксамидный заместитель, без его разрушения. Такому характеру протекания процесса способствует наличие в молекуле бензамида сильных электронодонорных заместителей, присутствие которых облегчает протекание реакции и позволяет проводить ее в относительно мягких условиях /Пат. США №3055905, 25.09.1962/.
В случае же присутствия заместителей с электроноакцепторными свойствами реакция сульфирования затруднена, поэтому для достижения количественного выхода сульфонилхлорида необходимо проведение процесса при высоких температурах в течение длительного времени, что приводит к полному или частичному разложению бензамидной группы / Сьютер Ч. // Химия органических соединений серы. - М.: Изд. иностр. лит., 1951. - т.2 - с.63/.
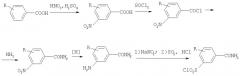
Получение 3-хлорсульфонилбензамидов с алифатическим амидным фрагментом и электроноакцепторными заместителями в ядре возможно посредством применения способа /Пат. Брит. №909751, 07.11.1962/, в котором целевые продукты получают в несколько стадий: 1) нитрование замещенных бензойных кислот концентрированным раствором азотной кислоты в 100%-ной серной кислоте; 2) дегидроксилирование карбоксильной группы тионилхлоридом с получением хлорангидрида; 3) получение амида бензойной кислоты ацилированием аммиака или алифатического амина хлорангидридом; 4) восстановление нитрогруппы до аминной в подкисленном соляной кислотой водном растворе этанола в присутствии порошка железа или гидрирование на катализаторе (палладий, платина, никель Ренея); 5) реакция диазотирования полученного соединения водным раствором нитрита натрия с последующей обработкой диазосоединения концентрированным раствором диоксида серы в уксусной кислоте с добавлением хлорида меди.
Многостадийность является существенным недостатком данного метода, т.к. потери на каждой из стадий не позволяют добиться значительного выхода целевого вещества. Это косвенно подтверждается отсутствием приведенных в указанном патенте выходов продуктов и промежуточных соединений.
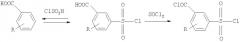
Наиболее близким к предлагаемому способу является способ, в котором для получения целевых соединений используются следующие стадии: 1) сульфохлорирование бензойной кислоты или ее замещенного трехкратным избытком хлорсульфоновой кислоты; 2) амидирование сульфонилхлоридной группы аммиаком или алифатическим амином; 3) внутримолекулярное переамидирование под действием хлорсульфоновой кислоты /Заявка РФ №200611148/.
В этом методе также несколько стадий, т.к. для проведения амидирования полученный сульфонилхлорид необходимо выделять из реакционной смеси. Последнюю с этой целью выливают на лед, при этом избыток ХСК образует большое количество кислых стоков. Для проведения заключительного этапа вновь необходим избыток ХСК, т.е. очевидным недостатком данного метода представляется и не вполне эффективное использование этого реагента.
Задачей настоящего изобретения является упрощение процесса получения 3-хлорсульфонилбензамидов с алифатическими аминными фрагментами и различными, в том числе и электроноакцепторными, заместителями в ароматическом кольце.
Сущность метода состоит в следующем: после обработки бензойной кислоты или ее замещенного избытком хлорсульфоновой кислоты в реакционную смесь вносится сульфаминовая кислота или ее N-алкилзамещенное, приводя в итоге к целевому продукту. Генерация сульфаминовой кислоты возможна непосредственно в реакционном пространстве из мочевины или ее N-алкилзамещенного при взаимодействии последнего с ХСК.
где R1 и R2 - H, Alk, Hal;
R' и R'' - H, Alk;
Х - СО, n=2; Х - SO3Н, n=1.
Реакция проводится в среде хлорсульфоновой кислоты при ее трехкратном избытке. Такие условия обусловлены тем, что ХСК выступает одновременно в роли растворителя и реагента.
После протекания сульфохлорирования бензойной кислоты или ее замещенного ХСК при температуре 100-150°С в течение 1-2,5 ч в (зависимости от строения исходного соединения) к реакционной смеси добавляется сульфаминовая кислота или ее N-алкилзамещенное и процесс при 80-100°С заканчивается в течение 1-1,5 часов. Выход продукта составляет 80-86%. В случае использования мочевины или ее N-алкилзамещенного условия проведения процесса не изменяются, т.к. время, затраченное на реакцию последней с ХСК, компенсируется более высокой реакционной способностью сульфаминовой кислоты, полученной in sutu, по сравнению с таковой, непосредственно вводимой в реакционную смесь. Выбор того или иного реагента в конкретном случае помимо необходимости получить продукт определенного строения определяется доступностью соответствующей мочевины или сульфаминовой кислоты. Впрочем, большинство из веществ такого рода являются коммерчески доступными и распространенными.
Наиболее значимым положительным отличием предложенного метода от других, приведенных выше, в том числе и от прототипа, является одностадийное протекание процесса получения целевых продуктов. Кроме того, при использовании описываемого метода сокращается расход хлорсульфоновой кислоты.
Изобретение иллюстрируется следующими примерами.
Пример 1. В трехгорлую колбу, снабженную механической мешалкой, термометром и обратным холодильником, загружают 12,1 г (0,1 моль) бензойной кислоты, затем приливают 20 мл (0,3 моль) свежеперегнанной хлорсульфоновой кислоты. Реакционную смесь нагревают до 100°С и выдерживают при этой температуре при перемешивании в течение 1,5 ч. После этого в колбу через воронку всыпают 10,6 г (0,11 моль) сульфаминовой кислоты, продолжают ведение процесса при температуре 80°С еще 1,5 ч. Остывшую до комнатной температуры смесь при интенсивном перемешивании выливают на лед. Выпавший продукт отфильтровывают и промывают водой, высушивают. Получают 18,6 г 3-хлорсульфонилбензамида. Температура плавления после перекристаллизации из толуола 90-91°С.
Пример 2. 20 г п-метилбензойной кислоты сульфохлорируют по методике, описанной в примере 1, затем вносят в колбу 8,8 г мочевины, продолжают ведение опыта при тех же условиях 20 мин, после этого снижают температуру до 80°С. По истечении 1 ч с этого момента охлажденную до 40°С реакционную смесь выливают на лед, выпавший осадок фильтруют, промывают водой, высушивают. Получают 27,9 г 3-хлорсульфонил-4-метилбензамида. Температура плавления после перекристаллизации из толуола 75-77,5°С.
Пример 3. 10 г о-хлорбензойной кислоты сульфохлорируют по методике опыта 1: температура опыта 130°С, время проведения реакции 2 часа. Всыпают в колбу 7,4 г N,N,N',N'-тетраметилмочевины, при 100°С выдерживают реакционную смесь 30 минут, затем при 90°С - еще 1,5 ч. Выпавший после выливания в в ледяную воду осадок отфильтровывают и сушат. Получают 13,7 г 2-хлор-5-хлорсульфонил-N,N-диметилбензамида. Температура плавления после перекристаллизации из толуола 110-112°С.
Пример 4. В плоскодонную колбу вносят 6 г 2,4-дихлорбензойной кислоты, приливают 10 мл перегнанной ХСК и, поместив колбу с установленным обратным холодильником в песчаную баню, ведут реакцию при кипении хлорсульфоновой кислоты (˜150°С) в течение 2,5 часов. Затем реакционную смесь охлаждают до 90°С, вносят в колбу 3,5 г N-метилсульфаминовой кислоты, при перемешивании продолжают опыт в течение 1,5 ч. Затем остывшую до 40°С реакционную смесь выливают при интенсивном перемешивании на лед, выпавший продукт отфильтровывают и сушат. Получают 7,8 г 2,4-дихлор-5-хлорсульфонил-N-метилбензамида. Температура плавления после кристаллизации из толуола 167-169°С.
1. Способ получения 3-хлорсульфонилбензамидов из бензойных кислот, отличающийся тем, что бензойную кислоту или ее замещенное подвергают взаимодействию с трехкратным избытком хлорсульфоновой кислоты при 100-150°С в течение 1,0-2,5 ч с последующим амидированием продукта реакции реагентом, выбранным из группы, включающей сульфаминовую кислоту, ее N-алкилзамещенное, мочевину, при 80-100°С в течение 1,0-1,5 ч.
2. Способ по п.1, отличающийся тем, что амидирование осуществляют с использованием мочевины.