Сенсибилизированный оперативный bold-mri способ получения изображения
Иллюстрации
Показать всеГруппа изобретений относится к медицине и предназначена для мониторинга процесса лечения заболевания или нарушения, излечиваемого при помощи локальной эмболизации или реканализации. Создают MR-BOLD взвешенное изображение целевой интересующей области внутри тела пациента. Вводят сенсибилизатор пациенту. Облучают целевую область внутри тела пациента соответствующим сенсибилизирующим излучением. Проводят запись изменения MR-BOLD изображения путем создания единичного или множества последовательных MR-BOLD изображений, взвешенных по Т2*, во время и/или после облучения. Обрабатывают полученные данные. Создают контрастную карту изображений с цветовой кодировкой или относительных количеств на попиксельной основе. Анализируют обработанные данные при помощи отображения композитного изображения, полученного наложением BOLD контрастной карты на изображение, созданное до введения сенсибилизатора. При этом области в указанном композитном изображении должны совпадать с областями, подвергнутыми лечебному воздействию. Предлагаемая группа позволяет мониторировать гемодинамические эффекты, проявляющиеся при воздействии сенсибилизатора на сосуды, обеспечить точный 3D-мониторинг сосудистого поражения опухоли сенсибилизатором, минимизировать повреждающее действие сенсибилизирующего излучения и максимизировать фотохимический эффект сенсибилизатора. 3 н. и 35 з.п. ф-лы, 6 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области клинического мониторинга и управления и относится к способу магнитно-резонансной томографии (МРТ, MRI), с этой целью основанному на эффекте, зависящем от уровня оксигенации крови (ЗУОК, BOLD), особенно в фотодинамической терапии.
Аббревиатуры: Bchl: бактериохлорофилл; BOLD: зависящий от уровня оксигенации крови; Chl: хлорофилл; ВИОЛ: временной интервал освещения лекарства; fMRI: функциональная MRI; GE: градиентное эхо; Hb: гемоглобин; HNE: 4-гидроксиноненал; IHC: иммуногистохимия; i.v.: внутривенный; ИВМ: интравитальная микроскопия; ПОЛ: перекисное окисление липидов; MEGE: мульти-эхо градиентное эхо; MR: магнитный резонанс; MRI: магнитно-резонансная томография; Pd-Bpheid: палладий-бактериофеофорбид; PDT: фотодинамическая терапия; pO2: парциальное давление кислорода; ФС: фотосенсибилизатор; RBC: красные кровяные тельца; ROS: реактивные кислородные агенты; s.c.: подкожный; ИС: интенсивность сигнала; SPO2: уровень насыщения гемоглобина; TRICT-декстран: изотиоционат тетраметилродамина - декстран; УФ: ультрафиолет.
Уровень техники
Фотодинамическая терапия (PDT) основана на накоплении лекарственного препарата, неактивного фотосенсибилизатора (ФС) в интересующей ткани с последующим локальным освещением соответствующей длиной волны. Возбужденные ФС реагируют in suti с молекулярным кислородом, создавая высоко токсичные реактивные кислородные агенты (ROS), которые ведут к некрозу обработанной ткани. PDT представляет собой относительно новый подход к лечению рака, такого как рак легких, желудка, крови, шейки матки, пищевода и кожи (Sibata и др., 2001; Hopper, 2000), и при лечении неопухолевых заболеваний, например облысения, псориаза, мезотелиомы и меноррагии (Dougherty, 2002), а также в кардиологии, например рестенозы после ангиопластики или атеросклероза (Mansfield и др., 2001), и офтальмологических заболеваний, таких как возрастная дистрофия желтого пятна (Fine, 1999).
В лабораториях изобретателей синтезировали новое семейство ФС, полученное из фотосинтетических пигментов хлорофилла (Chl) и бактериохлорофилла (Bchl), в частности из бактериохлорофилла (Bchl), для использования в PDT, диагностиках и для поражения клеток или инфекционных агентов in vitro при освещении (Zilberstain и др., 2001; Rosenbach-Belkin и др., 1996; Gross и др., 1997; Schreiber и др., 2002; Koudinova и др., 2003; US 5726169; US 5955585; US 6147195; EP 0584552; WO 97/19081; WO 00/33833; WO 01/40232; и заявка на патент Израиля №152900).
Ведущие соединения из нового семейства ФС, разработанные изобретателями, Pd-бактериофеофорбид (Pd-Bpheid) (Schreiber и др., 2002; WO 00/33833), демонстрируют лучшие фотохимические и фармакологические характеристики среди клинически используемых ФС. Pd-Bpheid демонстрирует более высокую фототоксичность и фотостабильность, более высокую скорость удаления из кровообращения при малом уровне или отсутствии повреждения смежных тканей, и сильную абсорбцию в ближней инфракрасной области спектра (760 нм) с ∑0˜105, способствуя более глубокой фотосенсибилизации в раковой ткани ˜1,5 см. Преклинически протестировали Pd-Bpheid (Tookad®, Steba Biotech Ltd) при PDT лечении нормальной простаты собаки и показали, что это привело к полному некрозу опухоли без функционального уретрального повреждения или повреждения в других смежных тканях (Chen и др., 2002). В настоящее время Pd-Bpheid проходит продвинутые клинические испытания PDT рака человеческой простаты.
Изобретателями показано, что освещение опухоли, обработанной бактериохлорофилл-серином (Bchl-Ser), ФС, описанным в EP 0584552, приводит к зависящему от света уменьшению кислорода (вследствие фотопотребления О2) (Zilberstein и др., 1997). Немедленное освещение после внутривенного введения сенсибилизатора (без временного интервала освещения лекарства (ВИОЛ)) показало, что это вызывает капиллярную окклюзию, кровоизлияние и застой крови, приводящий к некрозу опухоли и уничтожению (Zilberstein и др., 2001). Показано, что данный новый способ лечебного воздействия на сосуды Bchl-Ser или Pd-Bpheid вызывает высокие скорости излечения меланомы, глиомы, саркомы и ксенотрансплантатов простаты человека у мышей (Zilberstein и др., 2001; Schreiber и др., 2002; Koudinova и др., 2003) и у крыс (Kelleher и др., 1999). PDT с Pd-Bpheid также уменьшает частоту возникновения метастазов по сравнению с традиционной хирургией (Schreiber и др., 2002). В исследованиях, выполненных с другими сенсибилизаторами, такими как фотосенсибилизатор MV6401 на основе хлора и бензопорфирина, производного вертепорфина, подобные гемодинамические изменения были связаны с коротким или отсутствием ВИОЛ (Dolmans и др., 2002; Fingar и др., 1999; Pogue и др., 2001).
Точная подача света является необходимым условием для аккуратной, эффективной и безопасной PDT. Несмотря на то, что введение волокна во внутренние органы может производиться при помощи различных техник, таких как оптическая, рентгеновская или ультразвуковая, визуализация в реальном масштабе времени воздействия света и реакции опухоли сегодня не удовлетворяют требованиям. Необходимость в такой технике становится критической в случаях, когда целевая опухоль является внутренней и/или локализована поблизости от жизненно важных органов, нервов или крупных кровеносных сосудов. В таких случаях, преимуществом является возможность получения изображения фотосенсибилизированной зоны лечения. Следовательно, такая техника получения изображения потенциально предоставляет возможность более высокой точности и безопасности лечения, таким образом, уменьшая нежелательное повреждение соседних не затронутых заболеванием тканей.
Магнитно-резонансная томография (MRI) может определить анатомию человека на более детальном уровне, который не может быть достигнут при помощи любой другой медицинской техники получения изображения. Дополнительно к изображению анатомии MRI может оценить функцию ткани. В последнее время функциональная магнитно-резонансная томография (fMRI) развивалась как техника для анализа функции мозга (Detre и Floyd, 2001). fMRI предоставляет возможность обнаружения и получения изображения пространственных и временных изменений в оксигенации, потоке и объеме крови (Jordan и др., 2002) и включает в себя получение изображения, зависящего от уровня кислорода крови (BOLD), получение изображения диффузии, получение изображения перфузии, анализ потока цереброспинальной жидкости и MR спектроскопию.
BOLD-MRI представляет собой протокол получения изображения, который является чувствительным к определенным скоростям релаксации, которые подвержены влиянию дезоксигемоглобина. Контраст BOLD-MRI получают из парамагнитного контраста, свойственного дезоксигемоглобину, используя изображения, взвешенные по Т2* (Howe и др., 2001; Turner, 1997). Контраст BOLD-MRI сначала применялся в исследовании рака для мониторинга реакции опухоли на вазомодуляторы (Jordan и др., 2000; Taylor и др., 2001) и авторами настоящего изобретения для анализа функциональности сосудов опухоли, зрелости сосудов и ангиогенеза (Abramovitch и др., 1998а, 1998b; Gilead и Neeman, 1999).
Раскрытие изобретения
Согласно настоящему изобретению, исследовали и обнаружили, что фотопоглощение кислорода и последующие гемодинамические эффекты, свойственные Pd-Bpheid-PDT, генерируют изменение в контрасте BOLD и, следовательно, BOLD-MRI техника может быть использована для оценки реакции сосудов опухоли во время PDT сенсибилизатором in vivo.
Таким образом, настоящее изобретение предлагает оперативный способ магнитно-резонансной томографии (MRI), зависящей от уровня оксигенации крови (BOLD), для функционального клинического управления или мониторинга и последующего наблюдения за ходом лечения лечебного воздействия, включающего в себя лечение сенсибилизатором, который при возбуждении соответствующим сенсибилизирующим излучением инициирует локальное потребление или истощение кислорода, указанный способ содержит:
(i) создание BOLD взвешенного MR изображения целевой интересующей области внутри тела пациента (время t0);
(ii) введение указанного сенсибилизатора пациенту;
(iii) облучение целевой интересующей области внутри тела пациента соответствующим сенсибилизирующим излучением, причем пациента помещают в магнитное поле спектрометра MRI и проводят непрерывную MR томографию;
(iv) создание единичного или множества последовательных BOLD MR изображений, взвешенных по T2*, во время и/или после облучения (время t);
(v) обработку данных, созданных за время t0 и время t, и создание карты различий с цветовой кодировкой или относительных количеств на попиксельной основе; и
(vi) анализ обработанных данных при помощи отображения композитного изображения, полученного наложением карты, созданной в (v), на изображение, созданное в (i).
Лечебное воздействие предпочтительно представляет собой PDT.
Краткое описание чертежей
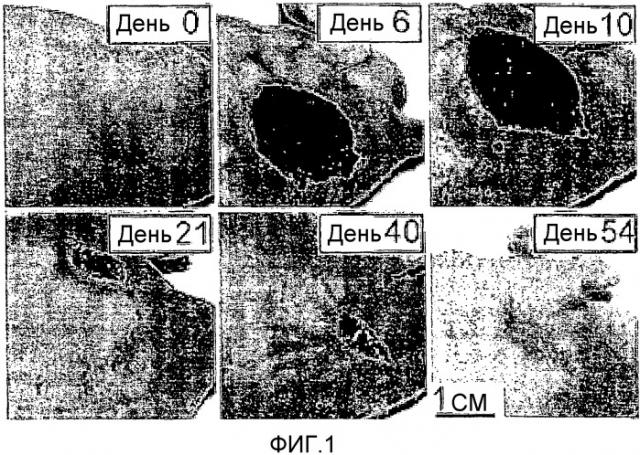
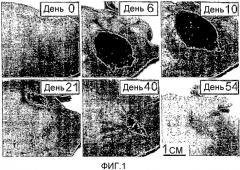
На Фиг.1 показаны фотографии меланомы M2R мыши, показывающие видимое наблюдение опухоли до и после Pd-Bpheid PDT. Мышь, имеющую ксенотрансплантат (8 мм) s.c. меланомы M2R, обрабатывали Pd-Bpheid (5 мг/кг, i.v.) и светом (763 нм, 102 Дж/см2) в течение 10 мин. Фотографии делали перед (нулевой день) и вплоть до 54 дня после обработки, когда мышь считалась излеченной. В области опухоли можно наблюдать тяжелое некротическое повреждение (дни 6 и 10) с последующим восстановлением (дни 21 и 40) и излечением (день 54).
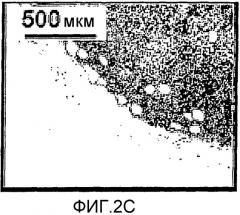
Фиг.2А-2F представляют собой фотографии, показывающие иммуногистохимию (IHC-2D, 2E, 2F) меланомы M2R мыши после Pd-Bpheid PDT. Опухоли препарировали через час после PDT, фиксировали и готовили для IHC. Положительное иммунное окрашивание 4-гидроксиноненалом (HNE) белковых продуктов присоединения, образованных в результате перекисного окисления липидов (ПОЛ) на участках опухоли (окрашенные в коричневый цвет, указывающие на ПОЛ), обнаружили после PDT (2D, 2F), но было негативным в контроле со светом (2Е). Фиг.2А, 2В и 2С (параллельные смежные секции для 2D, 2Е и 2F, соответственно) покрасили гематоксилин-эозином. Можно заметить, что на фотографиях с сильным увеличением жизнеспособных областей фотодинамически обработанной опухоли (2А, 2D, ×400) HNE ограничен поверхностью кровь/сосуд, в то время как в контрольной опухоли со светом (2В, 2Е) HNE не обнаружен. В фотодинамически обработанной опухоли при малом увеличении (2С, 2F, ×100) можно наблюдать распространенное ПОЛ, обусловленное PDT, в крупных сосудах на краю опухоли. Положительное окрашивание HNE также наблюдается в спонтанном некротическом ядре опухоли (не зависимо от PDT). КВ: кровеносный сосуд, ЖКО: жизнеспособный край опухоли, NEC: некроз.
На Фиг.3А-3G показано, что Pd-Bpheid PDT вызывает гемодинамические изменения. При помощи интравитальной микроскопии (ИВМ) был проведен мониторинг гемодинамических параметров мочки уха мыши. Кровеносные сосуды пометили TRICT-декстраном у (3А) обработанных PDT животных и контрольных животных со светом (3В). Изображения брали в указанных временных точках, соответствующих началу освещения. Поток красных кровяных телец (RBC) измеряли при помощи видеомикроскопии после i.v. введения ˜1% 4-Di-10-ASP, ex vivo окрашенных RBO, полученных из мыши-донора. Поток RBC измерили у животных, обработанных PDT (3С, n=5), и контрольных животных со светом (3D, n=3). Диаметр кровеносных сосудов был численно измерен из изображений, подобных 3А, 3В, у животных, обработанных PDT (3Е, n=6), и контрольных животных со светом (3F, n=4). Результаты представлены в виде % от исходного диаметра. Незаштрихованные и заштрихованные кружки представляют собой потоки RBC и диаметры сосудов, как, например, измеренные в артериях и венах соответственно. На Фиг.3G показана утечка TRICT-декстрана вне сосудов, численно измеренная из данных, как, например, на 3А и 3В. Незаштрихованные треугольники: PDT (n=6), заштрихованные треугольники: контроль со светом (n=4). Результаты представляют собой нормализованную утечку макромолекул (% начальной средней интенсивности пикселя).
На Фиг.4А-4С показано фотохимическое уменьшение sPO2, зарегистрированного в человеческой крови с использованием Pd-Bpheid (100 мкг/мл) и света (170 мВт/см2). (4А) Спектроскопически: без (заштрихованные кружки, только свет) или с Pd-Bpheid (незаштрихованные кружки, свет и Pd-Bpheid). Для предоставления возможности проведения спектроскопических измерений sPO2 свет был разделен 10×(1 мин света и 40 сек темноты) для обеспечения 8 повторяющихся 5-ти сек считываний. Серые и белые области представляют собой светлые и темные периоды времени, соответственно. (4В, 4С) MRI, взвешенная по Т2*: кровь фотосенсибилизировали в течение 1 мин (Р1, дубликат) и 5 мин (Р5, дубликат), соответственно, и образцы размещали отдельно для того, чтобы минимизировать влияние неоднородности поля. НО, необработанная кровь; КС, контроль со светом (5 мин); КБС контроль без света (дубликат); N2 обескислороженная кровь (при помощи N2 уравновешивания). Вышеуказанные эксперименты повторяли 3 раза. На Фиг.4А, 4В показаны репрезентативные эксперименты. Фиг.4С представляет собой среднее значение интенсивности сигнала (ИС)±SEM (n=3).
Фиг.5А-5Е представляют собой фотографии, показывающие оперативный контраст BOLD-MRI для Pd-Bpheid-PDT мыши, имеющей меланому M2R. Фиг.5А представляет собой фотографию, показывающую набор заданных значений эксперимента для удаленного введения Pd-Bpheid и освещения опухоли мыши внутри магнита. Фиг.5В-5Е представляют собой MR изображения: 5В, 5С-5DT, 5D, 5E - контроль со светом. (5В, 5D) анатомические изображения (до PDT, GE), показывающие локализацию (T) опухоли и направление сенсибилизирующего пучка света (желтая стрелка), (М) неосвещенной мышцы. (5С, 5Е) карты интенсивности MR сигналов контраста BOLD, наложенные на соответствующие анатомические изображения, в указанных временных точках (мин) относительно начала освещения. Карты с цветовой кодировкой представляют собой логарифмическое отношение интенсивности сигнала к начальному уровню. Отмечено, что уменьшение интенсивности сигнала при освещении мыши, обработанной Pd-Bpheid (5С +4, +6 мин), ограничено исключительно освещенной зоной опухоли, в то время как в отсутствие Pd-Bpheid (5Е) или света (неосвещенная мышца, отмеченная М) контраст не возникает. Показанное представляет собой репрезентативные эксперименты (PDT: n=6, контроль со светом: n=4).
Фиг.6А-6Е представляют собой графики, показывающие кинетики изменений в двух параметрах MRI контраста BOLD (ИС и ΔR2*) во время Pd-Bpheid-PDT. (6А-6С) Вычислили нормализованную интенсивность сигнала (% от начального уровня при t0±S.E.M.) двух интересующих областей: опухоли и неосвещенной контрольной мышцы, как указано на Фиг.5 (Т и М, соответственно). (6А): PDT (n=6), (6B): контроль со светом (n=4) и (6С): контроль без света (n=4). (6D, 6E) ΔR2* отражает изменения в оксигенации крови и является независимой от влияний потока. Карты R2* были получены при помощи взвешенной линейной регрессии ln(ИС) из данных, полученных с использованием мульти эха градиентного эха (MEGE). Быстрое увеличение ΔR2* при введении лекарства и освещении (6D) коррелирует с уменьшением в ИС (6E) в опухоли (n=4). Значимые изменения в ИС или ΔR2* не наблюдались у контрольных мышей со светом (n=4). (6D) и (6Е) представляют собой репрезентативные данные той же самой мыши.
Осуществление изобретения
PDT сосудов основана на внутривенном введении светочувствительного лекарства и немедленном освещении опухоли. Образование in-suti цитотоксических ROS с последующим фотопотреблением О2 (внутри вторых) приводит к гемодинамическим изменениям, перекрытию сосудов (минуты), некрозу и уничтожению опухоли (дни-недели). Эффект BOLD, создаваемый парамагнитным дезоксигемоглобином, формирует основу для функциональной MRI, традиционно используемой при получении нейроизображения.
Настоящее изобретение основано на том факте, что внутрисосудистая фотосенсибилизация, ведущая к фотопотреблению О2 в курсе PDT, создает измеряемый сигнал BOLD. Используя Pd-Bpheid в качестве сенсибилизатора, в данном описании согласно настоящему изобретению продемонстрировано абсолютное, мгновенное, зависящее от света увеличение (25-40%) в интенсивности MR сигнала во время PDT у ксенотрансплантатов меланомы M2R мыши. Результаты независимо подтверждены при помощи ИВМ и IHC. Эти результаты указывают, что BOLD-MRI является применимым для клинического мониторинга процесса разрушения опухоли при помощи PDT в реальном масштабе времени так же, как для управляемой подачи света в PDT или при других лечебных воздействиях.
Таким образом, в одном из аспектов, настоящее изобретение относится к оперативному способу BOLD-MRI для функционального клинического управления или мониторинга и последующего наблюдения за ходом лечения лечебного воздействия, включающего в себя лечение сенсибилизатором, который при возбуждении соответствующим сенсибилизирующим излучением вызывает локальное потребление или истощение кислорода, причем указанный способ содержит:
(i) создание BOLD взвешенного MR изображения целевой интересующей области внутри тела пациента (время t0);
(ii) введение указанного сенсибилизатора пациенту;
(iii) облучение целевой интересующей области внутри тела пациента соответствующим сенсибилизирующим излучением, причем пациента помещают в магнитное поле спектрометра MRI и проводят непрерывную MR томографию;
(iv) создание единичного или множества последовательных BOLD MR изображений, взвешенных по T2*, во время и/или после облучения (время t);
(v) обработку данных, созданных за время t0 и время t, и создание карты различий с цветовой кодировкой или относительных количеств на попиксельной основе; и
(vi) анализ обработанных данных при помощи отображения композитного изображения, полученного наложением карты, созданной в (v), на изображение, созданное в (i).
Как используется в настоящем описании, термин "сенсибилизатор" означает агент, переносимый кровью, или внутритканевой возбуждаемый электромагнитным излучением агент, который при возбуждении соответствующим излучением инициирует локальное потребление или истощение кислорода. Согласно настоящему изобретению, изменения в контрасте BOLD-MRI создаются посредством фотопотребления кислорода, являющегося результатом зависящего от сенсибилизатора/облучения in-situ продуцирования цитотоксических реактивных кислородных агентов (ROS), и/или посредством гемодинамических изменений, являющихся результатом поражения сосудов, вызванного указанными ROS, образуемыми возбужденным сенсибилизатором в интересующей области. Потребление кислорода и/или гемодинамическое поражение приводит в результате к изменению содержания парамагнитного дезоксигемоглобина, ведущего к изменениям в контрасте BOLD.
Любое лечебное воздействие, включающее в себя лечение сенсибилизатором, известное сегодня или которое может быть открыто в будущем, может быть использовано согласно настоящему изобретению. В наиболее предпочтительном варианте осуществления, лечебное воздействие представляет собой фотодинамическую терапию (PDT). В другом варианте осуществления, лечебное воздействие представляет собой PDT на основе рентгеновского излучения (Kokotov и др., 1994).
Согласно настоящему изобретению, лечебное воздействие, включающее в себя лечение сенсибилизатором, предпочтительно применяют при заболевании или нарушении, излечиваемом сенсибилизатором при помощи локальной эмболизации или реканализации.
Термин "заболевание или нарушение, излечиваемое локальной эмболизацией", означает заболевание или нарушение, излечиваемое при помощи терапевтического введения вещества в кровеносный сосуд с целью его закупорки. Такие заболевания или нарушения могут быть злокачественными заболеваниями, такими как солидные опухоли, иллюстрированные, но не в качестве ограничения, раком груди, простаты, почки, толстой кишки, легкого, желудка, желчного пузыря, матки, шейки матки, яичника, пищевода, мозга или кожи. В предпочтительных вариантах осуществления изобретения злокачественные заболевания представляют собой рак простаты, почки, груди и кожи.
Заболевание или нарушение, излечиваемое при помощи локальной эмболизации, также может быть незлокачественным заболеванием, таким как, но не в качестве ограничения, псориаз, ревматоидный артрит, доброкачественная гиперплазия простаты, доброкачественная мезотелиома, менорагия, актинический кератоз (предраковое заболевание, которое в 20% случаях развивается в чешуйчатую клеточную карциному) или офтальмологическое заболевание или нарушение, в частности возрастная дистрофия желтого пятна (AMD).
Термин "заболевание или нарушение, излечиваемое при помощи локальной реканализации", означает лечение, приводящее к фотодинамическому восстановлению ранее закупоренных сосудов. Примерами являются сердечно-сосудистые заболевания, такие как, но не в качестве ограничения, рестеноз после ангиопластики или атеросклероз.
Термин "интересующая область" представляет собой часть внутри тела пациента, предназначенную для лечения при помощи лечебного воздействия, например PDT. Например, интересующая область может быть областью опухоли в случае рака, пятном в случае возрастной дистрофии желтого пятна и участком при рестенозе.
В одном из предпочтительных вариантов осуществления настоящего изобретения сенсибилизатор, используемый в PDT, представляет собой фотоактивный краситель (в настоящем описании "фотосенсибилизатор"), возбуждаемый электромагнитным излучением, выбранным из группы, содержащей видимый, инфракрасный, ближний инфракрасный и ультрафиолетовый свет (УФ). В другом варианте осуществления сенсибилизатор представляет собой фотосенсибилизатор, непосредственно или опосредованно возбуждаемый ионизирующим излучением, например рентгеновским излучением.
В одном из вариантов настоящего изобретения фотосенсибилизатор представляет собой фотоактивный краситель, используемый в PDT, который при возбуждении УФ, видимым, инфракрасным или ближним инфракрасным светом катализирует фотопревращение кислорода в локальные цитотоксические ROS.
Способ настоящего изобретения охватывает любой сенсибилизатор, известный сегодня или разрабатываемый, или который может быть открыт в будущем, для использования в PDT. Примеры таких фотосенсибилизаторов включают в себя порфириновые производные, но не в качестве ограничения, такие как Фотофрин® (порфимер натрия, QLT Therapeutics) Foscan® (темопорфин, Biolitech Pharma Ltd.), Levulan® (ALA, 5-аминолевулиновая кислота и ее производные), Optrin® (Lutex, лутетиум тексафирин), Талапорфин (тапорфин натрия), Визудин® (BPD, вертепорфин, QLT Therapeutics) и другие производные Chl и Bchl, включающие в себя металлзамещенные производные Chl и Bchl, описанные для клинического использования в терапии и диагностике опухолей при помощи PDT, такие как, но не в качестве ограничения, производные Chl и Bchl, описанные в US 5726169; US 5955585; US 6147195; EP 0584552; WO 97/19081; WO 00/33833; WO 01/40232 и заявке на патент Израиля №152900, все патенты и заявки включены в данное описание во всей своей полноте в качестве ссылки, как если бы они полностью были раскрыты в данном описании.
В одном из предпочтительных вариантов настоящего изобретения фотосенсибилизатор представляет собой производное Bchl. В одном из наиболее предпочтительных вариантов осуществления фотосенсибилизатор представляет собой палладий-бактериофеофорбид (Pd-Bpheid) (Tookad®, Steba Biotech, Франция). В другом предпочтительном варианте осуществления, фотосенсибилизатор представляет собой водорастворимую соль палладий 31-оксо-15-метоксикарбонилметил-родобактериохлорин 131-(2-сульфоэтил)амид калия, описанную в заявке на патент Израиля №152900.
В еще одном варианте осуществления настоящего изобретения сенсибилизатор представляет собой один из тех, которые являются опосредованно возбудимыми рентгеновским излучением или другим ионизирующим излучением. Одним из примеров такого сенсибилизатора является супрамолекулярный ансамбль, состоящий из вододисперсного полистиролового латекса со встроенным сцинтилляционным соединением, 2,5-дифенилоксазолем и внешне прикрепленным гематопорфирином, описанным Kokotov и др., 1994.
Сенсибилизатор может быть введен пациенту интерстициально или, более предпочтительно, внутривенно. В некоторых случаях, с целью особой эффективности или безопасности, сенсибилизатор может быть введен локально при помощи инъекции или топического введения. Например, при рестенозе после ангиоплазии сенсибилизатор может быть введен внутрисосудистым способом, выше по потоку, смежно к участку лечения, обеспечивая более высокую локальную концентрацию сенсибилизатора. Для достижения фотодинамической активности процедура проводится при соответствующем внутрисосудистом освещении/облучении через оптическое волокно.
Как упоминалось в разделе Уровень техники, MRI с контрастом BOLD применяют предварительно при исследованиях рака для мониторинга реакций опухоли на вазомодуляторы, но впервые такое изменение в контрасте BOLD, полученном при помощи фотопотребления кислорода и последующих гемодинамических эффектов, создаваемых сенсибилизатором, возбуждаемым электромагнитным излучением, является применимым в реальном масштабе времени для клинического мониторинга/управления лечебным воздействием, таким как PDT.
Фотосенсибилизаторы, используемые в PDT опухолей, могут аккумулироваться в клетках опухоли и при облучении приводить к разрушению опухоли, или они могут присутствовать в кровеносных сосудах или интерстициальных тканях вокруг опухоли и при облучении приводить к нарушению, которое ведет к некрозу, сокращению и уничтожению опухоли. Согласно настоящему изобретению фотосенсибилизатор является одним из тех, которые являются сенсибилизированными, пока находятся в кровеносном сосуде или интерстициальных тканях.
При лечении офтальмологических заболеваний, вызванных неоваскуляризацией, таких как возрастная дистрофия желтого пятна - одной из ведущих причин слепоты в промышленно развитых странах, PDT предоставляет возможность закупорки неоваскулярных сосудов, используя фотохимические механизмы. Фотоактивный краситель, возбуждаемый светом низкой интенсивности, вводят пациенту, и целевую область глаза облучают на пике абсорбции красителя. Механизм воздействия заключается в образовании in suti ROS в сопровождении или последующими фотохимическими реакциями, включающими в себя перекисное окисление липидов в мембранах эндотелиальных клеток, которые вызывают адгезию и агрегацию.
Как используется в данном описании, термин "функциональное клиническое управление" означает интерактивное использование информации, полученной оперативным способом BOLD-MRI для точной подачи облучения на интересующую целевую область, например больную область, внутри тела пациента. Следовательно, такие данные могут быть использованы для мониторинга и последующего наблюдения за ходом лечения.
Изменения в контрасте BOLD-MRI относятся к изменениям между интенсивностью основного MR сигнала в изображениях, полученных до лечения, и интенсивностью MR сигнала в изображениях, полученных в дискретных временных точках во время и/или в конце лечения. С этой целью согласно стандартным MRI техникам BOLD взвешенное анатомическое MR изображение интересующей области внутри тела пациента создается перед введением сенсибилизатора пациенту (t0), причем это базовое изображение показывает локализацию опухоли. После введения сенсибилизатора и последующего облучения больной области, содержащей опухоль, создают одно или множество последовательных BOLD MR изображений, взвешенных по T2*, во время и/или после облучения (время t), например, на 4 или 6 мин, или на 5, 10, 15 и 20 мин, относительно начала облучения (время t). Данные, сгенерированные во время t0 и время t, обрабатывают, таким образом создавая карту различий с цветовой кодировкой или относительных количеств на попиксельной основе. Анализ обработанных данных получают путем наложения карты с цветовой кодировкой, созданной при помощи обработанных данных, на изображение, созданное во время t0, таким образом отображая композитное изображение, которое может предоставить руководство врачу, проводящему PDT. В композитном изображении области, показывающие эффект контраста BOLD вследствие PDT терапии (обозначенные при помощи цветовой кодировки, например, красные), будут совпадать с областью опухоли.
В одном из вариантов настоящего изобретения оперативный способ BOLD-MRI может быть выполнен во время проведения операции для оценки в реальном масштабе времени реакции опухоли на PDT, например во время операции опухоли мозга.
В другом аспекте настоящего изобретения, оперативный способ BOLD-MRI выполняется для функционального клинического управления PDT для получения изображения до лечения интересующей области для терапевтического лечения. В этом случае сенсибилизатор является нецитотоксическим или является цитотоксическим агентом, используемым в нетерапевтической не разрушающей дозе, такой как для образования минимально деструктивных или токсических условий в интересующей области. С этой целью сенсибилизатор может быть конъюгирован с макромолекулярным носителем, предпочтительно физиологически инертным высокомолекулярным соединением, таким как полиаминокислота или полисахарид, таким образом, сенсибилизатор становится неспособным к проникновению в клетку.
Согласно такому аспекту настоящее изобретение предоставляет способ BOLD-MRI для оперативного получения изображения больной области внутри тела пациента для функционального клинического управления, предшествующего терапевтическому лечению заболевания или нарушения, излечиваемого при помощи локальной эмболизации или реканализации, причем указанное лечение включает в себя переносимый кровью или внутритканевой агент, возбуждаемый электромагнитным излучением (в настоящем описании обозначаемый "сенсибилизатор"), который при возбуждении соответствующим излучением инициирует локальное потребление или истощение кислорода, который состоит из введения пациенту, которому проводят непрерывную MR томографию, в то время как пациент размещен в магнитном поле спектрометра MRI, нетерапевтической, ниже токсичной дозы указанного сенсибилизатора, облучения целевой больной области соответствующим сенсибилизирующим излучением и анализа изменений в контрасте BOLD-MRI, созданных путем потребления кислорода в ответ на возбуждение сенсибилизатора в больной области, путем сравнения с MR изображением больной области, созданным до введения сенсибилизатора.
Настоящее изобретение дополнительно предоставляет способ BOLD-MRI для оперативного получения изображения больной области тела в ходе терапевтического лечения болезни или нарушения, излечиваемого при помощи локальной эмболизации или реканализации, причем указанное лечение включает в себя переносимый кровью или внутритканевой агент, возбуждаемый электромагнитным излучением (в настоящем описании обозначаемый "сенсибилизатор"), который при возбуждении соответствующим излучением инициирует локальное потребление или истощение кислорода, который состоит из введения пациенту, которому проводят непрерывную MR томографию, в то время как пациент размещен в магнитном поле спектрометра MRI, терапевтической дозы указанного сенсибилизатора, облучения целевой больной области соответствующим сенсибилизирующим излучением и анализа изменений в BOLD-MRI контрасте, созданных путем потребления кислорода в ответ на возбуждение сенсибилизатора в больной области, путем сравнения с MR изображением больной области, созданным до введения сенсибилизатора.
Настоящее изобретение ниже проиллюстрировано при помощи не ограничивающих примеров и чертежей.
Примеры
Материалы и способы
(i) Животные, модель опухоли и PDT. "Голым" CD1 самцам мыши (30 г±2 г) имплантировали s.c. ксенотрансплантаты меланомы M2R. Провели PDT анестезированных мышей на опухолях (7-9 мм в диаметре), как описано выше (Zilberstein и др., 2001), с небольшими изменениями, для того чтобы предоставить возможность для манипулирования внутри магнита во время записи MRI, или для выполнения PDT на анестезированных мышах, размещенных на столике микроскопа во время ИВМ. За внутривенным (i.v.) введением Pd-Bpheid (5 мг/кг в носителе, предоставленным Negma-Lerads Laboratoires, Toussus Le-Nooble, Франция) сразу последовало освещение опухоли через оптическое волокно (световое пятно ⊘=1 см2, 763 нм, 102 Дж/см2) в течение 10 минут с использованием 1 Вт диодного лазера (CeramOptec GmbH, Bonn, Германия). Эксперименты проводили внутри магнита во время записи MRI (подробности указаны ниже). Комнатную температуру поддерживали постоянной (28°С) на протяжении всех экспериментов.
При таких условиях промежуточная температура кожи или опухоли (определяемая термометром) не увеличивалась более чем на 1С°. PDT выполнили в трех режимах: (i) для лечения опухоли после i.v. введения Pd-Bpheid немедленно следовало чрескожное освещение; (ii) для MR томографии введение Pd-Bpheid (при помощи удаленно активируемого i.v. зондирования) и чрескожное освещение проводили внутри магнита (Фиг.5А); и (iii) для ИВМ введение Pd-Bpheid и освещение полупрозрачного уха мыши проводили на столике микроскопа.
Контроли: Контроль со светом: освещение опухоли у мыши, в которую ввели только носитель (без фотосенсибилизатора). Контроль без света: мышам, имеющим опухоль, ввели Pd-Bpheid без освещения. Мыши были подвергнуты эвтаназии (СО2) для извлечения опухолевого накопления, когда опухоли достигли ≥10% веса тела. Все эксперименты проводились согласно установленным правилам содержания животных.
(ii) MRI эксперименты.
(а) Градиентное эхо (GE) и мульти-эхо градиентного эха (MEGE) MR изображений получили на горизонтальном 4,7 Е Bruker Biospec спектрометре (Rheinstetten, Германия), как описано ранее (Gilead и др., 1999). Параметры томографии были следующими: толщина слоя 0,8 мм, TR (время релаксации) 230 мсек, ТЕ (время эха) 10 мсек для GE и ТЕ 10, 21, 24 и 32, 48 мсек для MEGE, угол поворота 40°, время обследования (AQ) 117 сек, матрица 256×256 пикселей.
(b) Изучение животных: катушку возбуждения для всего тела и РЧ развязанную 1,5 см поверхностную катушку использовали для улучшения соотношения сигнал/шум (поле зрения 4 см, толщина слоя 0,8 мм). Мышей анестезировали, зондировали и связали при помощи клейкой ленты (на спине/на боку) для размещения опухоли над центром поверхностной катушки MRI; оптическое волокно лазера зафиксировали на месте для освещения области опухоли (Фиг.5А). После того как были получены четыре последовательных изображения провели курс лечения мышей i.v. Pd-Bpheid (5 мг/кг) последующим освещением в течение 10 мин, с одновременным получением 11 дополнительных изображений. Комнатную температуру поддерживали при 28°С.
(с) измерения ex-vivo: Свежесобранную человеческую кровь перемешали в цитрате натрия и ресуспендировали в плазме того же человека с 0,6-0,7 гематокрита для минимизации осаждения красных кровяных телец (RBC) во время экспериментов MRI. Образцы крови (500 мкл) поместили в стеклянные пробирки 6×50 мм (Kimble, Div of Owens, IL, США), запечатанные в атмосфере N2, и каждую поместили в 3,5 мл оптическую пластиковую кювету, содержащую 2 мл PBS. Использовали протонную объемную катушку (поле зрения 7 см, толщина слоя 2 мм, данные заносились в матрицу 512×512). Данные проанализировали как среднюю интенсивность сигнала образца крови относительно окружающей солевой смеси, забуференной фосфатом (PBS).
(d) Анализ данных: данные MRI проанализировали, используя Matlab (The Math Works Inc., Natick, Ma, США), Orisis (версия 4.0.9, Geneva, Швейцария) и Paravision 2.1.1 (Bruker, Rheinstetten, Германия). Интенсивность MR сигналов получили из каждого изображения либо из интересующей области внутри опухоли, либо в контрольной ткани и нормализовали по первому изображению. Карты откликов создали при помощи деления каждого изображения на среднее значение первых 2 изображений до PDT. Карты R2* получили при помощи взвешенной по шуму линейной регрессии log(ИС) для каждого пикселя. Проанализировали только пиксели с аппроксимацией R2≥0,36. R2*: параметр релаксации MRI; R2: параметр статистической корреляции.
(iii) Иммуногистохимия (IHC): Гистологические и иммуногистологические обследования использовали для подтверждения результатов, полученных во время PDT экспериментов, проводимых при помощи MRI и ИВМ. Препарированные опухоли зафиксировали в параформальдегиде и залили парафином. IHC ПОЛ, индуцированное PDT, было основано на иммуноопределении HNE (4-гидроксиноненал), продукт перокисления альдегида полиненасыщенных жирных кислот, которые образуют ковалентные связи с белками путем восстановительного аминирования и/или присоединения по типу Михаэля (Uchida и др., 1995). Области, поврежденные PDT, визуализировали при помощи IHC с анти-HNE. Таким образ