Мутеины плацентарного фактора роста 1 типа, способ их получения и применение
Иллюстрации
Показать всеИзобретение относится к генной инженерии, конкретно к получению мутеинов плацентарного фактора роста 1-го типа (PLGF-1), и может быть использовано в медицине. Мутеин мономерной формы PLGF-1 человека включает замену или удаление в полипептидной последовательности белка дикого типа одного остатка цистеина (Cys) в положении 142 полипептидной последовательности белка-предшественника с целью предотвращения мультимеризации данной мономерной формы. Изобретение позволяет получить химически стабильные мутеины PLGF-1 и эффективно применить их для диагностики и лечения онкологических и неонкологических патологий. 16 н. и 28 з.п. ф-лы, 7 ил., 2 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение касается стабильных мутеинов плацентарного фактора роста 1-го типа (PLGF-1), их получения, терапевтического и косметического применения и фармацевтических и косметических композиций, содержащих данные производные. Изобретение также касается получения антител к данным производным и их применения при диагностике и лечении онкологических и неонкологических патологий.
Уровень техники
Плацентарный фактор роста 1 типа (PLGF-1) представляет собой ангиогенный гомодимерный гликопротеин. Ангиогенная активность относится к димерной форме, так как мономерная форма не активна. Полная полинуклеотидная последовательность, кодирующая белок PLGF-1, вместе с его полипетидной последовательностью, были описаны Maglione и Persico в патенте ЕР-В-0 550 519 (WO-A-92/06194).
В этом патенте описан способ получения PLGF-1 в бактериях, модифицированных при помощи индуцибельной системы экспрессии, причем данный способ включает после индукции лизис бактерий и прямую экстракцию неочищенного белка из лизата. Белок, полученный таким способом, проявляет низкий уровень биологической активности.
Способ экстракции и очистки сырого плацентарного фактора, полученного путем экспрессии в бактериях, описан Maglione et al. в патентной заявке PCT/IT02/00065. Способ включает ряд операций экстракции, ренатурации и очистки, что в целом дает возможность получить чистый белок преимущественно в форме димера, т.е., иными словами, в его наиболее активной форме. В самом деле, известно, что мономерная форма белка биологически неактивна и приобретает ангиогенные функции только после ренатурации в димерную форму.
Однако авторы настоящего изобретения заметили, что белок в форме димера частично неустойчив и при хранении или обработке в водном растворе образует мультимерные формы, обладающие меньшей биологической активностью и по этой причине менее пригодные для терапевтического применения вследствие неопределенности доз и биологической активности.
Целью настоящего изобретения, таким образом, является решение проблемы недостаточной химической/биологической стабильности PLGF-1, которая в основном наблюдается при хранении его в водных растворах.
Раскрытие изобретения
Изобретение основывается на неожиданном открытии того, что производные природного белка PLGF-1 с модификациями в полипептидной последовательности, в частности включающими замену или удаление, по меньшей мере, одного остатка цистеина, проявляют значительное повышение химической стабильности, сохраняя при этом исходную биологическую активность в сущности неизменной. В свете этого открытия первый объект заявки представлен мутеином мономерной формы плацентарного фактора 1 типа (PLGF-1) человека или животных, включающим замену или удаление по меньшей мере одного из девяти остатков цистеина (Cys), содержащихся в полипетидной последовательности белка дикого типа. Такая замена или удаление не влияет на процесс димеризации, необходимый для получения белка в биологически активной форме, но предотвращает мультимеризацию мономерной формы.
Было замечено, что из различных остатков цистеина особенно эффективно удаление или замена остатка, находящегося в С-концевой части, особенно в положении 142 в полной полипептидной последовательности, то есть включающей и зрелый белок PLGF-1, и соответствующий сигнальный пептид. В предпочтительном воплощении изобретения остаток цистеина в положении 142 замещен остатком глицина (Gly). При такой замене образуется мутеин мономерной формы PLGF-1, обладающий неизмененной способностью к димеризации, но практически не способный к образованию мультимерных продуктов. Наряду с модификациями, описанными выше, мутеины согласно настоящему изобретению могут содержать и другие удаления, замены или добавления одной или нескольких аминокислот белка дикого типа, при условии что такие модификации не изменяют функциональные характеристики самого мутеина.
Второй объект изобретения, таким образом, представлен мутеином фактора PLGF-1 в форме димера, предпочтительно очищенный таким образом, чтобы он содержал только димер. Данный мутеин может равным образом быть зрелым белком или белком-предшественником, включающим сигнальный пептид в N-концевой части.
Следующим предметом изобретения является нуклеотидная последовательность, включающая ДНК, кодирующую рассматриваемый мутеин. Последовательность характеризуется тем, что кодон TGC или TGT, кодирующий аминокислоту цистеин в природной последовательности PLGF-1, удален или модифицирован. В предпочтительном воплощении изобретения кодон, соответствующий цистеину, заменен кодовом GGC, GGT, GGA или GGG - все они кодируют аминокислоту глицин (Gly). Предпочтительно для создания кодона GGC основание тимидин (Т) в положении 382 (кодон TGC) в последовательности SEQ ID NO:1 заменяют основанием гуанозин (G).
Следующим предметом изобретения является система экспрессии, включающая нуклеотидную последовательность, указанную выше, которая фланкирована нетранслируемыми последовательностями, контролирующими и регулирующими экспрессию. Эта система может быть индуцирована в прокариотических клетках, предпочтительно бактериальных клетках.
Экспрессия находится под контролем индуцибельного промотора и может быть индуцирована при помощи соответствующих соединений. Клетки-хозяева, модифицированные с помощью данной системы экспрессии, также являются объектом изобретения. Они представлены прокариотическими клетками, предпочтительно клетками бактерий, таких как Е. coli. Изобретение также охватывает способы получения нуклеотидной последовательности, в которых кодирующую мутеин ДНК получают методом полимеразной цепной реакции (ПЦР), используя в качестве праймеров олигонуклеотиды, модифицированные соответствующим образом относительно последовательности белка дикого типа. Предпочтительно в качестве 5'-3' прямого праймера применяется олигонуклеотид SEQ ID NO:3, а в качестве 5'-3' обратного праймера применяется олигонуклеотид SEQ ID NO:4.
Следующим объектом изобретения является способ получения и экстрагирования мутеина, в котором клетки-хозяева, предпочтительно бактериальные, модифицированные с помощью системы экспрессии согласно изобретению, культивируют в подходящей культуральной среде, индуцируют экспрессию белка соответствующим индуктором, выделяют и лизируют клетки и экстрагируют мутеин из лизата. На стадии ферментации и перед стадией индукции экспрессии клетки культивируют до достижения высокой оптической плотности (O.D.) культуральной среды. После этого индуцируют экспрессию белка добавлением соответствующих индуцирующих агентов. На последующих стадиях клетки лизируют для высвобождения внутриклеточного материала в культуральную среду, а именно: нуклеинового материала и телец включения, причем последние солюбилизируют и полученный при этом белок подвергают ренатурации в димерную форму. Процесс экстракции и очистки может включать дополнительные необязательные стадии для очистки димерного белка. В предпочтительном воплощении процесс включает по меньшей мере еще одну дополнительную стадию очистки методом ионообменной или обращенно фазовой хроматографии. В другом воплощении процесс включает первоначальную очистку методом анионообменной хроматографии с последующей очисткой методом обращенно фазовой хроматографии.
Мутеин, полученный при помощи способа продукции, экстракции и очистки согласно изобретению, содержит не менее 98,5% активного белка и не более 1,5% мономерной формы. Активная форма в основном состоит из димерной формы и содержит только следовые количества мультимерной формы. Тесты на стабильность подтверждают высокую стабильность при хранении и во время обработки, что типично для мутеина в димерной форме.
Краткое описание фигур
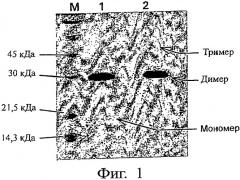
На Фиг.1 представлен электрофоретический профиль PLGF-1CG, полученный методом SDS-PAGE, после ресуспендирования в физрастворе при концентрации 20 мг/мл и хранения при 4-8°С в течение 40 дней. Этот профиль сравнивается с профилем мутеина сразу после солюбилизации.
Обозначения: (М) - маркеры молекулярного веса; (1) - PLGF-1CG (3 мкг), солюбилизированный при концентрации 20 мг/мл и замороженный (контроль); (2) - PLGF-1CG (3 мкг), солюбилизированный в физрастворе при концентрации 20 мг/мл и хранившийся при 4-8°С в течение 40 дней.
На Фиг.2 представлены данные из табл. 2, выраженные в виде графика.
На Фиг.3 представлен электрофоретический профиль, полученный методом SDS-PAGE, мутеина PLGF-1CG, солюбилизированного в геле Карбопол при 0,2 мг/мл и хранившегося при 4-8°С в течение 170 дней. Обозначения: (М) - маркеры молекулярного веса; (1) - PLGF-1CG (2 мкг), солюбилизированный в геле Карбопол при концентрации 0,2 мг/мл и хранившийся при 4-8°С в течение 170 дней; (2) - PLGF-1CG (2 мкг), солюбилизированный в геле Карбопол при концентрации 0,2 мг/мл и замороженный (контроль).
На Фиг.4 представлен электрофоретический профиль, полученный методом SDS-PAGE, нативной формы PLGF-1CG, солюбилизированной в геле Карбопол при 0,2 мг/мл и хранившейся при 4-8°С в течение 150 дней. Обозначения: (М) - маркеры молекулярного веса; (1) - PLGF-1CG (2 мкг), солюбилизированный в геле Карбопол при концентрации 0,2 мг/мл и хранившийся при 4-8°С в течение 150 дней; (2) - PLGF-1CG (2 мкг), солюбилизированный в геле Карбопол при концентрации 0,2 мг/мл и замороженный (контроль).
На Фиг.5 представлена схема, иллюстрирующая процесс конструирования плазмиды pET3PLGF1CG, кодирующей мутеин PLGF-1, именуемый PLGF-1CG.
На Фиг.6 представлена ангиогенная активность PLGF-1 дикого типа и мутеина PLGF-1CG при возрастающих концентрациях. Активность основного фактора роста фибробластов bFGF приведена для сравнения.
На Фиг.7 представлен эффект мутеина PLGF-1CG на вызванное изопреналином ишемическое повреждение сердечной ткани у кроликов. На оси х приведена продолжительность обработки в днях, а величина AUC означает общую площадь под кривой, ограниченной количеством баллов ЭКГ за день. Перечень последовательностей:
SEQ ID NO:1 - нуклеотидная последовательность PLGF-1 дикого типа без сигнального пептида.
SEQ ID NO:2 - нуклеотидная последовательность природного PLGF-1. SEQ ID NO:3 - последовательность олигонуклеотида, используемого в качестве прямого праймера при ПЦР.
SEQ ID NO:4 - последовательность олигонуклеотида, используемого в качестве обратного праймера при ПЦР.
Осуществление изобретения
Полная последовательность полипептида фактора PLGF-1 человека, состоящая из 149 аминокислот, вместе с фрагментом кДНК из 1645 нуклеотидов, содержащим последовательность, кодирующую фактор PLGF-1, приведены в патенте ЕР-В-0 550 519. Находящаяся в свободном доступе плазмида, содержащая нуклеотидную последовательность из 1645 оснований, также депонирована в АТСС за номером 40892.
Последовательность, кодирующая белок-предшественник, заключается между положениями 322 и 768 и обозначается в данной заявке как SEQ ID NO:1.
PLGF-1 дикого типа в виде белка-предшественника представляет собой полипептид из 149 аминокислот, содержащий сигнальный пептид из 18 аминокислот в N-концевой части. Последовательность зрелого белка, заключенная между положениями 19 и 149, обозначается в данной заявке как SEQ ID NO:2. Данная последовательность содержит 9 остатков цистеина (Cys), находящихся в положениях 35, 60, 66, 69, 70, 77, 111, 113 и 125.
В мутеинах согласно изобретению, по меньшей мере, один из остатков цистеина удален или замещен другим остатком с одним единственным условием: чтобы мутация не оказывала заметного влияния на или не устраняла способности мутеина в мономерной форме к образованию биологически активной и терапевтически полезной димерной формы. Экспериментальные данные показывают, что удаляемый или замещаемый остаток должен предпочтительно находиться в С-концевой части белка и что оптимальным остатком для целей изобретения является остаток в положении 125.
Мутеины плацентарного фактора роста дикого типа могут быть получены путем синтеза известными в литературе методами синтеза полимеров. Однако предпочтительным методом является экспрессия белка в генетически модифицированных клетках-хозяевах. Для этой цели клетки трансформируют путем введения клонирующего и/или экспрессирующего вектора, содержащего вставку, соответствующую гену PLGF-1 после соответствующей модификации.
Получение ДНК, кодирующей мутенины по изобретению, проводится методом сайт-специфического мутагенеза и предполагает точковые мутации в кодонах, соответствующих цистеину, то есть в кодонах TGC или ТОТ. Эти мутации могут представлять собой делеции или замены одного или нескольких оснований без смещения рамки считывания вслед за мутацией. Таким образом, в случае делеции необходимо удалить весь кодон. Предпочтительно сайт-специфическая мутация представлена точковой заменой одного основания в кодоне цистеина с последующим образованием нового кодона. В этом смысле мутация приводит к замене остатка цистеина остатком другой аминокислоты.
Для получения кДНК, кодирующей требуемый мутеин, могут применяться различные известные методы сайт-специфического мутагенеза.
К методам, которые можно использовать, относятся, к примеру, мутагенез с помощью олигонуклеотидов (Adelman et al., "DNA" 2: 183, 1983), мутагенез с помощью ПЦР (Leung et al.. Technique 1: 11-15, 1989) или кассетный мутагенез (Wells et al., Gene 34: 315,1985).
В предпочтительном воплощении изобретения синтез мутантной ДНК проводится методом мутагенеза посредством полимеразной цепной реакции (ПЦР). В качестве матрицы для реакции ПЦР применяли ДНК, кодирующую фактор PLGF-1 дикого типа, описанную в литературе, или любые ее эквиваленты, являющиеся результатом вырожденности генетического кода. Предпочтительно используется только часть, кодирующая метионилированный в N-концевом положении белок вместе с или без сигнального пептида; к примеру, последовательность, приведенная в настоящей заявке как SEQ ID NO:1, или ее эквиваленты, заключенные в экспрессионный вектор pET3P1GF-l, что соответствует белку без сигнального пептида. В качестве праймеров для ПЦР использовали олигонуклеотид 5'-3' (прямой праймер), комплементарный участку, кодирующему N-концевую часть белка, и олигонуклеотид 5'-3' (обратный праймер), комплементарный участку последовательности, содержащему кодон цистеина, подлежащего мутированию. Обратный олигонуклеотид должен содержать замену основания или оснований, необходимых для введения требуемой мутации. Используемые праймеры могут в равной степени содержать дополнительные основания в 5'-концевых и в 3'-концевых участках для введения сайтов рестрикции, подходящих для выделения и очистки мутированной последовательности.
Кодон, соответствующий остатку цистеина, может быть замещен кодоном, кодирующим любую нейтральную аминокислоту, как полярную, типа Ser, Thr, Gin или Asn, так и неполярную, типа Gly, Ala, Val, He или Leu. Предпочтительными являются аминокислоты Gly или Ala.
В предпочтительном воплощении прямой праймер представлен последовательностью, приведенной в SEQ ID NO:3, тогда как обратный праймер представлен последовательностью SEQ ID NO:4. Последняя включает замену T→G в положении 382 последовательности SEQ ID NO:1, замену, которая трансформирует кодон TGC цистеина в положении 125 SEQ ID NO:4 в кодон GGC, соответствующий глицину.
Соответствующим образом модифицированную кДНК затем разрезают и вставляют в экспрессионный вектор под контролем подходящей индуцибельной системы, совместимой с клеткой-хозяином.
Предпочтительно используются индуцибельные экспрессионные системы, совместимые с прокариотическими клетками. Вот примеры таких систем:
экспрессионная система pBAD (Invitrogen BV), в которой синтез белка находится под контролем промотора araBAD и может быть индуцирован в различных штаммах Е. coli с помощью арабинозы;
экспрессионная система Т7 (Invitrogen BV или Promega), в которой синтез белка контролируется промотором РНК-полимеразы фага Т7 и может быть индуцирован с помощью лактозы, изопропил-β-D-тиогалактопиранозида (IPTG) либо их производных или функционально эквивалентных аналогов. В этом случае необходимо использовать производные Е. coli DES-типа, (В121 или JM109), то есть те, что содержат копию гена РНК-полимеразы фага Т7, находящегося под контролем индуцируемого лактозой промотора;
экспрессионная система Trc (Invitrogen BV), в которой синтез белка находится под контролем гибридного промотора trc. Этот промотор был получен слиянием промотора trp с промоторами lac и может быть индуцирован в различных штаммах E.coli с помощью лактозы или близких к ней эквивалентов (IPTG);
экспрессионная система Тас (Amersham Biosciences), в которой синтез белка находится под контролем промотора tac. В этой системе синтез белка индуцируется в штаммах E.coli lacIq (типа JM105) с помощью лактозы или близких к ней эквивалентов (IPTG);
экспрессионная система PL, в которой синтез белка находится под контролем промотора PL и может быть индуцирован добавлением триптофана. В этом случае необходимо использовать производные Е. coli (GI724), содержащие копию гена, кодирующего репрессор cI фага лямбда, под контролем индуцируемого триптофаном промотора.
Конечно, можно экспрессировать модифицированную ДНК, кодирующую мутеин, в эукариотических клетках-хозяевах, происходящих из дрожжей или многоклеточных организмов. В этом случае нужно выбрать экспрессионную систему, совместимую с данными клетками.
В предпочтительном воплощении изобретения экспрессия осуществляется под контролем РНК-полимеразной системы фага Т7 и индуцируется изопропил-β-D-тиогалактопиранозидом.
Экспрессирующий вектор также включает дополнительные последовательности, кодирующие нормальные функции, необходимые для клонирования, селекции и экспрессии, такие как селективные маркеры, и/или сайт полиаденилирования, и/или последовательность регуляции транскрипции.
Таким образом, клетки-хозяева траснформируют, используя стандартные методы, известные специалистам в этой области, экспрессирующим вектором, содержащим кДНК, кодирующую требуемый мутеин. Эти клетки могут быть прокариотическими, эукариотическими, клетками животных, человека или растений, в частности бактериальными клетками типа Е. coli или Bacillus, дрожжевыми клетками типа Saccharomyces или клетками животных типа Vero, HeLa, CHO, COS.
Предпочтительный микроорганизм получают путем встраивания в коммерчески доступный штамм [В 12 (DE3) pLysS] (Promega Corporation USA) гена мутеина PLGF-1 человека.
Модифицированные клетки, используемые для получения мутеинов согласно изобретению, хранятся до употребления в лиофилизированном виде для сохранения их экспрессирующей способности. Перед употреблением лиофилизированный материал ресолюбилизируют в подходящем буфере.
Затем модифицированные клетки хозяина выращивают в жидкой культуральной среде. Несмотря на то что в продаже имеется большой выбор известных культуральных сред и их можно эффективно использовать, стадия ферментации по изобретению предпочтительно проводится в культуральной среде, лишенной каких-либо материалов, происходящих из животных или человека, во избежание риска инфекции. Наиболее подходящей средой для этого процесса являются дрожжевые экстракты (Difco), дополненные одним или несколькими подходящими антибиотиками. Стадии ферментации может предшествовать стадия предварительной инокуляции, на которой лиофилизированный микроорганизм суспендируют в культуральной среде и поочередно подвергают операциям инкубации и разбавления с целью получения оптимального количества клеток микроорганизма в культуре.
Ферментация проводится в вышеуказанной культуральной среде при температуре, подходящей для микроорганизма, обычно приблизительно 37°С, при насыщении кислородом, составляющим от 20% до 40%, предпочтительно 30% относительно воздуха. Значение рН во время культивирования поддерживается на оптимальном для используемого микроорганизма уровне, который в норме нейтрален или слегка кислый или щелочной (от 6,4 до 7,4). Кроме того, поскольку процесс ферментации происходит с перемешиванием, целесообразно применять противопенные добавки.
По мере протекания ферментации она сопровождается повышением оптической плотности культуральной среды. Поэтому оптическая плотность при 600 нм используется в соответствии с изобретением для наблюдения за развитием процесса. Плотность клеток, а тем самым и оптическая плотность, которую достигает культура ко времени индукции экспрессии, должна быть достаточно высокой, чтобы гарантировать высокий выход экспрессируемого белка. Хотя для работы годятся и оптические плотности при 600 нм (OD600) свыше 0,2 единиц, однако можно получить оптические плотности вплоть до 50 благодаря применяемым культуральным средам. Для достижения высокого уровня продукции мутеинов предпочтительны плотности, превышающие 18. Плотности между 16 и 20 давали оптимальные результаты. Ферментация поддерживается при указанных выше условиях до достижения этих значений оптической плотности, после чего проводится индукция экспрессии белка.
Могут применяться любые вещества или физико-химические условия, способные индуцировать механизмы гетерологической экспрессии мутеинов в клетках используемого микроорганизма. В конкретном случае применения бактериального штамма BL21 (DE3) pLysS, модифицированного экспрессионной плазмидой, содержащей промотор фагаТ7, экспрессию индуцируют с помощью лактозы или ее производных, таких как изопропил-β-тиогалактопиранозид (IPTG) в соответствующей концентрации, то есть приблизительно 1 мМ. Продолжительность индукции может варьировать в зависимости от требований. Хорошие результаты получали при продолжительности в несколько часов, предпочтительно от 3 до 4 часов. В оптимальном процессе индукция продолжается в течение 3 часов 20 минут при насыщении растворенным кислородом примерно 10%.
До и после индукции отбираются образцы клеток, которые подвергаются контрольным анализам такими методами, как электрофорез в SDS-PAGE, для определения результатов индукции.
По достижении требуемого уровня экспрессии белка клетки отделяют от культуральной среды, к примеру, центрифугированием, и подвергают процессу экстракции.
Процесс экстракции предусматривает начальную стадию лизиса клеток. В самом деле, при экспрессии мутеина в бактериях он остается заключенным внутри клетки-хозяина в виде телец включения. Процесс лизиса может проводиться с использованием замораживания/оттаивания, пресса Френча, обработки ультразвуком и прочих известных методов, в растворах для лизиса, содержащих детергенты в соответствующих концентрациях, предпочтительно содержащих тритон Х-100 в концентрации от 0,5% до 1%. Предпочтительным методом при использовании бактериального штамма BL21 (DE3) pLysS является метод замораживания/оттаивания, который в оптимальном варианте повторяют по меньшей мере два раза подряд.
Учитывая, что мутеин PLGF-1 высвобождается в лизирующую среду в том виде, в каком он экспрессируется в клетках хозяина, то есть в виде биологически неактивного мономера, после лизиса следует стадия ренатурирования, по меньшей мере, частичного, которая заключается в димеризации мономера. Ренатурирование мутеина осуществляется при добавлении в разбавленный раствор окислительно-восстановительной пары в соответствующей концентрации с последующим периодом инкубации от 10 до 30 часов, предпочтительно от 18 до 20 часов, при температуре от 10°С до 30°С, предпочтительно 20°С, с перемешиванием. Примеры таких пар: цистин/цистеин, цистамин/цистеамин, 2-гидроксиэтилдисульфид/2-меркаптоэтанол, или глутатион в окисленной и восстановленной форме. Последний является предпочтительным средством и применяется в окисленной форме при концентрации от 0,1 до 2,5 мМ, предпочтительно 0,5 мМ, и в восстановленной форме - от 0,25 до 6,25 мМ, предпочтительно 1,25 мМ.
В том случае, когда экспрессируемый мутеин PLGF-1 высвобождается в лизирующую среду в виде телец включения, стадии ренатурации предшествует операция солюбилизации. Фракцию, содержащую тельца включения, солюбилизируют в денатурирующем буфере, содержащем известные денатурирующие вещества, такие как мочевина, гуанидин-изотиоцианат, гуанидин-гидрохлорид. Предпочтительно денатурирующий раствор представляет собой раствор мочевины в денатурирующей концентрации, например, 8 М. Для ускорения процесса солюбилизации может оказаться выгодным подвергнуть фракцию, содержащую тельца включения, гомогенизации или обработке ультразвуком. После этого раствор, содержащий белок, разбавляют самим денатурирующим буфером и/или разбавляющим раствором до достижения оптической плотности при 280 нм примерно 0,5 единиц OD280. Подходящие разбавляющие растворы содержат соли и полиэтиленгликоль (ПЭГ) и имеют щелочное значение рН (около 8).
Высвобождение мутеина PLGF-1 в лизирующую среду обычно сопровождается высвобождением различных компонентов и внутриклеточных веществ из микроорганизма, прежде всего нуклеиновых веществ, которые могут повлиять на процесс очистки белка или помешать ему. Чтобы избежать этой проблемы, полученную непосредственно при лизисе клеток суспензию/раствор можно подвергнуть дополнительной, необязательной и предварительной обработке, состоящей во фрагментировании данного материала. Это осуществляется при помощи энзиматических средств, таких как ДНКазы (природные или рекомбинантные типа Bensonase), химических средств, таких как дезоксихолевая кислота, или физико-механических средств, таких как обработка ультразвуком, быстрое перемешивание лопастями, например, в гомогенизаторе. Физическая фрагментация ДНК проводится в соответствующем объеме промывочного раствора, содержащего хелаторы и детергенты, например, ЭДТА и тритон Х-100, и предпочтительно ее повторяют несколько раз, перемежая с разбавлением, центрифугированием и удалением супернатанта, чтобы удалить всевозможные клеточные компоненты или вещества из фракции, содержащей тельца включения.
Несмотря на то что мутеин PLGF-1 после ренатурирования может быть сразу использован как есть, предпочтительно его подвергают, по меньшей мере, одной стадии очистки любым из методов, хорошо известных в этой области для очистки белкового материала. С этой целью мутеин может быть подвергнут гель-фильтрации, ионообменной хроматографии, аффинной хроматографии, ВЭЖХ, обращенно фазовой хроматографии и/или гель-электрофорезу. Предпочтительными методами являются анионообменная и обращенно фазовая хроматография. Если нужно получить особенно высокий уровень очистки, к примеру, подходящий для терапевтического применения, то сочетают, по меньшей мере, два из указанных выше методов подряд.
Раствор, содержащий частично ренатурированный мутеин, то есть находящийся, по крайней мере частично, в виде димера, можно наносить на анионообменную смолу для обогащения смеси димерной формой и освобождения ее от бактериальных загрязнений. Можно использовать любой коммерчески доступный матрикс, пригодный для анионообменной хроматографии, в той мере, в какой его емкость, характеристики нагрузки и скорости пропускания совместимы с промышленным потоком. В предпочтительном воплощении применяется смола с высокой скоростью потока, например, Q-сефароза Fast Flow (Amersham biosciences) или эквивалентная. Используемые смолы позволяют наносить большие объемы белкового раствора, при этом отношение наносимого объема к объему колонки варьирует от 1:1 до 10:1. Предпочтительны отношения объемов, близкие к 10:1, поскольку они позволяют оптимально использовать колонку. Весь процесс хроматографии может преимущественно проводиться в автоматическом режиме с помощью компьютеризированной системы, управляемой соответствующей программой, к примеру, системы FPLC Director Software (Amersham biosciences).
В том варианте процесса, который представлен выше, частично ренатурированный мутеин может быть очищен при помощи обратнофазовой хроматографии.
В этом случае соответствующим образом разбавленный раствор, содержащий частично ренатурированный мутеин, то есть находящийся частично в виде димера и частично в виде мономера, можно нанести на коммерчески доступный хроматографический матрикс, подходящий для указанного применения. Предпочтительно используют смолу с такими гранулометрическими характеристиками, которые гарантируют оптимальное использование абсорбирующей способности матрикса вместе с легкостью набивки колонки. Примеры таких матриксов - смолы RP Source 15 или RP Source 30 (Amersham biosciences). Все растворы для уравновешивания, нанесения, промывки смолы и элюции представляют собой водно-органические растворы, содержащие различное количество в процентах органических растворителей. Примеры таких растворов - это растворы, содержащие этанол, метанол или ацетонитрил. Предпочтительно применяются водно-спиртовые растворы, содержащие возрастающие количества этанола. Преимущественно весь процесс обратнофазовой хроматографии проводится в автоматическом режиме с помощью компьютеризированной системы, работающей под управлением соответствующей программы, например системы FPLC Director Software (Amersham biosciences).
При использовании двух и более методов очистки, следующих друг за другом, мутеин может быть получен в высокоочищенной активной форме, то есть при этом белок находится преимущественно в виде димера без примесей мономерной формы. Полученный таким образом препарат содержит не менее 98,5% активной формы, предпочтительно не менее 99,5%. Остаточная мономерная форма не превышает 1,5%. С учетом того, что мутеин химически устойчив, все продукты мультимеризации сведены до уровня примеси. Очищенный белок, полученный вышеописанным способом, может быть подвергнут дальнейшей обработке, например ультрафильтрации через мембрану. В этом случае препарат фильтруют через мембрану, имеющую предел исключения (отсекания), меньший или равный 30 кД, и подвергают диафильтрации против воды, подкисленной ТФУ, до достижения степени разбавления 1:106. Конечный продукт, полученный таким образом, может быть адекватно приготовлен вместе с лиофилизационными добавками и подвергнут лиофилизации для сохранения активности на оптимальном уровне. В практическом воплощении изобретения мутеин может быть соответствующим образом экстрагирован, выделен и очищен в соответствии со способом очистки, описанным в международной патентной заявке РСТ IT02/00065 (Geymonat) для очистки белка PLGF-1 дикого типа, при необходимости адаптируя рабочие условия.
Химическую устойчивость мутеинов PLGF-1 по изобретению оценивали методами, в которых лиофилизованный мутеин и белок PLGF-1 дикого типа солюбилизировали в солевом растворе или вводили в состав геля и хранили при температуре 4-8°С в течение 40, 170 и 210 дней. Приведенные ниже результаты четко показали, что мутеин в активной форме димера устойчив при всех исследованных концентрациях (20, 5 и 1 мг/мл), так как он не имеет тенденции к выпадению в осадок или к образованию мультимеров: в самом деле, его концентрация, как оказалось, осталась на первоначальном уровне. Напротив, концентрация димерной формы белка дикого типа резко снижается уже через несколько дней.
Мутеины по изобретению наряду с улучшением химической/биологической стабильности проявляют ангиогенную активность, сравнимую с активностью белка PLGF-1 дикого типа. Эта активность делает мутеины по изобретению пригодными для всех терапевтических и косметических применений природного PLGF-1, известных к настоящему времени из предшествующего уровня техники.
Ангиогенное действие мутеинов PLGF-1 по изобретению определяли известными методами, выполняемыми in vivo или in vitro. В частности, использовали тест на васкуляризацию роговицы кролика или тест на васкуляризацию хориоаллантоисной мембраны кур (САМ), как описано в Maglione et al. "II Farmaco", 55,165-167 (2000).
Второй метод, используемый для оценки васкуляризации кожи, - компьютеризированный морфометрический анализ образцов кожи животных, как описано Streit et al., Proc. Natl. Acad. Sci. USA 1999, December 21, 96(26), 14888-14893. Срезы кожной ткани, подвергавшиеся или не подвергавшиеся обработке по настоящему изобретению, окрашивали иммуногистохимически с помощью моноклональных антител против CD31 используемого животного. Обработанные таким образом срезы анализировали под электронным микроскопом, определяя число кровеносных сосудов на 1 мм2, их средние размеры и занимаемую ими относительную площадь. Ангиогенное действие мутеинов на ткань миокарда, особенно в случае ишемии или инфаркта миокарда, оценивали на модели сердечной ишемии у животных, как описано Maglione et al. (supra).
Активность мутеинов по изобретению при лечении склеродермии оценивали на животной модели, как описано Yamamoto et al.. Arch. Dermatol. Res. Nov. 2000, 292(11), 535-541. Состояние склеродермии у мышей СЗН вызывали блеомицином (100 мкг/мл) путем ежедневного введения подкожно в течение 3 недель. Через 3 недели животных забивали и образцы кожи из обработанных участков подвергали гистологическому анализу. Влияние обработки проявляется в гистологических явлениях, которые могут быть приписаны вызванному блеомицином склерозированию кожи, в частности утолщению кожи и высокому содержанию гидроксипролина.
Приведенные ниже результаты свидетельствуют об эффективности мутеинов PLGF-1 по изобретению при лечении всех патологических или естественных дегенеративных состояний, поддающихся улучшению при усилении васкуляризации пораженных участков. Первое применение - это профилактика или лечение ишемии и повреждений, возникающих после эпизода ишемии. Заболевания, которые могут подлежать лечению: ишемия ткани миокарда, инфаркт миокарда, ишемический удар и хронические болезни миокарда, ишемия и ишемический удар головного мозга, ишемия кишечника, периферическая ишемия конечностей.
Второе терапевтическое применение - лечение склеродермии. Это болезнь, которая затрагивает микрососудистую систему, кожную и подкожную соединительную ткань и соединительную ткань внутренних органов. Болезнь вызывает активацию фибробластов и чрезмерную продукцию и отложение коллагена в тканях и вокруг сосудов, что сильно способствует образованию участков фиброза и кальцификации, а тем самым и возникновению симптомов, вызываемых болезнью. В частности, при капилляроскопии можно видеть, что большое количество склеротизированного коллагена окружает сосуды кожи, вызывая сужение просвета сосудов. Различают очаговую склеродермию с поражением кожи, которая характеризуется огрубением и утолщением кожи вследствие чрезмерного и неадекватного отложения коллагена, и прогрессирующую системную склеродермию (склероз), при которой кровеносные сосуды связаны с фиброзом кожи, наряду с системным склерозом с поражением внутренних органов. Кожа, прежде всего на пальцах и руках, оказывается огрубевшей, утолщенной и опухшей. Болезнь также проявляется на уровне миокарда как сердечная недостаточность и на уровне пульмонарной, желудочно-кишечной, почечной и костно-мышечной систем. У некоторых пациентов также возникает эрозивная артропатия, вызванная фиброзом кожи, что сильно затрудняет подвижность суставов. Maglione et al. сообщали (итальянская патентная заявка ИМ 2002 А000119) в отношении фактора PLGF-1 дикого типа, что усиление ангиогенеза, в особенности в коже, в результате применения композиций, содержащих PLGF-1, оказывает благотворное действие на общее состояние вызванного неомицином склероза у мышей. Такие же результаты наблюдались на животных, у которых заранее вызывали состояние склеродермии и лечили мутеинами согласно изобретению.
Третье терапевтическое применение - лечение, способствующее процессам заживления ожогов, язв и внутренних или кожных ран, в частности, в ходе послеоперационных процедур.
Следующее применение согласно изобретению касается лечения явлений, типичных для старения кожи. Такое лечение, хотя оно считается по сути косметическим, имеет терапевтические последствия, если учитывать преждевременное ухудшение состояния кожной ткани вследствие продолжительного воздействия солнечного света (фотостарение), других видов излучения или агрессивных факторов окружающей среды/атмосферы.
При исследовании образцов фотоповрежденной кожи под электронным микроскопом проявляется типичная морфология микрососудов, которая характеризуется, среди прочего, наличием патологически расширенных капилляров, покрытых эластином или окруженных плотным аморфным веществом. Обнаружено, что стимулирование новой васкуляризации кожи оказывает как при естественном, так и преждевременном старении кожи